Похожие презентации:
Неорганические соединения серы
1. Неорганические соединения серы
ассистент кафедры химии ВятГГУСелезенев Р. В.
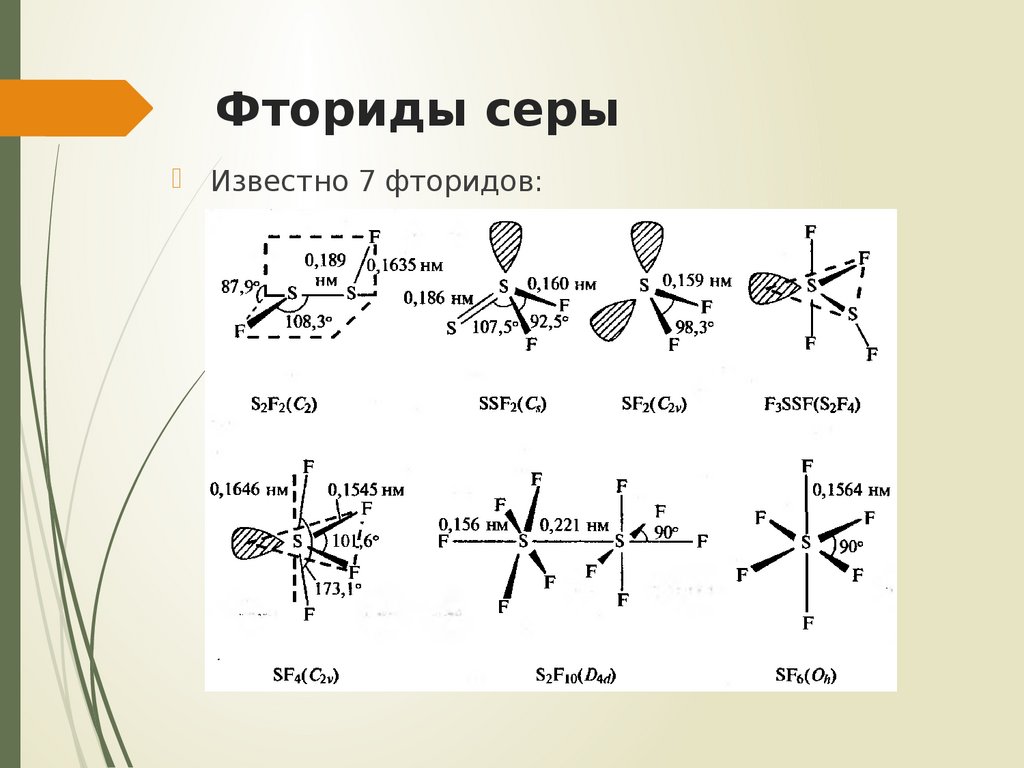
2. Фториды серы
Известно 7 фторидов:3. Фториды серы. Получение
Фторирование хлоридовИз дигалогенидов
Фторирование серы
Из простых веществ
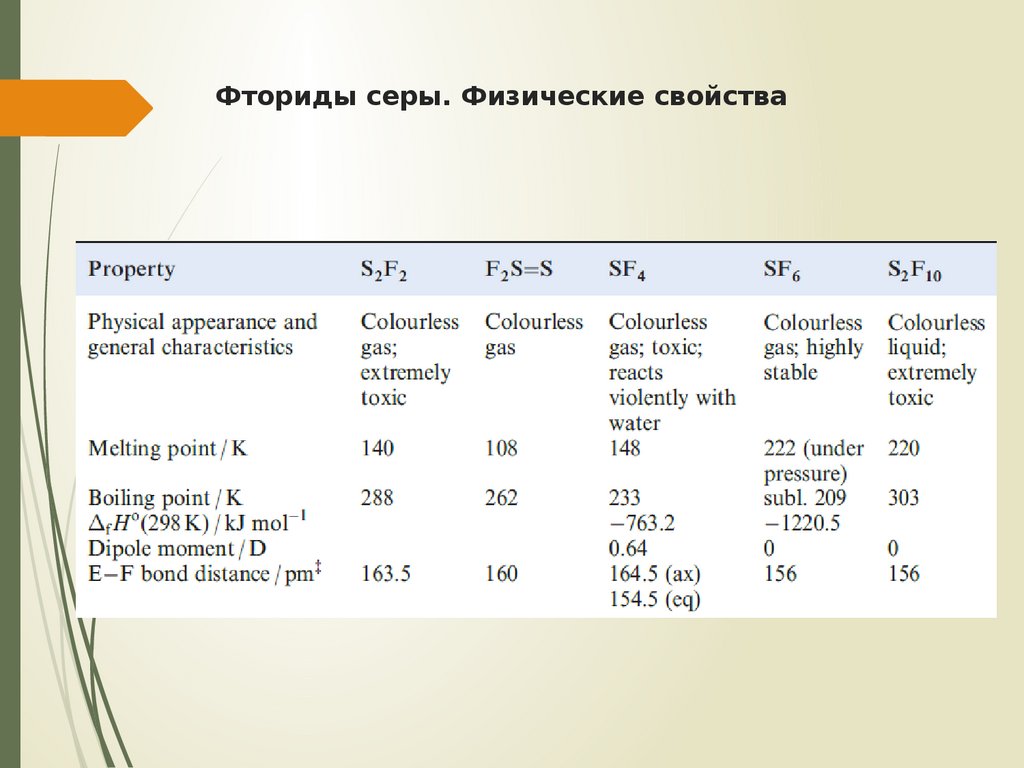
4. Фториды серы. Физические свойства
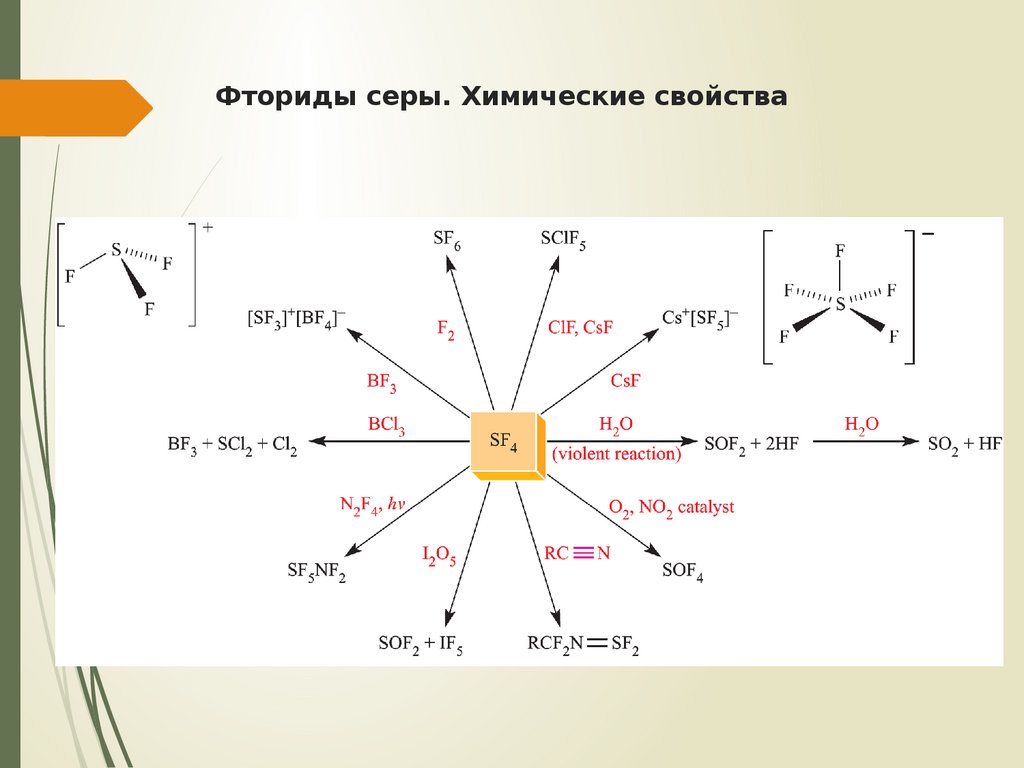
5. Фториды серы. Химические свойства
6. Фториды серы. Химические свойства
ГидролизГорение в кислороде
Диспропорционирование
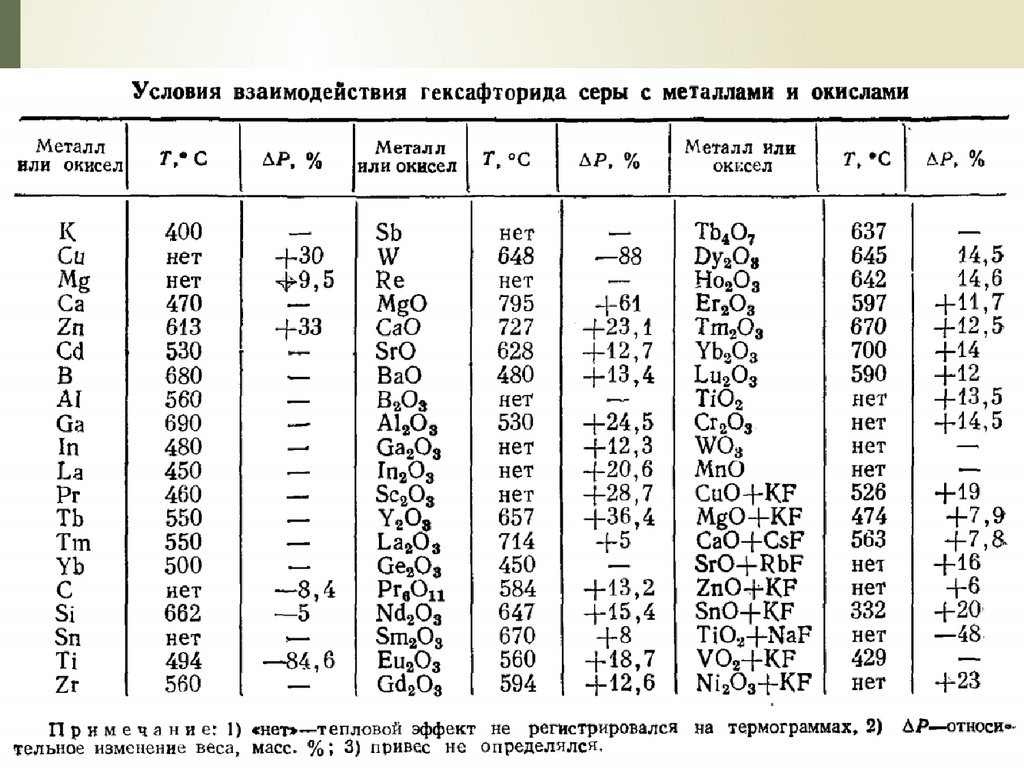
Взаимодействие с металлами
Фторирующие агенты
7.
8. Хлориды серы. Физические свойства
S2Cl2 – золотисто-желтая ядовитаялегкокипящая дурно-пахнущая
жидкость, т. пл. = -76°С, т. кип. =
138°С
SCl2 – вишнево-красная ядовитая
легкокипящая дурно-пахнущая
жидкость, т. пл. = -122°С, т. кип. =
59°С
9. Хлориды серы. Химические свойства
Гидролиз с образованием H2S, SO2,H2SO3, H2SO4, H2SxO6
Окисляется кислородом
SOCl2
SO2Cl2
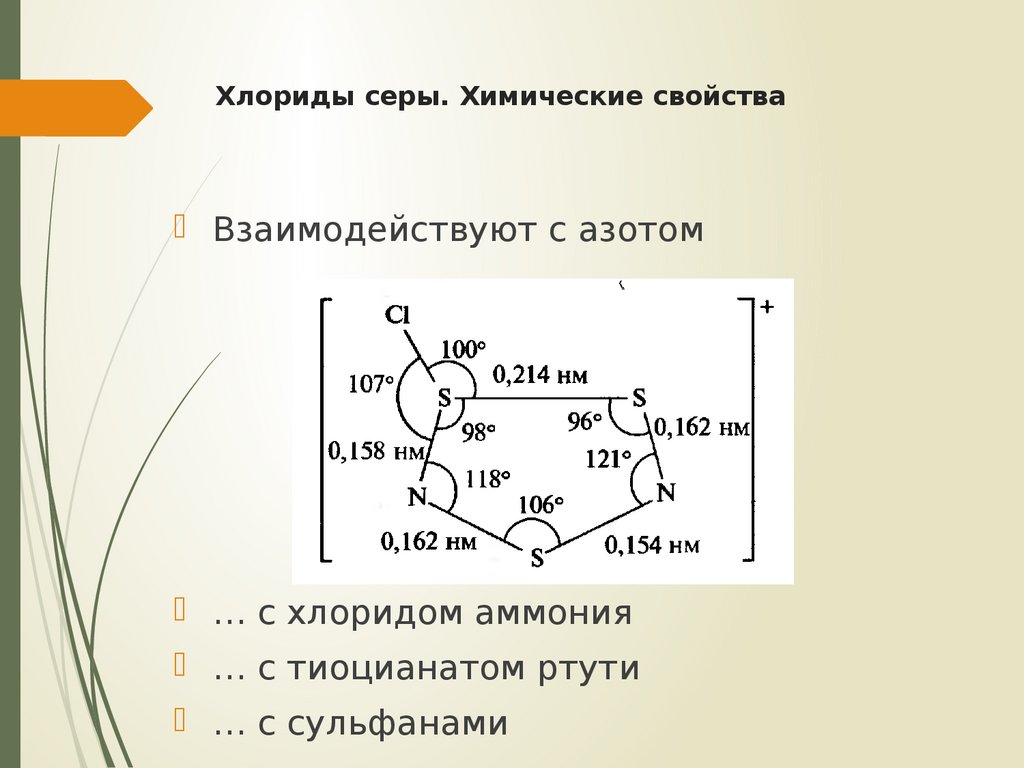
10. Хлориды серы. Химические свойства
Взаимодействуют с азотом… с хлоридом аммония
… с тиоцианатом ртути
… с сульфанами
11. Бромиды серы. Получение
Прямой синтезSBr2 был обнаружен как продукт,
изолированный в матрице, когда через смесь
S2Cl2/SCl2:Вг2:Аг в соотношении 1:1: 150
пропускали микроволновой разряд мощностью
80 Вт, а продукт конденсировали на окне из Csl
в гелиевом криостате при 9К
Дибромсульфаны образуются при действии
безводного бромоводорода на
соответствующие хлориды
12. Бромиды серы. Свойства
Очень нестабильны. Разлагаются прикомнатной температуре
S2Br2 – гранатово-красная жидкость с т. пл. =
-46°С, т. кип. = 54°С
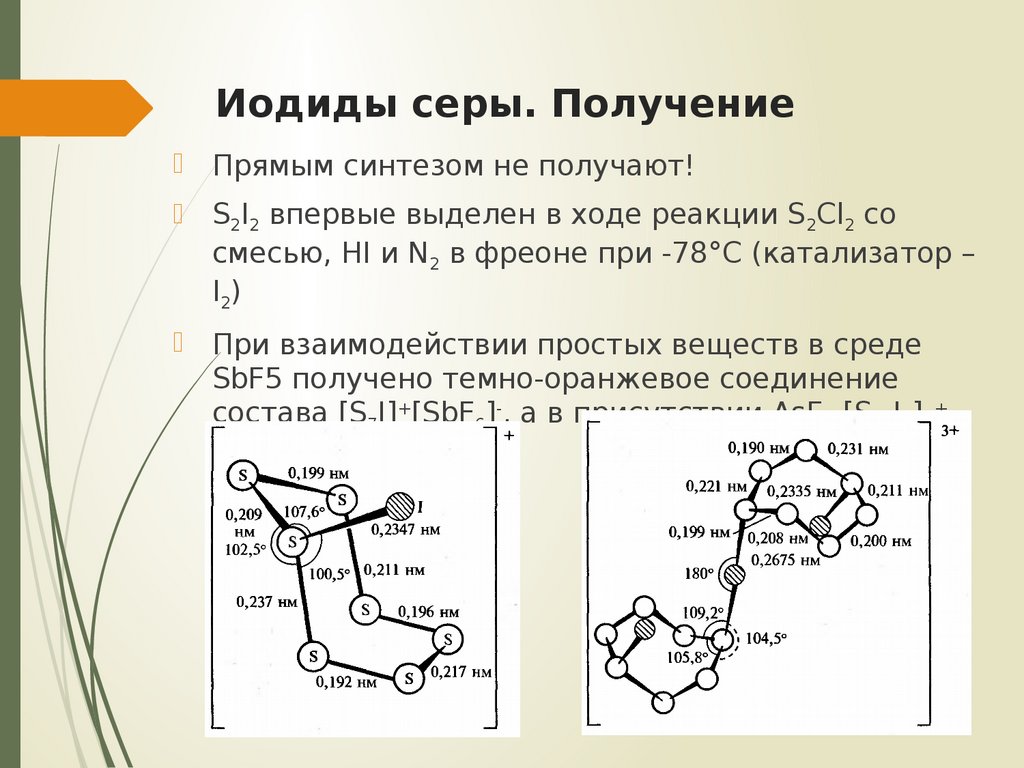
13. Иодиды серы. Получение
Прямым синтезом не получают!S2I2 впервые выделен в ходе реакции S2Cl2 со
смесью, HI и N2 в фреоне при -78°С (катализатор –
I2)
При взаимодействии простых веществ в среде
SbF5 получено темно-оранжевое соединение
состава [S7I]+[SbF6]-, а в присутствии AsF3 [S14I3]3+
[SbF6]3-· AsF3
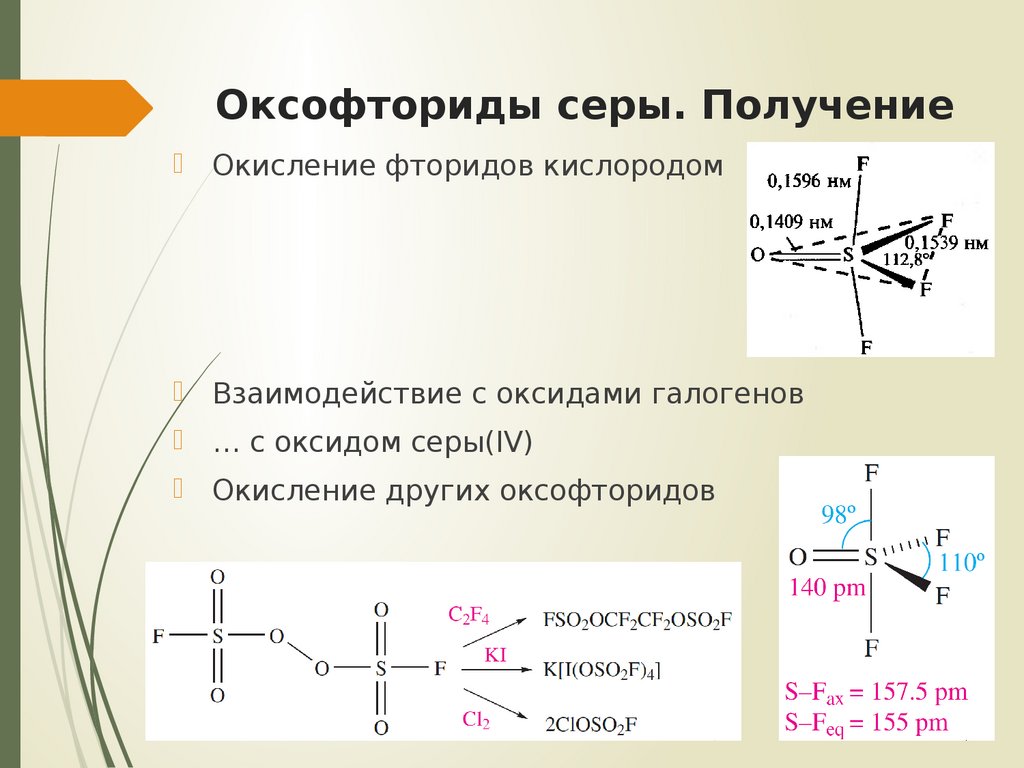
14. Оксофториды серы. Получение
Окисление фторидов кислородомВзаимодействие с оксидами галогенов
… с оксидом серы(IV)
Окисление других оксофторидов
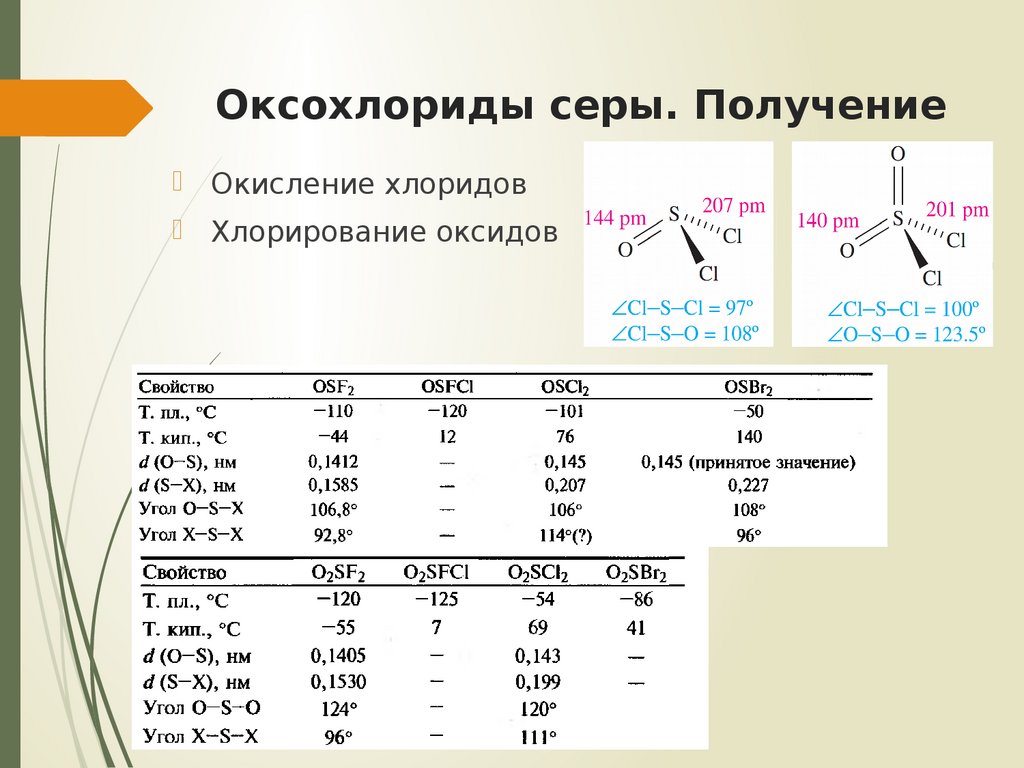
15. Оксохлориды серы. Получение
Окисление хлоридовХлорирование оксидов
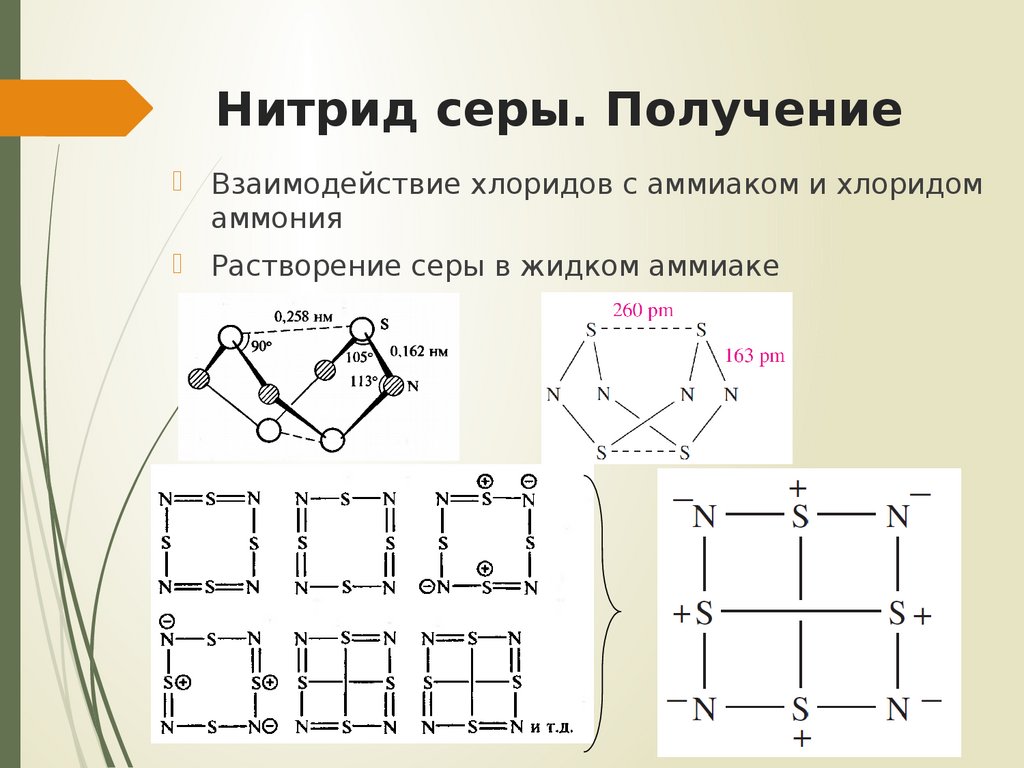
16. Нитрид серы. Получение
Взаимодействие хлоридов с аммиаком и хлоридомаммония
Растворение серы в жидком аммиаке
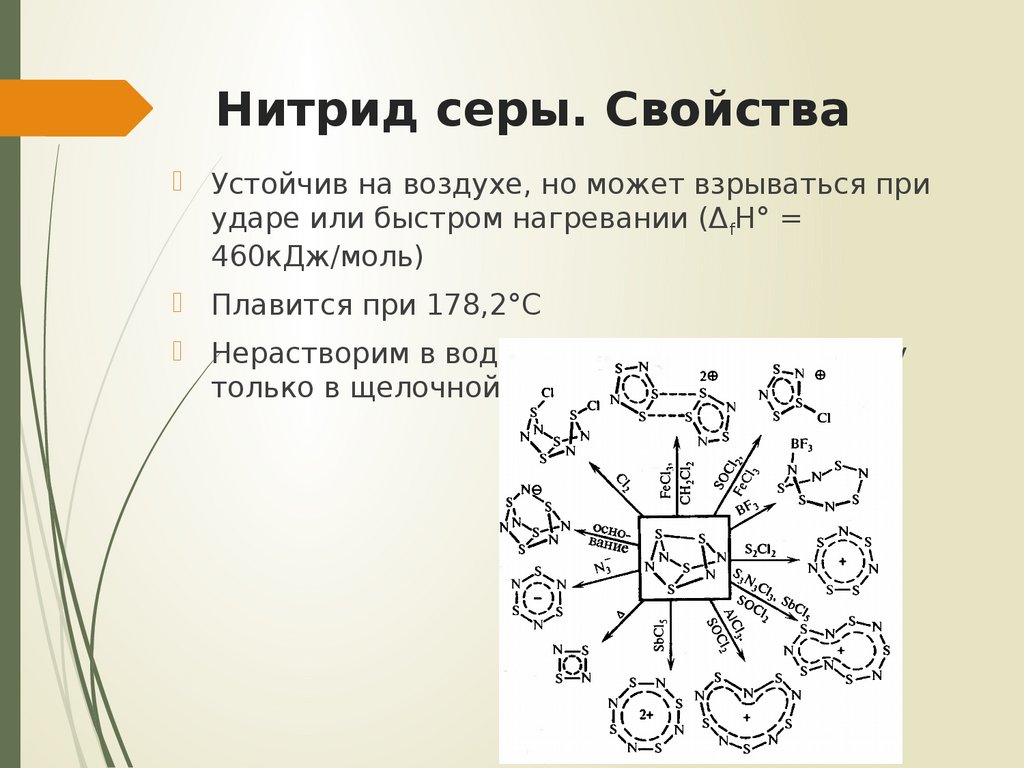
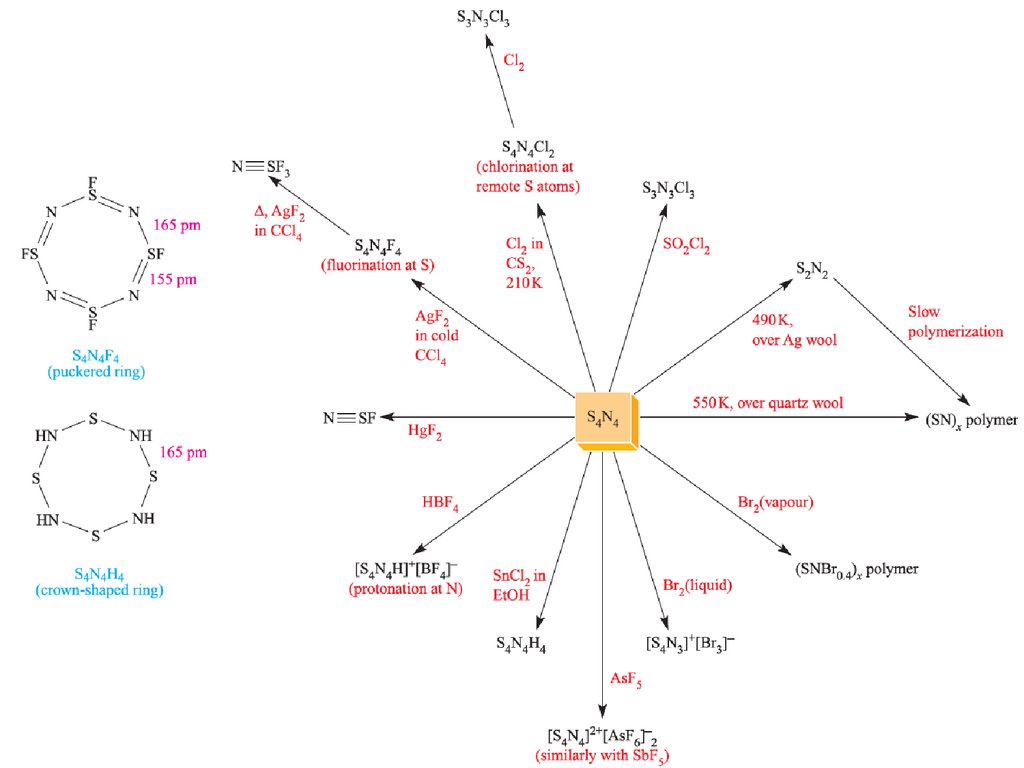
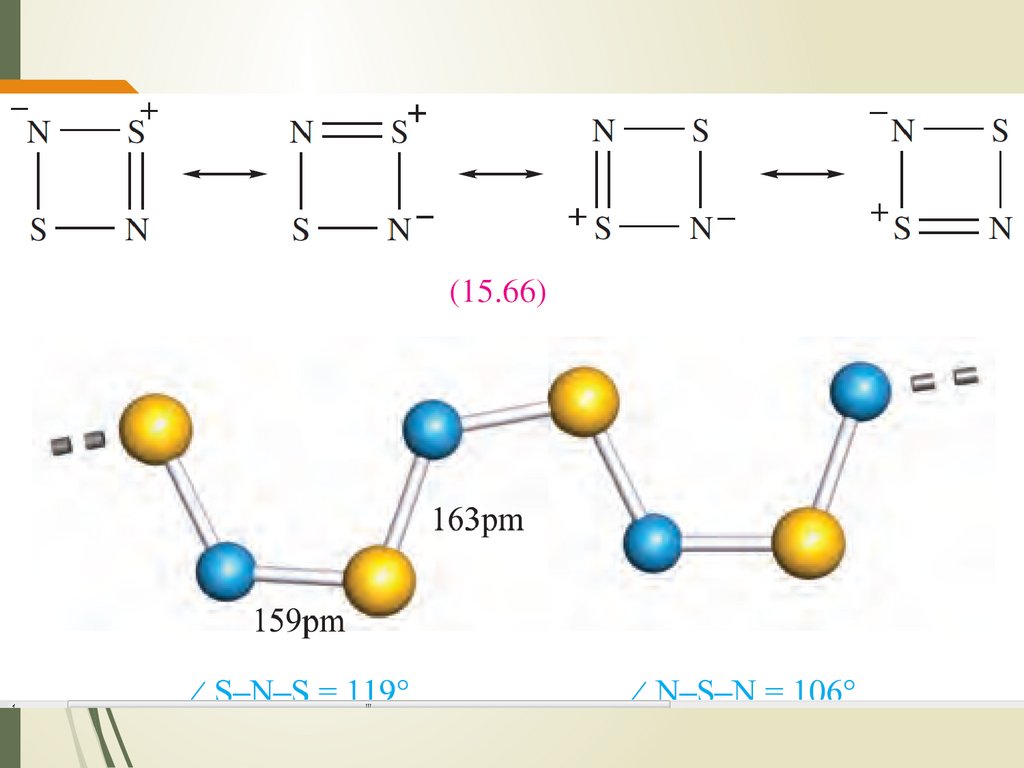
17. Нитрид серы. Свойства
Устойчив на воздухе, но может взрываться приударе или быстром нагревании (ΔfH° =
460кДж/моль)
Плавится при 178,2°С
Нерастворим в воде, подвергается гидролизу
только в щелочной среде
18.
19.
20. Катионы серы
21. Пероксосерные кислоты
Получаются при взаимодействиихлорсульфоновой кислоты с пероксидом
водорода
… при электролизе раствора серной
кислоты (Г. Каро, 1898)
Представляют собой кристаллические
легкоплавкие вещества с
т. пл. (H2SO5) = 45°C, т. пл. (H2S2O8) =
65°C
Проявляют сильные окислительные
свойства
22. Тиосерная кислота
В водной среде быстро разлагается досеры, SO2, H2S, H2Sn, H2SO4 и т. д.
Безводная кислота нестабильна и
разлагается ниже 0°C
Получается только в апротонных
растворителях
Хороший восстановитель
23. Ди- и политионовые кислоты
Получают из дитионата барияОкисляются галогенами, перманганатом
калия и др. до сульфатов
Восстанавливаются (напр., Na/Hg) до
сульфитов и дитионитов
В растворах разлагаются до
тиосульфатов, сульфитов, сульфидов и т.
д.
Политионовые получаются в растворе
Вакенродера (р-р H2S и SO2)
… при взаимодействии хлорсульфанов с
гидросульфитами и гидротиосульфатами











 Химия
Химия








