Похожие презентации:
NiCl2 - Никель хлориді
1. Тақырыбы: NiCl2 Орындаған: Усетаева С. Қабылдаған:Усипбекова Е.
2.
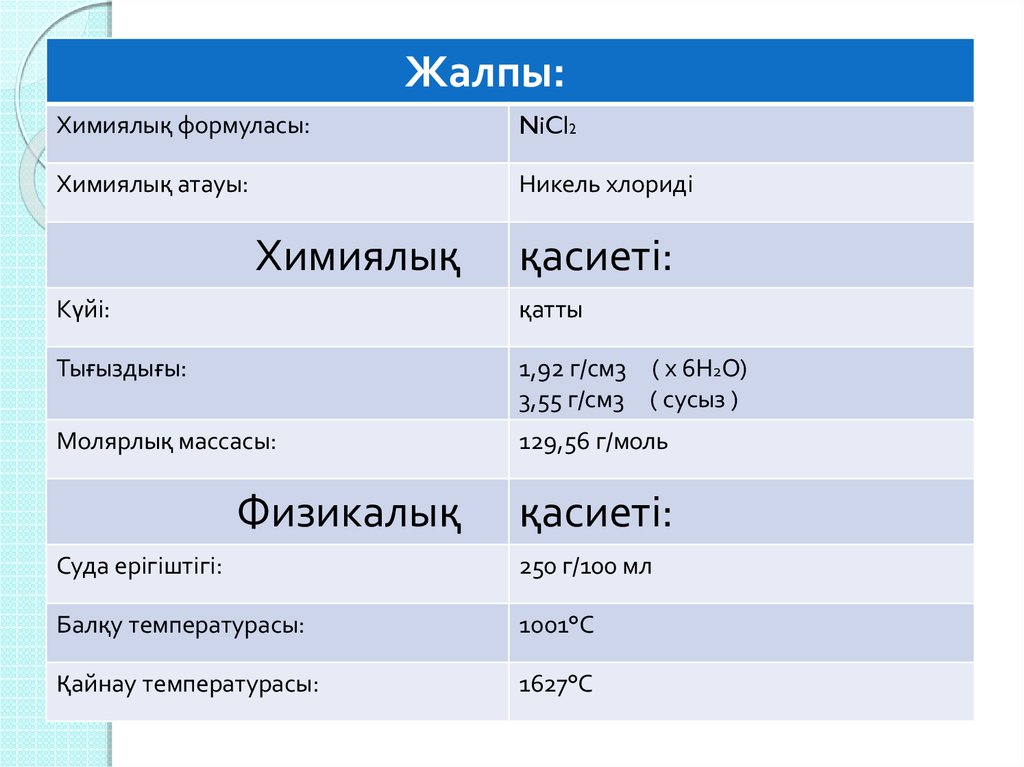
Жалпы:Химиялық формуласы:
NiCl2
Химиялық атауы:
Никель хлориді
Химиялық
қасиеті:
Күйі:
қатты
Тығыздығы:
1,92 г/см3 ( х 6Н2О)
3,55 г/см3 ( сусыз )
Молярлық массасы:
129,56 г/моль
Физикалық
қасиеті:
Суда ерігіштігі:
250 г/100 мл
Балқу температурасы:
1001°С
Қайнау температурасы:
1627°С
3. Растворяется в воде, спирте, эфире. Превращается в NiO при прокаливании на воздухе или в кислороде. Восстанавливается водородом
при нагревании. Молярнаяэлектропроводность при бесконечном разведении при 25 °C
равна 260,7 См·см²/моль. Получают действием хлора на
нагретый
до
600—800°С
никель,
дегидратацией
кристаллогидратов NiCl2·nН2О (n=1, 2, 4, 6, 7).
Применяется в гальванотехнике; как катализаторпереносчик хлора с участием НСl или Cl2. Получается при
сгорании порошка Ni в токе Сl2. Физические свойства.
Золотисто-желтые гигроскопичные кристаллы. Возг. при
970°; плотн. 3,55 г/см³ (безводный); раств, в воде 59,5 г/100 г
(10),
Образует
ряд
кристаллогидратов.
4. Производство и синтеза: Самый большой масштаб производства хлорида никеля включает экстракцию с соляной кислотой
никелевого штейна и остатков ,полученных из обжарки переработки никельсодержащих руд.
NiCl 2 · 6H 2 O , получают в лаборатории , так как он является
недорогим и имеет длительный срок годности при
хранении.Нагревание гексагидрата в диапазоне 66-133. ° С дает
желтоватый дигидрат, NiCl 2 · 2H 2 O.Гидраты преобразовать в
безводной форме при нагревании в тионилхлоридом или
нагреванием в токе газообразного хлористого водорода. Просто
нагревание гидраты не дает безводный дихлорид.
Дегидратации сопровождается изменением цвета от зеленого до
желтого. В случае , если нужно чистое соединение без
присутствия кобальта, хлорида никеля можно получить
осторожно нагревая хлорид никеля гексаммин:
5. Сусыз NiCl2 тұзы:
6. NiCl2 х 6 Н2О гидраты
7. Координационные комплексы Цвет различных Ni (II) комплексов в водном растворе. Слева направо, [Ni (NH 3) 6] 2+, [Ni
Координационные комплексыЦвет различных Ni (II) комплексов в водном растворе. Слева
направо, [Ni (NH 3) 6] 2+, [Ni ( ен ) 3] 2+, [NiCl 4] 2-, [Ni (H 2 O) 6] 2+
Большинство реакций, приписываемых "хлорида никеля"
включать гексагидрат, хотя специализированные реакции
требуют безводной формы. Реакции , начиная с NiCl 2 ·
6H 2 O , могут быть использованы для формирования
различных никеля координационных комплексов , так как
H 2 O лиганды быстро вытесняются
аммиак , амины , тиоэфиры , тиоляты и органо фосфинов . В
некоторых производных, хлорид остается в пределах
координационной сферы , в то время как хлорид смещается
с высоко основным лигандами. Иллюстративные
комплексы включают:
8.
Сложныйцвет
Магнетизм
Геометрия
[Ni (NH 3) 6] Cl 2
сине-фиолетовый
парамагнитный
восьмигранный
[Ni ( EN ) 3] 2+
Фиолетовый
парамагнитный
восьмигранный
NiCl 2 ( ДФФЭ )
оранжевый
диамагнитный
квадратная плоская
[Ni ( CN ) 4] 2-
бесцветный
диамагнитный
квадратная плоская
[NiCl 4] 2- [9] [10]
Желто-зеленый
парамагнитный
четырехгранный
9. Зияны: Никель хлоридінің адамның ішкі организіміне қолданғанда , демалған кезде, теріге және көзге тиген кезде зияны бар.
Сонымен қатарникель хлоридін ұзақ уақыт қолдану рак ауруларына
алып келеді





![Координационные комплексы Цвет различных Ni (II) комплексов в водном растворе. Слева направо, [Ni (NH 3) 6] 2+, [Ni Координационные комплексы Цвет различных Ni (II) комплексов в водном растворе. Слева направо, [Ni (NH 3) 6] 2+, [Ni](https://cf2.ppt-online.org/files2/slide/l/LBzpImxe6CMW3a98tobiGUEfndJR4Sq0chvQXkrY5/slide-6.jpg)



 Химия
Химия