Похожие презентации:
Микрофлора лекарственных растений и лекарственного сырья. Фитопатогенные микробы
1.
МИКРОФЛОРА ЛЕКАРСТВЕННЫХ РАСТЕНИЙ ИЛЕКАРСТВЕННОГО СЫРЬЯ.
ФИТОПАТОГЕННЫЕ МИКРОБЫ.
МИКРОФЛОРА ГОТОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ.
АСЕПТИКА И АНТИСЕПТИКА.
ДЕЗИНФЕКЦИЯ И СТЕРИЛИЗАЦИЯ.
КОНСЕРВАЦИЯ.
2. МИКРОФЛОРА ЛЕКАРСТВЕННЫХ РАСТЕНИЙ
1. представители нормальноймикрофлоры растений;
2. фитопатогенные микроорганизмы возбудители инфекционных
заболеваний растений.
3. МИКРОФЛОРА ЛЕКАРСТВЕННЫХ РАСТЕНИЙ
Нормальная микрофлора растений наповерхности листьев, семенах и на
прикорневой системе представлена
ризосферными и эпифитными
микробами.
Зона почвы, находящаяся в контакте с
корневой системой растений, носит
название ризосферы, а микроорганизмы,
развивающиеся в данной зоне,
называются ризосферными.
4. Нормальная микрофлора растений
НОРМАЛЬНАЯ МИКРОФЛОРАРАСТЕНИЙ
Качественный и количественный состав
микрофлоры ризосферы специфичен для
каждого вида растений. Основная масса
прикорневой микрофлоры представлена:
неспороносными грамотрицательными
бактериями рода Pseudomonas, микобактериями
и грибами, главным образом, базидиомицетами,
реже фикомицетами, аскомицетами. Указанные
грибы образуют симбиоз с корнями растений, в
том числе и лекарственных, называемый
микоризой.
5. Нормальная микрофлора растений
НОРМАЛЬНАЯ МИКРОФЛОРАРАСТЕНИЙ
Микориза - это морфологически
единое образование, состоящее из
гриба и частей корневой системы
растения. При этом гриб может быть
симбионтом по отношению к
растению-хозяину, или реже, хозяином
для растения симбионта.
6. Нормальная микрофлора растений
НОРМАЛЬНАЯ МИКРОФЛОРАРАСТЕНИЙ
Микориза особенно благоприятна для
развития растений:
1. увеличивает поглощающую поверхность
корней за счет разветвлений гиф гриба;
2. грибы своими ферментами разлагают
богатые азотом органические соединения,
обеспечивая растения аминокислотами,
минеральными веществами и водой;
3. микоризные грибы снабжают растения
ростовыми веществами.
7. Нормальная микрофлора растений
НОРМАЛЬНАЯ МИКРОФЛОРАРАСТЕНИЙ
Эпифитной называется микрофлора,
находящаяся на поверхности надземных
частей растений. По качественному составу
она довольно однообразна и типичными ее
представителями являются Xenthomonas
herbicola aureum - грамотрицательные короткие
подвижные палочки, образующие колонии
золотистого цвета на МПА; Pseudomonas
fluorescens - полиморфные грамотрицательные
палочки с полярными жгутиками, дающие
флуоресценцию на МПА и МПБ.
8. Нормальная микрофлора растений
НОРМАЛЬНАЯ МИКРОФЛОРАРАСТЕНИЙ
Реже встречаются споровые бактерии
Bacillus mesentericus, Bacillus vulgatus,
бесспоровые молочнокислые бактерии,
E. coli, грибы плесневые и дрожжевые.
Многие эпифитные микроорганизмы
являются антагонистами
фитопатогенных бактерий, тем самым,
предохраняют растения от
заболеваний.
9. Фитопатогенные микроорганизмы
Микроорганизмы, вызывающиеинфекционные заболевания растений
называются фитопатогенными.
Инфекционные болезни растений
бактериального происхождения —
бактериозы.
К бактериозам относятся различные виды
гнилей, бактериальные мшистости, ожоги
(некрозы), увядания, опухоли и др.
10. Фитопатогенные бактерии
РодыВиды
Вызываемые
заболевания
Erwinia
E. amylovora
Ожог, увядание
Pseudomonas
P. syringae
Пятнистость
Xеnthomonas
X. heterocea
Пятнистость, увядание
Corynebacterium
C. insidiosum, C.
fasciens
Увядание
Pectobacterium
P. phetophtorum, P.
aroidae
Гнили
Rhisobium
R. legyminosorum
Язвы
Agrobacterium
A. tumefaciens
Опухоли
11. Фитопатогенные микроорганизмы
К вирусным болезням относятся мозаичныеболезни, желтуха, болезни увядания,
карликовость, закукливание и другие.
Большинство вирусов относится к семейству
Reoviridae, родам Phytoreovirus, Fijvirus.
Различают также микофитозы, или
грибковые болезни, например, фузариозы,
аскохитозы, воловни и многие другие.
К инфекционным болезням растений относят
и актиномикозы, вызываемые
актиномицетами.
12. Фитопатогенные микроорганизмы
Фитопатогенные микроорганизмы сравнительно легкомогут проникать в растения через естественные
образования (чечевички, нектарники, желёзки,
корневые волоски) и искусственные повреждения,
даже ничтожные царапины.
Некоторые микроорганизмы, способны вырабатывать
ферменты, гидролизирующие кутикулу растений и
облегчающие внедрение возбудителя.
Фитопатогенные бактерии не могут длительно
существовать в почве из-за антагонистического
действия других бактерий, актиномицетов и грибов
13. МИКРОФЛОРА РАСТИТЕЛЬНОГО ЛЕКАРСТВЕННОГО СЫРЬЯ
Лекарственное растительное сырье можетобсеменяться микробами на всех этапах
заготовки (сбор, первичная обработка, сушка,
измельчение, упаковка) и хранения.
Внешними проявлениями микробной порчи
растительного сырья являются изменение цвета
и консистенции, загнивание, плесневение всего
растения или его частей.
Чаще всего портятся плоды, ягоды и корневища,
богатые сахаристыми веществами. Более
устойчивыми оказываются сухие листья, корни,
кора.
14. МИКРОФЛОРА РАСТИТЕЛЬНОГО ЛЕКАРСТВЕННОГО СЫРЬЯ
Состав микроорганизмов зависит от видалекарственного сырья, его структуры и
фармакологических свойств.
Преобладают грибы (Mucor, Rhizopus,
Peniciliiurn, Aspergillus, Fusarium, Accharomyces,
Candida, Aureobasidium, Alternaria, Actinomyces,
иногда — Sporotrichum и др), актиномицеты,
спорообразующие виды бактерий (B. subtillis, B.
mesatherium) а также неспоровые
(Chromobacterium aurcmtiaciim, Phylomonas и др).
15. САНИТАРНО-МИКРОБИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ГОТОВЫХ ЛЕКАРСТВ
1) Определение общего микробного числа (ОМЧ)Для определения ОМЧ бактерий посевы выполняют на
МПА, а для определения ОМЧ грибов – на среду
Сабуро или Кандида-агар
Чашки с посевами помещают в термостат на 48 часов,
затем подсчитывают число колоний и определяют
количество микроорганизмов в 1 мл или 1 г образца.
16.
Жидких лекарственных формЖидкую лекарственную форму разводят стерильным 0,9% раствором
натрия хлорида 1:10 (или 1:100). 0,5 мл разведения сеют газоном на
питательную среду.
Твёрдых лекарственных форм
1 г твёрдой лекарственной формы помещают в пробирку с 10 мл
стерильного 0,9% раствора натрия хлорида. После растворения сухого
вещества производят посев 0,5мл раствора газоном на питательную
среду.
Мягких лекарственных форм
1 г мягкой лекарственной формы помещают в пробирку с 10 мл
подогретого стерильного 1,4% раствора натрия гидрокарбоната для
диспергирования, которое производят вращательным движением
пробирки в течение 2-4 минут. Микробные клетки переходят в раствор,
который в объёме 0,5мл сеют газоном на питательную среду.
Инъекционных растворов, глазных капель, лекарственных
средств для новорождённых
Эти лекарственные формы сеют неразведёнными в объёме 0,5мл газоном
на питательную среду.
17. САНИТАРНО-МИКРОБИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ГОТОВЫХ ЛЕКАРСТВ
2) Определение количества условно-патогенных ипатогенных микроорганизмов
Выявление бактерий семейства Enterobacteriaceae:
- родов Escherichia, Salmonella - производят посев
образца на среду Эндо, Левина, висмут-сульфит-агар.
Идентификационные свойства энтеробактерий:
грамотрицательные неспоровые палочки, отрицательная
реакция на цитохромоксидазу, ферментируют глюкозу;
кроме этого для Escherichia – образуют индол, не
утилизируют цитрат натрия (на среде Симмонса), для
Salmonella – не ферментируют сахарозу и лактозу,
образуют сероводород.
- рода Proteus – производят посев образца на МПА по
Щукевичу.
18.
Выявление Staphylococcus aureus - производят посевобразца на желточно-солевой агар (ЖСА). После
инкубации вокруг колоний патогенных стафилококков
образуется зона опалесценции, что свидетельствует о
наличии фактора патогенности - лецитиназы. Для
определения принадлежности чистой культуры к
Staphylococcus aureus исследуют наличие
плазмокоагулазной актиности.
Выявление Pseudomonas aeruginosa - производят
посев образца на питательную среду с глицерином.
Синегнойная палочка образует зеленоватые
флюоресцирующие колонии, выделяющие в среду синезелёный пигмент; даёт положительную реакцию на
цитохромоксидазу.
*Примечание: наличие условно-патогенных и патогенных
микроорганизмов в лекарственных препаратах не
допустимо!
19. Микробиологическая чистота готовых лекарственных средств
КАТЕГОПРИМЕНЕНИЕ
ТРЕБОВАНИЯ
2
3
РИЯ
1
1
для инъекций,
инфузий и других видов
парентерального введения;
в
полости
тела,
где
отсутствуют
микроорганизмы;
2
глазные препараты;
на раны, ожоги
Стерильность
местно, трансдермально, интравагинально;
-
в полости уха, носа;
суммарно в 1 г или 1 мл при отсутствии
-
для ингаляции
Не
более
100
Enterobacteriaceae,
бактерий
Для приёма внутрь:
грибов
Pseudomonas
aeruginosa, Staphylococus aureus
3
и
20. Микробиологическая чистота готовых лекарственных средств
3а- детские лекарственные средства
- Не более 50 бактерий и грибов суммарно в 1 г или 1 мл
(от 1 месца до 1 года)
при
отсутствии
Enterobacteriaceae,
Pseudomonas
aeruginosa, Staphylococus aureus
3б
- детские лекарственные средства
- Не более 500 аэробных
бактерий, 50 дрожжевых и
плесневых грибов в 1 г или 1 мл при отсутствии
Enterobacteriaceae,
Pseudomonas
aeruginosa,
Staphylococus aureus
3в
- жидкие лекарственные средства
- Не более 500 аэробных
из
плесневых грибов в 1 мл при отсутствии Escherichia coli,
синтетического
сырья
(растворы, сиропы, капли и др.)
3г
-
лекарственные
синтетического
средства
сырья
бактерий, 50 дрожжевых и
Salmonella; не более 100 других кишечных бактерий
из
- Не более 1000 аэробных бактерий, 100 дрожжевых и
(таблетки,
плесневых грибов в 1 г при отсутствии Escherichia coli,
драже, капсулы, гранулы и др.)
Salmonella; не более 100 других кишечных бактерий
21. Микробиологическая чистота готовых лекарственных средств
3е- лекарственные средства из сырья
- Не более 10000 аэробных бактерий, 100 дрожжевых и
растительного,
плесневых грибов в 1 г при отсутствии Pseudomonas
животного
или
природного происхождения
aeruginosa,
Staphylococus
aureus,
Escherichia
coli,
Salmonella; не более 100 других кишечных бактерий
1
4
2
-
препараты
введения
для
3
ректального
- Не более 1000 аэробных бактерий, 100 дрожжевых и
плесневых грибов в 1 г при отсутствии Enterobacteriaceae,
Pseudomonas aeruginosa, Staphylococus aureus
- Лекарственные средства для новорожденных (от рождения до 1 месяца) –
растворы для внутреннего и наружного применения, глазные капли, масла
для обработки кожных покровов) – должны быть стерильными согласно
Приказу МЗ СССР № 1026 от 19.10.82 «Об усилении контроля за
санитарным состоянием родильных домов, детских лечебнопрофилактических учреждений и аптек».
- Вода для инъекций – должна быть апирогенная - согласно ФС 42-2620-97.
22. Микробиологическая чистота основного сырья
КАТЕ-ПРИМЕНЕНИЕ
ТРЕБОВАНИЯ
ГОРИЯ
Основное сырье (субстанции):
1
для
производства
стерильных
препаратов
при
отсутствии
Enterobacteriaceae,
Pseudomonas
aeruginosa, Staphylococus aureus
Основное сырье (субстанции):
2
- Не более 100 бактерий и грибов суммарно в 1 г или 1 мл
- Не более 1000 аэробных бактерий и 100 дрожжевых и
для производства нестерильных
плесневых грибов в 1 г или 1 мл при отсутствии
лекарственных средств
Enterobacteriaceae,
Pseudomonas
aeruginosa,
Staphylococus aureus
3
Вспомогательные
материалы
- Не более 1000 аэробных бактерий и 100 дрожжевых и
(крахмал, тальк, мука пшеничная и
плесневых грибов в 1 г при отсутствии Pseudomonas
др.)
aeruginosa,
Staphylococus
aureus,
Escherichia
Salmonella; не более 100 других кишечных бактерий
coli,
23. Микробиологическая чистота основного сырья
4Сырьё растительного, животного и
- Не более 10000 аэробных бактерий и 200 дрожжевых и
природного происхождения, уровень
плесневых грибов в 1 г или 1 мл при отсутствии
микробной загрязнённости которого
Pseudomonas
невозможно
Escherichia
снизить
во
время
технологического процесса
5
Лекарственное
сырьё,
которое
обработке
использованием
нагревания
формы
Salmonella;
Staphylococus
aureus,
не
других
более
100
кишечных бактерий
подвергается
приготовления
coli,
aeruginosa,
с
для
лекарственной
- Не более 107 аэробных бактерий и 104 дрожжевых и
плесневых грибов в 1 г или 1 мл при отсутствии
Pseudomonas
Escherichia
coli,
aeruginosa,
Salmonella;
Staphylococus
aureus,
не
других
более
100
кишечных бактерий
Вода дистиллированная для приготовления лекарственных средств, кроме
инъекционных растворов и глазных капель – не более 15 микроорганнизмов в 1 мл
при отсутствии Enterobacteriaceae, Pseudomonas aeruginosa, Staphylococus aureus.
Вода очищенная - должна содержать не более 100 микроорганизмов в 1 мл при
отсутствии Enterobacteriaceae, Pseudomonas aeruginosa, Staphylococus aureus – согласно
ФС 42-2619-97.
24.
ФИЗИЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НАМИКРООРГАНИЗМЫ
ТЕМПЕРАТУРА
ВЫСУШИВАНИЕ
ЛУЧИСТАЯ ЭНЕРГИЯ
УЛЬТРАЗВУК
ДАВЛЕНИЕ
25. ТЕМПЕРАТУРА
Высокая температура вызывает коагуляцию структурныхбелков и ферментов микроорганизмов. Большинство
вегетативных форм гибнет при температуре 60°С в течение
30 мин, а при 80-100°С – через 1 мин.
Споры бактерий устойчивы к температуре 100°С, гибнут
при 130°С и более при длительной экспозиции.
Для сохранения жизнеспособности относительно
благоприятны низкие температуры. Бактерии выживают
при температуре ниже –100°С; споры бактерий и вирусы
годами сохраняются в жидком азоте (до –250°С).
26. КЛАССИФИКАЦИЯ МИКРООРГАНИЗМОВ ПО ОТНОШЕНИЮ К ТЕМПЕРАТУРЕ
Термофильные виды (теплолюбивые) Зона оптимальногороста равна 50-60°С, верхняя зона задержки роста - 75°С.
Термофилы обитают в горячих источниках.
Психрофильные виды (холодолюбивые) растут в
диапазоне температур 0-10°С, максимальная зона задержки
роста 20-30°С. К ним относит большинство сапрофитов,
обитающих в почве, пресной и морской воде. Но есть
некоторые виды, вызывающие заболевания у человека.
Мезофильные виды лучше растут в пределах 20-40°С;
максимальная 43-45°С, минимальная 15-20°С. В
окружающей среде могут переживать, но обычно не
размножаются. К ним относится большинство патогенных и
условно-патогенных микроорганизмов.
27. ВЫСУШИВАНИЕ
Высушивание приводит к обезвоживанию цитоплазмы,нарушается целостность цитоплазматической мембраны,
что ведет к гибели клетки.
При относительной влажности окружающей среды ниже
30% жизнедеятельность большинства бактерий
прекращается. Время их отмирания при высушивании
различно.
Особой устойчивостью обладают споры бактерий.
28.
ЛУЧИСТАЯ ЭНЕРГИЯСолнечный свет губительно действует на микроорганизмы.
Наибольший бактерицидный эффект оказывает
коротковолновые УФ-лучи. Они инактивируют ферменты
клетки и разрушают ДНК. Энергию излучения используют
для дезинфекции, а также для стерилизации
термолабильных материалов.
29. УЛЬТРАЗВУК
Ультразвук вызывает поражение клетки. Под действиемультразвука внутри клетки возникает очень высокое
давление. Это приводит к разрыву клеточной стенки и
гибели клетки. Ультразвук используют для стерилизации и
хранения стерильных материалов.
30.
ВЫСОКОЕ ДАВЛЕНИЕК атмосферному давлению бактерии, а особенно споры, очень
устойчивы. Сочетанное действие повышенных температур и
повышенного давления используется в паровых стерилизаторах
для стерилизации паром под давлением.
31.
ХИМИЧЕСКИЕ ФАКТОРЫВ малых концентрациях химическое вещество может являться
питанием для бактерий, а в больших — оказывать на них
губительное действие. Способность ряда химических веществ
подавлять жизнедеятельность микроорганизмов зависит от
концентрации химических веществ и времени контакта с
микробом.
32.
МИКРОБНАЯ ДЕКОНТАМИНАЦИЯполное или частичное удаление микроорганизмов с
объектов внешней среды и биотопов человека с помощью
факторов прямого повреждающего действия.
Может быть выделено
два принципиально различных типа деконтаминации:
Микробная деконтаминация
объектов внешней среды
Микробная деконтаминация
живых организмов
Дезинфекция
Стерилизация
Антисептика
Химиотерапия
Асептика
33.
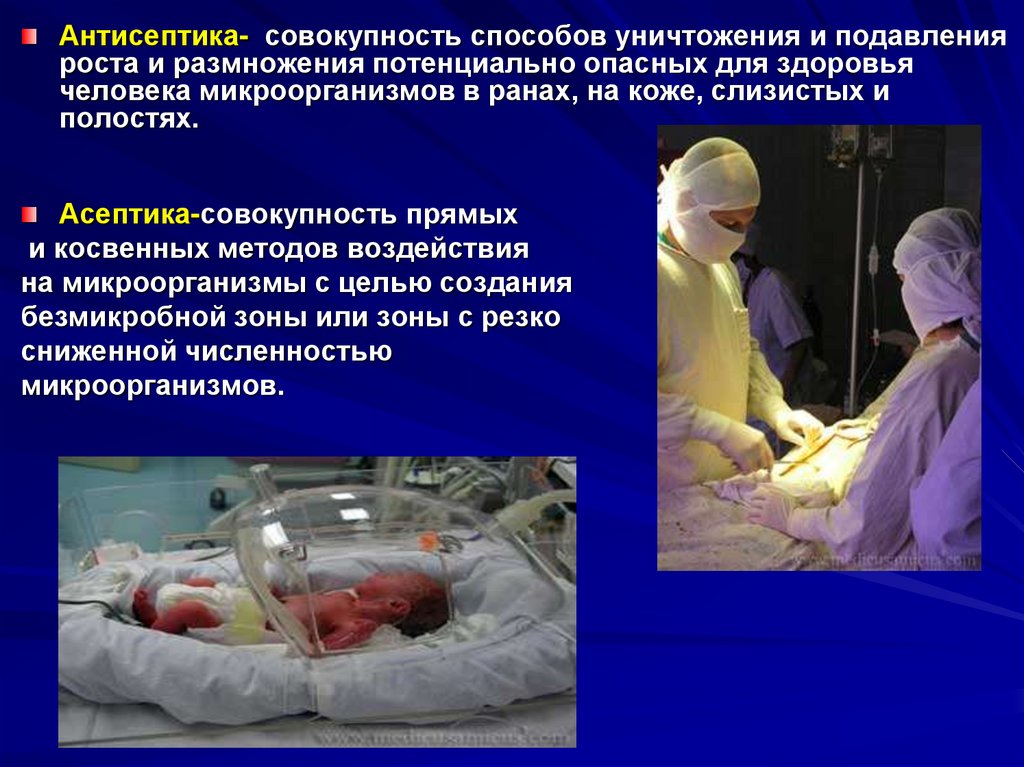
Антисептика- совокупность способов уничтожения и подавленияроста и размножения потенциально опасных для здоровья
человека микроорганизмов в ранах, на коже, слизистых и
полостях.
Асептика-совокупность прямых
и косвенных методов воздействия
на микроорганизмы с целью создания
безмикробной зоны или зоны с резко
сниженной численностью
микроорганизмов.
34.
ДЕЗИНФЕ́ КЦИЯкомплекс мероприятий, направленных на уничтожение
возбудителей инфекционных заболеваний и разрушение
токсинов на объектах внешней среды.
1. Профилактическая — проводится постоянно, независимо от
эпидемической обстановки.
2. Очаговая:
текущая — проводится при наличии инфекции с целью
предупреждения распространения инфекционных заболеваний
за пределы очага.
заключительная — проводится после изоляции,
госпитализации, выздоровления или смерти больного с целью
освобождения эпидемического очага от возбудителей.
35.
МЕТОДЫ ДЕЗИНФЕКЦИИ:Механический - основан на механических приемах удаления
возбудителей инфекционных заболеваний
Физический - воздействие различных видов высокой
температуры а также ультрафиолетового облучения, облучение
токами высокой частоты и ультразвуком.
Химический (основной способ) - уничтожении болезнетворных
микроорганизмов и разрушении токсинов дезинфицирующими
веществами.
Комбинированный.
автомат для мойки и дезинфекции
36.
СПОСОБЫ ДЕЗИНФЕКЦИИ:КИПЯЧЕНИЕ
ОРОШЕНИЕ
ПРОТИРАНИЕ
ПОГРУЖЕНИЕ (ЗАМАЧИВАНИЕ)
ЗАСЫПАНИЕ
37.
ТРЕБОВАНИЯК ДЕЗИНФЕКАНТАМ
ДЕЗИНФЕКТАНТЫ должны обладать
широким спектром действия
микробицидным эффектом,
хорошо растворяться в воде и образовывать стойкие активные
растворы
обладать низкой токсичностью и аллергенностью
сохранять активность в обеззараживаемой среде
не повреждать обеззараживаемые объекты
не иметь неприятного запаха
быть экологически чистыми
При химических способах
дезинфекции применяются
кислоты, щелочи, окислители,
соли тяжелых металлов,
фенолы, крезолы
38.
СТЕРИЛИЗАЦИЯполное освобождение объектов окружающей среды от
микроорганизмов и их спор.
39. МЕТОДЫ СТЕРИЛИЗАЦИИ, РАЗРЕШЕННЫЕ ДЛЯ ПРИМЕНЕНИЯ В ЛПУ.
Тип методаМетод
Стерилизующий агент
Физический
(термический)
Паровой
Водяной насыщенный пар под
избыточным давлением
Воздушный
Сухой горячий воздух
Инфракрасный
Инфракрасное излучение
Гласперленовый
Среда нагретых стеклянных шариков
Газовый
Окись этилена
Плазменный
Пары перекиси водорода в
сочетании с их низкотемпературной
плазмой
Жидкостный
Растворы химических средств
(альдегид-, кислород- и
хлорсодержащие)
Химический
40. Термическая стерилизация
Обжигание и кипячениеОбжигание в настоящее время для стерилизации инструментов не
используется. Метод можно применять в домашних условиях при
невозможности использования других. Обжигание металлических
инструментов проводится открытым пламенем. Обычно на металлический
поднос кладут инструмент, наливают небольшое количество этилового
спирта и поджигают его.
Кипячение долгое время было основным способом стерилизации
инструментов, но в последнее время применяется редко, так как при этом
методе достигается температура лишь в 100°С, что недостаточно для
уничтожения спороносных бактерий.
Инструменты кипятят в специальных электрических стерилизаторах
различной емкости. Инструменты в раскрытом виде (шприцы в
разобранном виде) укладывают на сетку и погружают в
дистиллированную воду (возможно добавление гидрокарбоната натрия до 2% раствора).
Обычное время стерилизации - 30 минут с момента закипания.
41. Термическая стерилизация (паровой метод)
Для достижения температур выше точкикипения воды пользуются автоклавом.
Автоклав представляет собой установку
для стерилизации паром под давлением.
Температура насыщенного пара зависит
от давления.
Режимы работы автоклава:
132 °C — 2 атмосферы(2 кгс/см2) — 20
минут — основной режим. Стерилизуют
все изделия (стекло, металл, текстиль,
КРОМЕ РЕЗИНОВЫХ).
120 °C — 1,1 атмосфера(1,1 кгс/см2) — 45
минут — щадящий режим. (стекло,
металл, резиновые изделия, полимерные
изделия — согласно паспорту, текстиль)
110 °C — 0,5 атмосферы(0,5 кгс/см2) —
180 мин — особо щадящий
режим(нестойкие препараты,
Компактный переносной
питательные среды)
автоклав
42.
ПАРОВАЯ СТЕРИЛИЗАЦИЯПреимущества:
Наиболее распространенный метод стерилизации
Безопасен для окружающей среды и медицинского персонала.
Короткая экспозиция.
Не обладает токсичностью.
Низкая стоимость.
Недостатки: Качество стерилизации
может быть нарушено при попадании
воздуха, повышенной влажности
материалов и плохом качестве пара.
Могут повреждаться изделия,
чувствительные к действию высокой
температуры и влажности
(коррозия металлических инструментов).
43.
ПАРОВАЯ СТЕРИЛИЗАЦИЯОСТ – 42-21-2-85. Отраслевой стандарт. Стерилизация и
дезинфекция изделий медицинского назначения.
Методы, средства, режимы.
Режимы стерилизации:
2,0 атм – 132*С – 20 мин
1, 1 атм – 120*С – 45 мин
Сроки хранения стерильного материала после паровой
стерилизации (не вскрывая упаковки)
бикс простой – 3 суток
бикс с бактериальным фильтром – 20 суток
крафт - пакет, заклеенный с двух сторон – 20 суток
крафт - пакет с двумя скрепками - 3 суток
бязевая упаковка - 3 суток
44. Термическая стерилизация (СУХОВОЗДУШНАЯ СТЕРИЛИЗАЦИЯ )
Сухой жар. Стерилизация осуществляется вспециальных аппаратах - сухо-жаровых шкафахстерилизаторах. Стерилизация в сухожаровом шкафу
происходит при помощи циркуляции внутри него горячего
воздуха.
При стерилизации сухим жаром бактериальные споры
переносят более высокие температуры и притом дольше,
чем при стерилизации влажным жаром. Поэтому
жаростойкую стеклянную посуду, порошки, масла и т. п.
стерилизуют в течение 1 часа при температуре 180°С.
Стерилизация в автоклаве и сухожаровом шкафу в
настоящее время является главным, наиболее
надежным способом стерилизации хирургических
инструментов, стеклянной посуды
45.
СУХОВОЗДУШНАЯ СТЕРИЛИЗАЦИЯОСТ – 42-21-2-85. Отраслевой стандарт. Стерилизация и
дезинфекция изделий медицинского назначения.
Методы, средства, режимы.
Особенности суховоздушной стерилизации: горячий воздух
плохо перемещается по камере и могут образоваться
«холодные» точки, поэтому, при загрузке шкафа материал
должен занимать только 2/3 объема шкафа.
Режимы стерилизации: 1800С – 1 час
1600С – 2, 5 часа
Сроки хранения стерильного материала после суховоздушной
стерилизации:
материал, простерилизованный без упаковки, используется
непосредственно сразу
крафт - пакет, заклеенный с двух сторон – 20 суток
крафт - пакет с двумя скрепками - 3 суток
46.
СУХОВОЗДУШНАЯ СТЕРИЛИЗАЦИЯПреимущества: Низкие коррозийные свойства.
Глубокое проникновение в материал Безопасен для окружающей
среды Не требует аэрации.
Недостатки: Длительная экспозиция. Температурные режимы и
время стерилизации отличаются в разных странах. Могут
повреждаться термолабильные изделия.
47. Термическая стерилизация (гласперленовый метод)
Принцип действия гласперленового стерилизатора основанна приведении стерилизуемых хирургических инструментов в
контакт с маленькими стеклянными сферами, имеющими
температуру 250С.
Стерилизатор предназначен для быстрой стерилизации
цельнометаллических, не имеющих полостей, каналов и
замковых частей, стоматологических и других медицинских
инструментов и приспособлений в среде нагретых до
температуры 190-290ºС стеклянных шариков при полном
погружении в них мелких изделий, а также рабочих частей
более крупных изделий.
Стерилизация инструмента производится в течение очень
короткого времени — не более 20 секунд. Благодаря такому
короткому периоду и неразрушающему воздействию
стерилизационных (глассперленовых) шариков на
инструмент, негативное влияние высокой температуры
практически отсутствует.
Всего за 5 секунд стерилизует: щипцы, клещи, скальпельдержатели, зонды, шпатели, долота, зубила, алмазы, файлы,
боры, корневые элеваторы, расширители, угловые
наконечники, иглодержатели, пинцеты, десневые ножницы и
т.д.
48. Термическая стерилизация (инфракрасный метод)
Малогабаритный стерилизаторпредназначен для
стерилизации
стоматологических и
микрохирургических
инструментов из металлов в
условиях госпиталей,
поликлиник, больниц и других
лечебных и косметологических
учреждений. Стерилизация
осуществляется инфракрасным
мощным кратковременным
тепловым воздействием.
49. Химическая стерилизация (газовый метод)
В мировой практике встречаются 3 основных методанизкотемпературной стерилизации: газовый этиленоксидный,
газовый формальдегидный и плазменный.
Газовая стерилизация осуществляется в специальных герметичных
камерах.
Стерилизующим агентом обычно являются: пары формалина (на дно
камеры кладут таблетки формальдегида) или окись этилена.
Инструменты, уложенные на сетку, считаются стерильными через 6-48
часов (в зависимости от компонентов газовой смеси и температуры в
камере).
Отличительной чертой метода является его минимальное
отрицательное влияние на качество инструментария, в связи с чем
способ используют прежде всего для стерилизации оптических, особо
точных и дорогостоящих инструментов.
50. Химическая стерилизация (газовый метод)
При стерилизации пищевых продуктов,лекарственных препаратов и разного рода
приборов, а также в лабораторной практике
оправдало себя применение окиси этилена,
которая убивает и вегетативные клетки, и
споры, но действует только в том случае, если
подвергаемые стерилизации материалы
содержат некоторое количество (5-15%) воды.
Окись этилена применяют в виде газовой смеси
(с N2 или С02), в которой ее доля составляет от
2 до 50%.
Этиленоксидный метод обеспечивает самый
щадящий температурный режим стерилизации.
51. Химическая стерилизация (плазменный метод)
Плазменный метод позволяет создать биоцидную среду наоснове водного раствора пероксида водорода, а также
низкотемпературной плазмы (ионизированный газ,
образующийся при низком давлении).
Это самый современный метод стерилизации, известный на
сегодняшний день. Он позволяет стерилизовать любые
медицинские изделия, от полых инструментов до кабелей,
электроприборов,к которым в ряде случаев вообще не
удается применить ни один из известных методов
стерилизации.
При этом методе после впрыскивания раствора перекиси
водорода в стерилизационную камеру включается источник
электромагнитного излучения частотой 13,56 Мгц, под
воздействием которого одновременно происходит деление
одной части молекул Н2О2 на две группы (ОН-), а другой
части - на одну гидропероксильную группу (ООН-) и один
атом водорода, сопровождающееся выделением видимого и
ультрафиолетового излучения. В результате создается
биоцидная среда, состоящая из молекул перекиси водорода,
свободных радикалов и ультрафиолетового излучения.
52.
Плазма образуется под воздействием сильного электромагнитного излучения ватмосфере паров перекиси водорода. При отключении электромагнитного поля
свободные радикалы преобразуются в молекулы воды и кислорода, не
оставляя никаких токсичных отходов.
Минимальное время обработки в плазменном стерилизаторе – от 35 минут,
рабочая температура – 36-60°С. Одно из основных преимуществ этого метода
– отсутствие токсичных отходов, образуются только кислород и водный пар.
Плазменная стерилизация уничтожает все формы и виды микроорганизмов.
Плазменные стерилизаторы – перспективное оборудование, но для
большинства российских медицинских учреждений слишком дорогостоящее
53. Химическая стерилизация (растворами антисептиков)
Стерилизация растворами химических антисептиков, также как лучевая и газоваястерилизация, относится к холодным способам стерилизации и не приводит к
затуплению инструментов, в связи с чем применяется для обработки прежде всего
режущих хирургических инструментов.
Для стерилизации в основном используют три раствора: тройной раствор, 96° этиловый
спирт и 6% перекись водорода. В последнее время для холодной стерилизации
оптических инструментов стали применять спиртовой раствор хлоргексидина, первомур
и другие.
Для холодной стерилизации инструменты полностью погружают в раскрытом (или
разобранном) виде в один из указанных растворов. При замачивании в спирте и
тройном растворе инструменты считаются стерильными через 2-3 часа, в перекиси
водорода - через 6 часов.
Данный метод представляет интерес для стерилизации растворов, содержащих
лекарственные вещества, изменяющиеся при воздействии высокой температуры.
В качестве антисептиков находят применение: фенол, трикрезол, хинозол, нипагин,
нипазол, хлорэтон, меркурофен и цефирол. В литературе имеются также сообщения о
применении для этой цели хлоркрезола, хлорбутола, фенилмеркурнитрата, соединений
четвертичного аммония (бензалконий, цетримид) и некоторых других веществ.
54.
Карболовая кислота входит в тройной раствор (раствор Крупенина). Имстерилизуют режущие инструменты и предметы из пластмасс. В нем
хранятся простерилизованные иглы, скальпели, корнцанги,
полиэтиленовые трубки.
Лизол с зеленым мылом используется для помывки стен, полов, мебели
операционно-перевязочного блока, а также для обработки инструментов,
резиновых перчаток, предметов, загрязненных гноем или калом во время
операции.
Сулема (дихлорид ртути) 1 : 1000, 1 : 3000 Стерилизуются перчатки,
дренажи и другие предметы.
Оксицианид ртути 1 : 10000 применяется для стерилизации
мочеточниковых катетеров, цистоскопов и других инструментов с оптикой.
Диоцид - препарат ртути, сочетает в себе антисептические и моющие
свойства. Некоторые используют для обработки рук хирурга - руки моют в
тазу раствором 1 : 3000, 1 : 5000 - 6 мин.
Этиловый спирт применяется для стерилизации режущих инструментов,
резиновых и полиэтиленовых трубок, 96%-м спиртом дубят руки хирурги
перед операцией.
Хотя 70%-й спирт бактерициднее 96%-го, однако спорообразная инфекция
не погибает длительное время. Возбудители газовой гангрены и споры
сибирской язвы могут сохраняться в спирте в течение нескольких месяцев.
Для увеличения бактерицидности спиртовых растворов к ним добавляются
тимол (1 : 1000), 1%-й раствор бриллиантового зеленого (раствор
Баккала), формалин и др.
55.
Давно используются бактерицидные свойства галогенов. Н. И. Пироговприменял йод спиртовый 2%-й, 5%-й и 10%-й, еще не зная о
существовании микроорганизмов. Йод обладает бактерицидным и
спороцидным эффектом. Он и ныне не утратил своего значения. Однако
чаще используют его комплексные соединения с поверхностью активными веществами, так называемыми. йодофорами, к которым
относятся йодонат, йодопиродон, йодолан и др. Они чаще применяются
для обработки рук хирурга и операционного поля.
Соединения хлора издавна используются для дезинфекции (хлорная
известь) и стерилизация (гипохлорид натрия, хлорамин и др.).
Бактерицидность этих препаратов зависит от содержания в них активного
хлора. В хлорамине активного хлора 28-29 %, а дихлоризоциануровой
кислоте - 70-80 %, гипохлориде натрия - 9,5 %.
Перекись водорода (33 % перекись водорода - пергидроль) в 3 % и 6 %
концентрации используется для стерилизации и дезинфекции Она
безвредна для человека.
Смесь перекиси водорода с муравьиной кислотой, предложенная И. Д.
Житнюком и П. А. Мелехоым в 1970 г., была названа первомуром. В
процессе приготовления С-4 образуется надмуравьиная кислота - она и
является действующим началом. Используется для обработки рук хирурга
или стерилизации инструментов
В Чехословакии предложили перстерил для стерилизации резиновых и
полиэтиленовых трубок.
В России выпущен бета-пропиолактон. В концентрации 1 : 1000
синегнойная палочка в 2%-м растворе погибает в течение 10 мин. Его
добавляют в количестве 0,2% в готовые питательные среды, которые
затем инкубируют 2 ч при 37°С. Если оставить среду на ночь,
пропиолактон полностью разложится.
56. Стерилизация ионизирующим излучением
Антимикробная обработка может быть осуществлена с помощьюионизирующего излучения (у-лучи), ультрафиолетовых лучей и
ультразвука. Наибольшее применение в наше время получила
стерилизация у-лучами.
Радиационный метод или лучевую стерилизацию γ-лучами, применяют в
специальных установках при промышленной стерилизации однократного
применения- полимерных шприцев, систем переливания крови, чашек
Петри, пипеток и др.хрупких и термолабильных изделий.
Используются изотопы Со60 и Cs137. Доза проникающей радиации
должна быть весьма значительной - до 20-25 мкГр, что требует
соблюдения особо строгих мер безопасности. В связи с этим лучевая
стерилизация проводится в специальных помещениях и является
заводским методом стерилизации (непосредственно в стационарах она не
производится).
Стерилизация инструментов и прочих материалов проводится в
герметичных упаковках и при целостности последних сохраняется до 5
лет. Герметичная упаковка делает удобными хранение и использование
инструментов (необходимо просто вскрыть упаковку). Метод выгоден для
стерилизации несложных одноразовых инструментов (шприцы, шовный
материал, катетеры, зонды, системы для переливания крови, перчатки и
пр.) и получает все более широкое распространение. Во многом это
объясняется тем, что при лучевой стерилизации нисколько не теряются
свойства стерилизуемых объектов.
57. Стерилизация ультрафиолетовым излучением
Источники УФ-излучения (длина волны 260 нм) — ртутныекварцевые лампы. Их мощное бактериостатическое
действие основано на совпадении спектра испускания лампы
и спектра поглощения ДНК микроорганизмов, что может
является причиной их гибели при длительной обработке
излучением кварцевых ламп,
при недостаточно мощном действии УФ в прокариотической
клетке активизируются процессы световой и темновой
репарации, то есть клетка восстанавливается.
Метод применяется для стерилизации помещений,
оборудования в биксах, а также для стерилизации
дистиллированной воды.
58.
Бактерицидная камерадля
хранения
стерильных
медицинских изделий
Рециркулятор
предназначен
для
обеззараживания воздуха помещений в
присутствии и отсутствии людей в процессе
принудительной циркуляции воздушного
потока через корпус, внутри которого
размещены две бактерицидные лампы
низкого давления.
Эффективный стерилизатор позволяющий
стерилизовать хирургические инструменты и
перевязочные материалы сухим теплом и
ультрафиолетовыми лучами. Имеет мощное
бактерицидное действие.
59. Механический метод стерилизации. Бактериальная фильтрация
Метод состоит в отделениимикробов от жидкости с
помощью стерильных
микропористых фильтров
Механизм фильтрации
объясняется главным образом
адсорбцией микробов,
происходящей в порах
фильтрующих материалов,
которые в большинстве случаев
заряжены отрицательно.
В качестве микропористого
фильтрующего материала
используют каолин, фарфор,
бумажно-асбестовую массу,
инфузорную землю, коллодий и
другие пористые материалы, а
также стекло.
60. Механический метод стерилизации. Бактериальная фильтрация
Механический метод стерилизации с помощьюмикропористых фильтров имеет некоторые
преимущества по сравнению с методами
тепловой стерилизации, когда раствор
подвергается воздействию высокой температуры.
Для многих растворов термолабильных веществ
он по существу является вообще единственным
доступным методом стерилизации.
Широкое применение находят микропористые
фильтры на химико-фармацевтических заводах
и при производстве вакцин и сывороток.
Бактериальные
фильтры
61.
КОНТРОЛЬ КАЧЕСТВА СТЕРИЛИЗАЦИИхимический — при каждой загрузке помещают химические
тесты - индикаторы стерилизации При достижении заданного
режима стерилизации тесты меняют свой цвет
термический — 2 раза в месяц максимальным термометром во
время стерилизации проводят замер температуры в
контрольных точках, которая должна достичь заданных
параметров
биологический — проводится 2 раза в год. В контрольных
точках помещают биотесты с термоустойчивой споровой
культурой.
62.
Стабильность лекарств достигаетсясоблюдением условий их приготовления,
выбором оптимальных условий
(температура, время) стерилизации,
применением допустимых антимикробных
средств, позволяющих достигать эффекта
стерилизации при более низких
температурах и, также, использованием
стабилизаторов - веществ, повышающих
химическую устойчивость лекарств.
63.
Консервация (лат. conservatio,сохранение) — действия,
направленные на долгосрочное
сохранение объектов
Для сохранения некоторых композиций в
фармации изредка приходится
использовать консерванты.
Для экстрактов роль консерванта нередко
выполняет этанол. К числу наиболее
распространённых консервантов для
мазей относятся парабены.






























































 Биология
Биология








