Похожие презентации:
ВКР: Иммобилизованный биокатализатор на основе адгезированных амидазосодержащих клеток родококков для синтеза акриловой кислоты
1. Иммобилизованный биокатализатор на основе адгезированных амидазосодержащих клеток родококков для синтеза акриловой кислоты
Министерство науки и высшего образования Российской ФедерацииФедеральное государственное бюджетное образовательное учреждение
высшего образования
«Пермский национальный исследовательский
политехнический университет»
Факультет химической технологии,
промышленной экологии и биотехнологии
Кафедра «Химия и биотехнология»
Направление: 19.03.01 – Биотехнология
Иммобилизованный биокатализатор на
основе адгезированных
амидазосодержащих клеток родококков
для синтеза акриловой кислоты
Выполнил: студент гр. БТ-15-1б Якимова М.С.
Руководитель: к.б.н., Максимов А.Ю.
Консультант: д.б.н. Максимова Ю.Г.
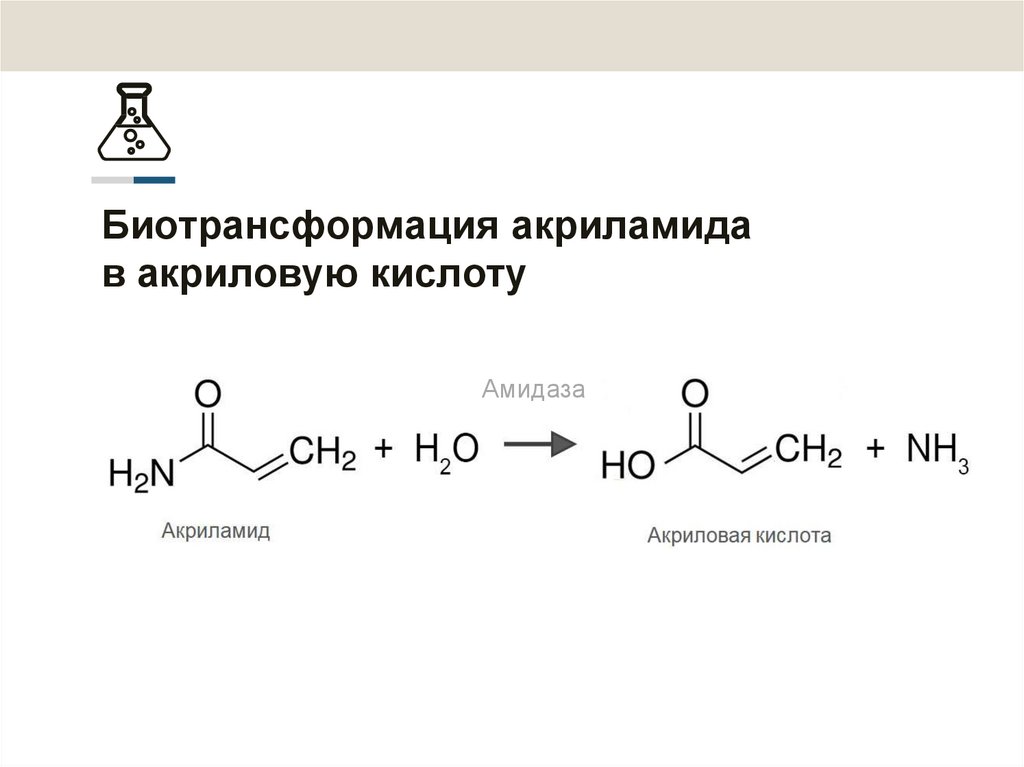
2. Биотрансформация акриламида в акриловую кислоту
Амидаза3. Биокатализ
ускорение с помощью ферментов химическихреакций, протекающих в живых организмах;
высокоэффективен;
происходит в более «мягких» условиях.
4. Иммобилизация клеток
отсутствие затрат на выделение и очистку
ферментов;
более высокая активность и стабильность
биокатализатора;
возможность создания непрерывных и
полунепрерывных автоматизированных
процессов;
снижение количества отходов.
5. Цель работы
Изучение процесса адгезии клеток родококковна углеродных носителях, оценка воздействия
физико-химических условий и иммобилизации
клеток на их амидазную активность
6. Задачи
1. Изучить зависимость адсорбции R. erythropolis 4-1 на углеродныхносителях от концентрации клеток в суспензии;
2. Изучить влияние концентрации субстрата, температуры, рН
реакционной среды на амидазную активность суспендированных
клеток бактериального штамма Rhodococcus erythropolis 4-1;
3. Определить влияние условий хранения клеток R. erythropolis 4-1
на их амидазную активность;
4. Изучить влияние концентрации субстрата, температуры, рН
реакционной среды на амидазную активность клеток R.
erythropolis 4-1, иммобилизованных на углеродных носителях.
7. Исследуемый бактериальный штамм
Rhodococcus erythropolis 4-1, обладающийамидазной активностью.
8. Носители – углеродные материалы
уголь-сырец, измельченный допорошкообразного состояния;
● уголь активный дробленый Norit PK 1–3
(Голландия);
● активированные вискозные
углеродные волокна Карбопон.
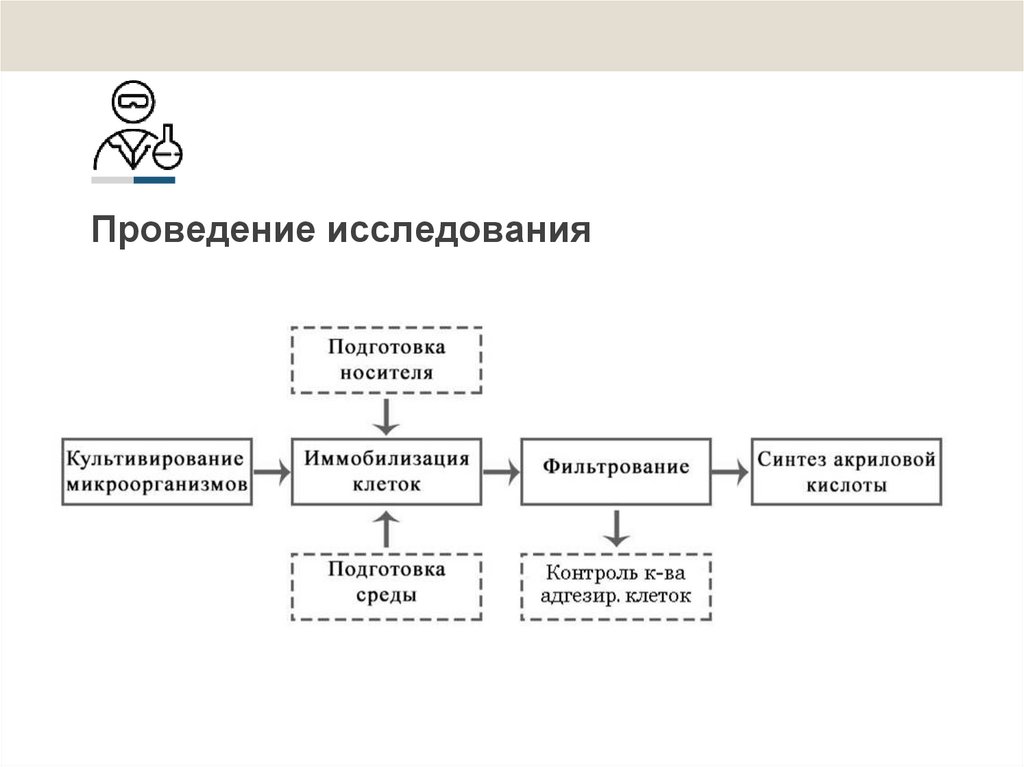
9. Проведение исследования
10. Определение количества адгезированных клеток
где:А – масса адгезированных клеток, мг;
m – концентрация клеток в суспензии до иммобилизации (мг/мл);
V – объем суспензии, из которого иммобилизовали клетки, мл;
ОДисх – оптическая плотность при 540 нм суспензии клеток до
адгезии;
ОДфильтр – оптическая плотность при 540 нм суспензии клеток
после адгезии.
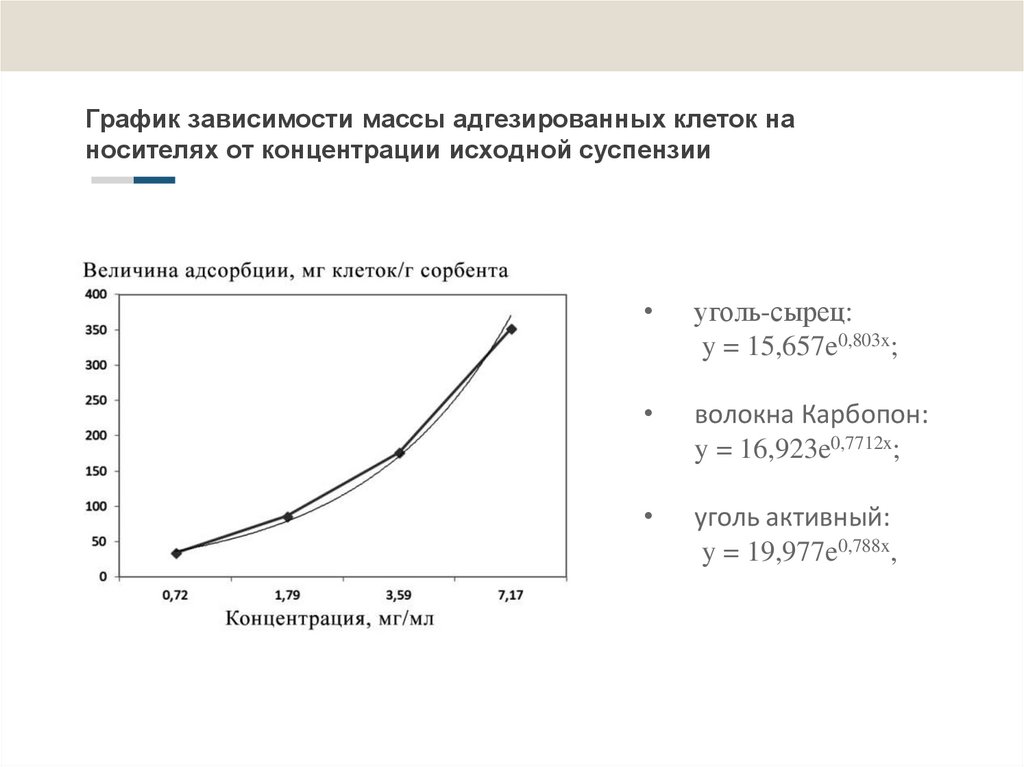
11. График зависимости массы адгезированных клеток на носителях от концентрации исходной суспензии
уголь-сырец:
y = 15,657e0,803x;
волокна Карбопон:
y = 16,923e0,7712x;
уголь активный:
y = 19,977e0,788x,
12. График зависимости активности свободных клеток от условий хранения культуры
13. Графики зависимости активности свободных и иммобилизованных клеток от температуры проведения реакции
4540
35
30
25
20
15
10
5
0
Активность, ммоль/г/ч
Активность, ммоль/г/л
Графики зависимости активности свободных и
иммобилизованных клеток от температуры проведения реакции
20
40
Температура, °С
а) контроль
60
60
50
40
30
20
10
0
0
20
40
Температура, °С
в) Карбопон
60
80
50
40
30
20
10
0
80
0
Активность, ммоль/г/л
Активность, ммоль/г/ч
0
60
20
40
60
Температура, °С
б) активный уголь
80
60
50
40
30
20
10
0
0
20
40
60
Температура, °С
г) уголь-сырец
80
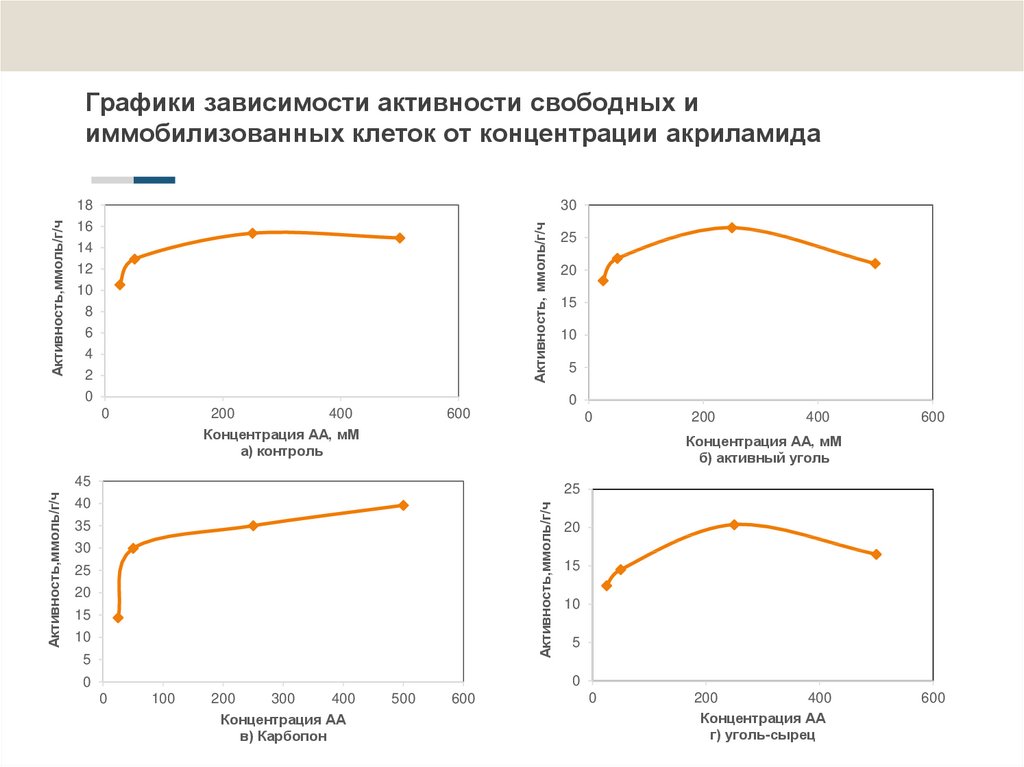
14. Графики зависимости активности свободных и иммобилизованных клеток от концентрации акриламида
1816
14
12
10
8
6
4
2
0
30
Активность, ммоль/г/ч
Активность,ммоль/г/ч
Графики зависимости активности свободных и
иммобилизованных клеток от концентрации акриламида
20
15
10
5
0
0
200
400
Концентрация АА, мМ
а) контроль
600
0
200
400
600
Концентрация АА, мМ
б) активный уголь
45
25
40
Активность,ммоль/г/ч
Активность,ммоль/г/ч
25
35
30
25
20
15
10
5
20
15
10
5
0
0
0
100
200
300
400
Концентрация АА
в) Карбопон
500
600
0
200
400
Концентрация АА
г) уголь-сырец
600
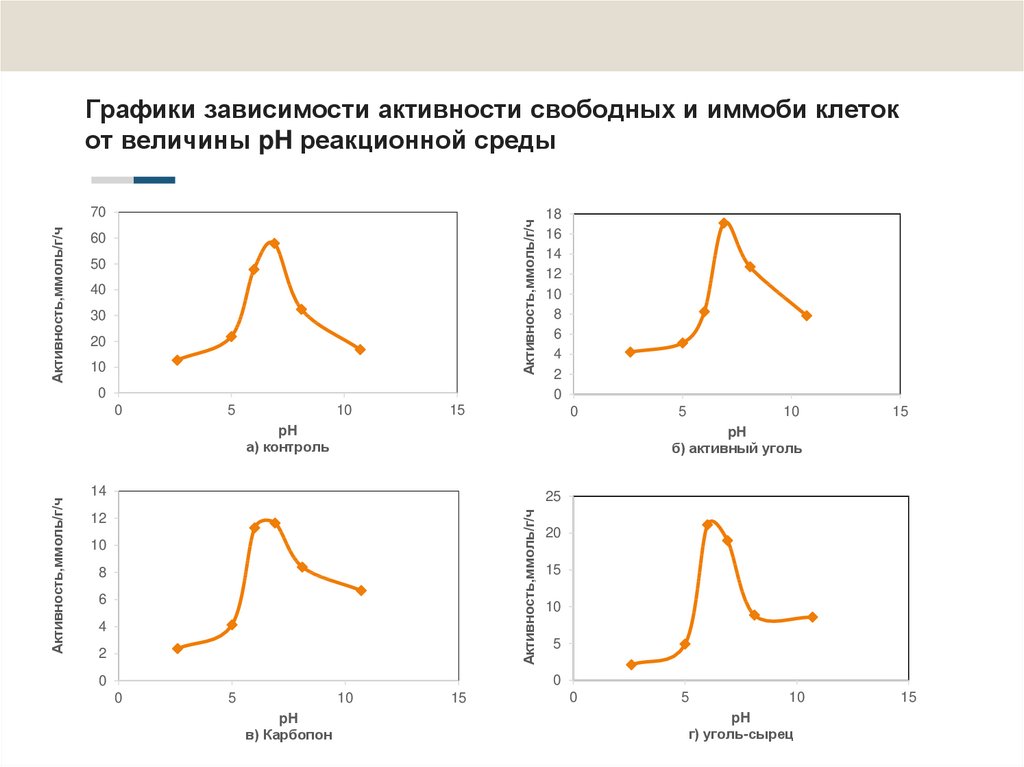
15. Графики зависимости активности свободных и иммоби клеток от величины pH реакционной среды
Активность,ммоль/г/чАктивность,ммоль/г/ч
70
60
50
40
30
20
10
0
0
5
10
18
16
14
12
10
8
6
4
2
0
15
0
14
5
10
pH
б) активный уголь
15
25
Активность,ммоль/г/ч
Активность,ммоль/г/ч
pH
а) контроль
12
10
8
6
4
2
20
15
10
5
0
0
0
5
10
pH
в) Карбопон
15
0
5
10
pH
г) уголь-сырец
15
16. Выводы
1. При изучении процесса адсорбции клеток R. erythropolis 4-1 на углеродныхносителях было показано, что масса адсорбированных клеток увеличивается
пропорционально концентрации суспензии, и в пределах изученных
концентраций суспензии (0,72 - 8,90 мг/мл) насыщение сорбента клетками не
наблюдается.
2. Определено, что амидазная активность свободных клеток R. erythropolis 4-1
максимальна при температуре 30ºС, рН 6,5 и концентрации субстрата 150 мМ.
3. Показано, что оптимальными условиями хранения биокатализатора является
замораживание при температурах -20 и -80ºС, тогда как высушивание клеток R.
erythropolis 4-1 приводит к снижению амидазной активности.
4. Показано, что углеродные носители выполняют защитную роль для
иммобилизованных клеток. При воздействии температуры 70ºС амидазная
активность адсорбированных клеток R. erythropolis 4-1 в 2-3 раза превышала
активность суспендированных клеток. При рН 10,7, у клеток, иммобилизованных
на активном угле, сохранялось 46%, на карбопоне - 58%, на угле-сырце - 41% от
максимальной амидазной активности, тогда как у свободных клеток - 29%.











 Биология
Биология Промышленность
Промышленность








