Похожие презентации:
Modifications post-traductionnelles et diversité fonctionnelle des protéines
1. LES MODIFICATION POST-TRADUCTIONNELLES: MPT-SUMO
Réalisée par : Bessioud OumaymaÉtudiante en 2éme année médecine génerale
2éme groupe
2. Modifications post-traductionnelles et diversité fonctionnelle des protéines :
Chaque cellule d’un organismecontient un ensemble d’informations
génétiques, dont la mise en oeuvre
obéit au dogme central de la biologie
moléculaire: l’information est
transmise des acides nucléiques à
une protéine , mais pas dans le sens
opposé. La règle a été formulée
par Francis Crick en 1958.
Le processus de transition
ADN → ARN est appelé transcription et
le processus de transition
ARN → protéine est
appelé traduction (Fig. 1).
3.
Les modifications post-traductionnelles sont alors un processusde régulation au niveau de la protéine. Le passage de l'ADN à
l'ARN et de l'ARN aux protéines n'est-il pas suffisant? Il s'avère
que non, cela ne suffit pas. Dans la cellule de tout organisme, il
existe une quantité énorme de protéines fonctionnellement
différentes:
* protéines structurelles (nécessaires à la structure de la
paroi cellulaire et des membranes)
*enzymes (nécessaires aux processus catalytiques)
*protéines régulatrices (jouent le rôle de régulateurs de
l'expression génique, de facteurs de transcription) etc.....
Parfois, une seule protéine peut remplir différentes fonctions
dans la cellule d’un même organisme, et c’est précisément à
quoi contribuent les modifications post-traductionnelles (PTM).
Les PTM consistent en la modification covalente de protéines
traduites à partir d'ARN. Ils jouent un rôle clé dans
l'hétérogénéité des protéines, à l'exclusion des protéines
identiques, leur dégradation, leur spécificité tissulaire, leur
régulation de l'activité. Par exemple, la PTM réalisée à l'extrémité
N-terminale de la chaîne polypeptidique facilite le transport des
protéines à travers les membranes biologiques.
4.
Grâce au PTM, une grande variété de protéines et defacteurs de transcription fonctionnellement actifs
peuvent être obtenus dans des cellules eucaryotes.
Par exemple, le facteur de transcription bien connu
p53(tumor protein), qui joue le rôle de suppresseur
de tumeur et participe à la régulation du cycle
cellulaire, subit plusieurs PTM, à savoir la
phosphorylation, l'acétylation et la glycosylation. Les
données PTM aident la protéine p53 à augmenter le
nombre de sites de liaison à l'ADN.
Ainsi, la PTM est nécessaire pour changer la
conformation, la localisation cellulaire, l'activité
enzymatique et les facteurs de transcription, la
régulation des interactions protéine-protéine et le
contrôle de la "vie" des protéines. Les protéines PTM
peuvent être réalisées de plusieurs manières .
5.
À ce jour, plus de 100 PTM sont connus. Lesplus courantes et étudiées sont:
glycosylation - addition d'un fragment
glucidique supplémentaire, généralement à
l'asparagine, à l'hydroxylysine, à la sérine ou
à la thréonine;
acétylation - l'addition d'un groupe acétyle
supplémentaire à l' extrémité N- terminale
de la chaîne polypeptidique;
méthylation - l'addition d'un groupe méthyle
supplémentaire à la lysine ou à l'arginine;
phosphorylation - l'addition d'un groupe
phosphate supplémentaire, généralement à la
sérine, à la thréonine ou à la tyrosine.
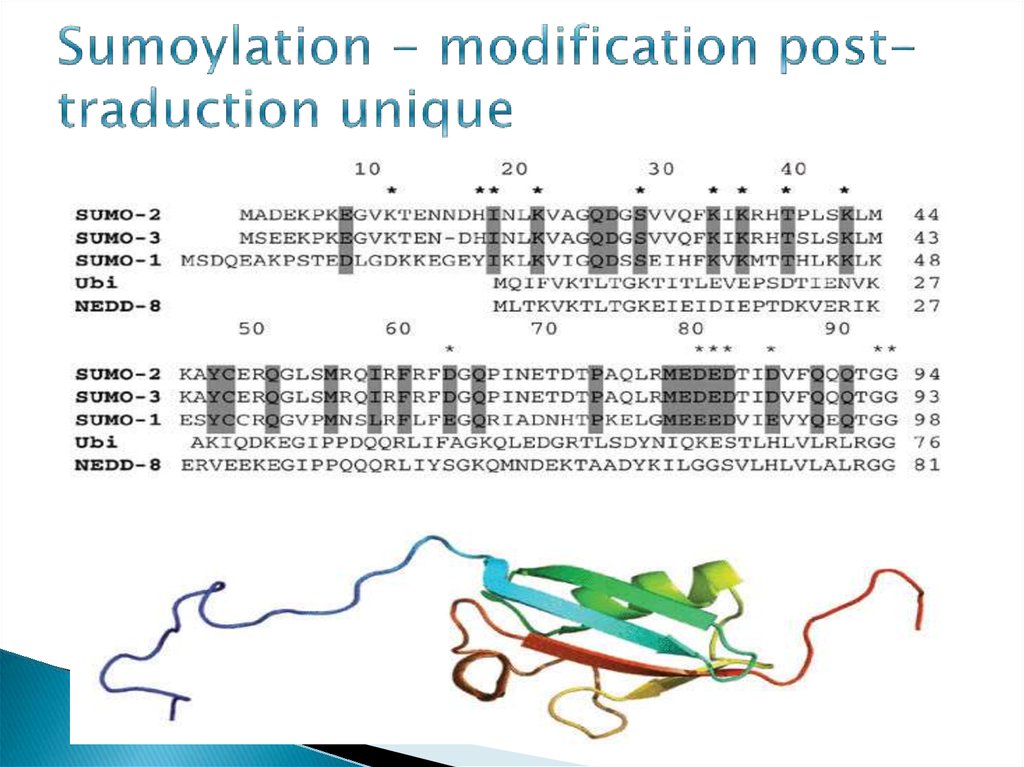
6. Sumoylation - modification post-traduction unique
7.
Le sumoying est un processus évolutif hautement conservéde la levure à l'homme. SUMO est exprimé dans tous les
organismes eucaryotes (levure, plantes, animaux), mais est
absent chez les bactéries (mais est présent dans
les archées ). La levure, les vers et les insectes expriment
une isoforme SUMO. Chez les vertébrés, plusieurs
isoformes ont été identifiées - SUMO1, SUMO2, SUMO3
(Fig. 2), qui se trouvent dans tous les tissus, et SUMO4, qui
est un pseudo gène. Bien que le mécanisme de
conjugaison de SUMO soit identique pour les trois
isoformes, différentes formes de protéines sont
caractérisées par différentes caractéristiques
fonctionnelles.
Examinons ensemble le processus de sumoylation: à quel
point une protéine si petite est-elle «puissante» ?
Rappelez-vous le dogme central de la biologie
moléculaire: ADN → ARN → protéine. La protéine SUMO est
synthétisée selon le même principe (ADN → ARN →
SUMO). Mais la protéine SUMO, juste synthétisée, ne peut
démarrer le processus de sumoylation et procéder à la
conjugaison de substrats protéiques. Pour devenir actif, il
doit d'abord subir une protéolyse *
8.
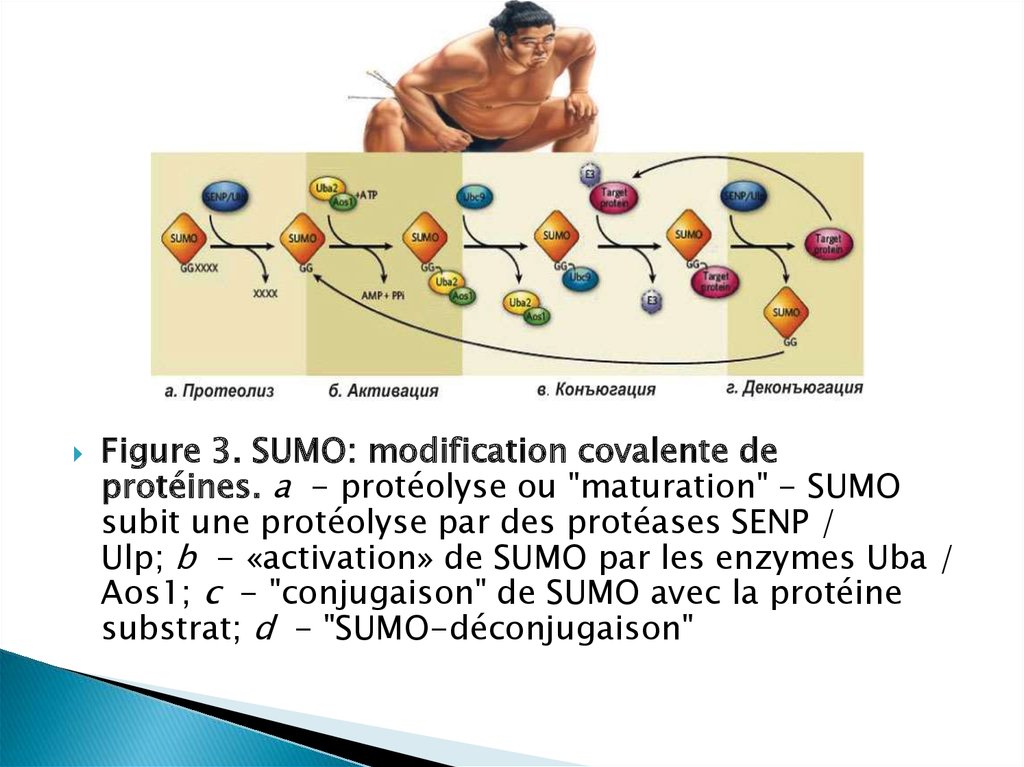
Figure 3. SUMO: modification covalente deprotéines. a - protéolyse ou "maturation" - SUMO
subit une protéolyse par des protéases SENP /
Ulp; b - «activation» de SUMO par les enzymes Uba /
Aos1; c - "conjugaison" de SUMO avec la protéine
substrat; d - "SUMO-déconjugaison"
9. La signification fonctionnelle du sumo et de la sommation
Comme il a déjà été mentionné précédemment, la première cibletrouvée pour la sumoylation était la protéine RanGAP1, dont
l'étude a pour la première fois montré le lien entre le transport
nucléaire et SUMO. La conjugaison de SUMO avec RanGAP1 est
réalisée via RanBP2 - protéine nucléaire: cette modification est
importante pour le transport nucléaire et la localisation de
RanGAP1. La perte de sumoylation peut entraîner une
perturbation du transport nucléaire RanGAP1 afin de lui
permettre de fonctionner normalement. De plus, la somme de
RanGAP1 est importante pour la fonction mitotique de Ran
Un fait intéressant est que la sumoylation peut être impliquée
dans la pathogenèse de nombreuses maladies
neurodégénératives. Il a été démontré que la sumoylation est
nécessaire au transport nucléaire du facteur DJ-1, qui supprime
l'activité transcriptionnelle de la protéine apoptotique p53, et
aux mutations souvent associées au développement de la forme
autosomique récessive précoce de la maladie de Parkinson (une
maladie neurodégénérative courante due à la perte progressive
de neurones dopaminergiques dans la substantia nigra pars
compacta (SNc))
10.
L'étude de la PTM de protéines liant l'ADN méthylique amontré que la sumoylation joue un rôle important dans la
régulation de leur activité. Par exemple, la sumoylation de la
protéine de liaison à l'ADN méthylique MBD1, d'une part,
n'empêche pas la liaison à l'ADN méthylé et, d'autre part, la
présence de cette modification entraîne la perte de l'activité
de répression de MBD1.
La signification fonctionnelle de la polyisolation est encore
mal comprise. Cependant, le rôle structurel des chaînes
SUMO-2/3 dans les cellules de mammifères a été montré. La
protéine CENP-E a subi une polysumoylation SUMO-2/3 et
est localisée au kinétochores 7 , ce qui est important pour
l'alignement des chromosomes au stade métaphasique au
cours de la mitose . Il y a des versions que la
polysumoylation peut, comme l'ubiquitinylation, conduire à
la dégradation des protéines. Par exemple, il a été démontré
que la PML suppressive tumorale pouvait subir une
polysumoylation et une dégradation du protéasome 26S. La
polysumoylation peut affecter d'autres PTM en protégeant
les sites de liaison du substrat protéique avec les enzymes
participant au PTM .
11.
Pour résumer la connaissance du nouveaupetit concurrent du sumo, nous pouvons
parler en toute sécurité de sa grande
importance et de la nécessité de réguler un
large éventail de processus cellulaires chez
tous les organismes vivants, de la levure à
l'homme. Les connaissances acquises sur la
protéine SUMO peuvent intéresser non
seulement les amateurs d’art japonais, mais
également les admirateurs de la biologie.










 Биология
Биология Лингвистика
Лингвистика





