Похожие презентации:
Основные классы неорганических соединений
1. Основные классы неорганических соединений
2.
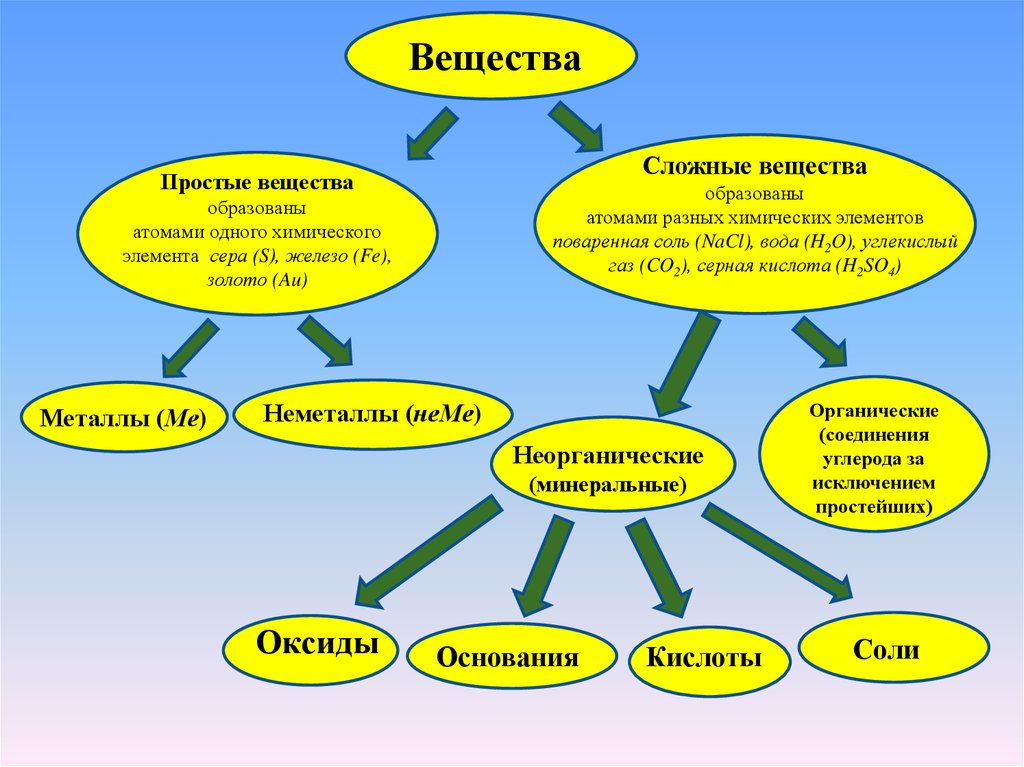
ВеществаСложные вещества
Простые вещества
образованы
атомами разных химических элементов
поваренная соль (NaCl), вода (H2O), углекислый
газ (CO2), серная кислота (H2SO4)
образованы
атомами одного химического
элемента сера (S), железо (Fe),
золото (Au)
Металлы (Ме)
Неметаллы (неМе)
Неорганические
(минеральные)
Оксиды
Основания
Кислоты
Органические
(соединения
углерода за
исключением
простейших)
Соли
3.
4.
ОксидыСолеобразующие
Несолеобразующие
В результате химических реакций
образуют соли
CuO + 2HCl → CuCl2 + H2O
CO2 + 2NaOH → Na2CO3 + H2O
Не реагируют с кислотами и
основаниями, не образуют солей
СО, N2O, NO, SiO
Амфотерные
Основные
соответствуют
основания
Na2O, K2O, MgO,
CaO
Кислотные
в состав входит элемент с амфотерными
свойствами (проявляющий и основные и
кислотные свойства в зависимости от условий)
соответствуют
кислоты
CO2, SO3, P2O5, N2O3,
Cl2O5, Mn2O7
ZnO
5.
6.
7.
8.
9.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ:• Основные оксиды взаимодействуют с водой, образуя щёлочи, большинство кислотных
оксидов при взаимодействии с водой образуют кислоты:
K2O + H2O = 2KOH
SO3 + H2O = H2SO4
Амфотерные оксиды с водой не взаимодействуют!
• Основные и амфотерные оксиды при взаимодействии с кислотами образуют соль и воду:
CuO + 2HCl = CuCl2 + H2O
CaO + H2SO4 = CaSO4 + H2O
ZnO + 2HCl = ZnCl2 + H2O
Кислотные оксиды с кислотами не взаимодействуют!
• Кислотные оксиды при взаимодействии с основаниями образуют соль и воду,
амфотерные оксиды - комплексную соль:
CO2 + 2NaOH = Na2CO3 + H2O
SO3 + 2KOH = K2SO4 + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
t
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Основные оксиды с основаниями не взаимодействуют!
• Основные и кислотные оксиды при взаимодействии образуют соли:
CaO + CO2 = CaCO3
10.
11.
12.
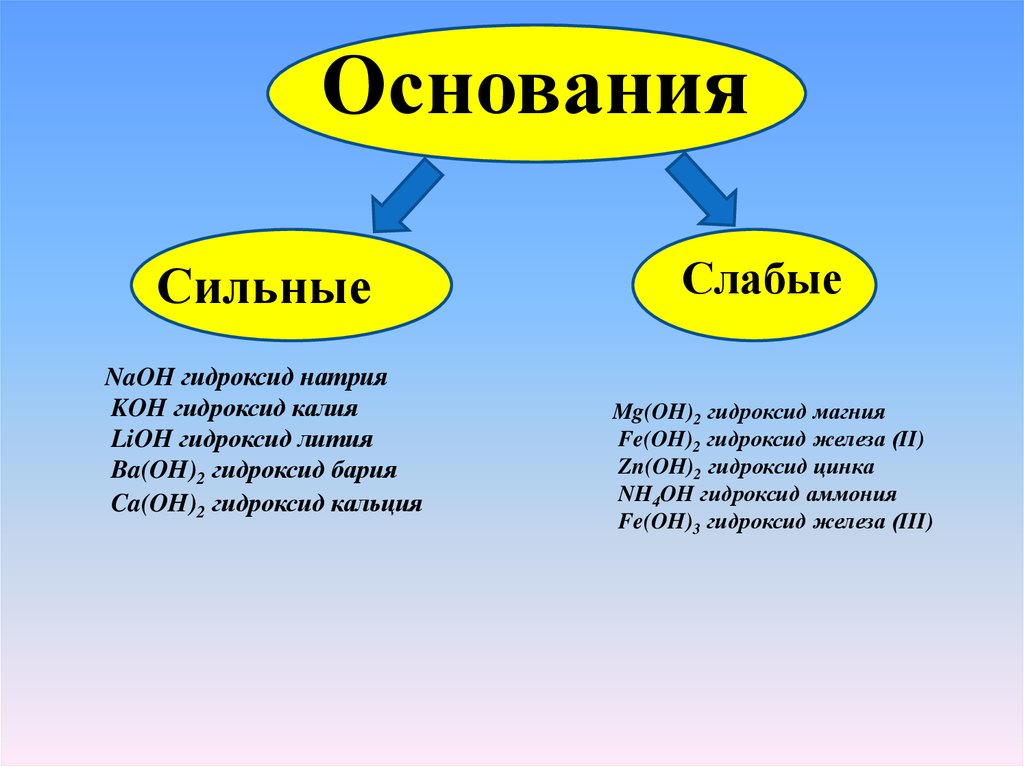
ОснованияСильные
NaOH гидроксид натрия
KOH гидроксид калия
LiOH гидроксид лития
Ba(OH)2 гидроксид бария
Ca(OH)2 гидроксид кальция
Слабые
Mg(OH)2 гидроксид магния
Fe(OH)2 гидроксид железа (II)
Zn(OH)2 гидроксид цинка
NH4OH гидроксид аммония
Fe(OH)3 гидроксид железа (III)
13.
Физические свойства оснований:Щёлочи - твёрдые белые кристаллические вещества (за
исключением NH4OH - прозрачная жидкость), хорошо
растворимые в воде. Растворение, как правило, сопровождается
выделением тепла. Водные растворы щелочей мылкие на ощупь,
едкие. Разъедают кожу, ткань.
Нерастворимые основания - твёрдые вещества, имеющие
разнообразную окраску
14.
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ:• Реагируют с кислотами с образованием соли и воды:
2KOH + H2SO4 = K2SO4 + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
• Взаимодействуют с солями:
2NaOH + CuCl2 = Cu(OH)2 + 2NaCl
• Нерастворимые основания разлагаются при нагревании:
t
Cu(OH)2 = CuO + H2O
15.
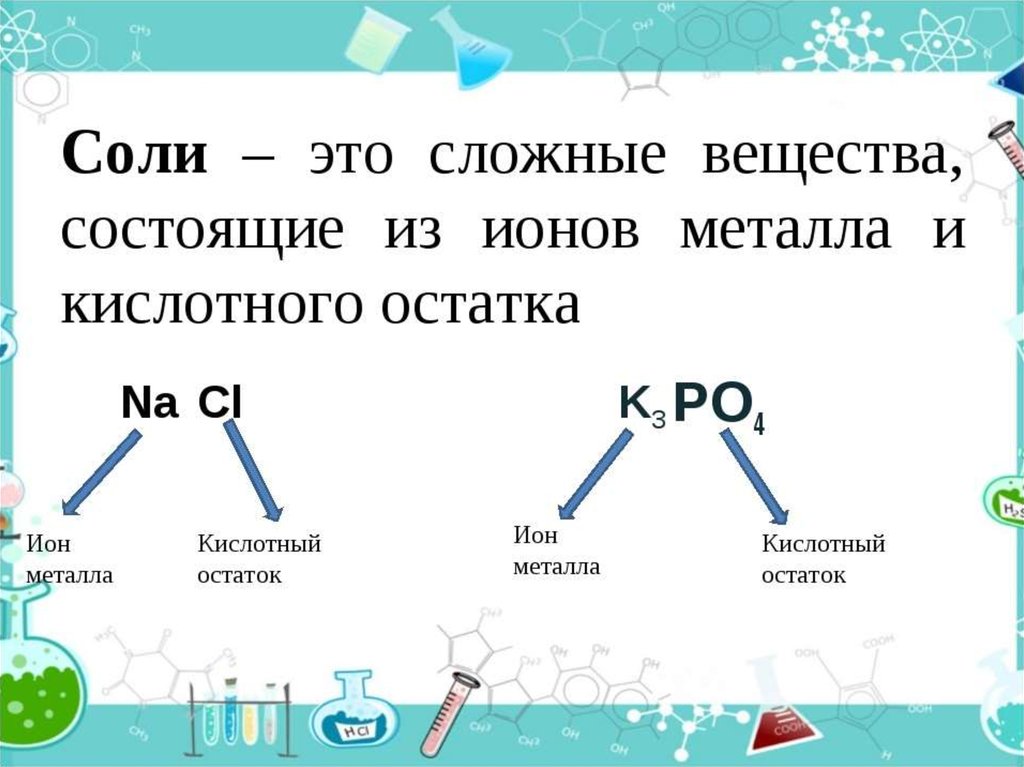
Атомы водорода в кислоте способны замещаться на металл собразованием солей
Zn + 2HCl → ZnCl₂ + H₂↑
Fe + H2SO4 → FeSO4 + H2↑
3Ca + 2H3PO4= Ca3(PO4)2+ 3H2↑
16.
Кислоты(по наличию атомов кислорода)
Кислородсодержащие
H2SO4
Бескислородные
HCl
17.
Кислоты(по числу атомов водорода в молекуле,
способных замещаться на металл)
Одноосновные
HCl
Двухосновные
H2SO4
Трёхосновные
и т.д.
(многоосновные)
H3PO4
18.
19.
20.
21.
22.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ:• Взаимодействуют с металлами, стоящими в
электрохимическом ряду напряжений до водорода:
Ca + H2SO4(р-р) = CaSO4 + H2↑
Ca + 2HCl = CaCl2 + H2↑
актМе + H2SO4(конц) ≠
актМе + HNO3(конц, р-р) ≠
• Взаимодействуют с солями:
H2SO4 + BaCl2 =BaSO4↓ + 2HCl
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
HCl + AgNO3 = AgCl↓ + HNO3
• При нагревании кислоты разлагаются:
t
H2SiO3 = SiO2 + H2O
t
H2 S = S + H2 ↑
23.
Наличие кислот и щелочей в растворе можноустановить с помощью индикаторов - веществ, обратимо
изменяющих цвет в зависимости от среды раствора
24.
25.
26.
27.
28.
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ:• Взаимодействуют с другими солями:
BaCl2 + K2SO4 = BaSO4 + 2KCl
Взаимодействуют с металлами:
Fe + CuSO4 = Cu + FeSO4
• Разлагаются под действием температуры:
t
CaCO3 = CaO + CO2↑
t
NH4Cl = NH3↑ + HCl
29.
30. Генетический ряд металла
МеталлNa
Основный
оксид
Na2O
Основание
NaOH
Соль
NaCl
31. Генетический ряд неметалла
НеметаллS
Кислотный
оксид
SO2
Кислота
H2SO3
Соль
Na2SO3





























 Химия
Химия








