Похожие презентации:
Окислительно-восстановительные реакции. Лекция 8
1.
Лекция 8Окислительно-восстановительные
реакции
2.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ1 1
1 1
0
0
Например: 2 H I Br 2 2 H Br I 2 или
0
0
2 I Br 2 2 Br I 2
Окислительно-восстановительными называют взаимодействия, связанные с
передачей электронов от одних атомов к другим.
Окисление металла:
2 2
1 0
Cu O 2 Cu O
2
0
2 2
0
0
Восстановление металла из его оксида: Cu O H 2 Cu H 2 O
Окислителем называют ион, который при взаимодействии принимает электроны;
восстановителем - ион, отдающий электроны.
3.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ3 1
2 1
2 1
4 1
2 Fe Cl 3 Sn Cl 2 2 Fe Cl 2 Sn Cl 4
или
3
2
2
4
2 Fe Sn 2 Fe Sn
При окислении степень окисления атома увеличивается;
при восстановлении – уменьшается.
4.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСтепень окисления – это формальный заряд атома в молекуле, определенный из
предположения ионного строения соединения или полного смещения электронов к
более электроотрицательному атому.
Степень окисления (С.О.) обозначается соответствующей цифрой и знаком,
стоящим перед ней, которые записывают над элементом. Степень окисления
часто не совпадает с валентностью элемента.
Например:
1 7 2
K Mn O 4
5.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПравила определения степени окисления
1. Степень окисления элемента в простом веществе равна нулю:
0
0
0
0
H 2 ; N 2 ; Cl 2 ; O 3
2. Степень окисления элемента в соединении ионного строения,
2 1
который находится в виде одноатомного иона, равна заряду
Mg Cl 2 Mg 2 2Cl
иона:
3 1
Al F 3 Al 3 3F
3. В соединениях с ковалентной полярной связью отрицательный
заряд относится к более электроотрицательному элементу:
1 1
ЭО Н 2; С.О. 1, кроме.солеобразных.гидридов. Li H
Для щелочных щелочноземельных металлов СО=+1 и +2
соответственно.
ЭО F 4; C.O. 1;
ЭОО 3,5; С.О. 2,
1
1
2 1
кроме. H 2 O 2 ; O F 2
4. Алгебраическая сумма С.О. элементов в нейтральной молекуле равна нулю; в сложном
ионе – заряду иона (принцип электронейтральности);
6.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТНапример:
В молекуле фосфорной кислоты степень окисления фосфора равна +5, так как
три атома водорода со степенью окисления +1 дают суммарный заряд +3, четыре
атома кислорода со степенью окисления –2 дают суммарный заряд –8. Для
электронейтральности молекулы фосфорной кислоты заряд у фосфора должен
1 5 2
быть +5:
H 3 PO4
В углеводородах и их производных степень окисления углерода
определяется без учета степени окисления соседнего атома углерода, т.е.
углерод-углеродная связь считается нулевой степени окисления.
Например: В этане степень окисления углерода составляет –3; в пропане –3 и –2:
3 1
3 1
С H 3 C H 3
3 1
2 1
3 1
С H 3 C H 2 C H 3
7.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТТипы окислительно-восстановительных реакций
- межмолекулярные реакции, в которых перераспределение электронов происходит
0
0
3
2
между разными веществами: 2 Al 3 O 2 Al 2 O 3
- реакции диспропорционирования или самоокисления самовосстановления – это
реакции, в которых один и тот же элемент и отдает, и принимает электроны:
1 3 2
1 5 2
3 1
4 H 3 P O 3 3 H 3 P O4 P H 3
- внутримолекулярные реакции, в которых окислитель и восстановитель входят в
1
0
3 2
1 2
состав одной и той же молекулы: 3 1 6 2
N H 4 Cr2 O7 N 2 Cr 2 O 3 4 H 2 O
2
- реакции конпропорционирования, в которых происходит выравнивание степеней
окисления атомов одного и того же элемента, находящихся в исходном веществе в
3 1 3 2
0
1 2
разных состояниях:
N H 4 N O2 N 2 2 H 2 O
8.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМетоды определения стехиометрических коэффициентов ОВР
1. Метод электронного баланса;
2. Метод полуреакций (электронно-ионного баланса).
9.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПример: Подобрать стехиометрические коэффициенты в ОВР методом
электронного баланса: Na 2 SO3 NaOH Cl 2
Решение:
1. Составить схему химической реакции: Na 2 SO3 NaOH Cl 2 Na 2 SO4 NaCl H 2 O
2. Рассчитать СО атомов соединений, входящих в уравнение реакции:
4
6
0
1
Na 2 S O3 NaOH Cl 2 Na 2 S O4 Na Cl H 2 O
3. Определить окислитель и восстановитель:
0
Cl 2 2e 2Cl 1
окислитель:
4
6
восстановитель: S 2e S
4. Составить уравнения электронного баланса, учитывая закон
0
электронейтральности: окислитель | Cl 2 2e 2Cl 1 | 2 | 1 | процесс.восстановления
4
6
восстановитель | S 2e S
| 2 | 1 | процесс.окисления
Число электронов, принятых окислителем, должно равняться числу электронов, отданных
восстановителем.
10.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ5. Написать суммарное уравнение, сложив эти уравнения:
0
окислитель | Cl 2 2e 2Cl 1 | 2 | 1 | процесс.восстановления
4
6
восстановитель | S 2e S
| 2 | 1 | процесс.окисления
_________________________________________
4
0
6
S 2e Cl 2 2e S 2Cl 1
6. Определить ионы, не подвергавшиеся изменению, и составить уравнение в
молекулярном виде, указав стехиометрические коэффициенты:
Na 2 SO3 2 NaOH Cl 2 Na 2 SO4 2 NaCl H 2 O
11.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВнешний вид выполненного задания методом электронного баланса:
4
6
0
1
Na 2 S O3 NaOH Cl 2 Na 2 S O4 Na Cl H 2 O
0
окислитель | Cl 2 2e 2Cl 1 | 2 | 1 | процесс.восстановления
4
6
восстановитель | S 2e S
| 2 | 1 | процесс.окисления
_________________________________________
4
6
0
S 2e Cl 2 2e S 2Cl 1
4
0
6
1
Na 2 S O3 2 NaOH Cl 2 Na 2 S O4 2 Na Cl H 2 O
12.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПример подбора коэффициентов методом электронно-ионного баланса:
1. Составить схему химической реакции (написать исходные вещества и
продукты реакции): KMnO4 KI H 2 SO4 I 2 MnSO4 K 2 SO4 H 2 O
2. Определить окислитель и восстановитель, а также продукт восстановления
окислителя (его восстановленную форму) и продукт окисления восстановителя
7
1
0
2
(его окисленную форму): K Mn O K I H SO I 2 Mn SO K SO H O
4
7
2
4
2
4
2
4
2
окислитель | Mn 5e Mn
1
0
восстановитель | 2 I 2e I 2
3. Сопоставить уравнения процесса восстановления иона-окислителя и процесса
окисления иона-восстановителя:
7
4
2
окислитель | Mn O 8 H 5e Mn 4 H 2 O | 2 | 10 | процесс.восстановления
1
0
| 5 | 10 | процесс.окисления
восстановитель | 2 I 2e I 2
13.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ4. Учесть закон электронейтральности, т.е. прировнять число зарядов продуктов
реакции числу зарядов исходных веществ. И после умножения на
соответствующие коэффициенты, получим:
7
4
2
окислитель | 2 Mn O 16 H 10e 2 Mn 8 H 2 O | процесс.восстановления
1
0
| процесс.окисления
восстановитель | 10 I 10e 5 I 2
5.
Так как процесс восстановления возможен только если есть процесс
окисления, то следует сложить оба уравнения:
7
4
2
окислитель | 2 Mn O 16 H 10e 2 Mn 8 H 2 O | процесс.восстановления
1
0
| процесс.окисления
восстанови
тель
|
10
I
10
e
5
I
2
_______________________________________________
7
4
1
2
0
2 Mn O 16 H 10 I 2 Mn 8 H 2 O 5 I 2
14.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ6. Определить ионы не подвергшиеся изменению в процессе реакции и из
совокупности всех ионов составить молекулярное уравнение:
7
1
0
2
2 K Mn O4 10 K I 8 H 2 SO4 5 I 2 2 Mn SO4 6 K 2 SO4 8 H 2 O
Когда написаны все коэффициенты, необходимо еще раз проверить, одинаковое
ли количество атомов всех элементов находится в левой и правой частях
уравнения.
15.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВнешний вид выполненного задания методом электронно-ионного баланса:
7
1
2
0
K Mn O4 K I H 2 SO4 I 2 Mn SO4 K 2 SO4 H 2 O
7
4
2
окислитель | Mn O 8 H 5e Mn 4 H 2 O | 2 | 10 | процесс.восстановления
1
0
восстановитель | 2 I 2e 5 I 2
| 5 | 10 | процесс.окисления
_______________________________________________
7
4
1
2
0
2 Mn O 16 H 10 I 2 Mn 8 H 2 O 5 I 2
7
1
0
2
2 K Mn O4 10 K I 8 H 2 SO4 5 I 2 2 Mn SO4 6 K 2 SO4 8 H 2 O
16.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТИспользование метода полуреакций позволяет:
1. Избежать формального представления о степени окисления;
2. Составить сокращенное уравнение окислительно-восстановительной реакции;
3. Выявить влияние среды на характер процесса.
Метод полуреакций (электронно-ионного баланса) применим лишь для описания и
подбора коэффициентов окислительно-восстановительных процессов протекающих в растворах.
Метод электронного баланса более универсален, поскольку
устанавливает стехиометрические отношения в процессах
восстановления в любых гомогенных и гетерогенных системах.
формально
окисления-
17.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТНапример:
7
4
4
2
2 K Mn O4 5 H 2 C 2 O4 3H 2 SO4 10 C O2 K 2 SO4 2 Mn SO4 8 H 2 O
1 2 2 3
3 2 2 1
H O O C C O O H
4 2
C O2
Например:
4
2
0
H 2 S O3 2 H 2 S 3 S 3H 2 O
4
7
2 6
6
6
5 H 2 S O3 2 K Mn O4 2 Mn S O4 2 H 2 S O4 K 2 S O4 3H 2 O
Окислитель и восстановитель реагируют между
окислительно-восстановительных эквивалентов.
собой
в
отношении
их
18.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭквивалентом окислителя называют такое массовое количество окислителя,
которое отвечает одному присоединенному электрону в данной окислительновосстановительной реакции:
М
Эокисл.
ne
Эквивалентом восстановителя называют такое массовое количество
восстановителя, которое отвечает одному отданному электрону в данной
окислительно-восстановительной реакции.
Эвосст.
М
ne
19.
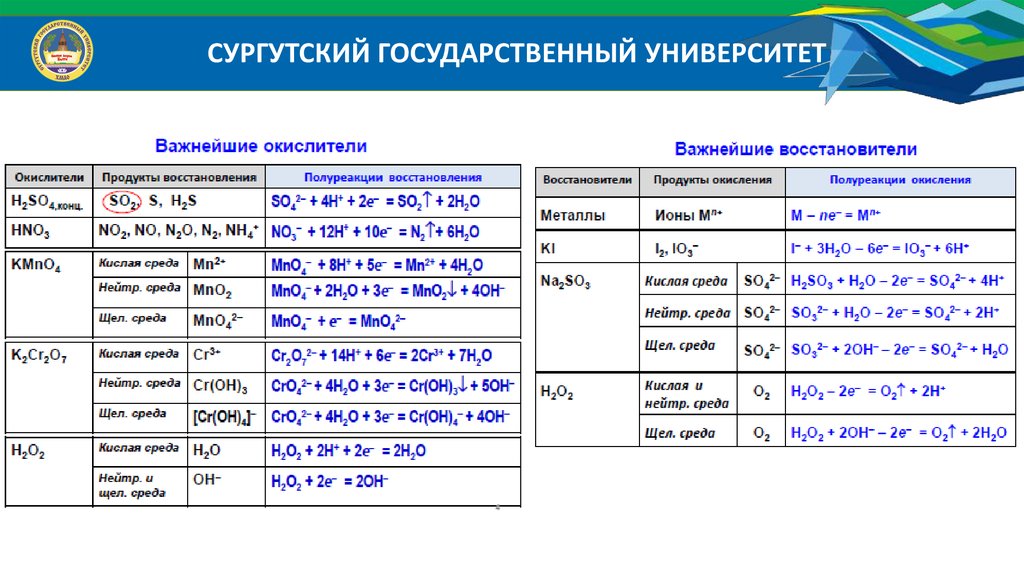
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ20.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКоличественной характеристикой окислительно-восстановительной активности
веществ
является
электродный
или
окислительно-восстановительный
(восстановительный) потенциал (Е).
Окислительно-восстановительный (электродный) потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction) — мера способности химического вещества присоединять электроны (восстанавливаться). Выражается в
милливольтах (мВ).
21.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЧем больше стандартный восстановительный потенциал, тем сильнее данное
вещество как окислитель и слабее как восстановитель.
В ОВР окислителем является
восстановительный потенциал.
Восстановителем
является
восстановительный потенциал.
то
то
вещество,
вещество,
для
для
которого
которого
Величина
равновесного
восстановительного
потенциала
уравнением Нернста:
RT a восст
0
Е восст / окисл Е восст / окисл
ln
nF a окисл
F=96485 Кл/моль– число Фарадея;
a – активность окисленной и восстановленной форм соединений;
n – количество электронов, участвующих в процессе.
больше
меньше
определяется
22.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПосле преобразования уравнение Нернста принимает вид:
0,059 a восст
0
Е восст / окисл Е восст / окисл
lg
n
a окисл
Для разбавленных растворов активности могут быть заменены концентрациями:
0,059 [восст.]
0
Е восст / окисл Е восст
lg
/ окисл
n
[окисл.]
Если стехиометрические коэффициенты окисленной и восстановленной форм
данной пары не равны единице, то они должны входить в уравнение Нернста в
качестве показателей степеней.
0
Например: Cl 2 2e 2Cl
Е восст / окисл Е
0
восст / окисл
0,059 [Cl ] 2
lg
2
[Cl 2 ]
23.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТДля сложных ионов:
7
Mn O4 8 H 5e Mn 2 4 H 2 O
и для пары
7
Mn O4 8 H / Mn 2 4 H 2 O
уравнение Нернста примет вид:
0
Е восст / окисл Е восст
/ окисл
0,059
[ Mn 2 ]
lg
5
[ MnO4 ] [ H ]8
24.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТРассмотрим на примере:
7
Mn O4 8 H 5e Mn 2 4 H 2 O
6
SO
4
2
4
2
3
SO
4
2 H 2e S O32 H 2 O
6
H 2 O 2e S O42 2 H
E 1,51B
E 0,90 B
E 0,90 B
Суммарно:
7
окислитель | Mn O4 8 H 5e Mn 2 4 H 2 O | 2 | 10 | процесс.восстановления
4
2
3
восстановитель | S O
6
H 2 O 2e S O42 2 H | 5 | 10 | процесс.окисления
______________________________________________________________________
7
2 Mn O4 6 H 5SO32 2 Mn 2 5SO42 3H 2 O
25.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТДля определения самопроизвольности протекания процесса можно определить
его электродвижущую силу (э.д.с.), как разность стандартных электродных
потенциалов окислителя и восстановителя:
0
0
Э. Д .С. Е окисл
Е
.
восст.
Следовательно Э.Д.С. рассмотренной ОВ реакции равна:
0
0
Э. Д .С. Е окисл
Е
.
восст. 1,51 0,90 0,61В
Если э.д.с. > 0, то процесс протекает самопроизвольно;
Если э.д.с. < 0, то процесс в прямом направлении невозможен, а протекает
самопроизвольно только в обратном направлении.
Абсолютное значение восстановительного потенциала экспериментально
определить нельзя, его можно измерить только относительно какого-либо
стандартного электрода.
26.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭлектрохимические процессы
Процессы взаимного превращения химической и электрической форм энергии
называют электрохимическими процессами.
Классификация электрохимических процессов:
1. Процессы превращения химической энергии в электрическую – это в
гальванических элементах;
2. Процессы превращения электрической энергии в химическую – в процессах
электролиза.
Электродами называют проводники, имеющие электронную проводимость
(проводники 1-го рода) и находящиеся в контакте с ионным проводником.
27.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЗаконы Фарадея
1. Масса выделившегося на электроде вещества пропорциональна количеству
прошедшего электричества.
Э I t Э Q
Э Q
,г
F
F
96485
А
Э электрохимический.эквивалент.вещества, г / моль;
n
Q I t
mв
Q количество.электричества, Кл;
А атомная. масса.вещества;
n количество.отданных.или.принятых.электронов;
I сила.тока, в.амперах(а.или. А);
t время, с;
F 96485 число.Фарадея; Кл / моль.
28.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ2. Равные количества электричества, прошедшие через раствор электролита,
выделяют эквивалентные количества вещества, т.е. при превращении 1 моля
эквивалентов вещества на электроде через него проходит 96485 количества
электричества, Кл.
Например: В результате реакции Cu
2
2e Cu
на электроде
выделилось 15,89 г меди. Тогда теоретическое количество
электричества можно определить из соотношения:
96485 Кл(26,8 А ч) 31,77 г.Cu.( масса.1. моля.эквивалентов )
х.Кл 15,89 г
Отсюда следует, что через электрод теоретически должно пройти следующее
количество электричества:
mв F 15,89 96485
х Q
48257,68 Кл
Э
31,77
29.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЕсли в результате реакции выделяется газ?
Например: В результате реакции: 2 Н 2e H
2
при нормальных условиях выделилось 5,6 л водорода. Тогда теоретическое
количество электричества можно определить из соотношения:
96485 Кл 1г.Н 2 (11,2 л.Н 2 объем. моля.эквивалентов.водорода)
х
5,6 л.Н 2
96485 5,6
х Q
48250 Кл
11,2
На законах Фарадея основаны расчеты электрохимических установок, а на их азе
созданы счетчики количества электричества (кулонометры, интеграторы тока) и
другие устройства.
30.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПонятие об электродном потенциале
Стандартные условия, при которых производят
сравнение электродных потенциалов:
- температура 25 ºС (298 К);
- давление 101325 Па;
- концентрация 1 М.
Электродный потенциал (потенциал электрода) – это разность потенциалов,
возникающая между металлом и раствором.
Равновесный электродный потенциал - это потенциал, устанавливающийся в
условиях равновесия электродной реакции.
Абсолютное значение электродного потенциала измерить невозможно, поскольку
введение измерительных зондов приводит к выявлению новой контактной
разности потенциалов. Поэтому измеряют разность потенциалов между данным
электродом и электродом сравнения, потенциал которого условно принят за ноль.
31.
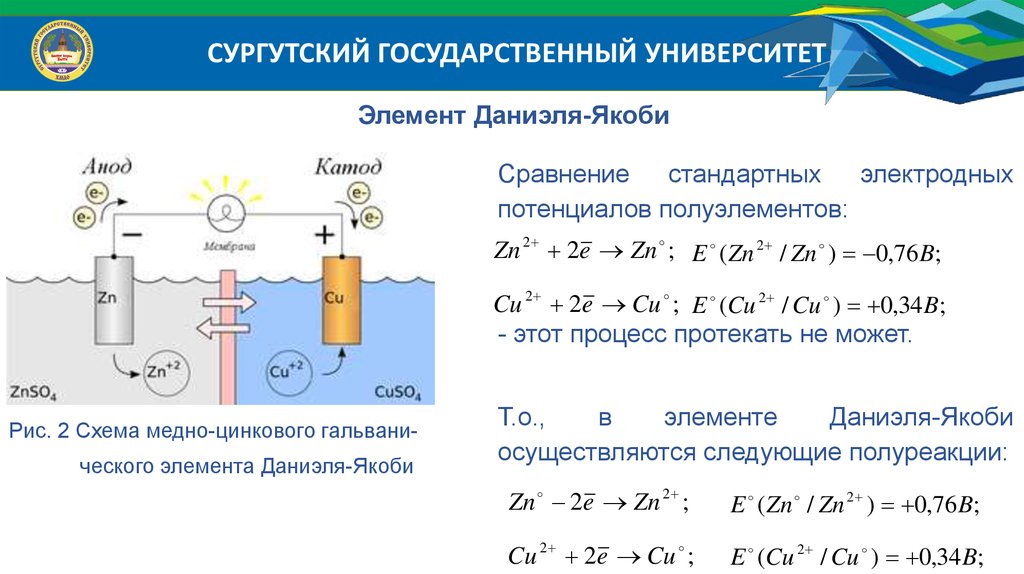
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭлемент Даниэля-Якоби
Сравнение стандартных электродных
потенциалов полуэлементов:
Zn 2 2e Zn ; E ( Zn 2 / Zn ) 0,76 B;
Cu 2 2e Cu ; E (Cu 2 / Cu ) 0,34 B;
- этот процесс протекать не может.
Рис. 2 Схема медно-цинкового гальванического элемента Даниэля-Якоби
Т.о.,
в
элементе
Даниэля-Якоби
осуществляются следующие полуреакции:
Zn 2e Zn 2 ;
E ( Zn / Zn 2 ) 0,76 B;
Cu 2 2e Cu ;
E (Cu 2 / Cu ) 0,34 B;
32.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭлемент Даниэля-Якоби
Получаем:
Анодный.процесс | Zn 2e Zn 2 | окисление.цинка |
E ( Zn / Zn 2 ) 0,76 B;
2
E (Cu 2 / Cu ) 0,34 B;
Катодный
.
процесс
|
Cu
2
e
Cu
|
восстановл
ение
.
меди
|
________________________________________________________________
Zn Cu 2 Zn 2 Cu
Расчет э.д.с.:
0
0
Э. Д .С. Е окисл
Е
.
восст. 0,34 ( 0,76) 1,10 В
Положительный знак э.д.с. определяет направление самопроизвольного
протекания реакции слева направо. Энергия Гиббса составит:
G 96485nE 96485 2 ( 1,10) 212267 Дж / моль 212кДж / моль
Что свидетельствует о самопроизвольном восстановлении меди.
33.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСвязь между энергией Гиббса и электродным (окислительно-восстановительным)
потенциалом выражается формулой:
G nFE ,
n количество.вещества;
Е электродный.(окислительно восстановительный )потенциал;
F 96485 Кл / моль постоянная.Фарадея;
Если процесс протекает в стандартных условиях, то связь между энергией Гиббса и
электродного потенциала выражается уравнением:
G 0 nFE 0 ,
Е 0 стандартный электродный потенциал, определенный при стандартных условиях.
34.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСтандартные электродные потенциалы металлов
35.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМеталлы, обладающие более отрицательным электродным потенциалом,
способны вытеснять менее активные металлы (с более положительным
потенциалом) из водных растворов их солей.
0
Например: Zn Cu
невозможна;
2
0
Cu Zn 2 протекает только слева направо, обратная реакция
Металлы, выступающие в качестве отрицательного электрода по отношению к
водородному, вытесняют водород из кислот, а металлы с более положительным
электродным потенциалом не обладают этим свойством.
36.
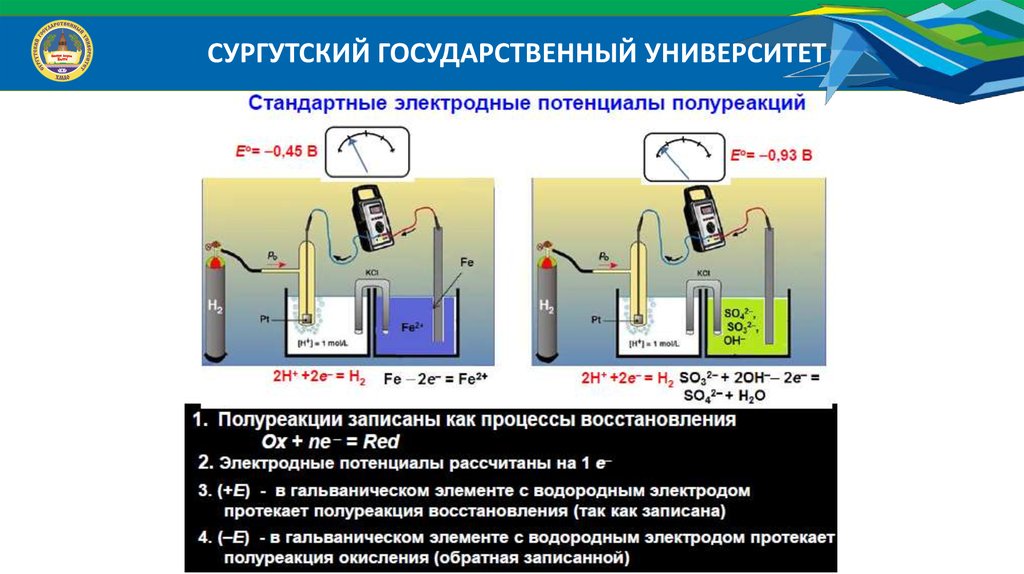
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЧтобы определить опытным путем потенциал окислительно-восстановительной
системы, необходимо составить гальваническую цепь.
Например: Определить восстановительный потенциал системы Fe 2 / Fe 3 .
Для этого возьмем по 10 мл 1 М растворов FeCl3 и FeSO4, в которые погрузим
комбинированный электрод и измерим Э.Д.С. системы. Величина э.д.с. составила
-1,061 В. Схема гальванического элемента исследованной системы будет:
2
3
( К ) Pt / Fe / Fe || KCl || KCl , AgCl / Ag ( А)
Приняв потенциал хлорсеребряного электрода равным
восстановительный потенциал данной системы Fe 2 / Fe 3 :
290
мВ,
0
0
Э. Д .С. Е окисл
Е
.
восст. Е Fe 2 / Fe 3 E Ag / AgCl
Е Fe 2 / Fe3 Э. Д .С. E Ag / AgCl 1,061 ( 0,290) 0,771В
найдем
37.
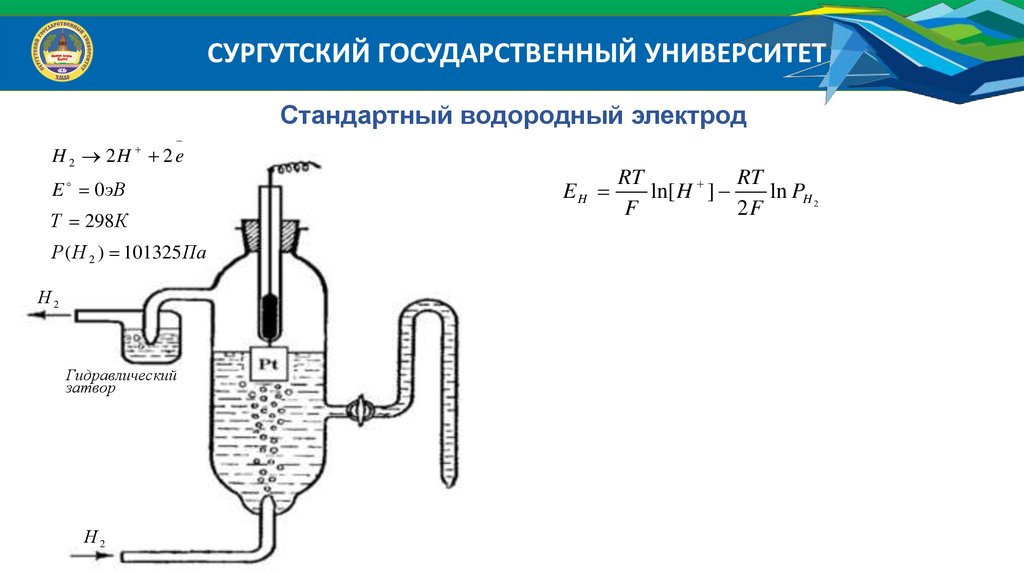
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСтандартный водородный электрод
H 2 2H 2 e
E 0 эВ
Т 298 К
Р ( Н 2 ) 101325 Па
Н2
Гидравлический
затвор
Н2
EH
RT
RT
ln[ H ]
ln PH 2
F
2F
38.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТУравнение Нернста:
Е восст / окисл Е
Если концентрации равны, то
0
восст / окисл
RT С восст
ln
nF С окисл
0
Е восст / окисл Е восст
/ окисл
При увеличении концентрации выше стандартной, электродный потенциал
увеличивается (становится более положительным). Аналогично действует
температура.
Если концентрация ниже стандартной, то электродный потенциал становится
ниже стандартного.
Если гальванический элемент составлен из одинаковых электродов, погруженных
в растворы их солей с различными концентрациями, то получим
концентрационный элемент, э.д.с. которого рассчитывают по уравнению Нернста:
Е восст / окисл
RT С окисл
ln
nF С восст
, т.к.
0
0
Е восст
Е
/ окисл
восст / окисл
39.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТДля гальванического элемента:
Ox(oxydation) окисленная.форма;
Re d (reduction) восстановленная.форма
Окислительно-восстановительный (red - ox) процесс состоит из двух полуреакций:
1. Катодный (восстановление): Ox e Re d
2. Анодный (окисление):
Re d e Ox
Общее уравнение редокс-реакции:
Ox Re d Ox Re d
e
Если взаимодействие протекает в одном растворе, то система не производит
работы, поскольку ток, обусловленный передачей электронов от восстановителя к
окислителю, равен нулю.
Если разделить катодный и анодный процессы разделить, то при замыкании
внешней цепи, наблюдается направленное движение электронов от анода к
катоду, а в растворе – движение анионов от катода к аноду.
40.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВ
гальванических
элементах
могут
электрохимических редокс-взаимодействия:
реализоваться
два
различных
1. Сами электроды участвуют в окислительно-восстановительной реакции;
Например: элемент Даниэля-Якоби.
2. Вещество электродов инертно по
отношению к реакции, протекающей
в растворе, а лишь участвуют передатчиками электронов между ионами, находящимися в растворе. Гальванические
Цепи подобного типа называют редоксцепями с инертными электродами.
41.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЗакономерности в ряду редокс-потенциалов:
1. Если стандартный редокс-потенциал отрицателен, то полуэлемент по отношению к
водородному выступает в качестве восстановителя (окисленная форма устойчивее).
Восстановительная активность тем выше, чем более отрицателен редокс-потенциал;
2. Если стандартный редокс-потенциал положителен, то полуэлемент по отношению к
водородному является окислителем (устойчивее восстановленная форма). Чем
положительнее величина редокс-потенциала, тем выше окислительная активность
полуэлемента;
3. С увеличением э.д.с.
протекают энергичнее.
редокс-цепи
окислительно-восстановительные
реакции
Т.о., ряд редокс-потенциалов позволяет количественно оценить активность окислителя и
восстановителя,
направление
и
интенсивность
протекания
окислительновосстановительной реакции.
42.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭлектролиз это окислительно-восстановительный процесс, протекающий на электродах под
действием электрического тока, проходящего через из раствор или расплав, т.е.
происходит превращение электрической энергии в химическую.
( К ) – отдает электроны катионам, идет процесс восстановления;
(
А ) – анод принимает электроны от анионов, идет процесс окисления.
Электролиз расплавов и растворов идет по разному.
43.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭлектролиз расплава:
C
NaCl 810
Na Cl
K : Na e Na
A : 2Cl 2e Cl 2
____________________
2 Na 2Cl 2 Na Cl 2
электролиз
44.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭлектролиз водных растворов электролитов
1. Катионы металлов, имеющих бо‘льший стандартный электродный потенциал,
чем у водорода (от Cu 2 до Аu 3 ), при электролизе практически полностью
восстанавливаются на катоде;
2. Катионы металлов, имеющих малый стандартный электродный потенциал
(от Li до Al 3 ), при электролизе не восстанавливаются на катоде, а вместо них
восстанавливаются молекулы воды:
K : 2 H 2 O 2e H 2 2OH ;
3. Катионы металлов, имеющих стандартный электродный потенциал, меньший,
чем у водорода, но больший, чем у алюминия (от Al 3 до Н ), при электролизе
на катоде восстанавливаются одновременно с молекулами воды:
K : 2 H 2 O 2e H 2 2OH
К : Ме
n
ne Me
45.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ46.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ47.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ48.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ49.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ50.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ51.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ52.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ53.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ54.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСпасибо за внимание!
Вопросы?


















































 Химия
Химия








