Похожие презентации:
Озон. Значение Озона
1. Озон
Шишкин Иван ученик 9Б2. Значение Озона
Озон (от др.-греч. "пахну") - однаиз аллотропных модификаций
кислорода, существует в виде
трёхатомных молекул O3. При
нормальных условиях озон
представляет собой газ
голубого цвета, обладающий
характерным резким запахом.
При охлаждении переходит в
жидкость цвета индиго, в
твёрдом виде представляет
собой кристаллы тёмно-синего
(почти чёрного) цвета.
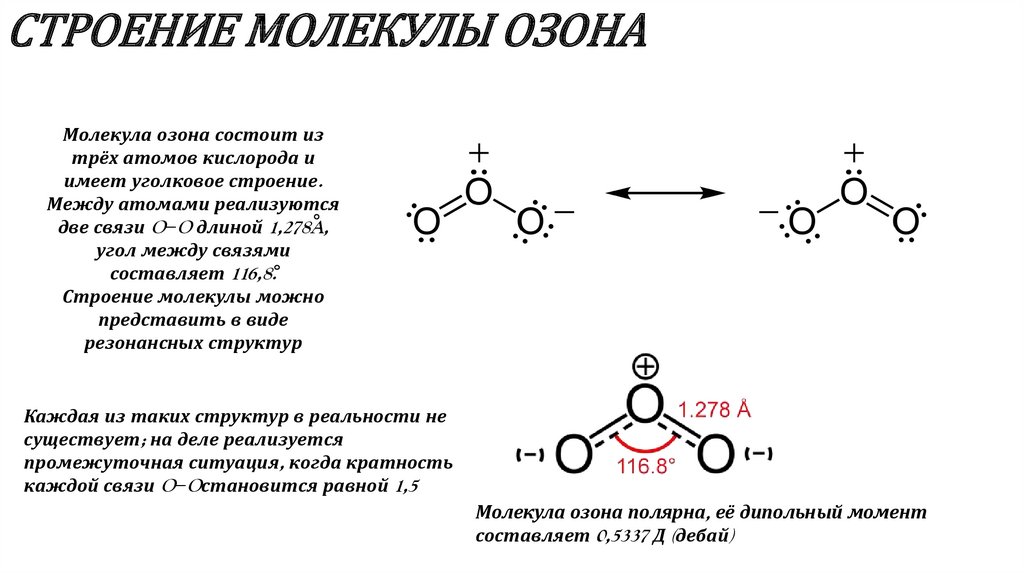
3. СТРОЕНИЕ МОЛЕКУЛЫ ОЗОНА
Молекула озона состоит изтрёх атомов кислорода и
имеет уголковое строение.
Между атомами реализуются
две связи O−O длиной 1,278A,
угол между связями
составляет 116,8.
Строение молекулы можно
представить в виде
резонансных структур
Каждая из таких структур в реальности не
существует; на деле реализуется
промежуточная ситуация, когда кратность
каждой связи O−Oстановится равной 1,5
Молекула озона полярна, её дипольный момент
составляет 0,5337 Д (дебай)
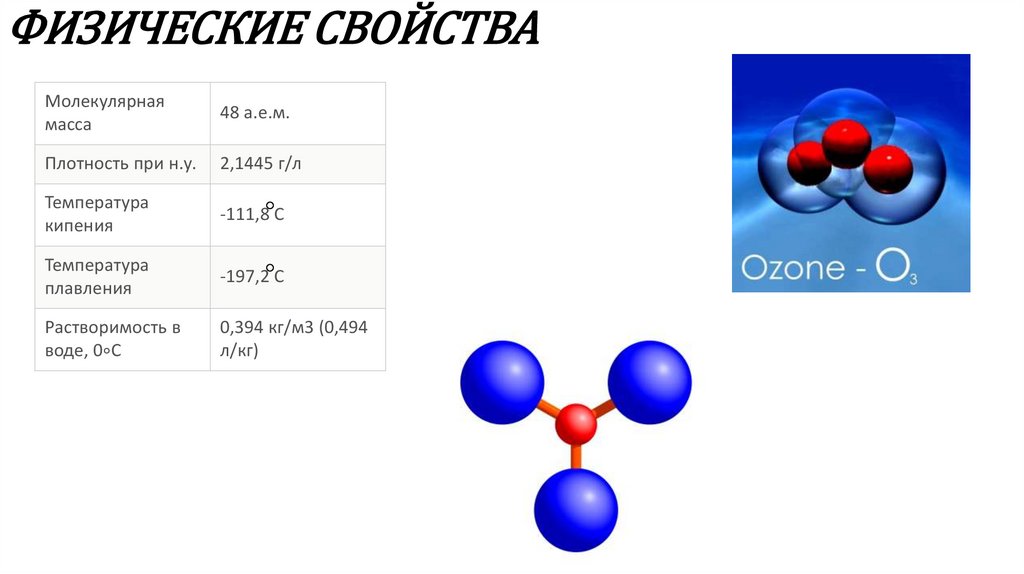
4. ФИЗИЧЕСКИЕ СВОЙСТВА
Молекулярнаямасса
48 а.е.м.
Плотность при н.у.
2,1445 г/л
Температура
кипения
-111,8 C
Температура
плавления
-197,2 C
Растворимость в
воде, 0∘C
0,394 кг/м3 (0,494
л/кг)
5. Получение озона
В лаборатории озон может быть получен привзаимодействии пероксида бария и охлаждённой
концентрированной серной кислоты:
3H2SO4+3BaO2→3BaSO4↓+O3↑+3H2O
В промышленности озон
получают в специальных
устройствах,
называемых
озонаторами. Через
воздух пропускают
электрическую искру; в
озонаторе протекает
химическая реакция в
соответствии с
уравнением:
3O2→cur2O3
Образующиися озон отделяют
фракционной перегонкой.
Озон образуется в атмосфере под действием
ультрафиолетового излучения или электрического
разряда молнии во время грозы. Именно
образованием озона обусловлен запах свежести в
воздухе после грозы.
6. ХИМИЧЕСКИЕ СВОЙСТВА ОЗОНА
Молекула O3 неустойчива; в течение
нескольких минут
после образования
озона происходит
процесс его
разложения до
молекулярного
кислорода:
2O3→3O2
Озон - очень сильный окислитель, гораздо более
сильный, чем кислород. Он окисляет почти все
металлы (кроме золота, иридия и платины) до
высших степеней окисления, повышает степень
окисления элементов в оксидах, окисляет
неметаллы. В подавляющем большинстве реакций
одним из продуктов является молекулярный
кислород O2
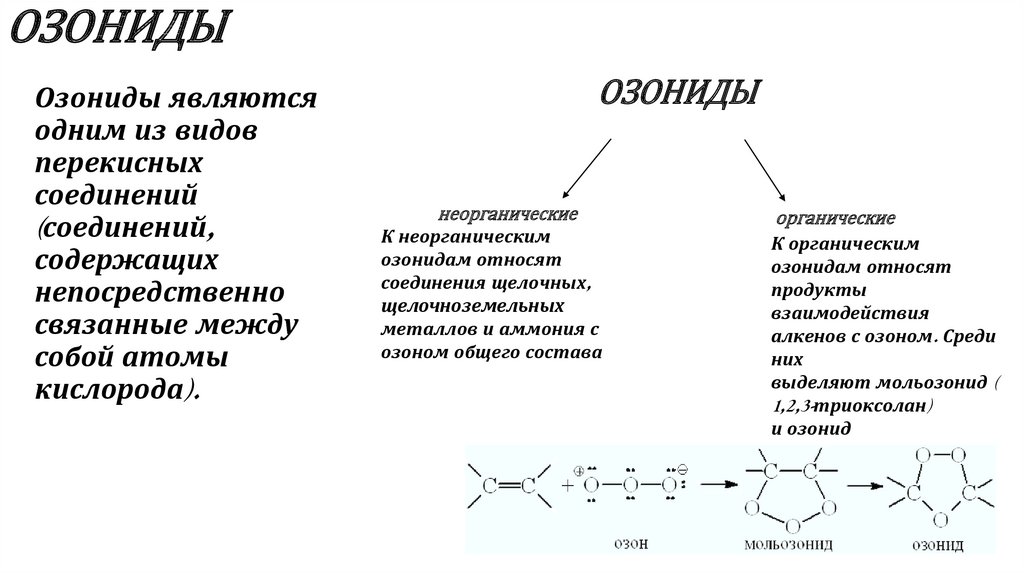
7. ОЗОНИДЫ
Озониды являютсяодним из видов
перекисных
соединений
(соединений,
содержащих
непосредственно
связанные между
собой атомы
кислорода).
ОЗОНИДЫ
неорганические
К неорганическим
озонидам относят
соединения щелочных,
щелочноземельных
металлов и аммония с
озоном общего состава
органические
К органическим
озонидам относят
продукты
взаимодействия
алкенов с озоном. Среди
них
выделяют мольозонид (
1,2,3-триоксолан)
и озонид
8. ПРИМЕНЕНИЕ ОЗОНА
Очищающий воду аппарат• В качестве сильного окислительного агента
озон применяется в следующих областях:
• стерилизация изделий медицинского
назначения;
• отбеливание бумаги;
• очистка масел и нефтепродуктов;
• лабораторный и промышленный синтез.
Также озон широко применяется в
качестве дезинфицирующего средства:
•озонирование воздуха и воды (очистка
от микроорганизмов);
•озонирование растворов медицинского
назначения;
•дезинфекция помещений и одежды.
При использовании озона в качестве агента
для очистки воды и воздуха не образуется
вредных и токсичных веществ (в отличие
от случая использования соединений хлора).





 Химия
Химия








