Похожие презентации:
Особенности строения ферментов
1.
Особенности строенияферментов
2.
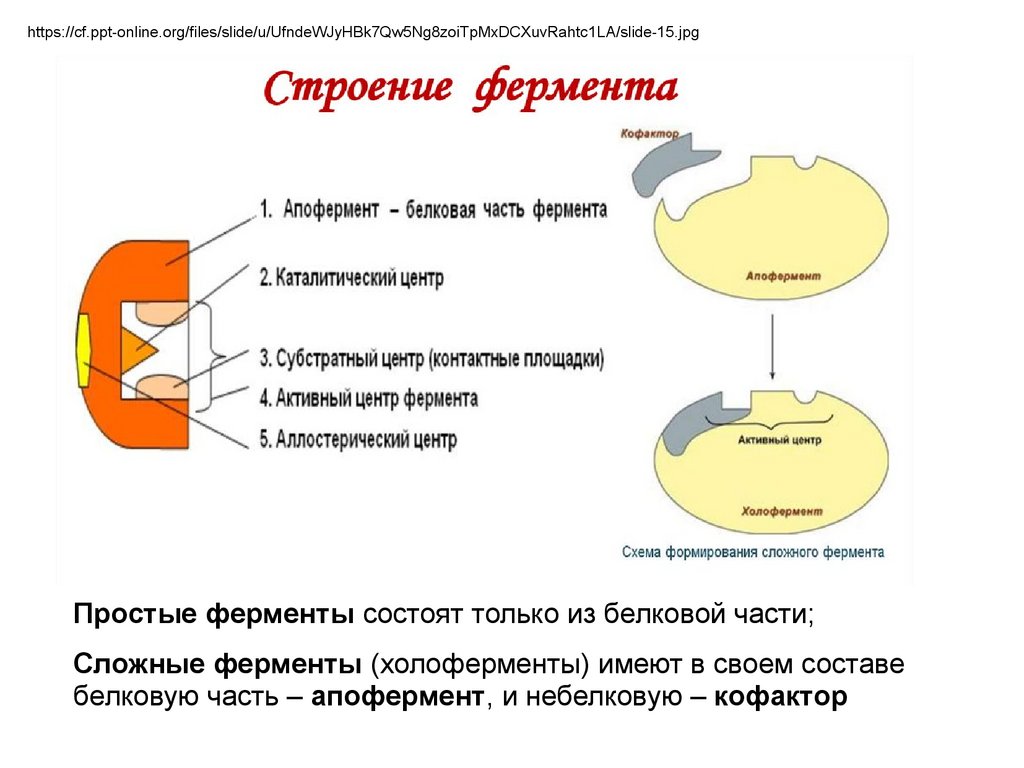
https://cf.ppt-online.org/files/slide/u/UfndeWJyHBk7Qw5Ng8zoiTpMxDCXuvRahtc1LA/slide-15.jpgПростые ферменты состоят только из белковой части;
Сложные ферменты (холоферменты) имеют в своем составе
белковую часть – апофермент, и небелковую – кофактор
3.
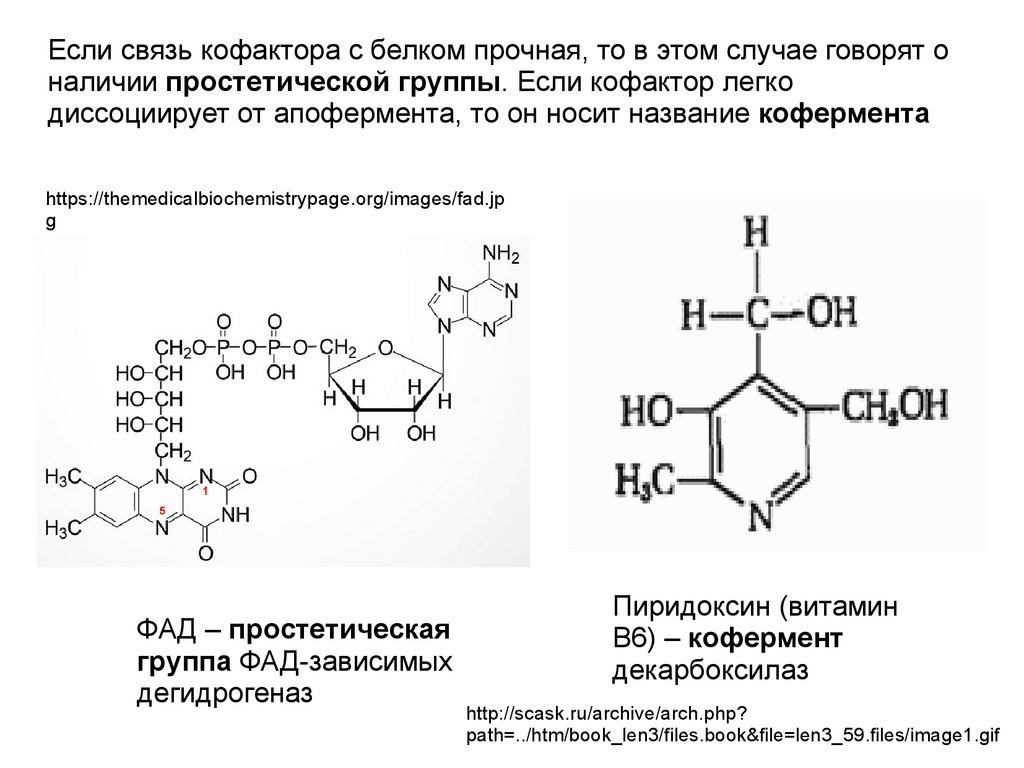
Если связь кофактора с белком прочная, то в этом случае говорят оналичии простетической группы. Если кофактор легко
диссоциирует от апофермента, то он носит название кофермента
https://themedicalbiochemistrypage.org/images/fad.jp
g
ФАД – простетическая
группа ФАД-зависимых
дегидрогеназ
Пиридоксин (витамин
B6) – кофермент
декарбоксилаз
http://scask.ru/archive/arch.php?
path=../htm/book_len3/files.book&file=len3_59.files/image1.gif
4.
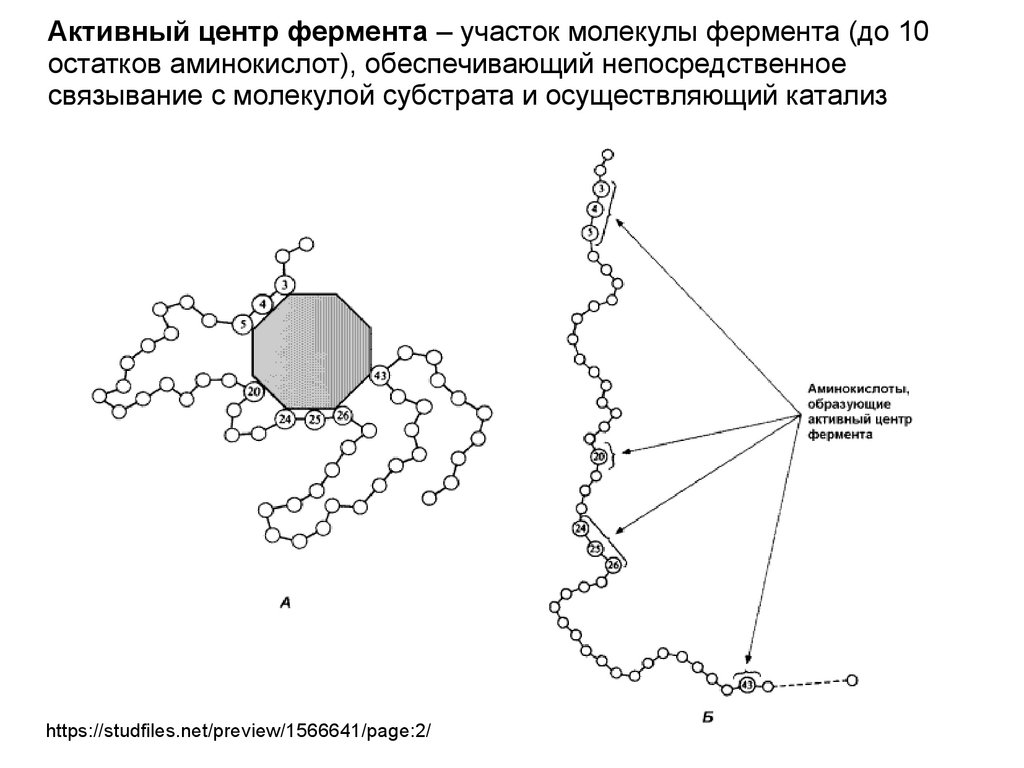
Активный центр фермента – участок молекулы фермента (до 10остатков аминокислот), обеспечивающий непосредственное
связывание с молекулой субстрата и осуществляющий катализ
https://studfiles.net/preview/1566641/page:2/
5.
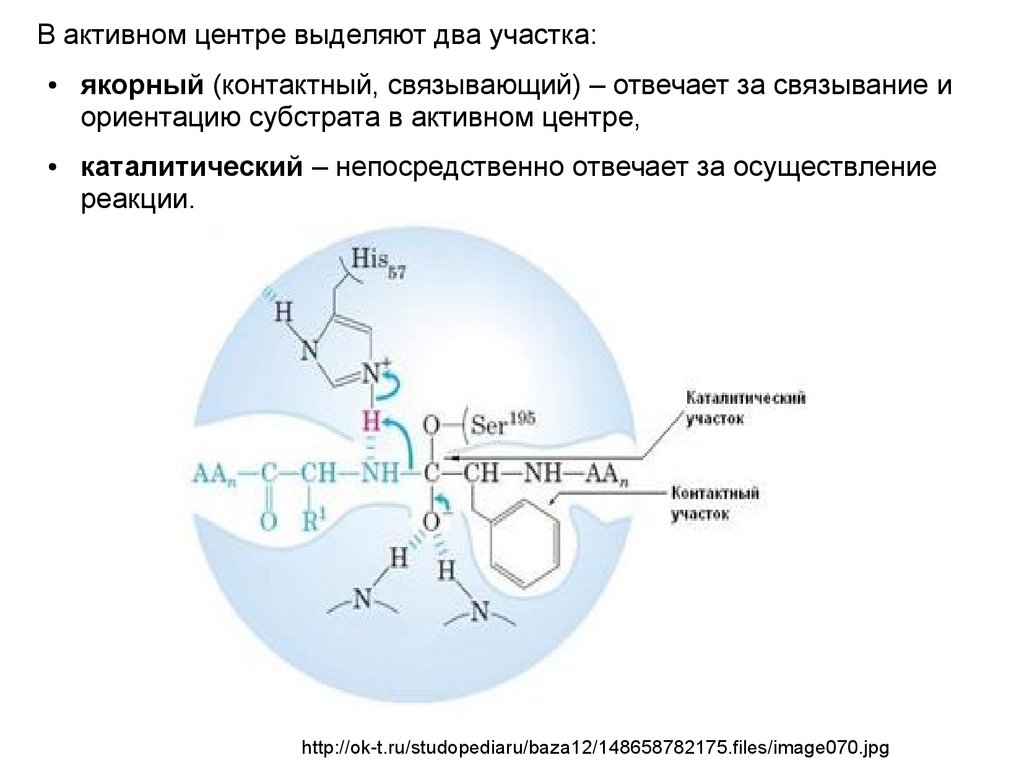
В активном центре выделяют два участка:якорный (контактный, связывающий) – отвечает за связывание и
ориентацию субстрата в активном центре,
каталитический – непосредственно отвечает за осуществление
реакции.
http://ok-t.ru/studopediaru/baza12/148658782175.files/image070.jpg
6.
Аллостерический центр – центр регуляции активности фермента,который пространственно отделен от активного центра и имеется не
у всех ферментов. Связывание с аллостерическим центром
низкомолекулярных веществ (эффекторов вызывает изменение
конфигурации белка-фермента и, как следствие, скорости
ферментативной реакции.
https://terra-medica.ru/w/images/f/f2/S04-03-stroenie-fermentov_3.jpg


 Биология
Биология








