Похожие презентации:
Комплексоутворення в біологічних системах. Основи хелатотерапії
1.
Комплексоутворення в біологічних системах.Основи хелатотерапії
Лектор: доцент Чорноус В.О.
2.
План1. Будова комплексних сполук. Теорія Вернера.
2. Складові частини комплексних сполук.
3. Утворення і дисоціація комплексних сполук.
4. Природа хімічного зв’язку в комплексних сполуках.
5. Класифікація і номенклатура комплексних сполук.
6. Біокомплексні сполуки. Металолігандний гомеостаз.
7. Біологічна роль комплексних сполук. Хелатотерапія.
3.
Поняття про комплексні сполукиСередні солі:
Na2SO4
2Na+ + SO42-
Na2SO4
K+ + Al3+ + 2SO42-
Подвійні солі: KAl(SO4)2 KAl(SO4)2
Змішані солі:
СаОСl2
CaOCl2
Ca2++ Cl- + ClO-
Комплексні сполуки: K3[Fe(CN)6]
K3[Fe(CN)6]
[Fe(CN)6]3-
3K+ + [Fe(CN)6]3Fe3+ + 6CN-
4.
Поняття про комплексні сполукиОсновні ознаки:
кількість хімічних зв’язків, що утворює хімічний елемент
перевищує його можливу максимальну валентність;
при дисоціації утворюється складний іон (комплексний іон),
утворений з молекул або іонів, здатних самостійно
існувати у розчині;
5.
Будова комплексних сполук. Теорія Вернера1893 рік А. Вернер
6.
Складові частини комплексних сполукКомплексоутворювачі – практично всі хімічні елементи.
Основна вимога – наявність вільних орбіталей.
Найбільш типові комплексоутворювачі:
атоми і іони d-елементів:
Сr,Со, Nі, Fе, Мn, Аg+, Аu+, Сu+, Нg2+, Сd2+, Zn2+, Сr3+,
Fе2+, Fе3+, Со2+, Ni2+, Pt
катіони s- і р-елементів:
Ве2+, Аl3+, Sn2+, Sn4+, Рb2+
деякі атоми неметалів:
●Sі, В, Р, N
7.
Складові частини комплексних сполукЛіганди – нейтральні молекули або аніони.
Основна вимога – наявність неподіленої пари електронів.
Дентатність (дент - ”зуб”) – кількість σ-зв`язків,
що може утворювати ліганд з комплексоутворювачем
8.
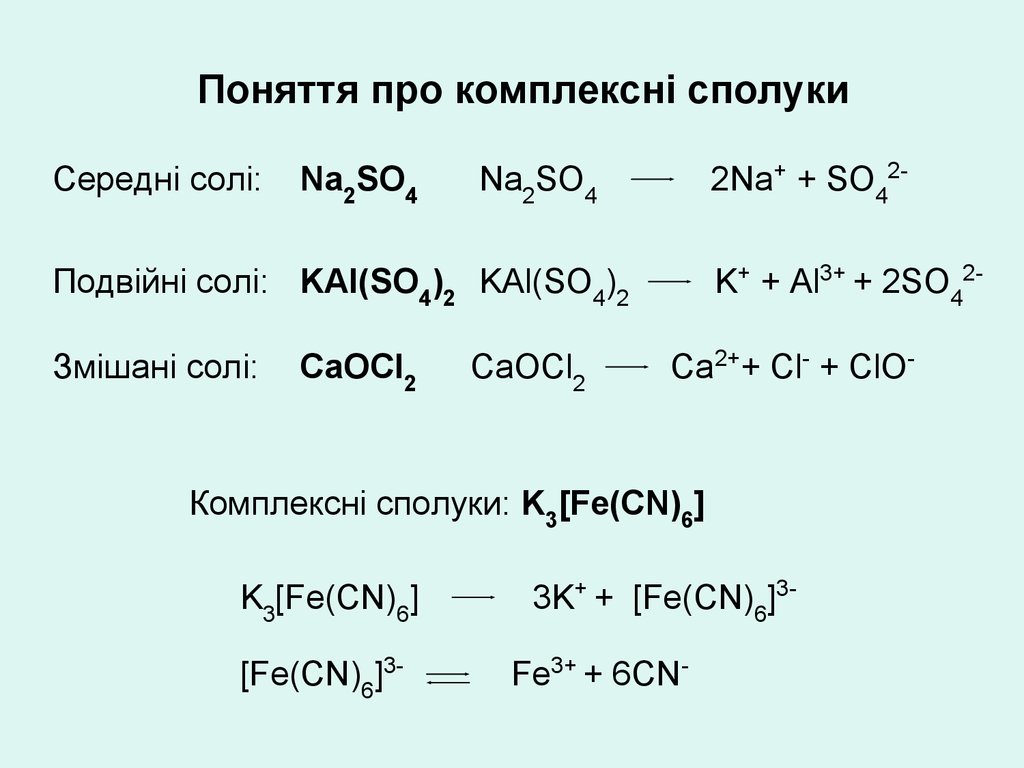
Складові частини комплексних сполукМонодентатні ліганди:
прості аніони: S2-, F–, Сl–, Вr–, І–.
складні аніони: ОН–, СN–, NО2–, S2О32–, NО3–.
Молекули: Н2О, NН3, NН2ОН, СН3NН2, С6Н6, С5Н5N.
9.
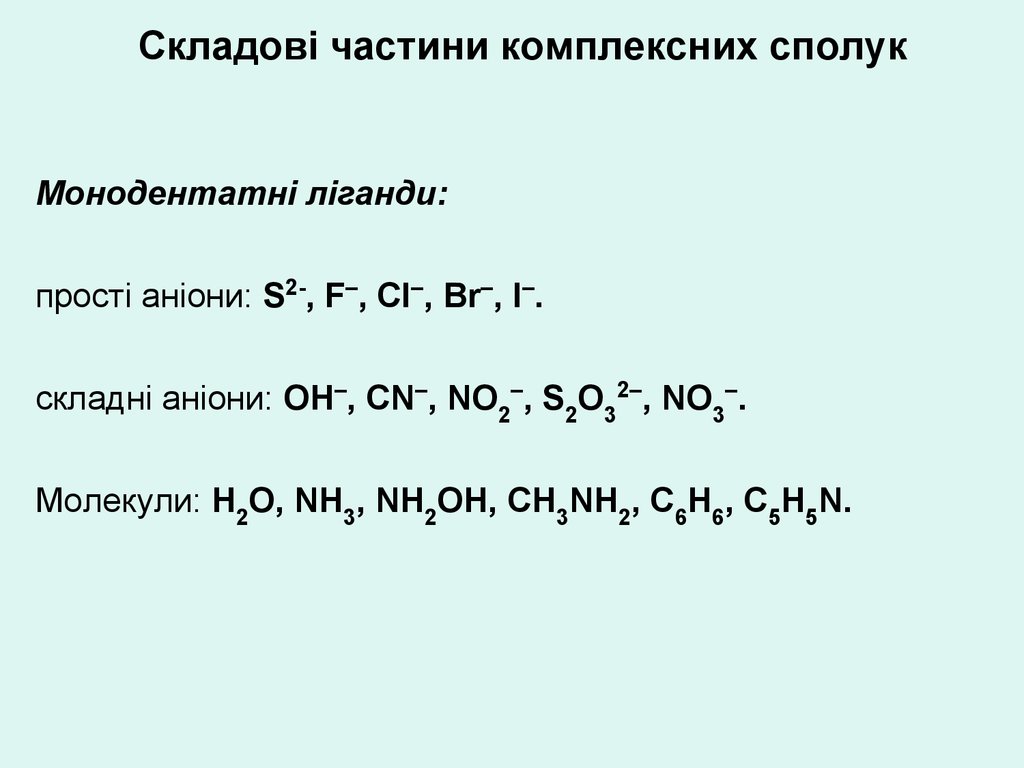
Складові частини комплексних сполукДидентатні ліганди:
аніони кислот: С2О42–, СО32–, SО42–
молекули: NH2NH2, СН2ОН-СН2ОН, NH2СН2СН2NH2
біфункціональні органічні сполуки: NН2СН2СООН
10.
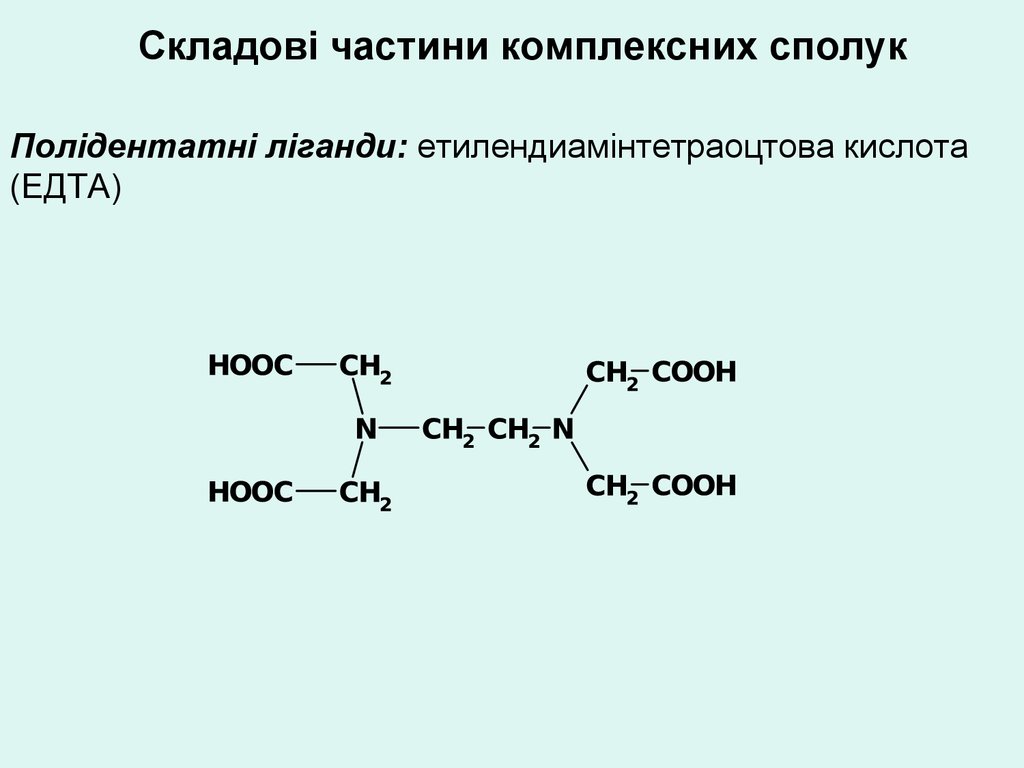
Складові частини комплексних сполукПолідентатні ліганди: етилендиамінтетраоцтова кислота
(ЕДТА)
11.
Складові частини комплексних сполукКоординаційне число – кількість σ-зв’язків,
що утворюють ліганди з центральним іоном.
Приймає парні значення: 2, 4, 6, 8
Залежить від заряду і радіуса комплексоутворювача
Координаційне число = (дентатність) Х (кількість лігандів)
КЧ стійкої комплексної сполуки приблизно в два рази
більше ніж ступінь окиснения центрального іону
КЧ = 2Z
12.
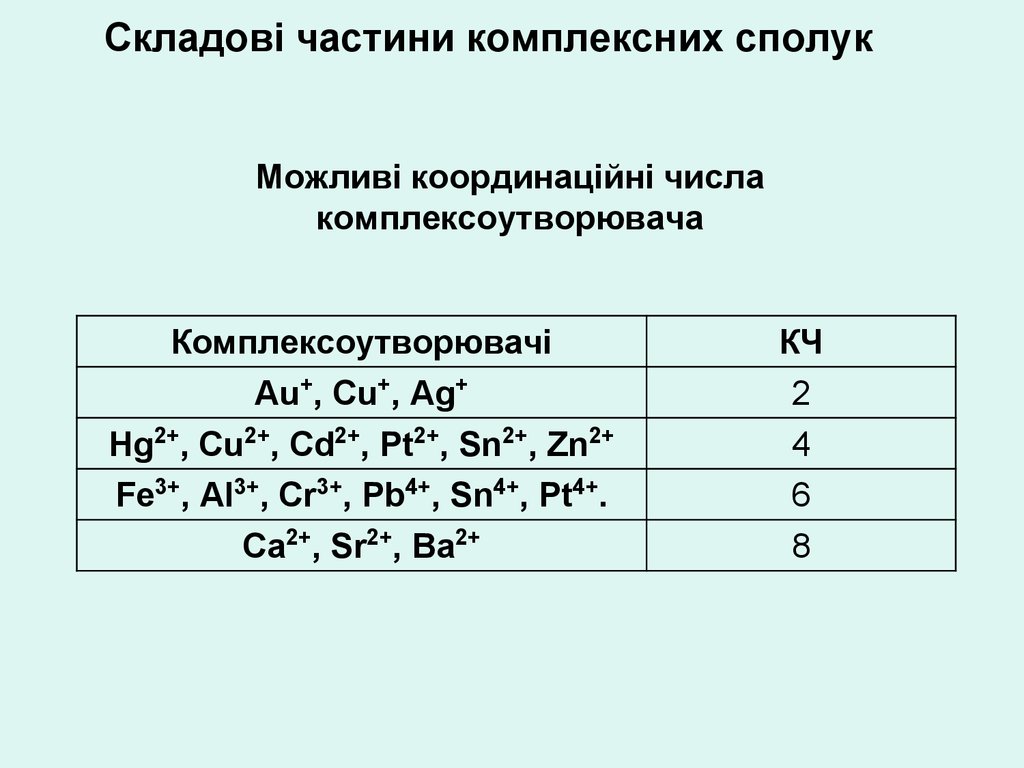
Складові частини комплексних сполукМожливі координаційні числа
комплексоутворювача
Комплексоутворювачі
Аu+, Сu+, Аg+
Нg2+, Сu2+, Сd2+, Pt2+, Sn2+, Zn2+
Fе3+, Аl3+, Сr3+, Рb4+, Sn4+, Рt4+.
Са2+, Sr2+, Ва2+
КЧ
2
4
6
8
13.
Складові частини комплексних сполукКоординаційне число зростає :
Із зменшенням радіуса лігандів
r(F-) < r(Cl-)
[АlСl4]– (кч=4) > [АlF6]3– (кч=6)
Із збільшенням радіуса центрального іону
r(Al) > r(B)
[ВF4]– (кч=4) > [АlF6]3– (кч=4)
Розрахунок заряду центрального іону
+1 0 -1
[Аg(NН3)2]ОН
+3 0 0
-1 -1
[Со(Н2О)(NH3)4Cl]Cl2
+3 -1
+3 -1
[АlF6]3–, [АlСl4]–
14.
Класифікація комплексних сполукВ залежності від заряду комплексного іону
аніонні,
катіонні
нейтральні
К4[Fе(СN)6]
[Аg(NН3)2]Сl
[Fе(CО)6]
В залежності від типу іонів зовнішньої координаційної сфери
комплексні кислоти комплексні основи комплексні солі
Н2[SіF6]
[Аg(NН3)2]ОН
[Zn(NН3)2]SO4
К4[Fе(СN)6]
15.
Класифікація комплексних сполукВ залежності від природи лігандів
Аквакомплекси
[Со(Н2О)6]Сl3
Аміакати і амінати
[Аg(NН3)2]ОН
Ацидокомплекси
Nа[Со(NО2)6]
Гідроксокомплекси
К3[Аl(ОН)6]
Полігалогеніди
Nа[АlF6]
Змішані комплексні [Со(Н2О)(NH3)4Cl]Cl2
сполуки
16.
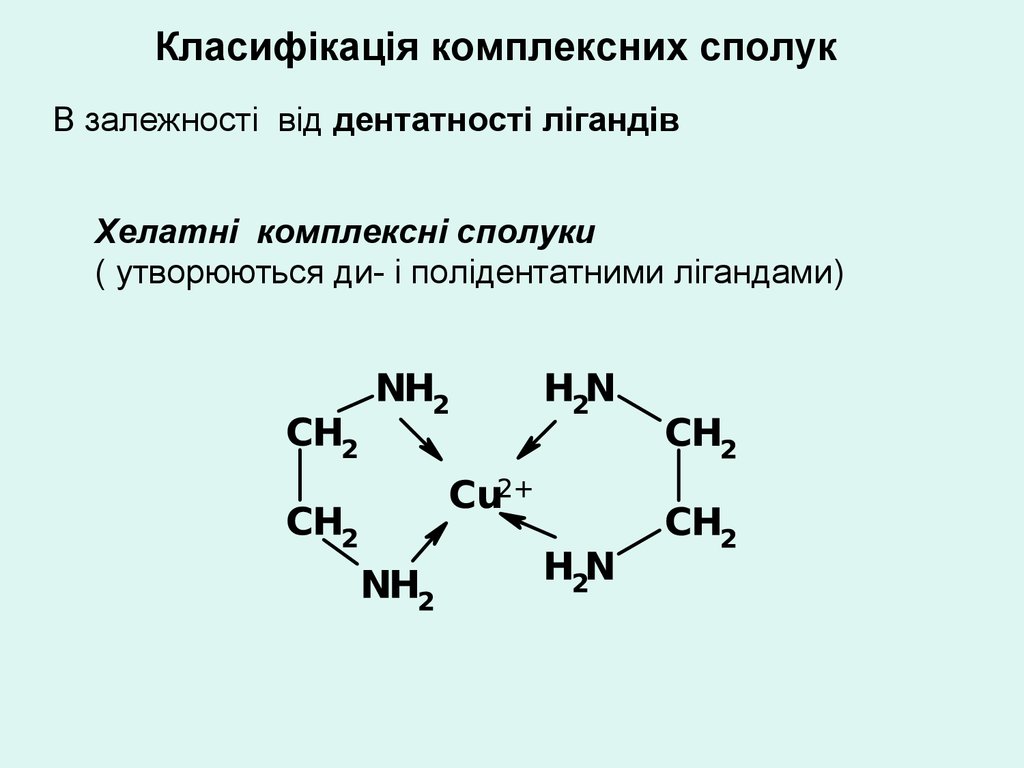
Класифікація комплексних сполукВ залежності від дентатності лігандів
Хелатні комплексні сполуки
( утворюються ди- і полідентатними лігандами)
17.
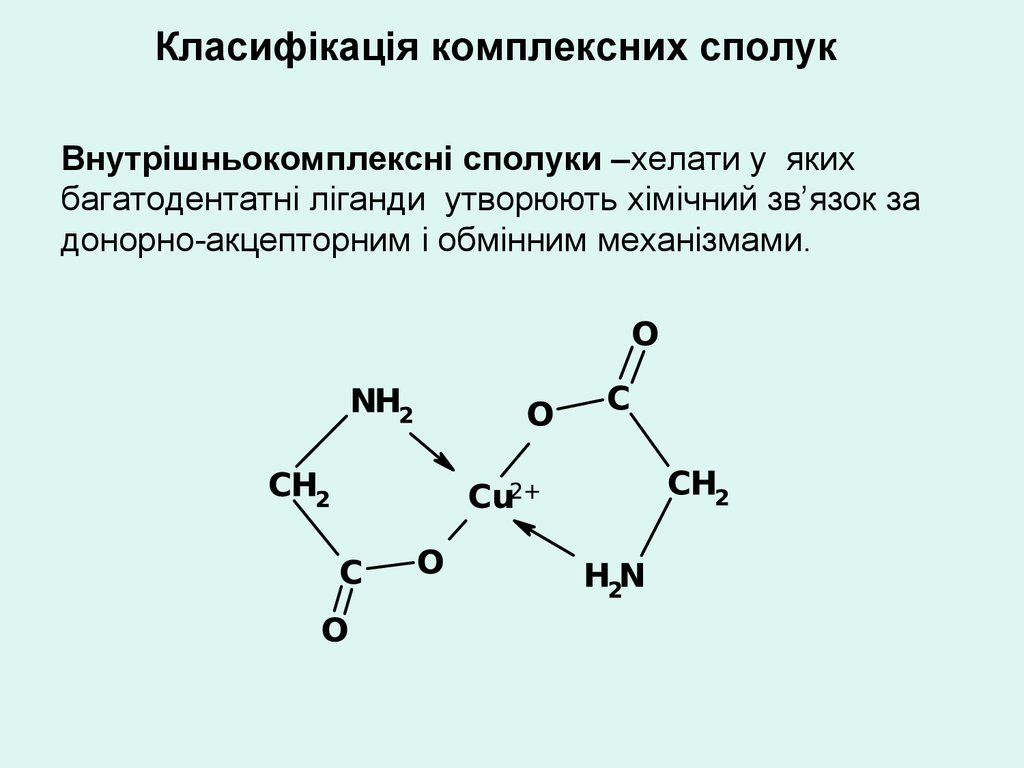
Класифікація комплексних сполукВнутрішньокомплексні сполуки –хелати у яких
багатодентатні ліганди утворюють хімічний зв’язок за
донорно-акцепторним і обмінним механізмами.
18.
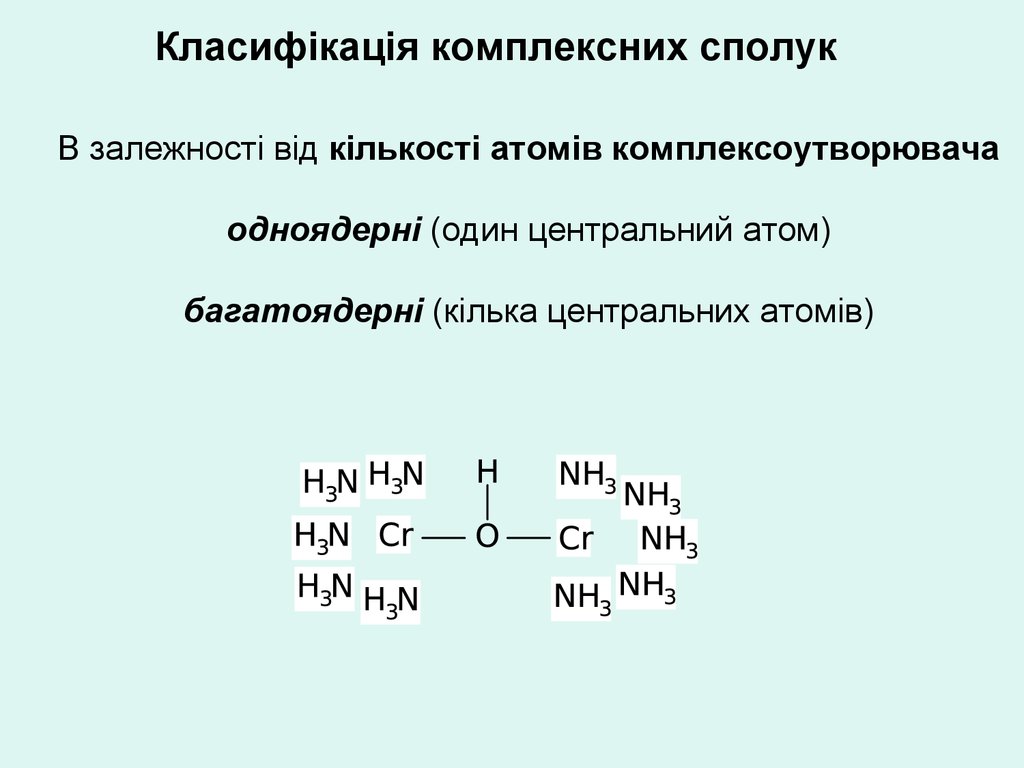
Класифікація комплексних сполукВ залежності від кількості атомів комплексоутворювача
одноядерні (один центральний атом)
багатоядерні (кілька центральних атомів)
19.
Номенклатура комплексних сполукНазва комплексної сполуки: назва катіону + назва аніону
Назва комплексного катіону:
назва лігандів + назва комплексоутворювача
Назва комплексного аніону:
назва лігандів + корінь назви комплексоутворювача + “ат”)
Кількість однакових лігандів вказують
префіксами: ди-, три-, тетра-, пента-, гекса
20.
Номенклатура комплексних сполукліганди
Назва
ліганди
Назва
FClBrIS2OHCNSCNNO2S2O32-
фторохлоробромойодосульфідогідроксоціанотіоціанатонітротіосульфато-
СO32C2O42NO3SO42Н 2О
NH3
CO
NO
карбонатооксалатонітратосульфато
аква
аміно
карбоніл
нітрозо
21.
Номенклатура комплексних сполукПриклади:
Аніонна комплексна сполука :
К4[Fе(СN)6] – калій гексаціаноферат (ІІ)
Катіонна комплексна сполука:
[Аg(NН3)2]Сl – диаміноаргентум хлорид
Нейтральна комплексна сполука:
[Рt(NН3)2Сl2] – дихлордиамінoплатина.
Тривіальні назви:
червона кров’яна сіль К3[Fе(СN)6],
жовта кров’яна сіль К4[Fе(СN)6].
22.
Ізомерія комплексних сполукІзомери – сполуки, що мають однаковий якісний і
кількісний склад але різну будову і тому різні властивості
Сольватна (гідратна) ізомерія – обумовлена обміном
молекул або іонів лігандів з молекулами розчинника (води)
[Сr(H2O)6]Cl3 - фіолетовий
[Сr(H2O)5Cl]Cl2 H2O – світло-зелений
[Сr(H2O)4Cl2]Cl 2H2O – темно-зелений
23.
Ізомерія комплексних сполукІонізаційна ізомерія – обумовлена обміном аніонів лігандів
з аніонами зовнішньої координаційної сфери
[Сo(NH3)5Br]SO4 – червоно-фіолетовий
[Сo(NH3)5SO4]Br– червоний
[Сo(NH3)5Br]SO4 + BaCl2 = [Сo(NH3)5Br]Cl2 + BaSO4
[Сo(NH3)5SO4] Br + BaCl2 = осад не утворюється
24.
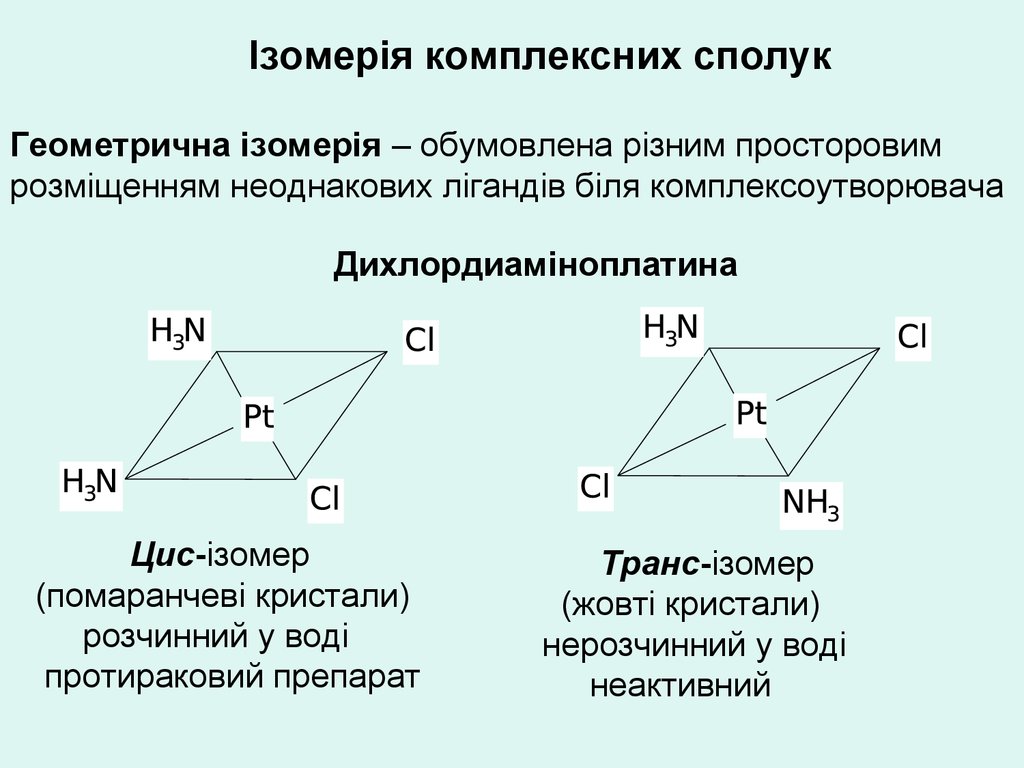
Ізомерія комплексних сполукГеометрична ізомерія – обумовлена різним просторовим
розміщенням неоднакових лігандів біля комплексоутворювача
Дихлордиаміноплатина
Цис-ізомер
(помаранчеві кристали)
розчинний у воді
протираковий препарат
Транс-ізомер
(жовті кристали)
нерозчинний у воді
неактивний
25.
Утворення і дисоціація комплексних сполук.Константи стійкості і нестійкості (ступінчасті і загальні)
Первинна дисоціація (необоротна).
[Аg(NН3)2]Сl → [Аg(NН3)2]+ + Сl–
26.
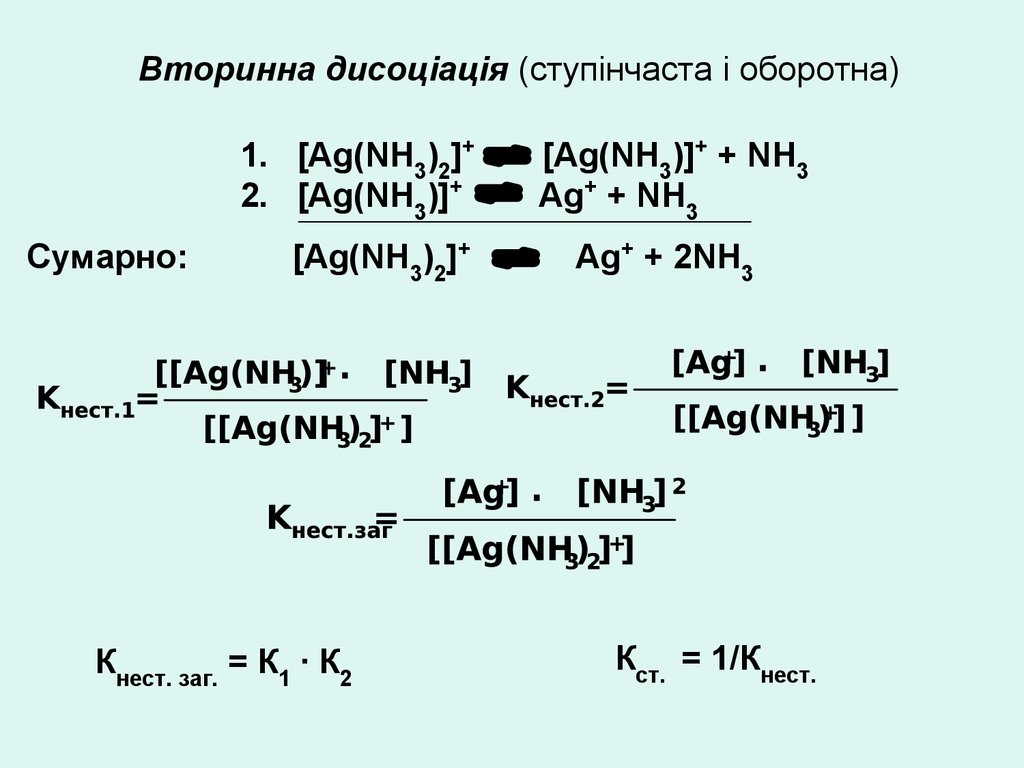
Вторинна дисоціація (ступінчаста і оборотна)1. [Аg(NН3)2]+
2. [Аg(NН3)]+
Сумарно:
[Аg(NН3)2]+
Кнест. заг. = К1 ∙ К2
[Аg(NН3)]+ + NН3
Аg+ + NН3
Аg+ + 2NН3
Кст. = 1/Кнест.
27.
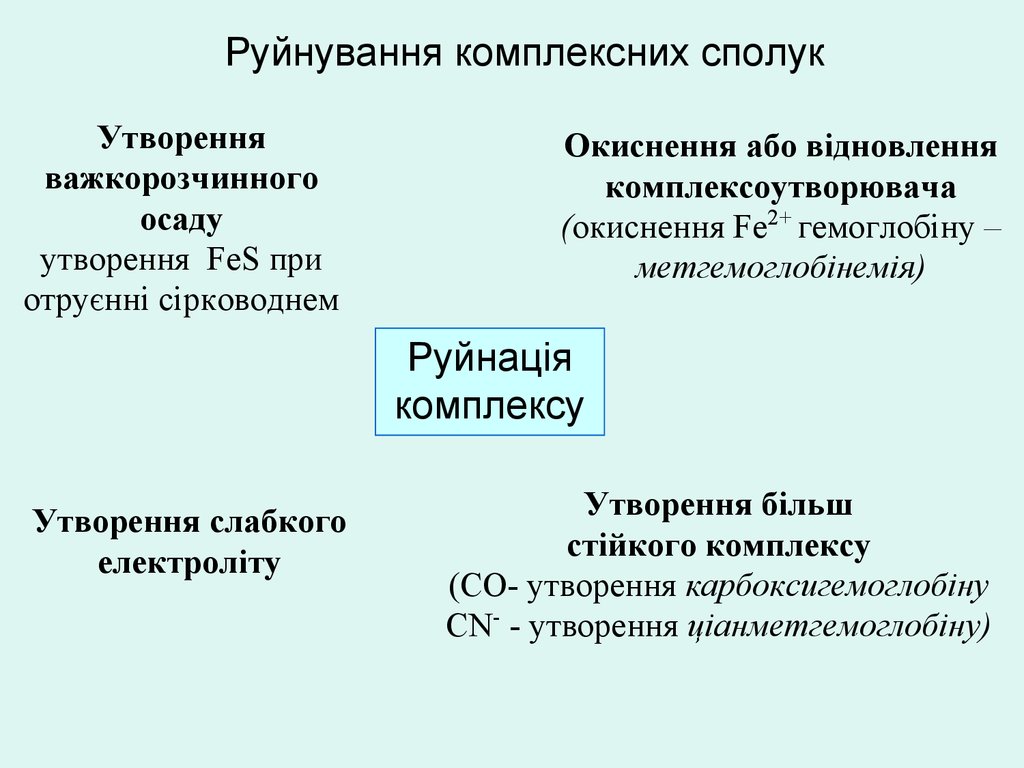
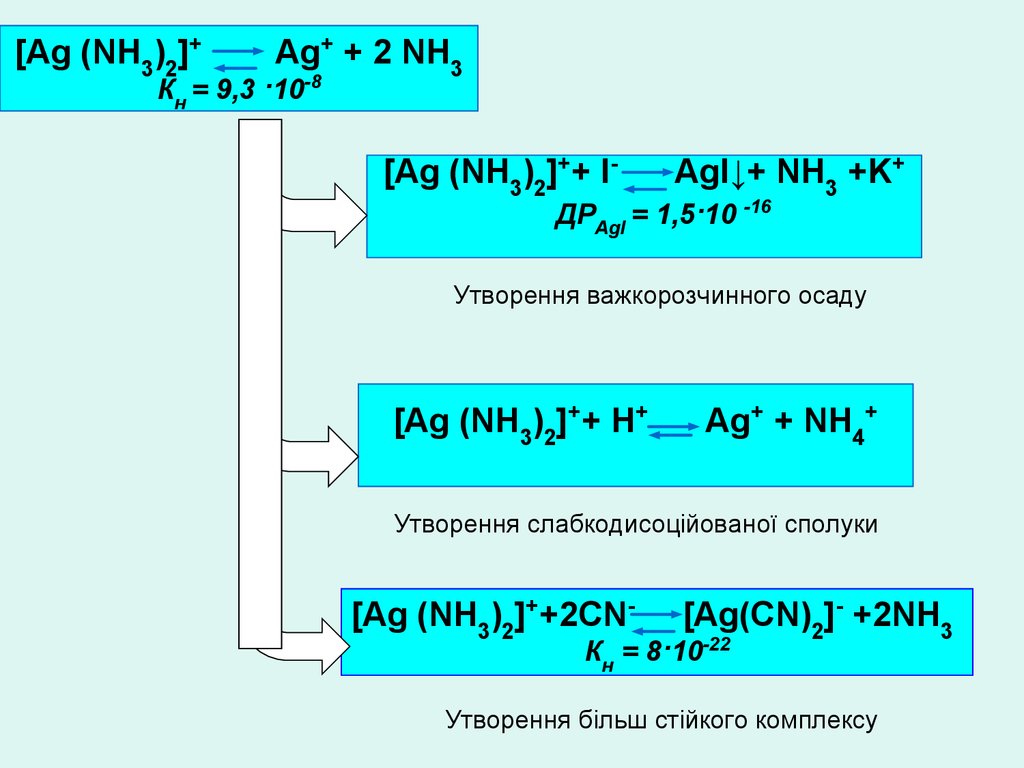
Руйнування комплексних сполукУтворення
важкорозчинного
осаду
утворення FeS при
отруєнні сірководнем
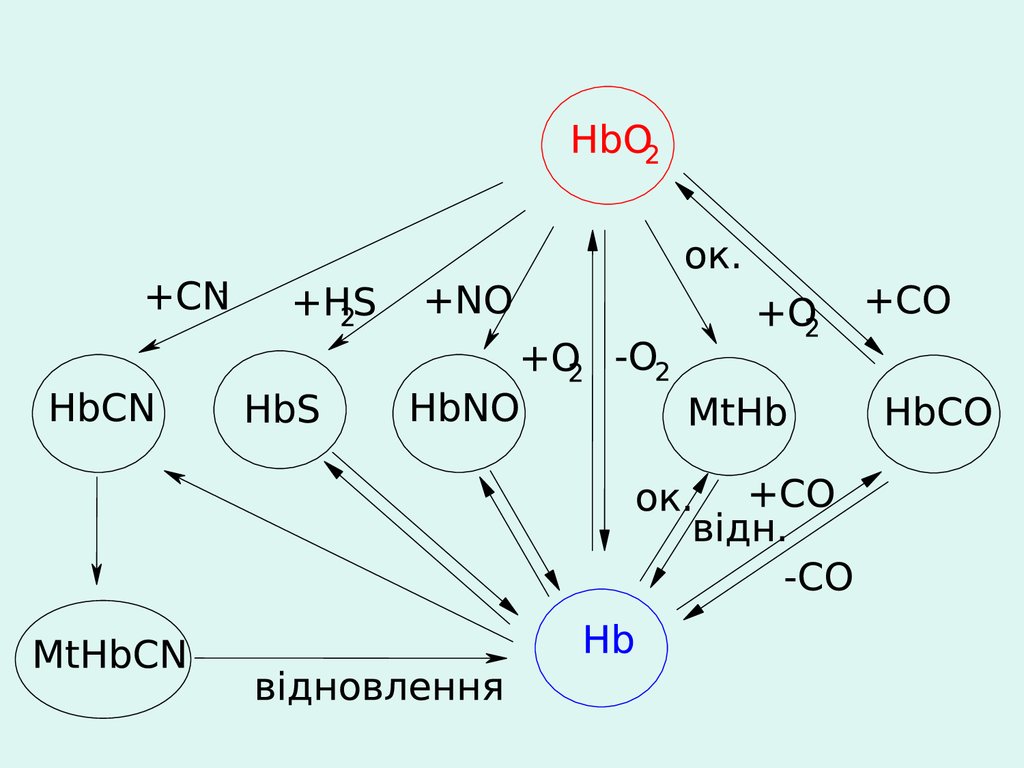
Окиснення або відновлення
комплексоутворювача
(окиснення Fe2+ гемоглобіну –
метгемоглобінемія)
Руйнація
комплексу
Утворення слабкого
електроліту
Утворення більш
стійкого комплексу
(СО- утворення карбоксигемоглобіну
СN- - утворення ціанметгемоглобіну)
28.
[Ag (NH3)2]+Ag+ + 2 NH3
Кн = 9,3 ·10-8
[Ag (NH3)2]++ I-
AgI↓+ NH3 +K+
ДРAgI = 1,5·10 -16
Утворення важкорозчинного осаду
[Ag (NH3)2]++ Н+
Ag+ + NH4+
Утворення слабкодисоційованої сполуки
[Ag (NH3)2]++2CN-
[Ag(CN)2]- +2NH3
Кн = 8·10-22
Утворення більш стійкого комплексу
29.
Природа хімічного зв’язку в комплексних сполуках.Метод Валентних зв’язків
У комплексних сполуках утворюється двохелектронний ковалентний зв’язок
за донорно-акцепторним механізмом за рахунок гібридизованих орбіталей
центрального іону і неподілених електронних пар лігандів
Координаційне
число
Тип гібридизації АО
Геометрична будова
комплексного іону
Комплексні іони
2
4
6
sp
sp3
dsp2
d2sp3
sp3d2
лінійна
тетраедрична
квадратна
октаедрична
октаедрична
[Cu(NH3)2]+
[Zn(NH3)4]2+
[Cu(NH3)4]2+
[Fe(CN)6]3[FeF6]3-
Вид гібридизації залежить від електронної конфігурації
комплексоутворювача а також властивостей лігандів
спарюють електрони
неспарюють електрони
–
СN > СО > NО2 >| Еn > NН3 > SСN– > || Н2О >| ОН– > F– > Сl– > Вr– > І–
сильні
середні
слабкі
–
30.
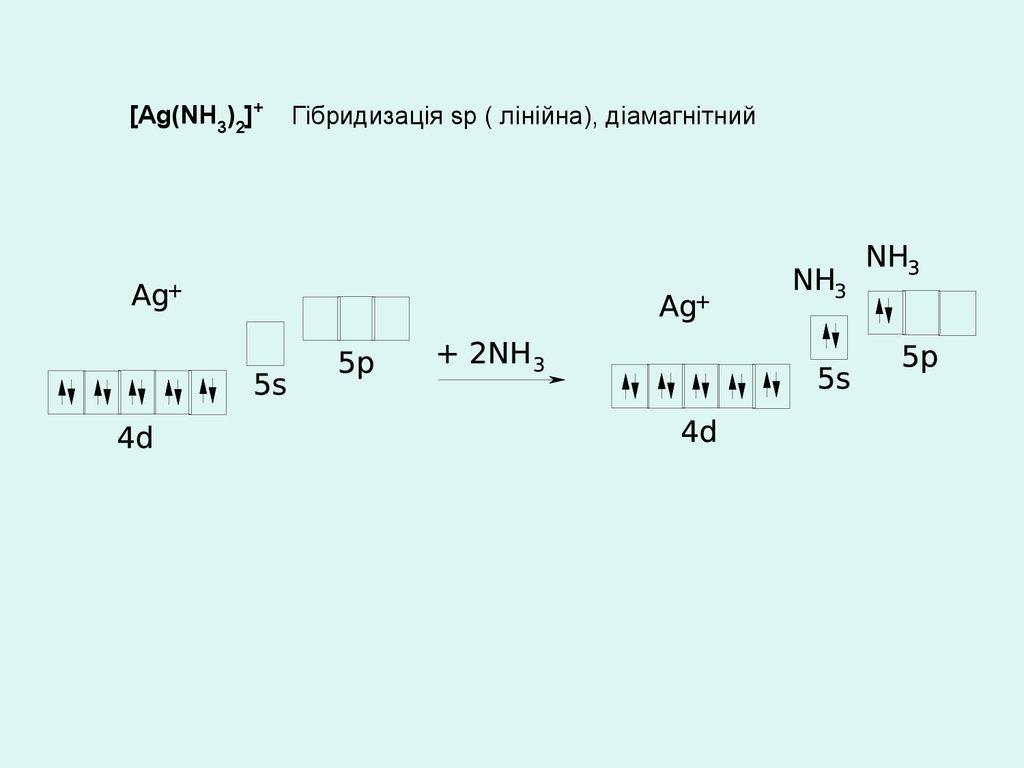
[Аg(NH3)2]+Гібридизація sp ( лінійна), діамагнітний
31.
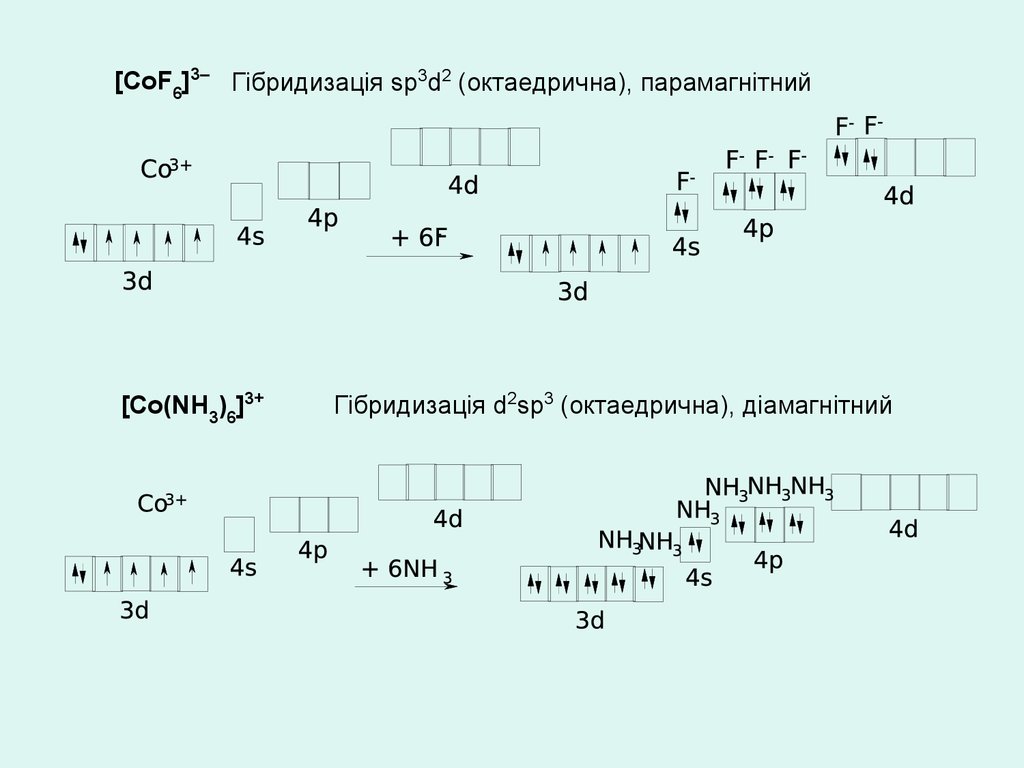
[СоF6]3– Гібридизація sр3d2 (октаедрична), парамагнітний[Со(NH3)6]3+
Гібридизація d2sр3 (октаедрична), діамагнітний
32.
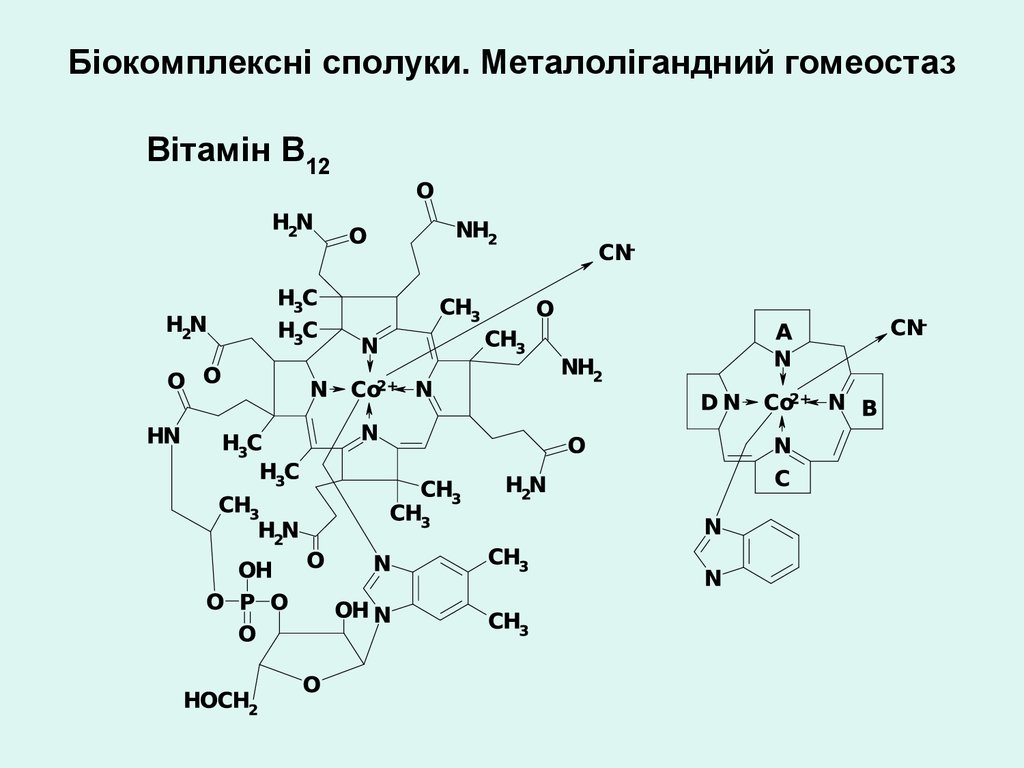
Біокомплексні сполуки. Металолігандний гомеостазВітамін В12
33.
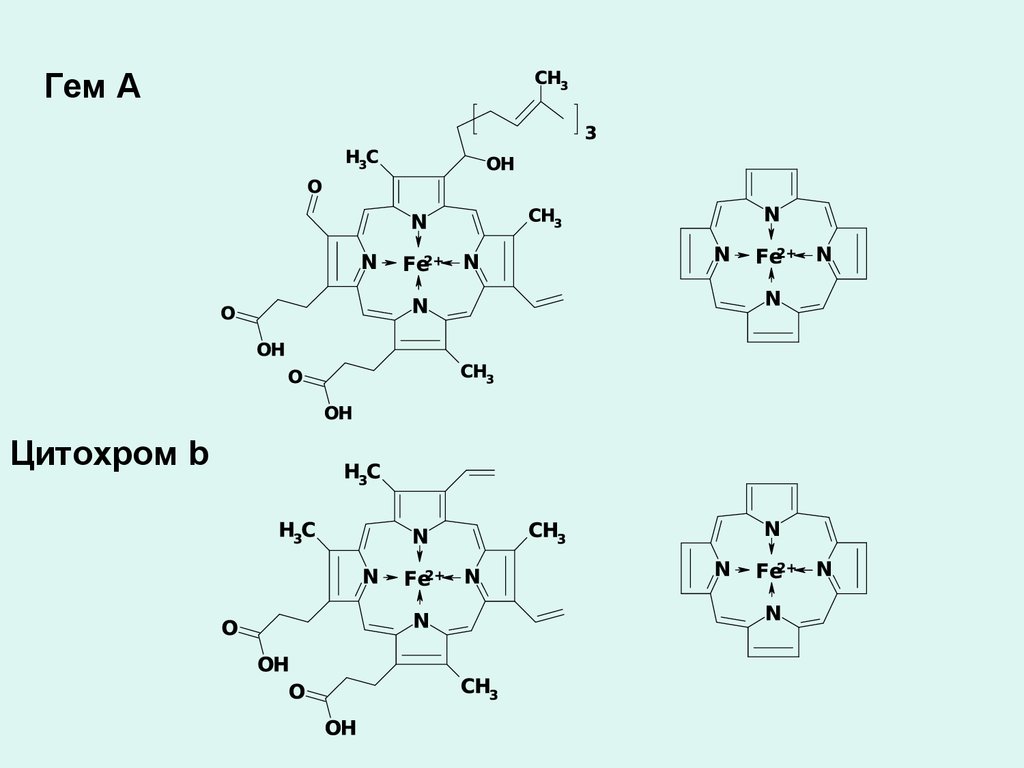
Гем АЦитохром b
34.
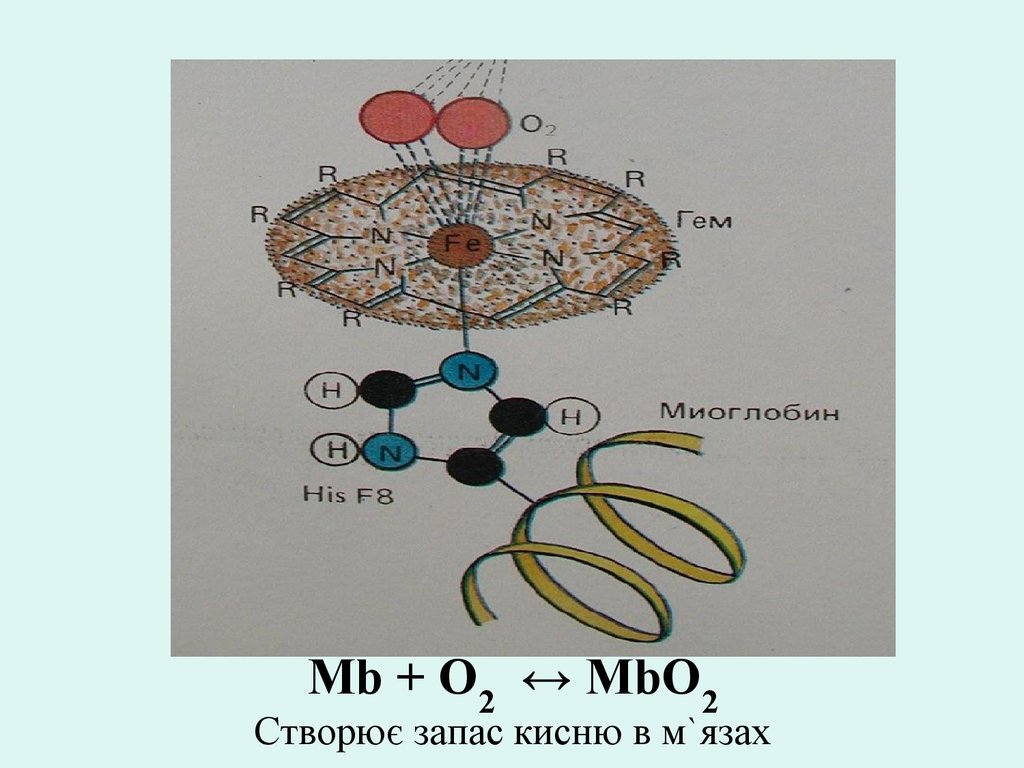
Mb + O2 ↔ MbO2Створює запас кисню в м`язах
35.
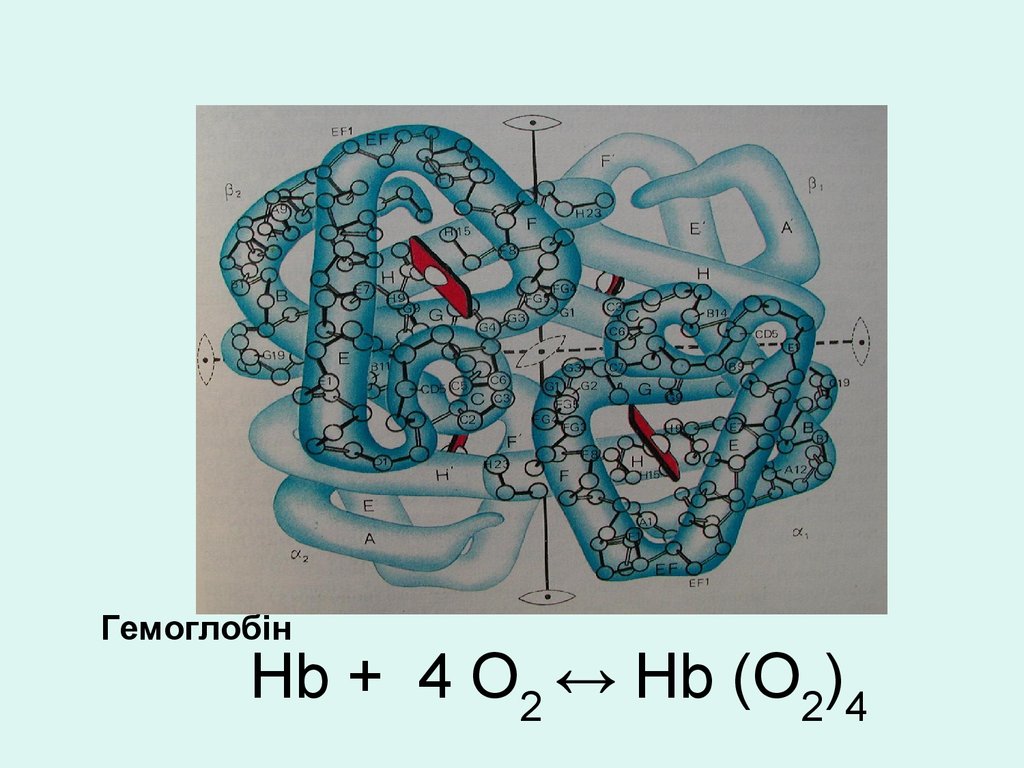
ГемоглобінHb + 4 O2 ↔ Hb (O2)4
36.
37.
ХелатотерапіяМеталолігандний гомеостаз – підтримання необхідного рівня
концентрацій мікроелементів-комплексоутворювачів шляхом
обміну з навколишнім середовищем.
Хелатотерапія – напрямок медицини, що ґрунтується
на використанні комплексонів для регулювання
металолігандного гомеостазу
Комплексони – похідні поліамінокислот, що відносяться
до класу внутрішньокомплексних сполук і мають здатність
утворювати стійкі комплекси з іонами металів
38.
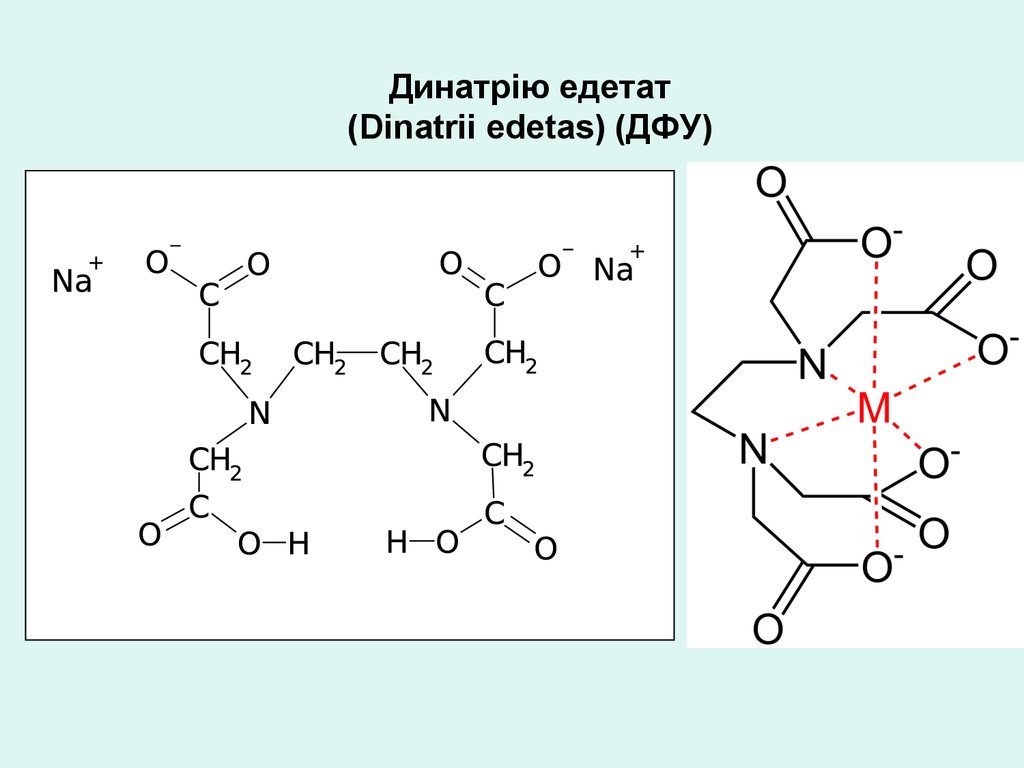
Динатрію едетат(Dinatrii edetas) (ДФУ)
39.
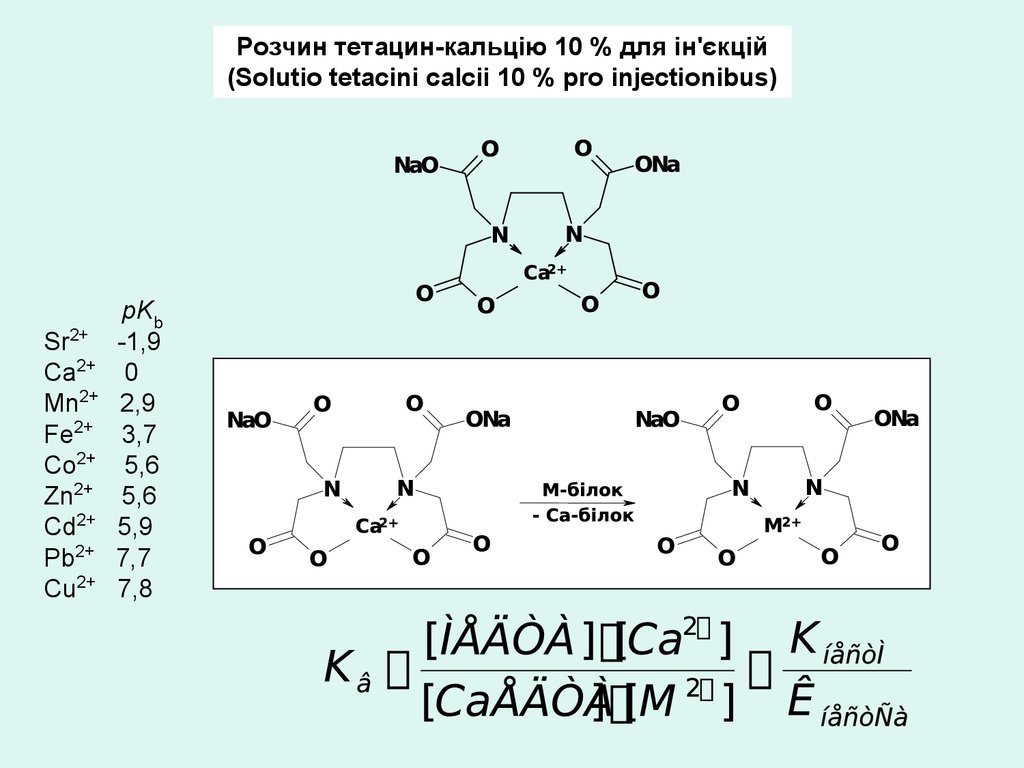
Розчин тетацин-кальцію 10 % для ін'єкцій(Solutio tetacini calcii 10 % pro injectionibus)
2+
Sr
Ca2+
Mn2+
Fe2+
Co2+
Zn2+
Cd2+
Pb2+
Cu2+
pKb
-1,9
0
2,9
3,7
5,6
5,6
5,9
7,7
7,8
40.
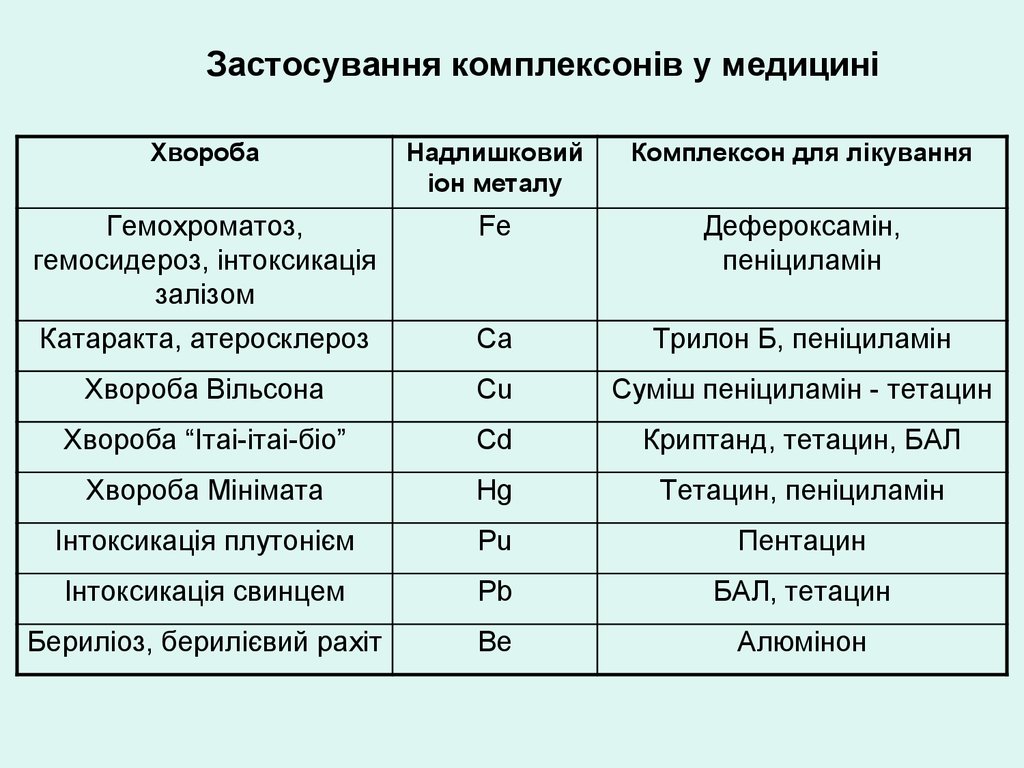
Застосування комплексонів у медициніХвороба
Надлишковий
іон металу
Комплексон для лікування
Гемохроматоз,
гемосидероз, інтоксикація
залізом
Fe
Дефероксамін,
пеніциламін
Катаракта, атеросклероз
Ca
Трилон Б, пеніциламін
Хвороба Вільсона
Cu
Суміш пеніциламін - тетацин
Хвороба “Ітаі-ітаі-біо”
Cd
Криптанд, тетацин, БАЛ
Хвороба Мінімата
Hg
Тетацин, пеніциламін
Інтоксикація плутонієм
Pu
Пентацин
Інтоксикація свинцем
Pb
БАЛ, тетацин
Бериліоз, берилієвий рахіт
Be
Алюмінон
41.
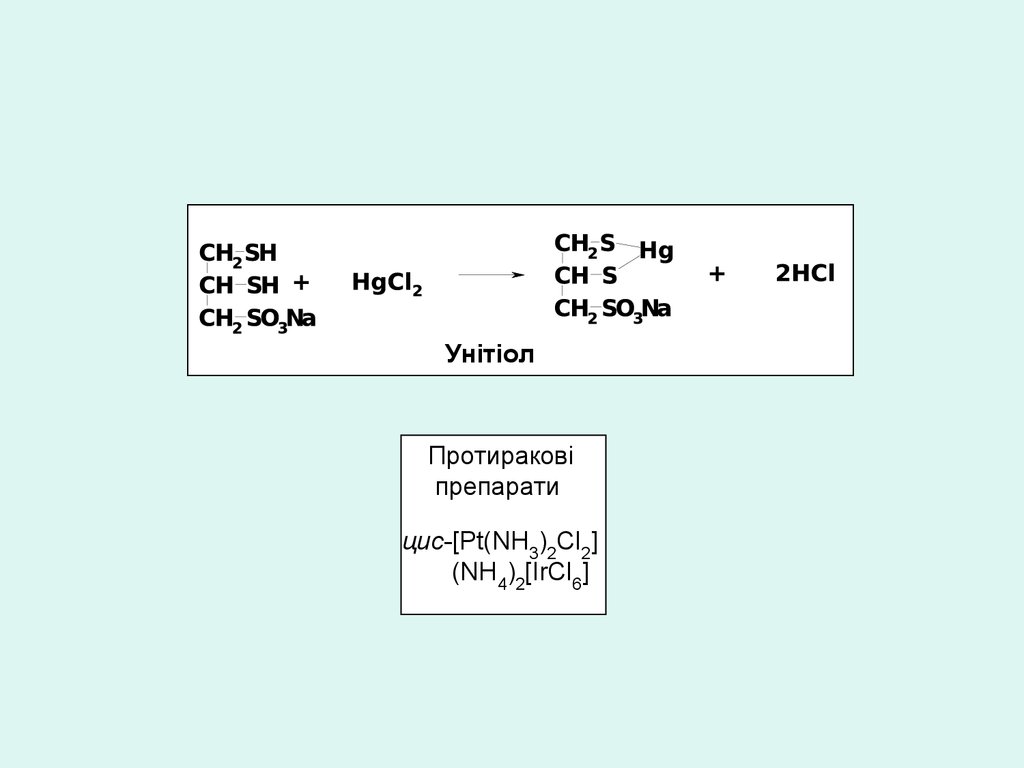
УнітіолПротиракові
препарати
цис-[Pt(NH3)2Cl2]
(NH4)2[IrCl6]


















 Биология
Биология Химия
Химия