Похожие презентации:
Белки и нуклеиновые кислоты
1.
Белкиинуклеиновы
2.
Белки в природеБелки входят в состав клеток, тканей всех живых организмов,
являются основной частью нашей пищи. Белок – высшая форма
развития органических веществ. В нем объединены признаки
разных классов органических соединений, что в своем сочетании
дает совершенно новые качества, выполняющие большую роль в
жизненных процессах организма. Например, гемоглобин
присоединяет и транспортирует кислород в организме, инсулин
регулирует содержание сахара в крови.
3.
Состав и строение белковПри рассмотрении строения белков выделяют четыре вида структур:
Первичная структура — определяется порядком чередования аминокислот в цепи.
Изменение в расположении даже одной аминокислоты ведет к образованию
совершенно новой молекулы белка. Число белковых молекул, которое образуется при
сочетании 20 разных аминокислот, достигает астрономической цифры.
Вторичная структура — белковая цепь укладывается в спираль, состоящую из
равномерных витков. Соседние витки соединены между собой слабыми водородными
связями, которые при многократном повторении придают устойчивость молекулам
белков с этой структурой.
Третичная структура — спираль вторичной структуры укладывается в клубок. Форма
клубка у каждого вида белков строго специфична и полностью зависит от первичной
структуры, т. е. от порядка расположения аминокислот в цепи. Третичная структура
удерживается благодаря множеству слабых электростатических связей: положительно и
отрицательно заряженные группы аминокислот притягиваются и сближают даже далеко
отстоящие друг от друга участки белковой цепи.
Четвертичная структура — некоторые белки, например гемоглобин, состоят из
нескольких цепей, различающихся по первичной структуре. Объединяясь вместе, они
создают сложный белок.
4.
Первичная структура белков:Третичная структура белков:
Вторичная структура белков:
Четвертичная структура белков:
5.
Белки представляют собой большие молекулы,состоящие из сотен и тысяч элементарных
звеньев - аминокислот. Такие вещества,
состоящие из повторяющихся элементарных
звеньев — мономеров, называются полимерами.
Соответственно белки можно назвать
полимерами, мономерами которых служат
аминокислоты.
состав белка
азот
сера
кислород
водород
углерод
6.
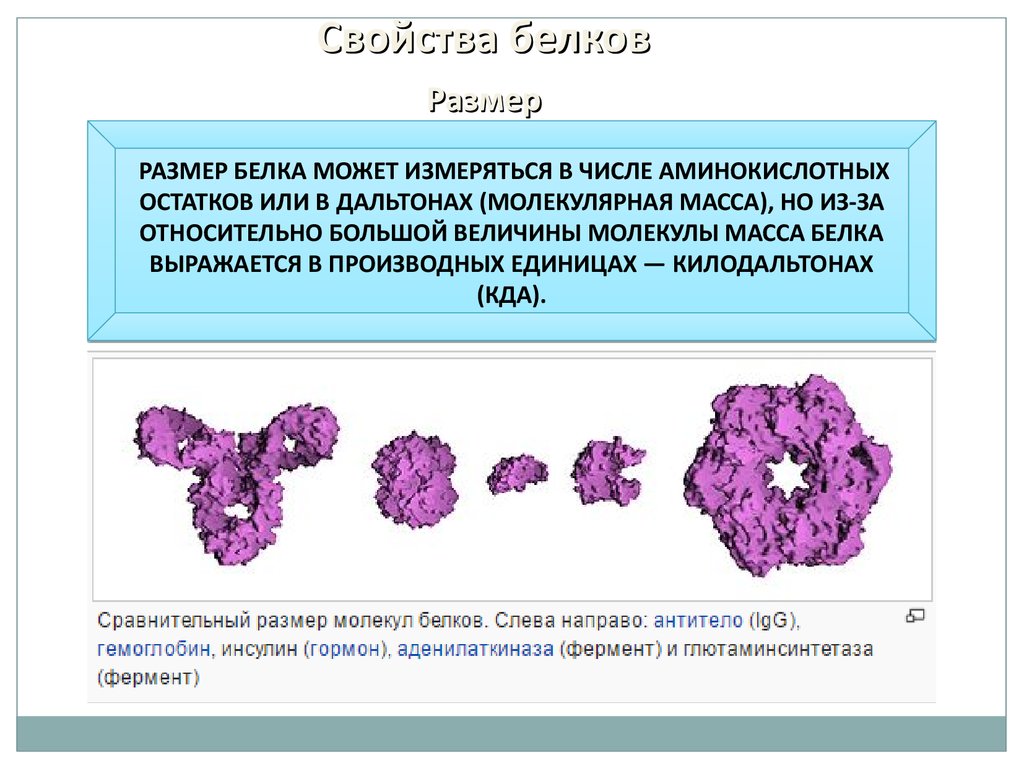
Свойства белковРазмер
РАЗМЕР БЕЛКА МОЖЕТ ИЗМЕРЯТЬСЯ В ЧИСЛЕ АМИНОКИСЛОТНЫХ
ОСТАТКОВ ИЛИ В ДАЛЬТОНАХ (МОЛЕКУЛЯРНАЯ МАССА), НО ИЗ-ЗА
ОТНОСИТЕЛЬНО БОЛЬШОЙ ВЕЛИЧИНЫ МОЛЕКУЛЫ МАССА БЕЛКА
ВЫРАЖАЕТСЯ В ПРОИЗВОДНЫХ ЕДИНИЦАХ — КИЛОДАЛЬТОНАХ
(КДА).
7.
Физико-химические свойства:Амфотерность
В зависимости от условий
проявляют кислотные и
основные свойства.
В белках присутствуют
несколько типов химических
группировок, способных к
ионизации в водном
растворе:
карбоксильные остатки
боковых цепей кислых
аминокислот (аспарагиновая
и
глутаминовая кислоты) и
азотсодержащие группы
боковых цепей основных
аминокислот (в первую
очередь, ε-аминогруппа
лизина и амидиновый
остаток CNH(NH2) аргинина,
в несколько меньшей
степени - имидазольный
остаток гистидина).
Растворимость
Белки различаются по степени
растворимости в воде.
Водорастворимые белки
называются альбуминами, к ним
относятся белки крови и молока. К
нерастворимым (склеропротеинам)
относятся, например, кератин
(волосы, шерсть млекопитающих,
перья птиц и т. п.) и фиброин,
который входит в состав шёлка и
паутины.
Белки также делятся на
гидрофильные и гидрофобные
(водооталкивающие). К
гидрофильным относится
большинство белков цитоплазмы,
ядра и межклеточного вещества, в
том числе нерастворимые кератин
и фиброин. К гидрофобным
относится большинство белков,
входящих в состав
биологических мембран.
Денатурация
Денатурация белка – это
любое изменение в его
биологической
активности или физикохимических свойствах,
связанные с потерей
четвертичной,
третичной или
вторичной структуры.
Денатурация белка может
быть полной или
частичной, обратимой или
необратимой.
8.
Превращения белков в организме.Белки — это основа жизни. Из них построена цитоплазма, из них состоят ферменты. Миозин и
актин, гемоглобин и антитела, ДНК и РНК белковой природы.
Животные и растительные белки в пищеварительном тракте человека расщепляются на
аминокислоты. Всасываясь, аминокислоты кровью доставляются в клетки тканей. Здесь из
аминокислот под действием ферментов синтезируются белки, свойственные тканям
человеческого тела.
Для синтезирования белков необходимо наличие определенных аминокислот. Но в одних
белках, поступающих с пищей, имеются все необходимые человеку аминокислоты, а в других не
все. Организм человека может сам синтезировать некоторые аминокислоты или заменять их
другими. Но 10 аминокислот он образовать не в состоянии. Их должен непременно получать с
пищей. Эти кислоты называются незаменимыми.
Белки, содержащие все необходимые аминокислоты, называют полноценными. Остальные
белки - неполноценные. Полноценными являются белки молока, сыра, мяса, рыбы, яиц,
картофеля, бобовых.
Синтезом белков в клетках управляет ДНК. Он осуществляется на поверхности рибосом с
помощью РНК. В организме человека белки почти не откладываются в запас. Излишки
аминокислот в клетках печени превращаются в углеводы — глюкозу и гликоген или в резервный
жир. Поэтому артистам балета слишком больших количеств белков в пище нужно избегать. Но и
намеренное голодание, когда вследствие больших энерготрат организм, израсходовав запасы
углеводов и жира, начинает тратить резервы белка, очень вредно. Это тратятся белки
цитоплазмы клеток.
9.
Проблема синтеза белковБелки представляют собой не просто определенную последовательность остатков
аминокислот. Не менее важна и вторичная структура (то бишь положение в
пространстве этой цепи) и третичная и четвертичная. При простом синтезе по типу
"голова к хвосту" нужная самоорганизация практически никогда не наблюдается белок денатурирует уже в процессе синтеза. Правильной аминокислотной
последовательности добится не так сложно, намного сложнее при этом получить
белок ФУНКЦИОНИРУЮЩИЙ. А функциональность их (по крайней мере, в плане
биоактивности) проявляется в очень узком интервале значений параметров
внешней среды. Это как на этапе у зэков - градус выше - термическая денатурация,
градус ниже - коагуляция, миллимолем солей
на литр больше - опять же изменение третичной
структуры и т.п.
А вот синтез белков как раз и удобнее
проводить в достаточно жестких условиях.
В этом и основная проблема.
10.
Причины невозможности получения белковсинтетическим путем.
1. Причина – в чрезвычайной сложности белковых молекул.
2. Чтобы получить заданный белок, необходимо выяснить его аминокислотный
состав, установить первичную структуру, т. е. порядок чередования аминокислот,
определить пространственную конфигурацию белковой молекулы и искусственно
воспроизвести все это.
3. Установление аминокислотного состава белков путем их гидролиза – наиболее
легкая задача.
4. Первый белок, у которого удалось расшифровать первичную структуру, был
инсулин (1954 г.), регулирующий содержание сахара в крови.
5. На установление порядка чередования аминокислот в инсулине было затрачено
почти десять лет.
6. Его молекула состоит из двух полипептидных цепочек, одна из которых содержит
двадцать один аминокислотный остаток, а другая – тридцать.
11.
Нуклеиновые кислотыНуклеиновая кислота — высокомолекулярное органическое соединение, биополимер
(полинуклеотид), образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК
присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению,
передаче и реализации наследственной информации.
Физические свойства:
Нуклеиновые кислоты хорошо растворимы в воде, практически нерастворимы в органических
растворителях. Очень чувствительны к действию температуры и критическим значениям уровня
pH. Молекулы ДНК с высокой молекулярной массой, выделенные из природных источников,
способны фрагментироваться под действием механических сил, например, при перемешивании
раствора. Нуклеиновые кислоты фрагментируются ферментами — нуклеазами.
Состав:
Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из
нуклеотидов соединяются через остаток фосфорной кислоты (фосфодиэфирная связь).
Поскольку в нуклеотидах существует только два типа гетероциклических молекул, рибоза и
дезоксирибоза, то и имеется лишь два вида нуклеиновых кислот —
дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК).
12.
Мономерные формы также встречаются в клетках и играют важную роль в процессахпередачи сигналов или запасании энергии. Наиболее известный мономер РНК —
АТФ, аденозинтрифосфорная кислота, важнейший аккумулятор энергии в клетке.
ДНК (дезоксирибонуклеиновая кислота). Сахар —
дезоксирибоза, азотистые основания: пуриновые — гуанин
(G), аденин (A), пиримидиновые — тимин (T) и цитозин (C).
часто состоит из двух полинуклеотидных цепей,
направленных антипараллельно.
ДНК
РНК (рибонуклеиновая кислота). Сахар — рибоза, азотистые
основания: пуриновые — гуанин (G), аденин (A),
пиримидиновые урацил (U) и цитозин (C). Структура
полинуклеотидной цепочки аналогична таковой в ДНК. Из-за
особенностей рибозы молекулы РНК часто имеют различные вторичные и третичные
структуры, образуя комплементарные участки между разными цепями. ДНК
(дезоксирибонуклеиновая кислота). Сахар — дезоксирибоза, азотистые основания:
пуриновые — гуанин (G), аденин (A), пиримидиновые — тимин (T) и цитозин (C). ДНК часто
состоит из двух полинуклеотидных цепей, направленных антипараллельно.
РНК (рибонуклеиновая кислота). Сахар — рибоза, азотистые основания: пуриновые —
гуанин (G), аденин (A), пиримидиновые урацил (U) и цитозин (C). Структура
полинуклеотидной цепочки аналогична таковой в ДНК. Из-за особенностей рибозы
молекулы РНК часто имеют различные вторичные и третичные структуры, образуя
комплементарные участки между разными цепями.










 Биология
Биология








