Похожие презентации:
Требования к технической и эксплуатационной документации медицинских изделий в национальной системе и ЕАЭС
1.
Требования к технической и эксплуатационнойдокументации медицинских изделий в
национальной системе и ЕАЭС.
Никифорова Лариса Юрьевна
2. ОКОНЧАНИЕ ДЕЙСТВИЯ НАЦИОНАЛЬНЫХ СИСТЕМ РЕГИСТРАЦИИ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Соглашение от 23 декабря 2014 года «О единыхпринципах и правилах обращения медицинских изделий
(изделий медицинского назначения и медицинской
техники) в рамках евразийского экономического союза»
Документы, подтверждающие факт государственной регистрации
медицинских изделий и выданные уполномоченным органом до
вступления настоящего Соглашения в силу, действуют на территории
государства-члена до окончания срока их действия, но не позднее 31
декабря 2021 г.
По взаимному согласию государств-членов в
настоящее Соглашение могут вноситься изменения,
которые оформляются отдельными протоколами и
являются
неотъемлемой
частью
настоящего
Соглашения
б) документы, подтверждающие факт регистрации медицинских изделий и
выданные уполномоченным органом государства-члена в области
здравоохранения в соответствии с законодательством этого государствачлена, действительны до окончания срока их действия, но не позднее 31
декабря 2021 г (Решение Комиссии ЕАЭС от 23.02.2016 № 46)
3. ОКОНЧАНИЕ ДЕЙСТВИЯ НАЦИОНАЛЬНЫХ СИСТЕМ РЕГИСТРАЦИИ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Изменение сроковобращения медицинских
изделий – 31.12.2026
До истечения срока действия
регистрационного
удостоверения
Продление процедуры
внесения изменений в
регистрационное
удостоверение??
4. ДОКУМЕНТЫ ДЛЯ РЕГИСТРАЦИИ МЕДИЦИНСКИХ ИЗДЕЛИЙ
5. ПЕРЕЧЕНЬ ДОКУМЕНТОВ ДЛЯ РЕГИСТРАЦИИ
Правила попостановлению от
27.12.2012 №
1416
К
Заявлению
о
регистрации - пункт 10,
всего 11 документов, в
том числе:
Решение
Комиссии ЕАЭС
от 12.02.2016 №
46
Приложение 4, вместе с
Заявлением о
регистрации, всего 30
документов, в том числе:
техническая
документация
производителя
(изготовителя);
Справка на медицинское изделие (8), Данные о
маркировке и упаковке (9), Информация о
разработке и производстве (10), Документ,
устанавливающий требования к техническим
характеристикам медицинского изделия (16),
Отчет об анализе рисков (20), Данные о
процедуре стерилизации (23), Информация о
специальном программном обеспечении (24)
эксплуатационная
документация
производителя
(изготовителя)
Эксплуатационный документ
или инструкция по
применению (26),
Руководство по сервисному
обслуживанию (27)
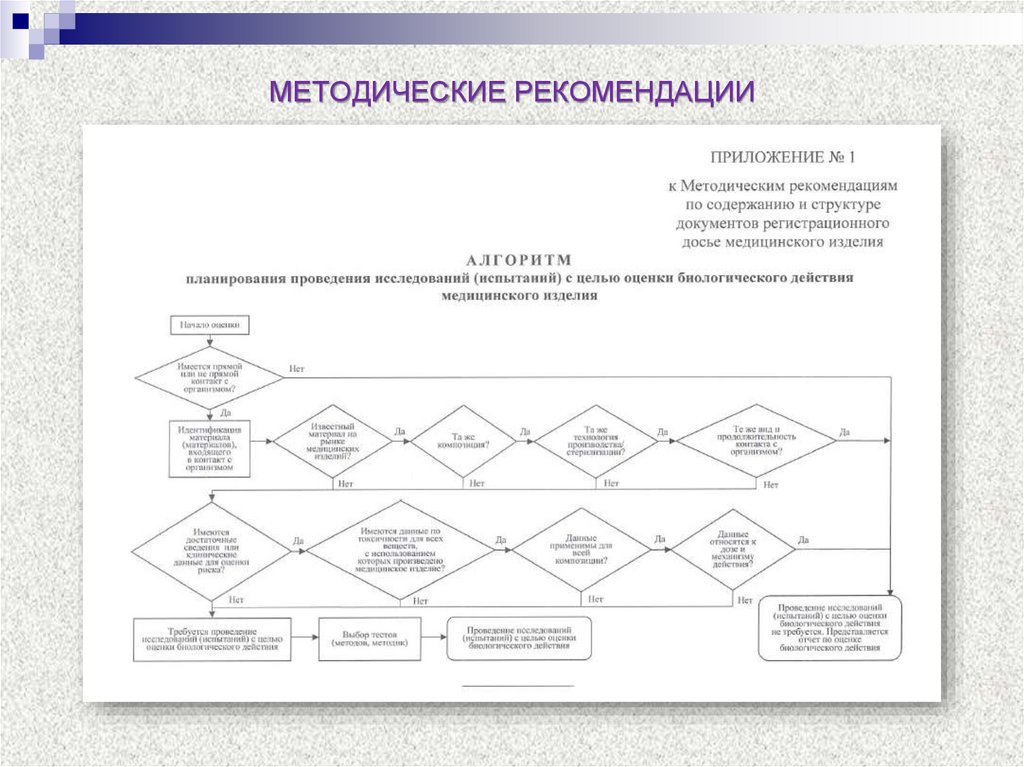
6. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
7. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
8. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
9. Правила регистрации и экспертизы безопасности, качества и эффективности медицинских изделий
НАЧАЛО ДЕЙСТВИЯ• РЕШЕНИЕ Совета ЕЭК от 12 февраля
2016 г. N 46
• Вступило в силу с 06 мая 2017 года
Приложение N 4. Перечень
документов, необходимых для
регистрации медицинского изделия,
и форма справки на медицинское
изделие
10. Правила регистрации и экспертизы безопасности, качества и эффективности медицинских изделий
Приложение N 4. Перечень документов, необходимыхдля регистрации медицинского изделия, и форма
справки на медицинское изделие
Документ, устанавливающий требования к техническим
характеристикам медицинского изделия
Эксплуатационный документ или инструкция по применению
медицинского изделия на государственном языке государств
признания (при необходимости) и русском языках
заверяется производителем (его уполномоченным
представителем)
11. Документ, устанавливающий требования к техническим характеристикам медицинского изделия
В решениях совета ЕАЭС:форма документов не установлена;
требования к минимальному содержанию не определены.
Таким образом:
форма документа свободная, с обязательным заверением в соответствии с
Приложением № 4;
содержание должно опираться на:
- определение «качество медицинского изделия», установленное в Решении ЕЭК
от 12 февраля 2016 г. N 46 - степень соответствия совокупности свойств и
характеристик
медицинского
изделия
целям
его
предназначенного
использования;
- требования Решения ЕЭК от 12 февраля 2016 г. N 27 «Общие требования
безопасности и эффективности медицинских изделий, требования к их
маркировке и эксплуатационной документации на них».
12. Документ, устанавливающий требования к техническим характеристикам медицинского изделия
Для медицинских изделий производства РоссийскойФедерации в качестве Документа, устанавливающего
требования,
рекомендуется
представлять
Технические
условия, выполненные в соответствии со стандартами Единой
системы конструкторской документации (ЕСКД).
Основной стандарт – ГОСТ 2.114-2016 Единая система
конструкторской документации. Технические условия.
Стандарт устанавливает общие требования, правила и нормы
к выполнению технических условий. На основе стандарта
могут
быть
разработаны
стандарты,
учитывающие
особенности выполнения технических условий изделий
различных видов техники с учетом их специфики.
13. Решения ЕЭК, которые необходимо принимать во внимание при подготовке Документа с техническими требованиями и Эксплуатационной
документацииРЕШЕНИЕ от 12 февраля 2016 г. N 27
• Общие требования безопасности и
эффективности медицинских изделий,
требований к их маркировке и
эксплуатационной документации на них
РЕШЕНИЕ от 12 февраля 2016 г. N 42
• Перечень видов медицинских изделий,
подлежащих отнесению при их регистрации к
средствам измерений
14. Решения ЕЭК, которые необходимо принимать во внимание при подготовке Документа с техническими требованиями и Эксплуатационной
документацииРЕШЕНИЕ от 12 февраля 2016 г. N 46
• Правила регистрации и экспертизы
безопасности, качества и эффективности
медицинских изделий
РЕШЕНИЕ от 22 декабря 2015 г. N 173
• Правила классификации медицинских изделий
в зависимости от потенциального риска
применения
15. Решения ЕЭК, которые необходимо принимать во внимание при подготовке Документа с техническими требованиями и Эксплуатационной
документацииРЕШЕНИЕ от 12 февраля 2016 г. N 29
• Правила проведения клинических и клиниколабораторных
испытаний
(исследований)
медицинских изделий
РЕШЕНИЕ от 10 ноября 2017 г. N 106
• Требования к внедрению, поддержанию и
оценке
системы
менеджмента
качества
медицинских изделий в зависимости от
потенциального риска их применения
16. ПЕРЕЧЕНЬ РЕКОМЕНДУЕМЫХ РАЗДЕЛОВ ДОКУМЕНТА С ТЕХНИЧЕСКИМИ ТРЕБОВАНИЯМИ
Наименование медицинского изделия• соответствие всем другим документам досье
• единое по всему тексту Документа
Перечень состава медицинского изделия
• комплектующие
• принадлежности
Наименование производителя
(производителей) медицинского изделия
• соответствие всем другим документам досье
• взаимосвязь между производителями
17. ПЕРЕЧЕНЬ РЕКОМЕНДУЕМЫХ РАЗДЕЛОВ ДОКУМЕНТА С ТЕХНИЧЕСКИМИ ТРЕБОВАНИЯМИ
Назначение медицинского изделия• соответствие всем другим документам досье
• отражающее специфичность медицинского
изделия
Область применения медицинского изделия
• медицинская область применения
• с учетом назначения
Кодификация и классификация медицинского
изделия
• Код вида медицинского изделия
• Класс потенциального риска применения медицинского изделия
18. ПЕРЕЧЕНЬ РЕКОМЕНДУЕМЫХ РАЗДЕЛОВ ДОКУМЕНТА С ТЕХНИЧЕСКИМИ ТРЕБОВАНИЯМИ
Основные технические характеристики• свойственные медицинскому изделию
• характеристики принадлежностей
Сведения о лекарственном средстве (при наличии)
• наименование и состав лекарственного средства
• наименование производителя лекарственного
средства
Специальные свойства и характеристики
медицинского изделия
• присущие только данному изделию
• Определяющие назначение медицинского изделия
19. ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ
РЕШЕНИЕ от 12 февраля 2016 г. N 2714. Требования к информации, содержащейся в инструкции по
применению медицинского изделия
64. Инструкция по применению может быть предоставлена
пользователю на бумажном носителе либо в электронном
виде как вместе с медицинским изделием, так и отдельно от
него, в том числе путем размещения информации на экране,
являющемся частью медицинского изделия. Выбранный способ
предоставления инструкции по применению должен быть
пригоден и доступен для пользователей.
20. ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ
РЕШЕНИЕ от 12 февраля 2016 г. N 2714. Требования к информации, содержащейся в инструкции по
применению медицинского изделия
65. Инструкция по применению должна содержать следующую
информацию:
21. ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ
РЕШЕНИЕ от 12 февраля 2016 г. N 2714. Требования к информации, содержащейся в инструкции по применению
медицинского изделия
66. Инструкция по применению должна быть составлена с использованием
терминов, понятных пользователю, и при необходимости сопровождаться
рисунками и диаграммами.
Инструкция по применению может содержать отдельные сведения для
профессиональных и непрофессиональных пользователей.
67. Инструкция по применению может быть представлена в сокращенном виде
или на маркировке (для медицинских изделий классов потенциального риска
применения 1 и 2а), если медицинское изделие может быть использовано
безопасно и по назначению, определенному производителем, без инструкции по
применению.
68. Одного экземпляра инструкции по применению может быть достаточно, если
поставляется несколько медицинских изделий одному пользователю по одному
адресу. По требованию потребителя производитель должен предоставить
дополнительные экземпляры инструкции по применению.
22. ОБЩИЕ РЕКОМЕНДАЦИИ
ЕДИНАЯ ТЕРМИНОЛОГИЯПОСЛЕДОВАТЕЛЬНОСТЬ ИЗЛОЖЕНИЯ
ПРИМЕНЕНИЕ
ЕДИНИЦ ИЗМЕРЕНИЯ
СИСТЕМЫ СИ
РУССКИЙ ЯЗЫК
ВЗАИМОСВЯЗЬ
МЕЖДУ
ХАРАКТЕРИСТИКАМИ
ТОЧНЫЕ ДАННЫЕ






















 Право
Право








