Похожие презентации:
Координационные соединения
1. Координационные соединения
2. Определения
Комплексное соединение — химическоевещество, в состав которого входят
комплексные частицы (координационные
единицы).
Комплексная частица — сложная частица,
способная к самостоятельному
существованию в кристалле или растворе,
образованная из других, более простых частиц,
также способных к самостоятельному
существованию. Иногда комплексными
частицами называют сложные химические
частицы, все или часть связей в которых
образованы по донорно-акцепторному
механизму.
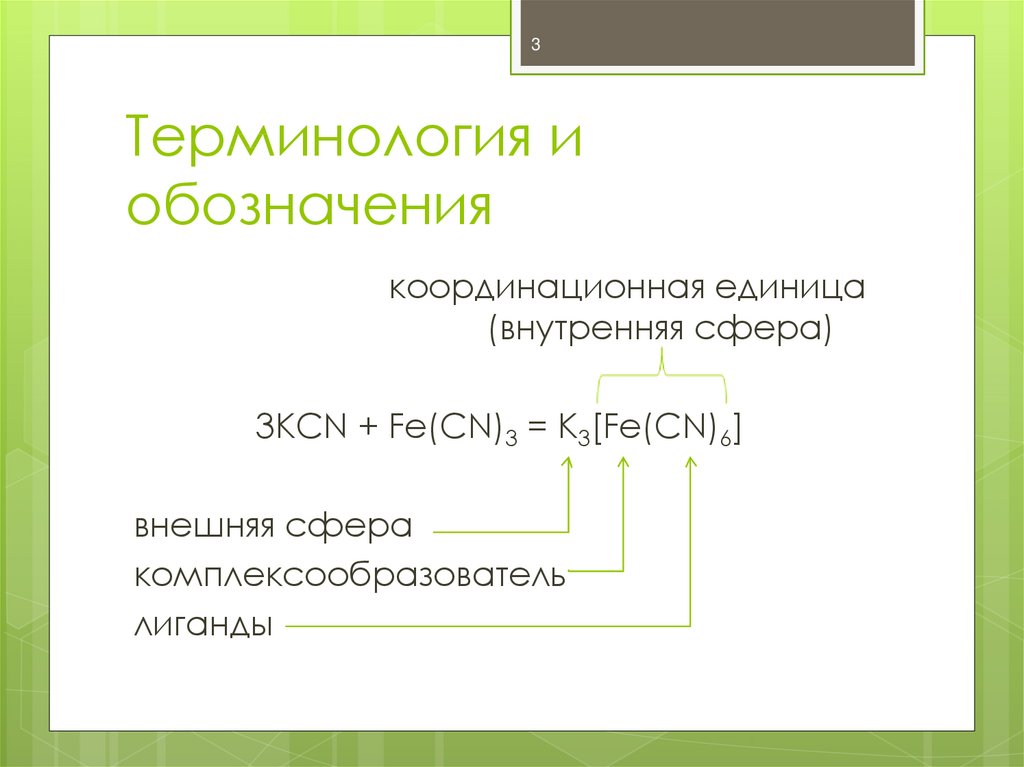
3. Терминология и обозначения
3Терминология и
обозначения
координационная единица
(внутренняя сфера)
3KCN + Fe(CN)3 = K3[Fe(CN)6]
внешняя сфера
комплексообразователь
лиганды
4. Альфред Вернер (Alfred Werner) (1866—1919)
4Альфред
Вернер (Alfred
Werner) (1866—
1919)
Швейцарский химик,
создатель координаци
онной теории, которая
легла в основу
химии комплексных
соединений,
лауреат Нобелевской
премии по
химии (1913)
5. Теория Вернера (1893 г.)
5Теория Вернера (1893 г.)
Большинство
элементов могут быть
комплексообразователями
Комплексообразователь
стремится
насытить главную и побочную
валентности
Побочная
валентность характеризуется
направленностью в пространстве
6. Характеристики КС
6Характеристики КС
Заряд
комплексного иона –
алгебраическая сумма зарядов
комплексообразователя и лигандов
Координационное
число – число σсвязей, образуемых
комплексообразователем с лигандами
7. Характеристики КС
7Характеристики КС
Заряд комплексооразователя
Координационное число
+1
+2
+3
+4
2(3) 4, 6 6(4) 6(8)
8. Характеристики лигандов
8Характеристики лигандов
Координационная
ёмкость
(дентатность) – число координационных
мест, занимаемых лигандом
Лиганды бывают:
Монодентатными
Бидентатными
Тридентатными
Полидентатными
9. Классификация КС
9Классификация КС
По
заряду комплексного иона
По типу лигандов
По способности к ионизации
Хелаты
По числу атомов
комплексообразователя
10. КС по заряду комплексного иона
10КС по заряду комплексного
иона
С
комплексным катионом:
[Cu(NH3)4]SO4, [Cr(H2O)6]Cl3,
[Co(NH3)6](OH)2
С комплексным анионом: K2[PtCl6],
H[AuCl4], KZn[Fe(CN)6]
С комплексным анионом и катионом:
[Co(NH3)6][Cr(NO2)6], [Ni(NH3)6]2[Fe(CN)6]
Нейтральные КС: [CrCl3(H2O)3],
[Ni(CN)2(NH3)4]
11. По типу лигандов
11По типу лигандов
Аминокомплексы:
[Zn(NH3)4](OH)2
Аквакомплексы: [Co(H2O)6]Cl2
Гидроксидокомплексы (для
амфотерных): Na3[Cr(OH)6],
Na2[Zn(OH)4], Na2[Be(OH)4]
Ацидокомплексы: K3[Fe(CN)6],
Na3[Ag(S2O3)2]
Карбонилы: [Fe(CO)5], [Co2(CO)8]
Смешанные комплексы: [Pt(NH3)5Cl]Cl3
12. По способности к ионизации
12По способности к ионизации
Электролиты:
Кислоты: H4[Fe(CN)6], H2[SiF6]
Основания: [Ni(NH3)6](OH)2
r(Ni2+) = 0,078 нм, r([Ni(NH3)6]2+) = 0,258 нм
Соли: K3[Co(NO2)6], [Co(NH3)6][Cr(OH)6]
Неэлектролиты:
[Co(NH3)3(NO2)3]
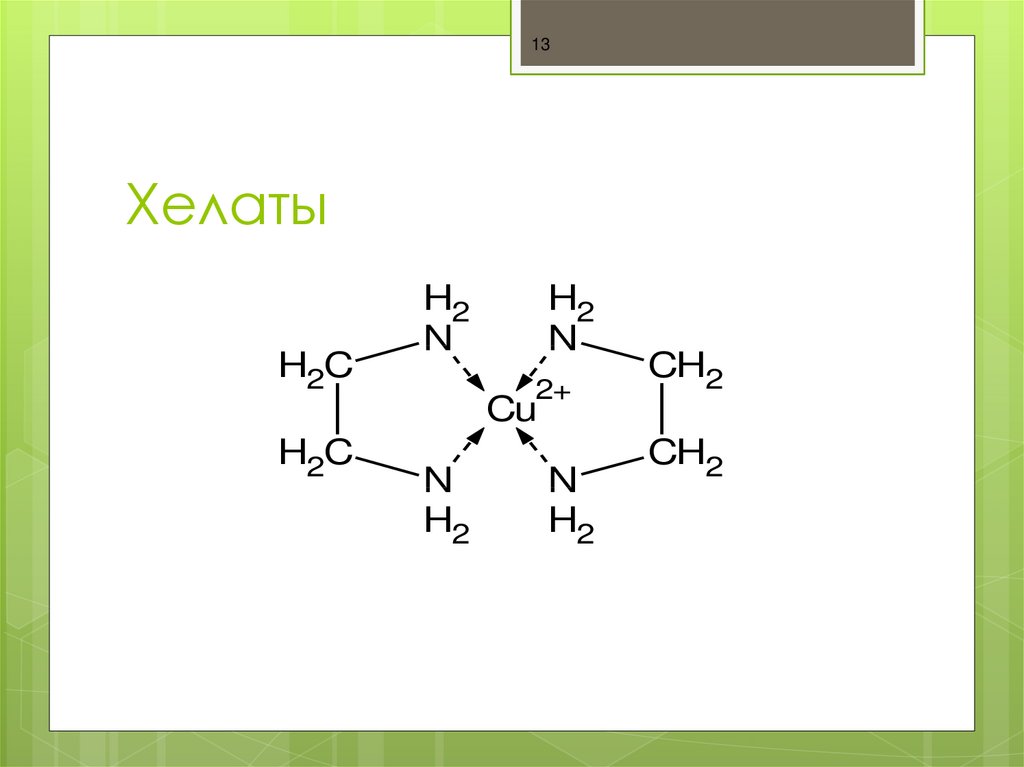
13. Хелаты
13Хелаты
H2C
H2
N
H2
N
2+
CH2
Cu
H2C
N
H2
N
H2
CH2
14. По числу атомов комплексообразователя
14По числу атомов
комплексообразователя
моноядерные
- с одним атомом
комплексообразователя)
многоядерные (полиядерные) – с двумя
и более атомами
комплексообразователя
15. Полиядерные КС
15Полиядерные КС
Мостиковые
– лиганды частично или
полностью находятся между атомами
комплексообразователя
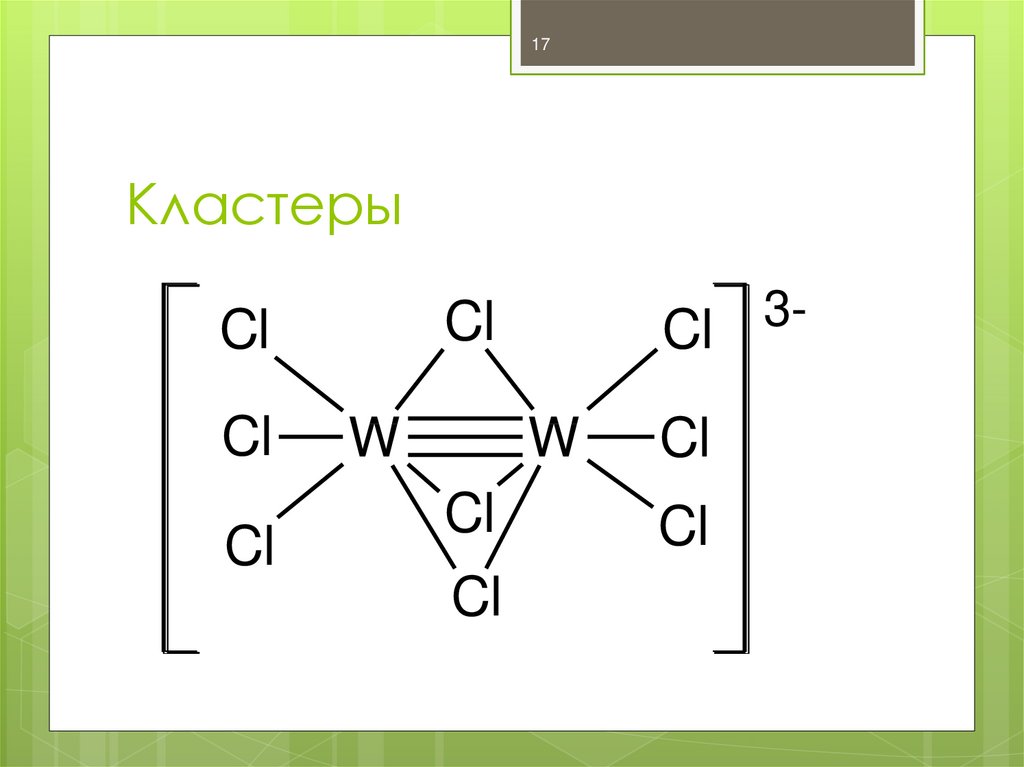
Кластеры – КС, имеющие связи Me-Me,
Me=Me, Me≡Me
16. Мостиковые КС
16Мостиковые КС
Cl
Cl
Al
Cl
Cl
Cl
Al
Cl
Cl
Cl
Cl
Cr Cl
Cl
Cl
Cl
Cr Cl
Cl
3-
17. Кластеры
17Кластеры
Cl
Cl
Cl
Cl
W
Cl
W
Cl
Cl
Cl
Cl
3-
18. Номенклатура КС
18Номенклатура КС
Название
координационной единицы:
перечисляют лиганды по алфавиту
называют комплексообразователь
в круглых скобках указывают его степень
окисления
19. Номенклатура КС
19Номенклатура КС
Названия
лигандов:
анионных: фторидо (F-), оксидо (O2-),
гидроксидо (OH-), пероксидо (O22-),
цианидо (CN-),сульфато (SO42-), азидо
(N3-)
нейтральных и катионных - без
добавления суффиксов
исключения: аква (H2O), аммин (NH3),
карбонил (CO)
20. Номенклатура КС
20Номенклатура КС
Одинаковые лиганды
Перед их названиями ставятся
умножающие приставки, если
лигандов:
2 – ди3 – три4 – тетра5 – пента6 – гекса-
21. Примеры названий КС
21Примеры названий КС
Нейтральные
[CoCl3(NH3)3] –
три(аммин)три(хлоридо)кобальт(III)
[Co(H2O)4(NO2)2] –
тетра(аква)ди(нитрито)кобальт(II)
[Ni(CO)4] - тетракарбонилникель
22. Примеры названий КС
22Примеры названий КС
С катионной координационной единицей:
[Ag(NH3)2]Cl – хлорид диамминсеребра(I)
[Pt(H2O)(NH3)2OH]NO3 – нитрат
(аква)ди(аммин)(гидроксидо)платины(II)
[CoCl2(NH3)4]Br – бромид
тетра(аммин)ди(хлоридо)кобальта(III)
23. Примеры названий КС
23Примеры названий КС
С анионной координационной единицей:
Na3[Ag(S2O3)2] – бис(тиосульфато)аргентат(I)
натрия
K3[Co(NO2)6] – гексанитритокобальтат(III) калия
FeK[Fe(CN)6] – гексацианидоферрат(II) железа(III)
калия; берлинская лазурь,
турнбулева синь
24. Примеры названий КС
24Примеры названий КС
С анионной и катионной координационными
единицами:
[Pd(NH3)4][PdCl6] – гексахлоридопалладат(IV)
тетраамминпалладия(II)
[Co(NH3)6][Co(NH3)2(NO2)4]3 –
ди(аммин)тетра(нитрито)кобальта
т(III) гексамминкобальта(III)
25. Равновесия в водных растворах координационных соединений
25Равновесия в водных
растворах координационных
соединений
За счёт ионов внешней сферы КС
являются сильными электролитами
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-; α = 1
Координационные единицы являются
слабыми электролитами
[Fe(CN)6]3- = Fe3+ + 6CN-; α << 1
26. Равновесия в водных растворах координационных соединений
26Ag+ + S2O32-
[Ag(S2O3)]-
[Ag(S 2O3 ) ]
β1
[Ag ][S2O32 ]
[Ag(S2O3)]- + S2O32-
[Ag(S2O3)2]3-
[Ag(S 2O3 )32 ]
β2
[Ag(S 2O3 ) ][S2O32 ]
27. Равновесия в водных растворах координационных соединений
27Ag+ + 2S2O32-
[Ag(S2O3)2]33
2 3 2
2 2
2 3
[Ag(S O ) ]
β0
[Ag ][S O ]
β0 = β1·β2
β1, β2 – ступенчатые константы устойчивости
(образования) комплекса
β0 – общая константа устойчивости
(образования) комплекса
28. Равновесия в водных растворах координационных соединений
28Равновесия в водных растворах
координационных соединений
Обратные
константам образования величины
K-1 называются константами нестойкости и
характеризуют равновесия распада
координационных частиц на
комплексообразователь и лиганды
K-1 = 1/β
Они также могут быть ступенчатыми и общими
29. Устойчивость комплексов
29Устойчивость комплексов
Свойства комплексообразователя, определяющие прочность
координационных связей:
Электронное строение комплексообразователя
Заряд иона комплексообразователя (чем больше заряд
тем устойчивее комплекс)
Радиус комплексообразователя (ряд Ирвинга-Вильямса –
устойчивость аналогичных комплексов:
Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+
Радиус ионов:
Mn2+ > Fe2+ > Co2+ > Ni2+ < Cu2+ < Zn2+)
Поляризующее действие и поляризуемость
комплексообразователя
30. Устойчивость комплексов
30Устойчивость комплексов
Свойства лигандов, определяющие устойчивость
комплексов:
Электронная структура
Заряд
Размеры
Поляризуемость
Дентатность
Геометрические характеристики
31. Природа химической связи в КС
31Природа химической связи в
КС
Метод
Теория
Метод
валентных связей
кристаллического поля
молекулярных орбиталей
(теория поля лигандов)
32. Метод валентных связей
32Метод валентных связей
σ-Связь
ковалентная двухэлектронная и
двухцентровая образуется по донорноакцепторному механизму
Комплексообразователь
– донор
вакантной орбитали, лиганд – донор
неподелённой пары электронов
Гибридизация
АО
комплексообразователя
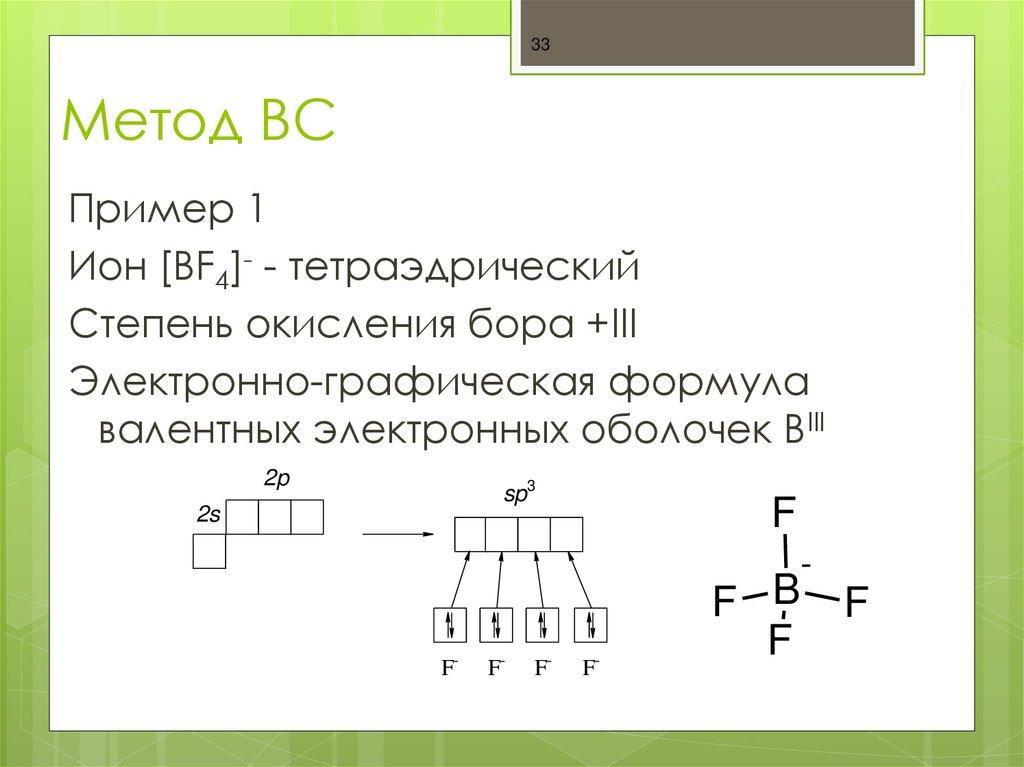
33. Метод ВС
33Метод ВС
Пример 1
Ион [BF4]- - тетраэдрический
Степень окисления бора +III
Электронно-графическая формула
валентных электронных оболочек BIII
2p
sp3
2s
F-
F-
F-
F
F-
F B
F
-
F
34. Метод ВС
34Метод ВС
Пример 2
Ион [Ag(CN)2]- - линейный
Степень окисления серебра +I
Электронно-графическая формула
валентных электронных оболочек AgI
5p
5p
5s
sp
4d
4d
N
-
C Ag C
N
CN- CN-
35. Метод ВС
35Метод ВС
Пример 3
Ион [Zn(OH)4]2- - тетраэдрический
Степень окисления цинка +II
Электронно-графическая формула
валентных электронных оболочек ZnII
4p
4s
3d
sp3
3d
OH- OH- OH- OH-
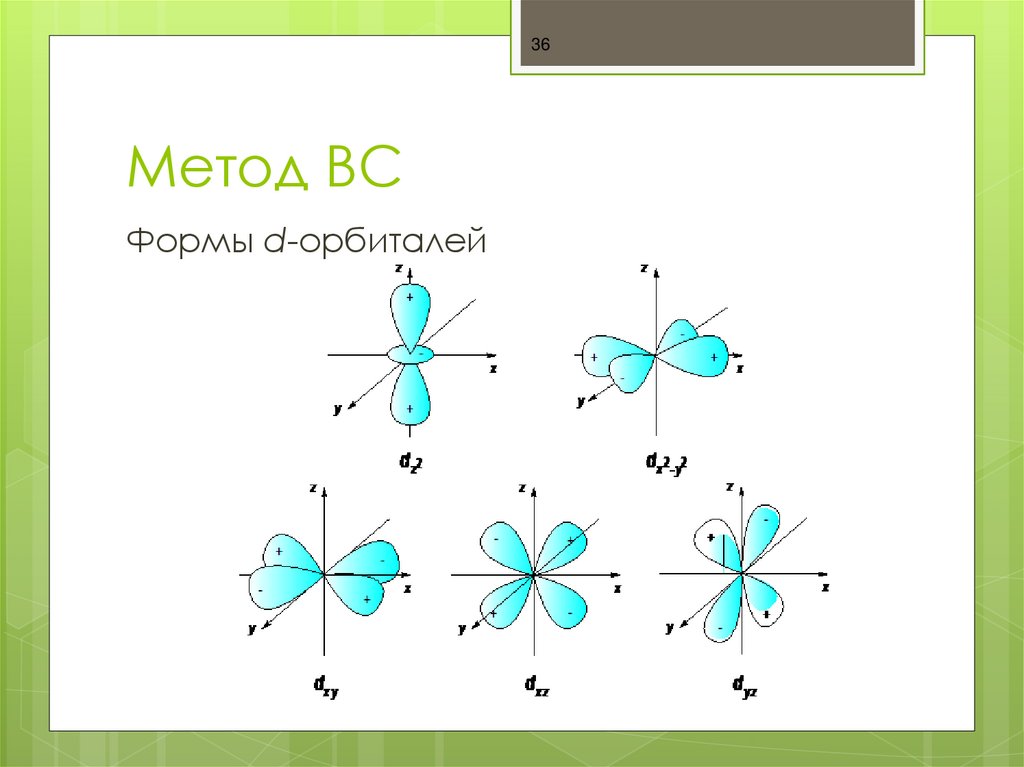
36. Метод ВС
36Метод ВС
Формы d-орбиталей
37. Метод ВС
37Метод ВС
Пример 4
Ион [Co(NH3)6]3+ - октаэдрический, диамагнитный,
внутриорбитальный
Степень окисления кобальта +III
Электронно-графическая формула валентных
электронных оболочек Co3+
4d
4d
4p
2
d sp
4s
3d
3
3d
NH3 NH3 NH3 NH3 NH3 NH3
38. Метод ВС
38Метод ВС
Пример 5
Ион [CoF6]3- - октаэдрический, парамагнитный,
внешнеорбитальный
Степень окисления кобальта +III
Электронно-графическая формула валентных
электронных оболочек Co3+
4d
4d
4p
3 2
sp d
4s
3d
3d
F-
F-
F-
F-
F-
F-
39. Метод ВС
39Метод ВС
Пример 6
Ион [SnCl6]2- - октаэдрический, диамагнитный,
внешнеорбитальный
Степень окисления олова +II
Электронно-графическая формула валентных
электронных оболочек Sn2+
5d
5d
5p
3 2
sp d
5s
4d
4d
Cl- Cl- Cl- Cl- Cl- Cl-
40. Теория кристаллического поля
40Теория кристаллического
поля
Механизм образования связей в координационных
соединениях объясняется чисто электростатическим
взаимодействием между центральным ионом и
лигандами.
Лиганды независимо от их реальной структуры
представляются как точечные заряды (иногда — диполи);
Электронная конфигурация центрального иона
(комплексообразователя) рассматривается в рамках
квантово-химических представлений;
Теория кристаллического поля применима для описания
химической связи координационных соединениях
исключительно d- и f-элементов.
Представления о расщеплении энергетических уровней
иона-комплексообразователя под влиянием лиганда —
центральный пункт ТКП.
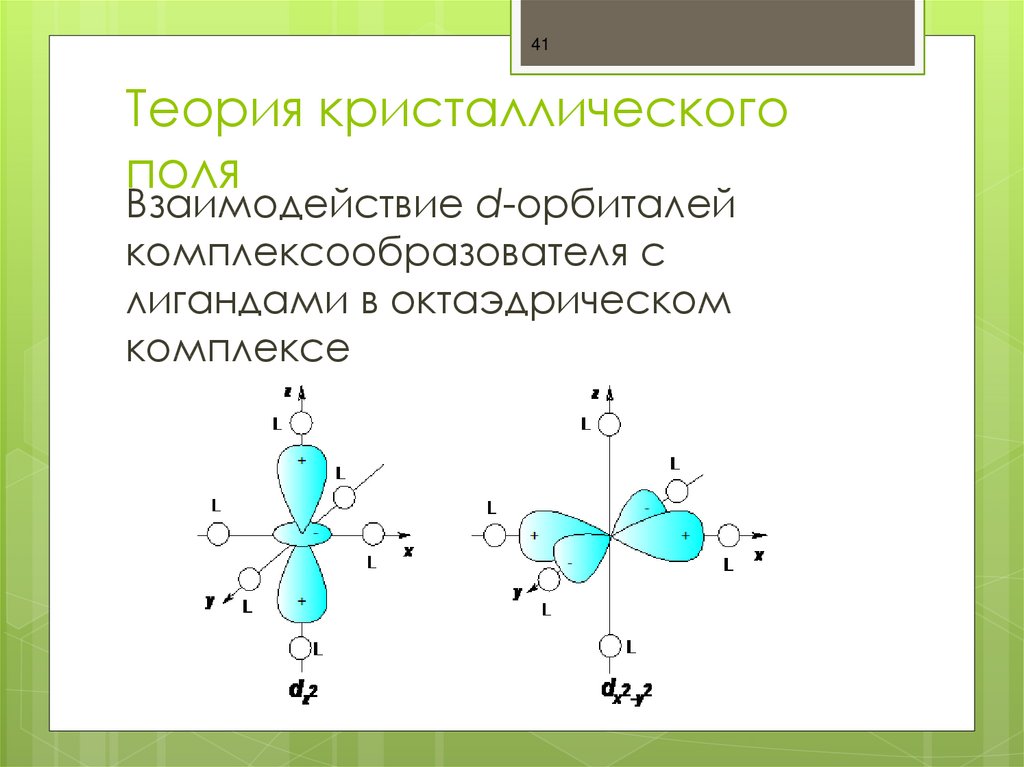
41. Теория кристаллического поля
41Теория кристаллического
поля
Взаимодействие d-орбиталей
комплексообразователя с
лигандами в октаэдрическом
комплексе
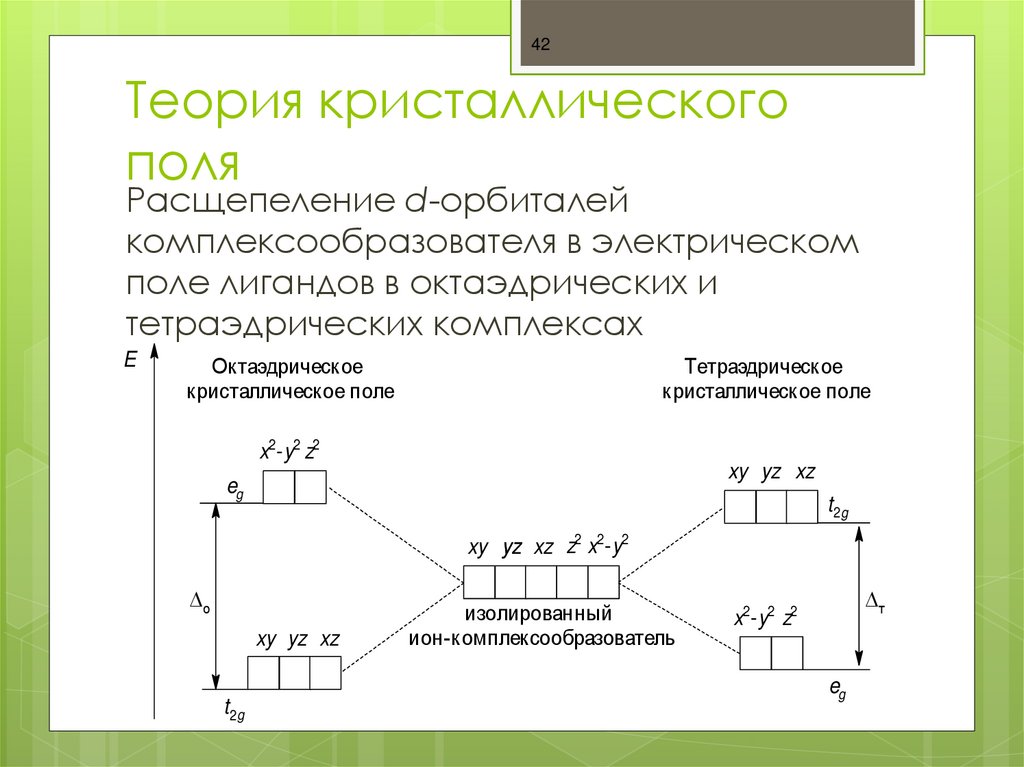
42. Теория кристаллического поля
42Теория кристаллического
поля
Расщепеление d-орбиталей
комплексообразователя в электрическом
поле лигандов в октаэдрических и
тетраэдрических комплексах
E
Октаэдрическое
кристаллическое поле
Тетраэдрическое
кристаллическое поле
x2-y2 z2
xy yz xz
eg
t2g
xy yz xz z2 x2-y2
о
xy yz xz
t2g
изолированный
ион-комплексообразователь
т
x2-y2 z2
eg
43. Теория кристаллического поля
43Теория кристаллического
поля
Энергия расщепления с увеличением степени
окисления комплексообразователя
увеличивается
Энергия расщепления при переходе от 3d- к 4d- и
5d-элементам увеличивается
При переходе от лигандов сильного поля к
лигандам слабого поля энергия расщепления
уменьшается
CO > CN– >> NH3 > H2O > F– > HO– > Cl– > Br– > I–
лиганды сильного поля
лиганды слабого поля
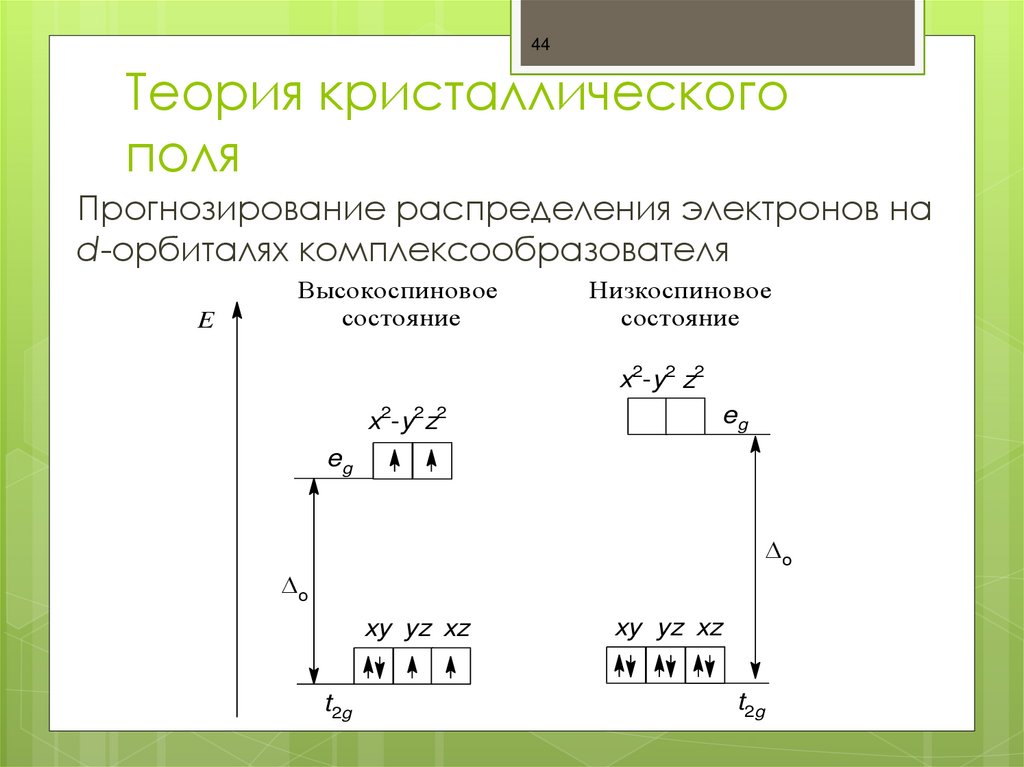
44. Теория кристаллического поля
44Теория кристаллического
поля
Прогнозирование распределения электронов на
d-орбиталях комплексообразователя
E
Высокоспиновое
состояние
Низкоспиновое
состояние
x2-y2 z2
x2-y2z2
eg
eg
о
о
xy yz xz
t2g
xy yz xz
t2g
45. Теория поля лигандов (метод МО)
Орбитали комплексообразователя,участвующие в образовании
комплекса:
s-Орбиталь внешнего электронного слоя
(1);
p-Орбитали внешнего электронного слоя
(3);
d-Орбитали предвнешнего или внешнего
электронного слоя (5)
Всего 9 орбиталей.
46. Теория поля лигандов (метод МО)
Орбитали лигандов, участвующие вобразовании комплекса:
Орбитали с неподелёнными парами
электронов (1, 2, 3 и т. д. в зависимости
от дентатности лиганда)
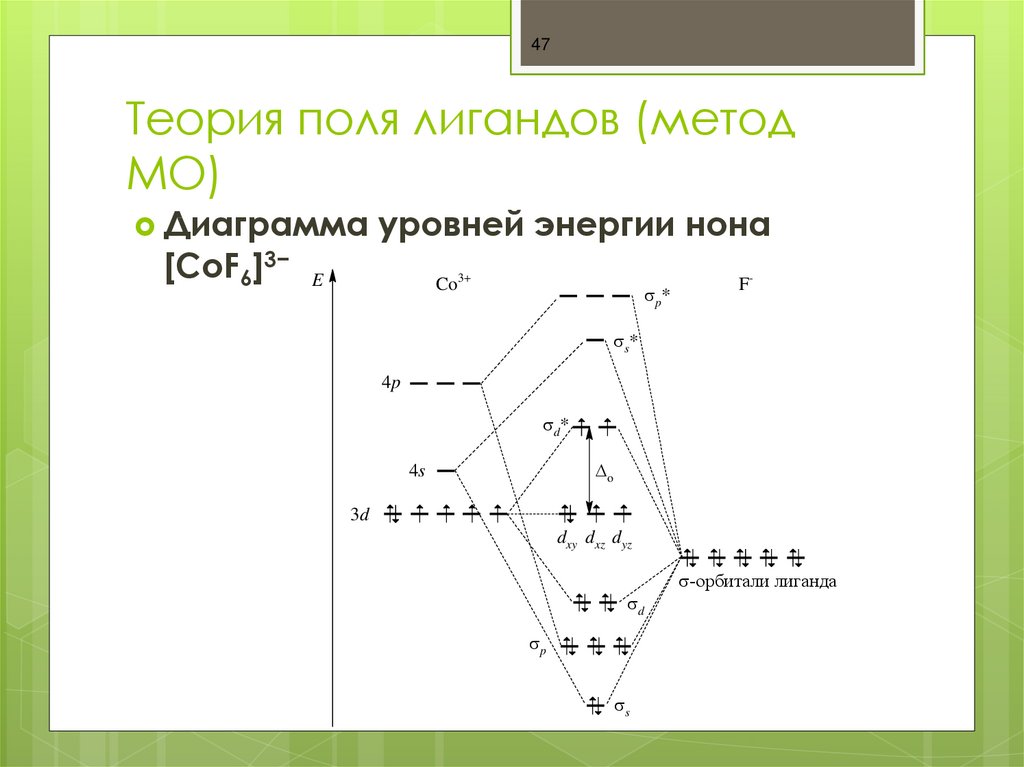
47. Теория поля лигандов (метод МО)
47Теория поля лигандов (метод
МО)
Диаграмма
[СоF6]3−
уровней энергии нона
E
Co3+
p*
F-
s*
4p
d*
o
4s
3d
dxy dxz dyz
-орбитали лиганда
d
p
s
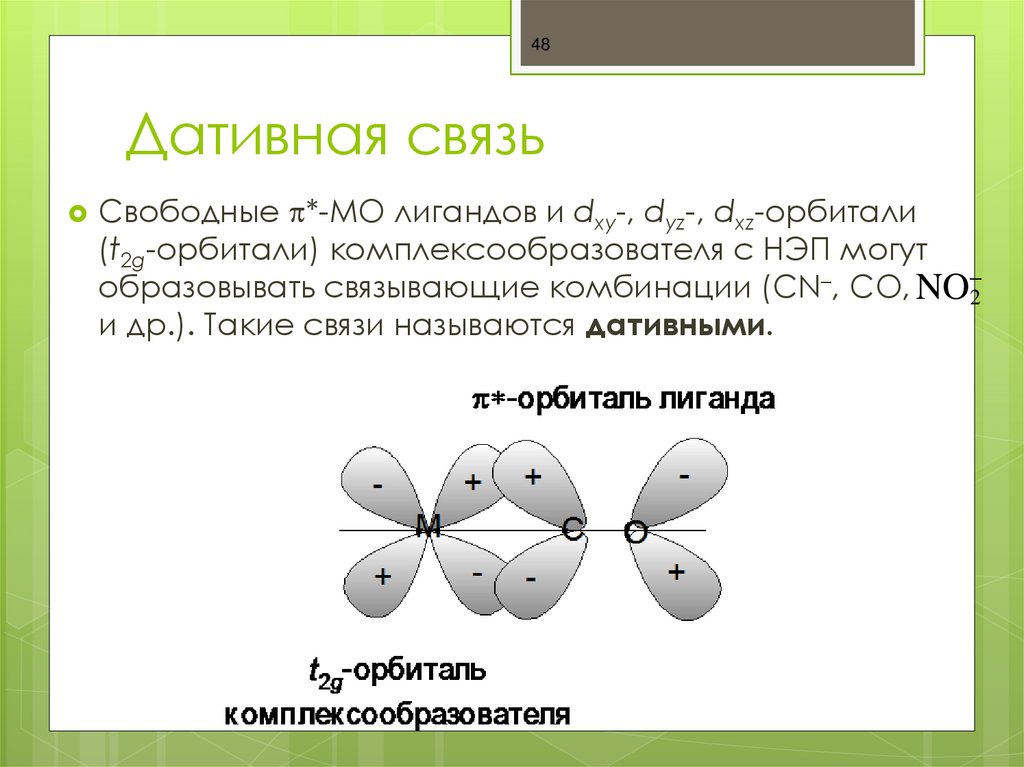
48. Дативная связь
48Дативная связь
Свободные *-МО лигандов и dxy-, dyz-, dxz-орбитали
(t2g-орбитали) комплексообразователя с НЭП могут
образовывать связывающие комбинации (CN–, CO, NO 2
и др.). Такие связи называются дативными.
49. Достоинства и недостатки МВС и ТКП
49Достоинства и недостатки МВС
и ТКП
МВС
хорошо
объясняет
пространственное
строение
комплексов
МВС
не
прогнозирует
электронные
спектры
поглощения,
магнитные и др.
свойства
комплексов
50. Достоинства и недостатки МВС и ТКП
50Достоинства и недостатки МВС
и ТКП
ТКП
объясняет (но
не прогнозирует)
электронные
спектры
поглощения,
магнитные и
некоторые др.
свойства
комплексов
ТКП, учитывая только
орбитали
комплексообразоват
еля, не прогнозирует
и не объясняет
образование
дативной связи, комплексов,
положение лиганда в
спектрохимическом
ряду
51. Изомерия координационных соединений
51Изомерия координационных
соединений
Изомеры
— соединения, молекулы
которых имеют одинаковый состав, но
разное строение. В связи с этим их
свойства различаются.
52. Виды изомерии
52Виды изомерии
Пространственная
Геометрическая;
Конфигурационная (оптическая)
Координационная
Ионизационная
Связевая
Гидратная
Трансформационная
53. Геометрическая изомерия
53Геометрическая изомерия
Диамминдихлоридоплатина(II)
Cl
Pt
Cl
NH3
Cl
Pt
NH3
цис-изомер желтого цвета,
c концентрированными
кислотами дает раствор
синего цвета
H3N
NH3
Cl
транс-изомер оранжевого
цвета,
с концентрированными
кислотами дает раствор
красного цвета
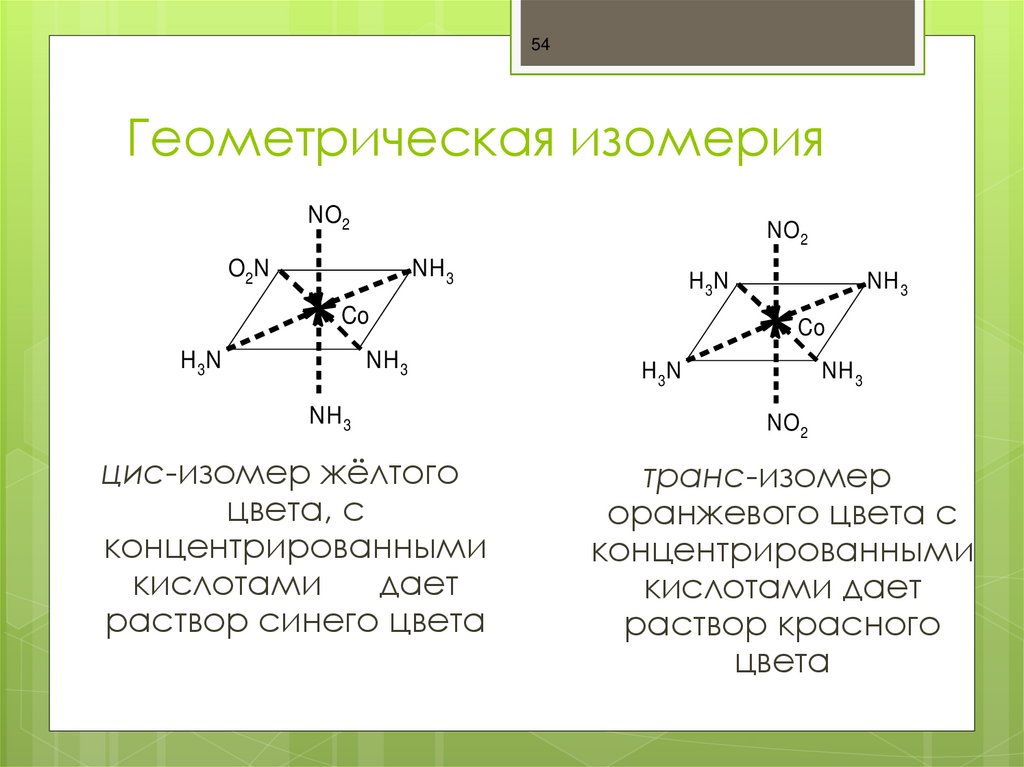
54. Геометрическая изомерия
54Геометрическая изомерия
NO2
NO2
O2 N
NH 3
H 3N
Co
H 3N
NH 3
NH 3
цис-изомер жёлтого
цвета, с
концентрированными
кислотами
дает
раствор синего цвета
NH 3
Co
H 3N
NH 3
NO2
транс-изомер
оранжевого цвета с
концентрированными
кислотами дает
раствор красного
цвета
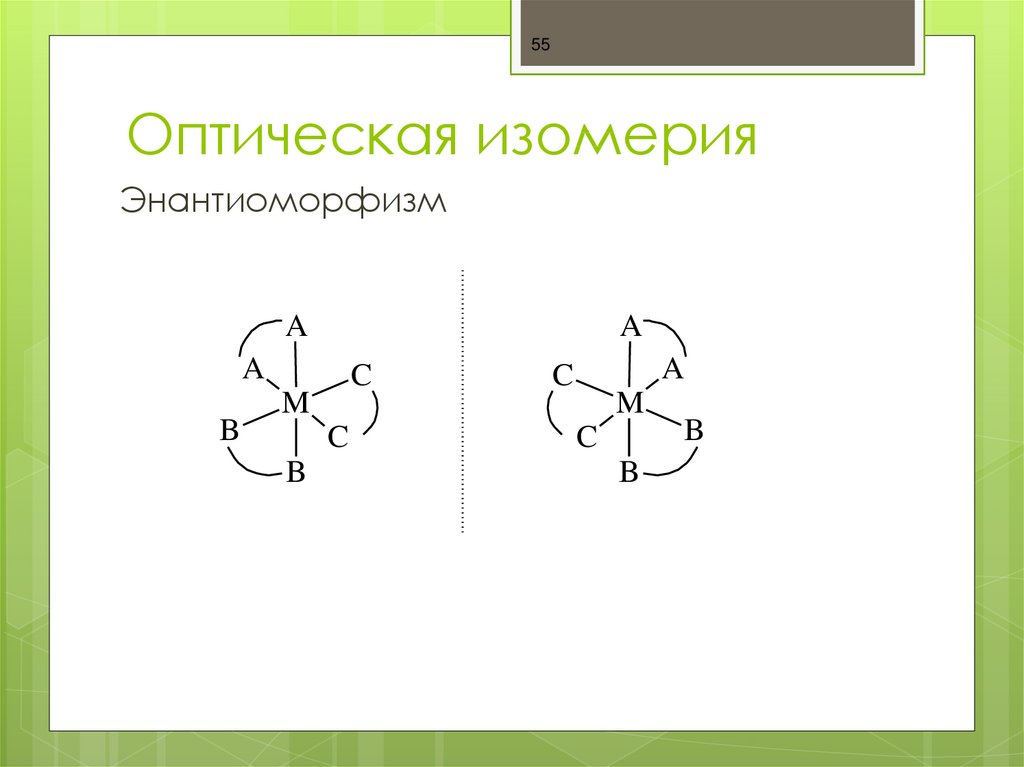
55. Оптическая изомерия
55Оптическая изомерия
Энантиоморфизм
A
A
A
B
C
M
C
B
A
C
M
C
B
B
56. Гидратная изомерия
[Cr(H2O)6]Cl3 - фиолетовый[Cr(H2O)5Cl]Cl2·Н2O - светлозелёный
[Cr(H2O)4Cl2]Сl·2H2O - тёмнозелёный
57. Координационная изомерия
[Pt(NH3)4][PdCl4] и [Pd(NH3)4][PtCl4]58. Ионизационная изомерия
[Pd(NH3)4Cl2]Br2 → [Pd(NH3)4Cl2]2+ + 2Br[Pd(NH3)4Br2]Cl2 → [Pd(NH3)4Br2]2+ + 2Cl-59. Связевая изомерия или изомерия связи
В случае амбидентатных лигандов (NO2-,NCS- и др.)
[Co(NH3)5NO2]Сl
и
[Co(NH3)5ONO]Cl
60. Трансформационная изомерия
(NH4)2[Pd(SCN)4][Pd(NH2C(S)NH2)2(SCN)2]
61. Получение КС
Комплексы анионного типа:Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
BiI3 + KI = K[BiI4]
PbCl2 + 2NaCl = Na2[PbCl4]
Ag2S2O3 + 3Na2S2O3 = 2Na3[Ag(S2O3)2]
Fe(SCN)3 + 6NaF = Na3[FeF6] + 3NaSCN
62. Получение КС
Комплексы катионного типа:(CuOH)2SO4 + 10NH3·H2O =
= 2[Cu(NH3)4](OH)2 + (NH4)2SO4 + 10H2O
AgCl + 2NH3·H2O = [Ag(NH3)2]Cl + 2H2O
Ag2O + 4NH3·H2O = 2[Ag(NH3)2]OH +
3H2O (реактив Толленса)
63. Получение КС
Соединения с комплексными анионом икатионом:
Ni2[Fe(CN)6] + 12NH3·H2O =
= [Ni(NH3)6]2[Fe(CN)6] + 12H2O
64. Получение КС
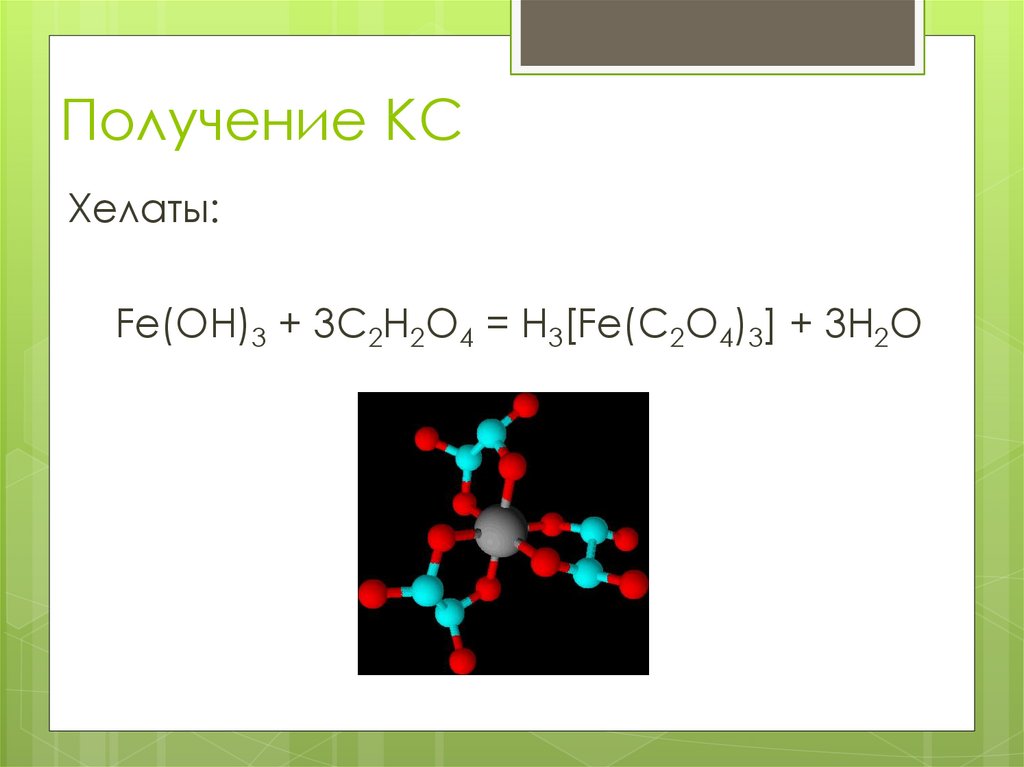
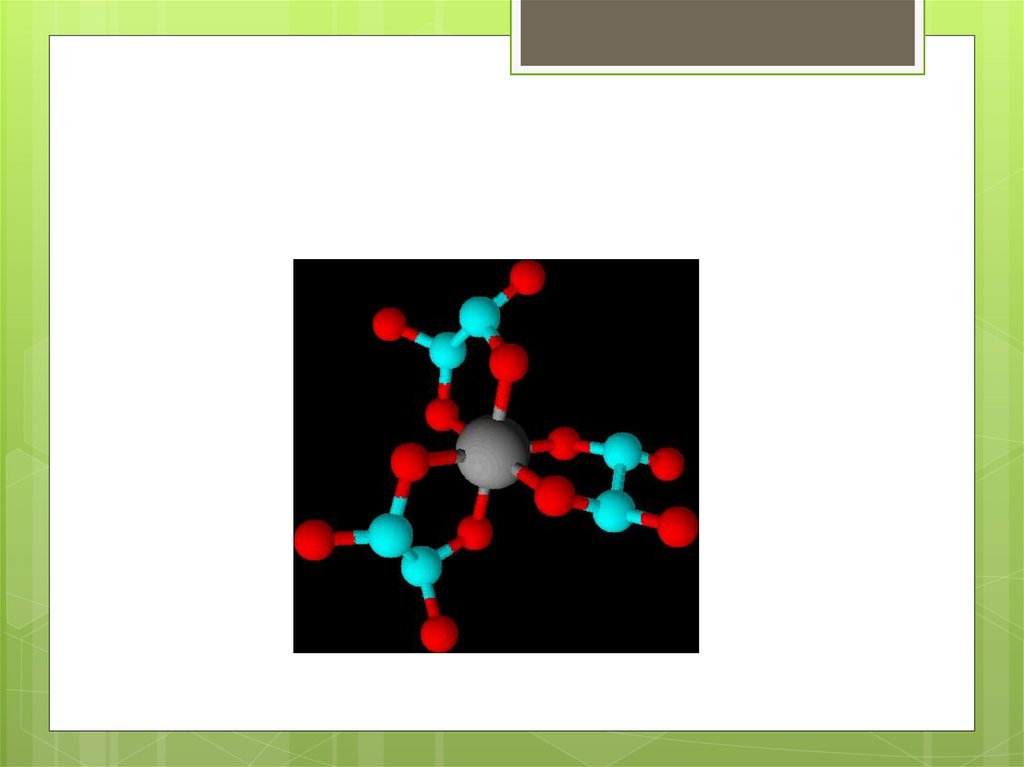
Хелаты:Fe(OH)3 + 3C2H2O4 = H3[Fe(C2O4)3] + 3H2O
65. Получение КС
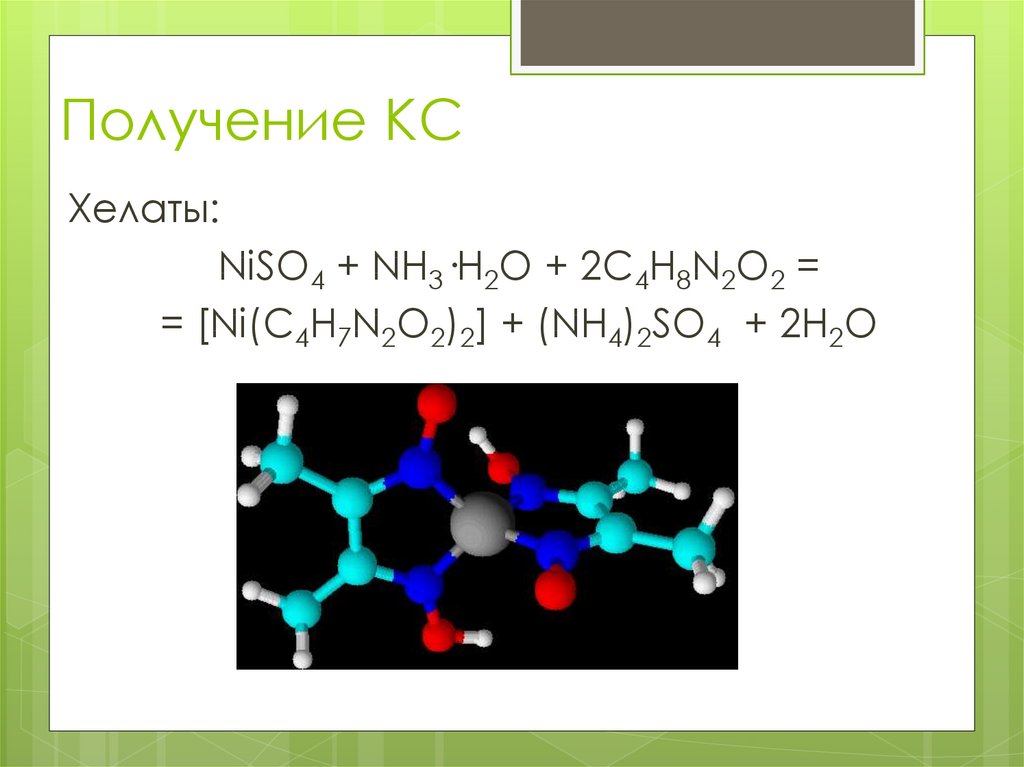
Хелаты:NiSO4 + NH3·H2O + 2C4H8N2O2 =
= [Ni(C4H7N2O2)2] + (NH4)2SO4 + 2H2O
66. Химические свойства КС
Реакцииобмена
Окислительно-восстановительные
реакции
67. Реакции обмена
Обмен ионов внешней сферыK4[Fe(CN)6] + 2NiCl2 = Ni2[Fe(CN)6]↓ + 4KCl
[Fe(CN)6]4- + 2Ni2+ = Ni2[Fe(CN)6]
AlK(SO4)2·12H2O – алюмокалиевые квасцы
[Al(H2O)6][K(H2O)6](SO4)2 + 2BaCl2 =
= [Al(H2O)6]Cl3 + KCl + 2BaSO4↓ + 6H2O
Fe(NH4)2(SO4)2·6H2O – соль Мора
[Fe(H2O)6](NH4)2(SO4)2 + 2BaCl2 = [Fe(H2O)6]Cl2 + NH4Cl
+ 2BaSO4↓
68. Реакции обмена
68Реакции обмена
Образование более устойчивых
комплексных ионов (связывание
комплексообразователя с новым
лигандом)
[Ag(NH3)2]Cl + 2Na2S2O3 =
= Na3[Ag(S2O3)2] + NaCl + 2NH3
[Ag(NH3)2]+ + 2S2O32- = [Ag(S2O3)2]3- + 2NH3
[Fe(H2O)6](NH4)2(SO4)2 + K3[Fe(CN)6] =
= FeK[Fe(CN)6]↓ + (NH4)2SO4 + K2SO4 + 6H2O
69. Реакции обмена
69Реакции обмена
При нагревании
[Co(H2O)6]Cl2 = [CoCl2(H2O)4] + 2H2O
розовый
синий
70. Реакции обмена
70Реакции обмена
Связывание комплексообразователя в
малорастворимое соединение
[Fe(H2O)6](NH4)2(SO4)2 + 2NaOH =
= Fe(OH)2↓ + (NH4)2SO4 + Na2SO4 + 6H2O
[Fe(H2O)6](NH4)2(SO4)2 + Na2S =
= FeS↓ + (NH4)2SO4 + Na2SO4 + 6H2O
71. Реакции обмена
71Реакции обмена
[Al(H2O)6][K(H2O)6](SO4)2 + 3KOH =
= Al(OH)3↓ + 2K2SO4 + 12H2O
[Cu(NH3)4](OH)2 + Na2S =
=CuS↓ + 2NaOH + 4NH3
72. Реакции обмена
72Реакции обмена
Связывание лигандов в более устойчивые
координационные соединения
[Ag(NH3)2]Cl + 2HNO3 = AgCl↓ +
2NH4NO3
[Ag(NH3)2]Cl + 2HCl = AgCl↓ + 2NH4Cl
73. Окислительно-восстановительные реакции
73Окислительновосстановительные реакции
5K4[Fe(CN)6] + KMnO4 + 4H2SO4 =
= 5K3[Fe(CN)6] + MnSO4 + 3K2SO4 + 4H2O
[Fe(CO)5] + 2HCl = FeCl2 + 5CO + H2
Реакция серебряного зеркала
(Толленса)
2[Ag(NH3)2]OH + CH2O + 2H2O =
= 2Ag↓ + HCOONH4 + 3NH3·H2O
74. Окислительно-восстановительные реакции
74Окислительновосстановительные реакции
2[Co(H2O)6]Cl2 + 6Mg =
= Co[CoCl4] + 6Mg(OH)2 + 6H2
При ультрафиолетовом облучении
6[Cu(NH3)4]Cl2 =
= 6[Cu(NH3)2]Cl + N2 + 6NH4Cl + 4NH3




























































 Химия
Химия








