Похожие презентации:
Газовые законы
1.
Работу выполнилстудент МГПТКЖТ
гр.№14
Мироевский Олег
2.
Идеальныйгаз
Исторические данные
Закон Бойля – Мариотта
Закон Шарля
Закон Гей – Люссака
Сводная таблица
3.
Газовые законы рассматриваютсядля идеального газа.
Модель идеального газа
предполагает следующее:
молекулы обладают пренебрежимо
малым объемом по сравнению с
объемом сосуда, между молекулами
не действуют силы притяжения,
при соударении молекул друг с
другом и со стенками сосуда
действуют силы отталкивания.
4.
Состояние идеального газахарактеризуется тремя
макроскопическими параметрами:
P – давление (Па)
T – температура (ºС)
V – объем (м²)
5.
Уравнение состояния идеальногогаза
р = nkT
n – концентрация –число молекул газа в единице объема.
k=1,38 10-23Дж/К
6.
Бенау Клайперон(1799-1864)
французский
физик получил
зависимость,
уравнение
устанавливающее
связь между:
P,T, V
7.
Дмитрий ИвановичМенделеев
(1834-1907)
русский ученый
впервые применил
соотношение
между:P,T, V
8.
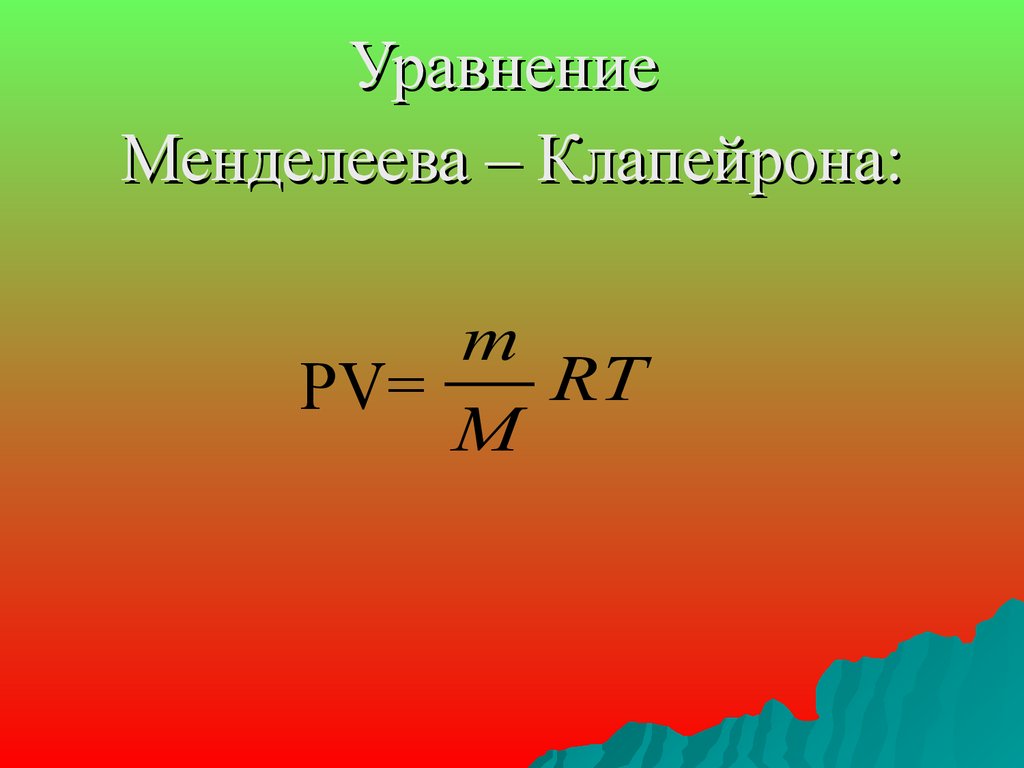
УравнениеМенделеева – Клапейрона:
m
RT
PV=
M
9.
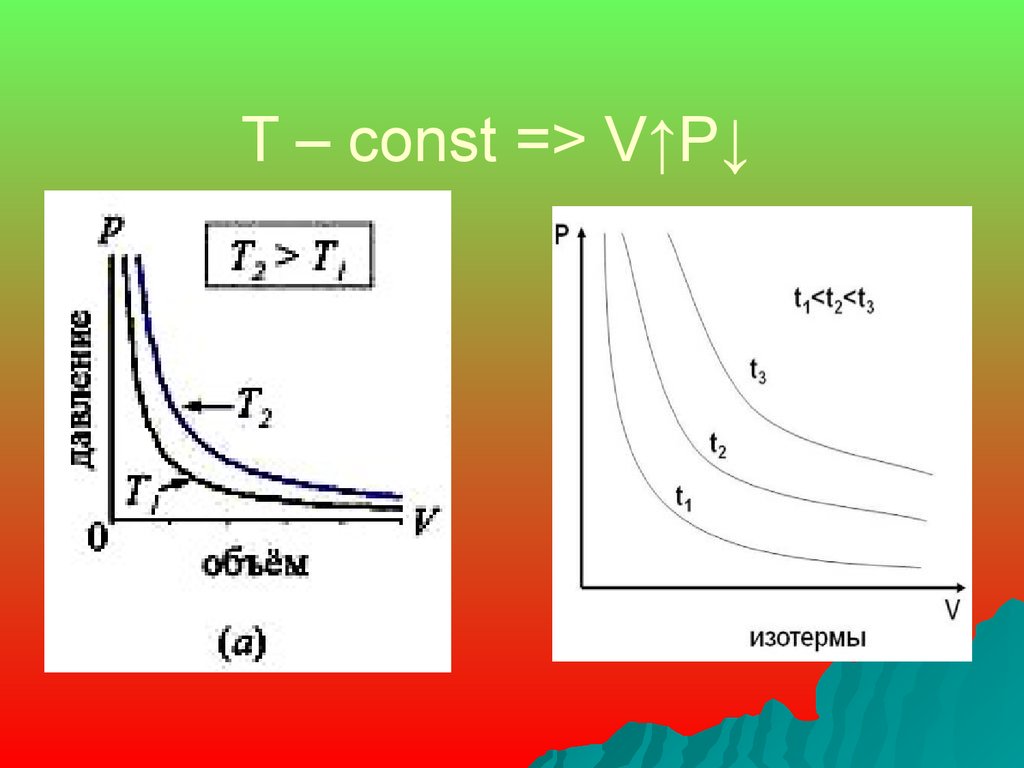
Закон Бойля – Мариотта:изотермический процесс- процесс
изменения состояния газа при
постоянной температуре (T-const)
m
RT
PV=
M
P1V1=P2V2
=>
10. T – const => V↑P↓
T – const => V↑P↓11.
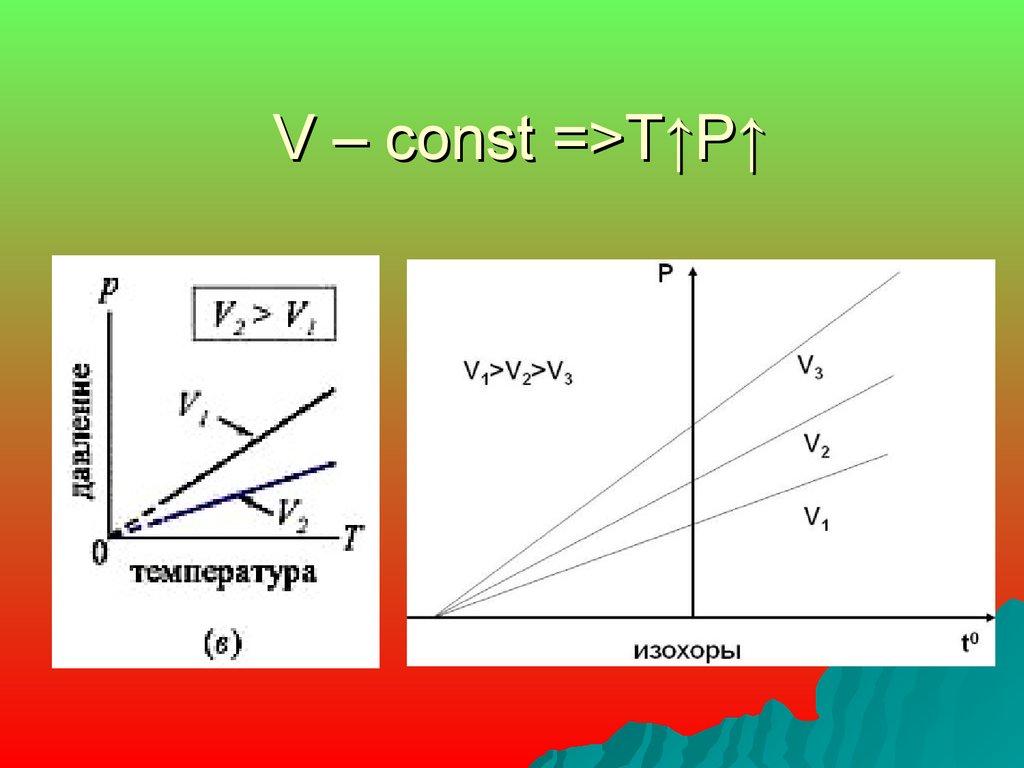
Закон Шарля: изохорный процесспроцесс изменения состояния газапри постоянном объеме (V-const)
P m
RV
T M
P P
T T
1
2
1
2
=>
12. V – const =>T↑P↑
V – const =>T↑P↑13.
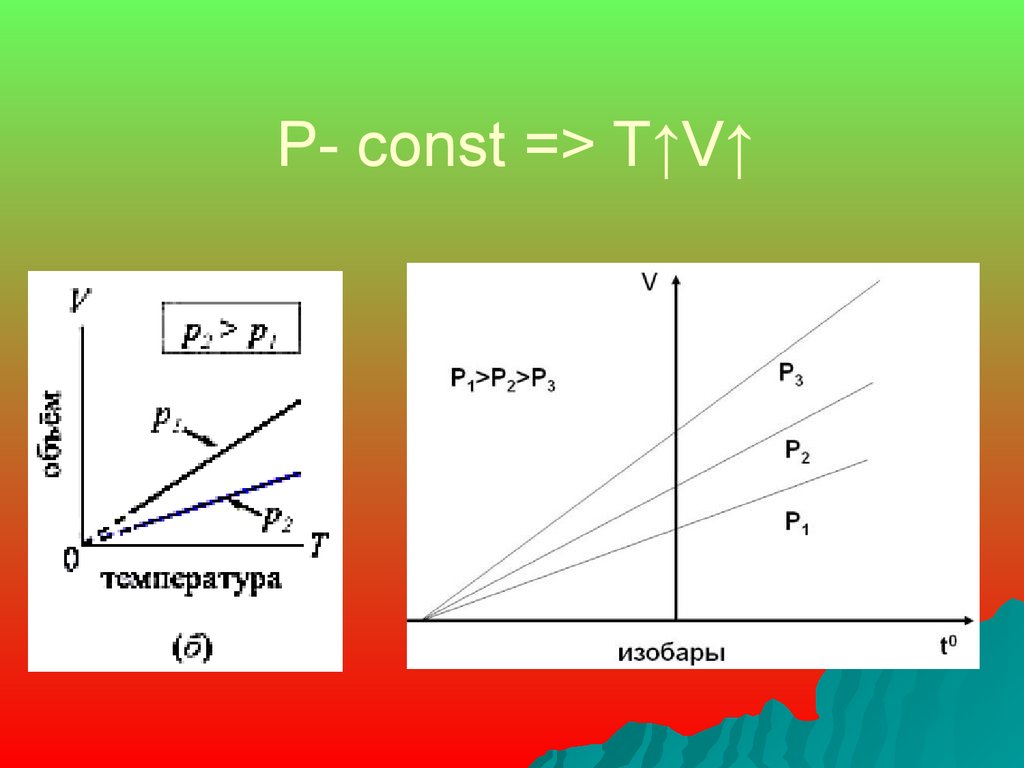
Закон Гей – Люссака: изобарныйпроцесс - процесс изменения
состояния газа при постоянном
давлении (P-const)
V
m
RP
T M
V V
T T
=>
1
2
1
2
14. P- const => T↑V↑
P- const => T↑V↑15.
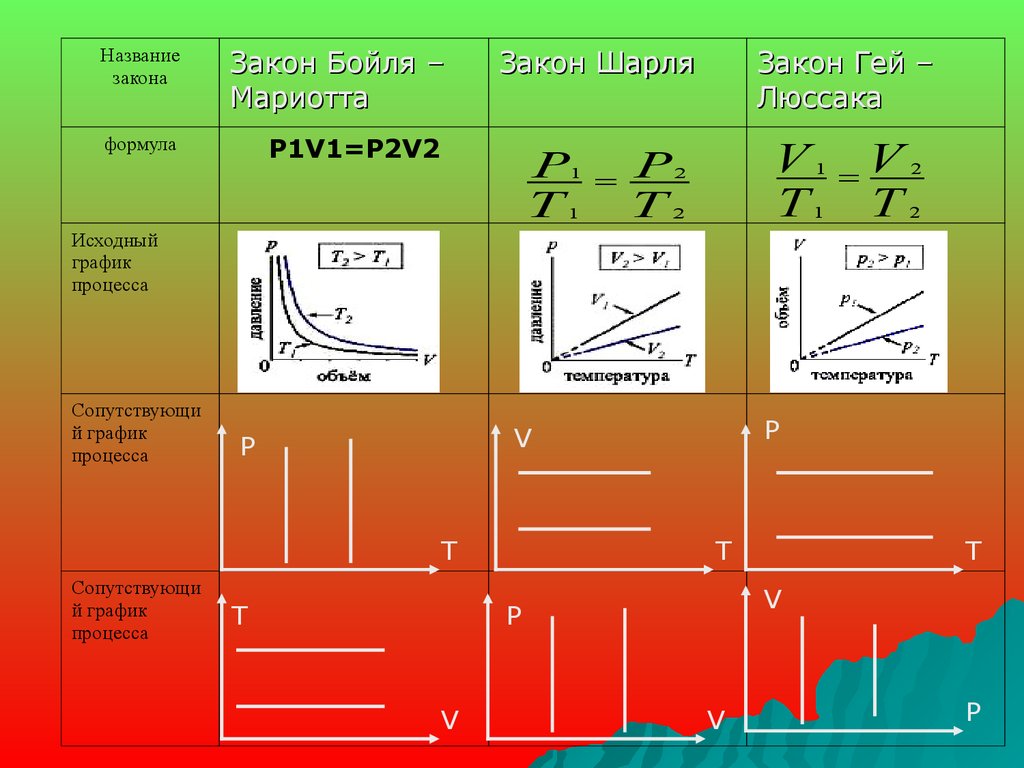
Названиезакона
Закон Бойля –
Мариотта
формула
P1V1=P2V2
Закон Шарля
P
T
1
1
P
T
Закон Гей –
Люссака
V
T
2
2
1
1
V
T
2
2
Исходный
график
процесса
Сопутствующи
й график
процесса
T
Сопутствующи
й график
процесса
P
V
P
T
T
V
P
V
T
V
P











 Физика
Физика








