Похожие презентации:
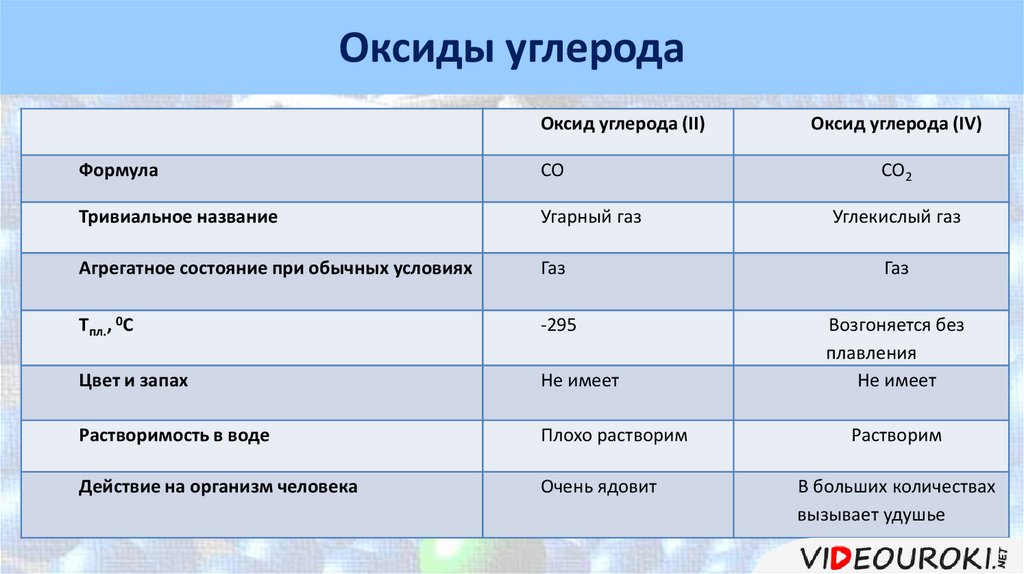
Углерод. Оксиды углерода
1.
Углерод.Оксиды углерода
2.
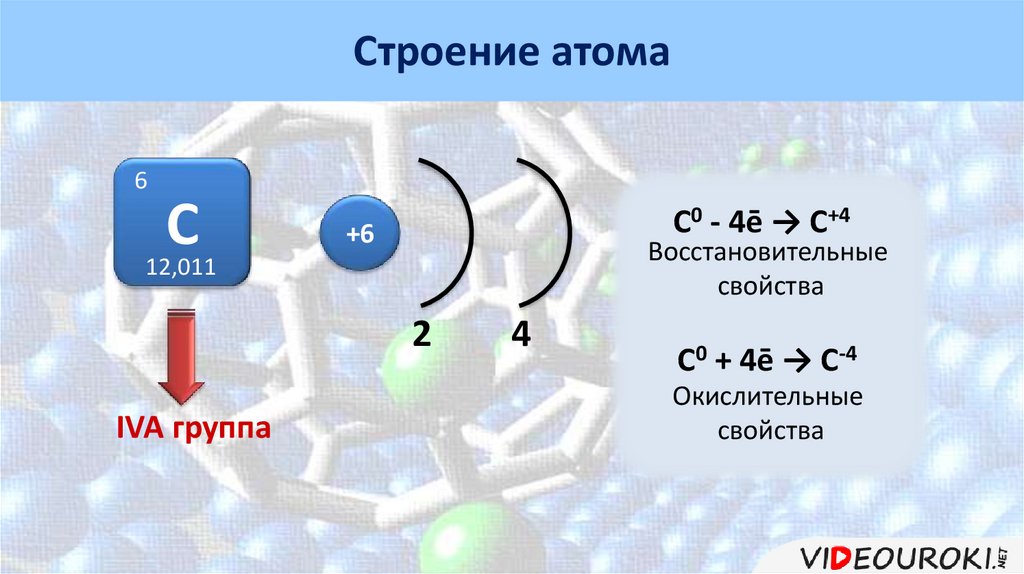
Строение атома6
C
12,011
C0 - 4ē → C+4
+6
Восстановительные
свойства
2
IVA группа
4
C0 + 4ē → C-4
Окислительные
свойства
3.
Аллотропные модификации углеродаАлмаз – прозрачное кристаллическое вещество.
Одно из самых твёрдых веществ в природе.
У алмаза атомная кристаллическая
решётка.
Алмаз имеет высокую светопреломляющую и
светоотражающую способности.
4.
Слово «алмаз» происходит отарабского алмас, что означает
«твердейший», или от греческого
слова адамас – «несокрушимый,
непреодолимый».
5.
1 карат соответствует 0,2 гОгранённые прозрачные алмазы
называют бриллиантами.
6.
Короны царейОрден Святого Андрея
Первозванного
7.
Алмаз«Куллинан»
Алмаз
«Шах»
8.
Применение алмазовАлмазы применяют как украшения.
Алмазы применяют для изготовления буров, свёрл и шлифовальных
инструментов.
Крупнейшие месторождения алмазов находятся в Южной Африке, в России
алмазы добывают в Якутии.
9.
Аллотропные модификации углеродаГрафит — тёмно-серое, жирное на ощупь кристаллическое вещество с
металлическим блеском.
Графит мягкий и непрозрачный, хорошо проводит теплоту и электрический
ток.
Атомы углерода в кристаллической решётке лежат в одной плоскости,
образуя правильные шестиугольники.
Графит тугоплавок.
Слоистая структура
10.
Применение графита1
3
1. электроды
2. твёрдые смазки
3. замедлители нейтронов
в ядерных реакторах
2
4
4. стержни для
карандашей
11.
12.
Сажа и древесный угольДревесный уголь получают при сухой перегонке
древесины.
Древесный уголь обладает адсорбцией.
Из древесного угля получают активированный
уголь.
Активированный уголь используют для
изготовления бытовых фильтров, противогазов.
Адсорбция углём
13.
Очистки спирта от сивушных масел.Очистки сахарного сиропа от
окрашенных веществ.
Улавливание бензина из природных
газов.
Н.Д. Зелинский
14.
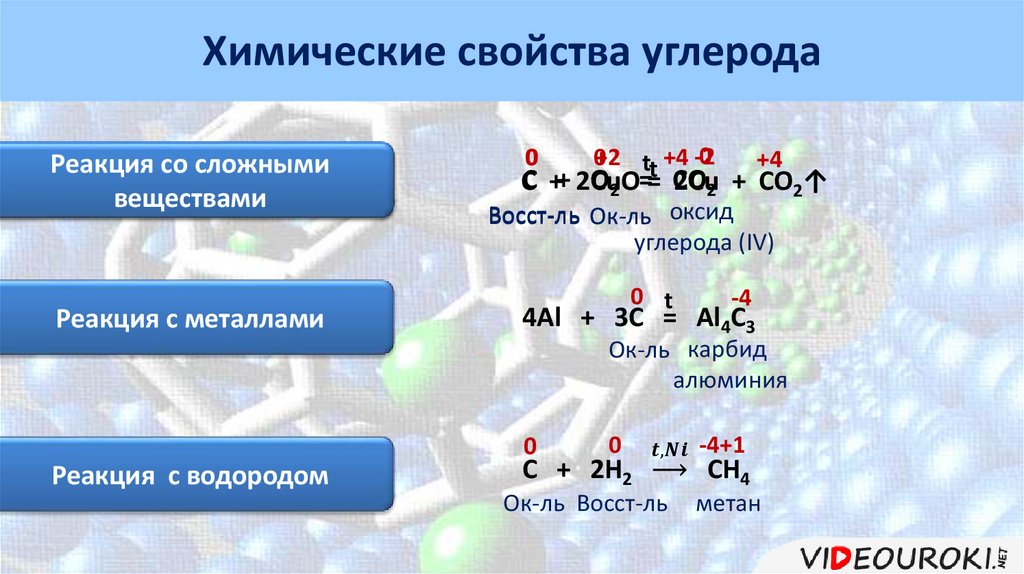
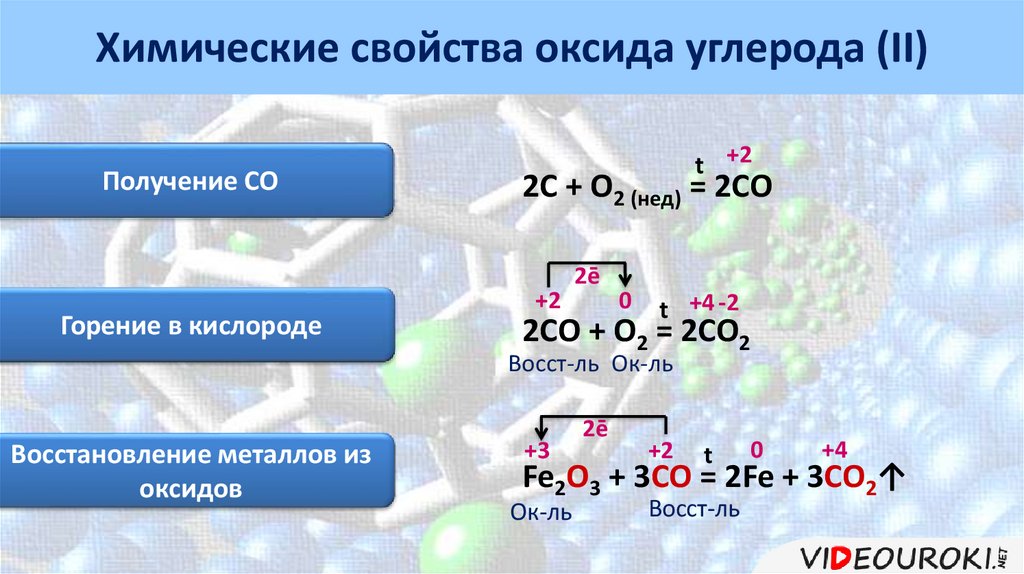
Химические свойства углеродаРеакция с кислородом
t
С + О2 = СО2
оксид
углерода (IV)
15.
Химические свойства углеродаРеакция со сложными
Реакция с кислородом
веществами
Реакция с металлами
0
0+2 tt +4 -2
+4
О2 == СО
CС ++ 2CuO
2Cu2 + CO2↑
Восст-ль Ок-ль оксид
углерода (IV)
0
0 t
-4
4Al + 3C = Al4C3
Ок-ль карбид
алюминия
0
Реакция с водородом
0
C + 2H2






















 Химия
Химия