Похожие презентации:
Особенности размещения электронов по орбиталям в атомах малых и больших периодов
1. Особенности размещения электронов по орбиталям в атомах малых и больших периодов.
2. Электроны, находящиеся на одном энергетическом уровне также могут отличаться друг от друга.
Электронное облако — этообласть наиболее вероятного
местонахождения электрона в
пространстве
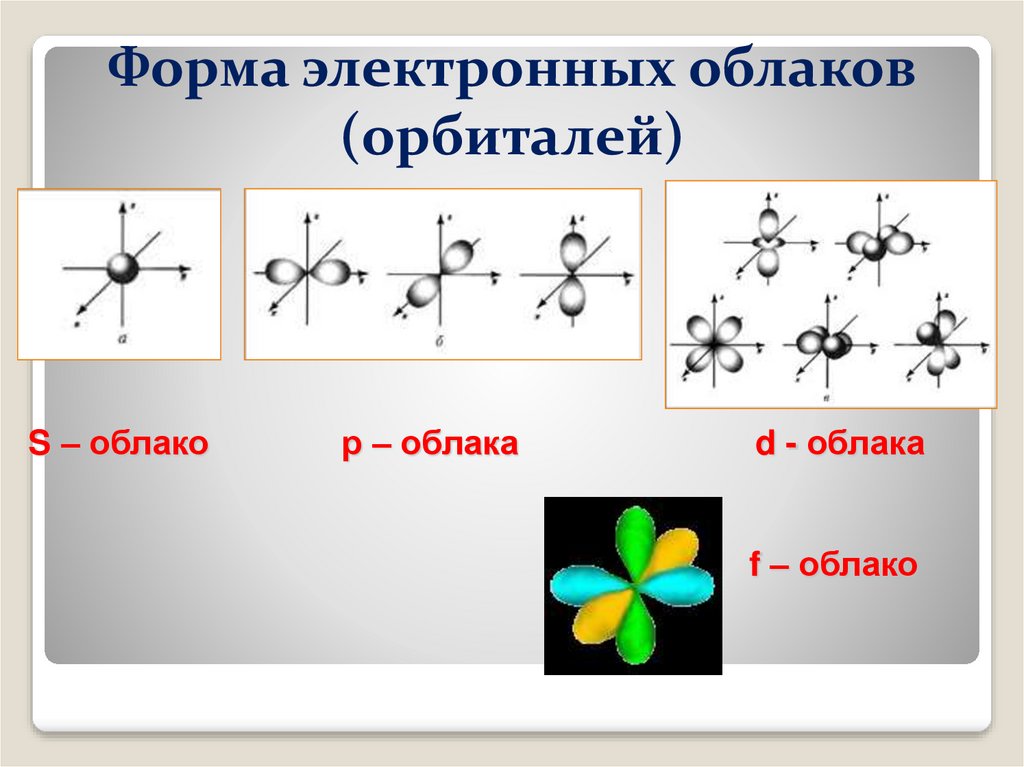
В зависимости от формы электронных обаков
различают s, р, d и f орбитали
3. Форма электронных облаков (орбиталей)
S – облакор – облака
d - облака
f – облако
4.
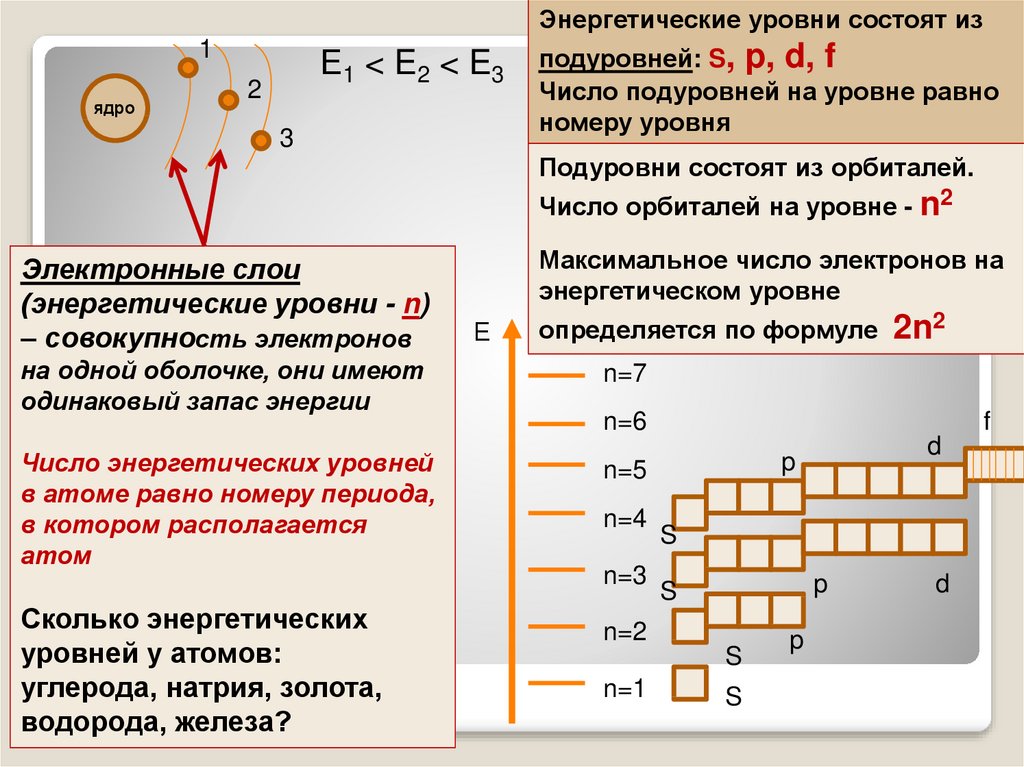
Энергетические уровни состоят из1
ядро
Е1 < E2 < E3
2
3
подуровней: S, p, d, f
Число подуровней на уровне равно
номеру уровня
Подуровни состоят из орбиталей.
Число орбиталей на уровне - n2
Электронные слои
(энергетические уровни - n)
– совокупность электронов
на одной оболочке, они имеют
одинаковый запас энергии
Число энергетических уровней
в атоме равно номеру периода,
в котором располагается
атом
Сколько энергетических
уровней у атомов:
углерода, натрия, золота,
водорода, железа?
Максимальное число электронов на
энергетическом уровне
Е
определяется по формуле
2n2
n=7
n=6
f
n=5
n=4
n=3
S
p
S
n=2
S
n=1
d
p
S
p
d
5.
Рассчитаем максимальное числоэлектронов для каждого
энергетического уровня по
формуле 2п2
Пример: n=1 (1 энергетический
уровень) 2• 12 = 2(максимальное
число электронов)
на 1-ом энергетическом уровне,
один подуровень (S), 2 электрона
если n=2 (2 энергетический
уровень)
2 • 22 = 8 электронов
n = 2; 2 подуровня (S, р), 8
электронов
6. Запомните!
Электроны,расположенные на
последнем энергетическом
уровне, называются внешними.
Число внешних электронов для
химических элементов главных
подгрупп равно номеру группы,
в которой находится элемент –
это его высшая валентность.




 Физика
Физика








