Похожие презентации:
Окислительно-восстановительные реакции (ОВР)
1. Окислительно-восстановительные реакции (ОВР)
Окислительновосстановительные реакции(ОВР)
2. План
1. Понятия окисление, восстановление,окислитель, восстановитель
2. Метод электронного баланса
3. Важнейшие окислители и восстановители
4. Взаимодействие кислот с металлами
5. Влияние среды на ОВР
3.
4. Метод электронного баланса
1.2.
3.
4.
5.
6.
7.
8.
Составляем схему уравнения
Указываем изменение степеней окисления элементов
Составляем электронные уравнения, указываем окислитель,
восстановитель, процессы окисления и восстановления
Находим коэффициенты при окислителе и восстановителе
(число отданных электронов должно быть равно числу
принятых)
Коэффициенты переносим в уравнение реакции
Находим коэффициенты при остальных элементах
(кроме Н и О)
Уравниваем реакцию по водороду (Н)
Проверяем правильность по кислороду (О)
5. Пример электронного баланса
5К2+1S-2 +2K+1Mn+7O4-2 +8H2+1S+6O4-2 = 5S0 + 2Mn+2S+6O4-2+ 6K2+1S+6O4-2 + 8H2+1O-2
5|10 |S-2
- 2ē S0
| окисление, восстановитель
2| 10|Mn+7 +5ē Mn+2| восстановление, окислитель
2 4+ 8 4=40 левая часть
2 4 +6 4+ 8=40 правая часть
6. Важнейшие окислители и восстановители
ОкислителиПростые вещества – типичные
неметаллы (Hal2, О2)
Восстановители
Простые вещества:
типичные (активные) металлы
некоторые неметаллы (Н2, С)
Кислородсодержащие кислоты и их Бескислородные кислоты (НСl, HBr,
соли (KMnO4, H2SO4 конц, HNO3,
HI)
K2Cr2O7)
Катион водорода в растворах кислот Гидриды щелочных и
(H+)
щелочноземельных металлов (Н-)
Металлы в высшей степени
окисления
Неметаллы в низшей степени
окисления
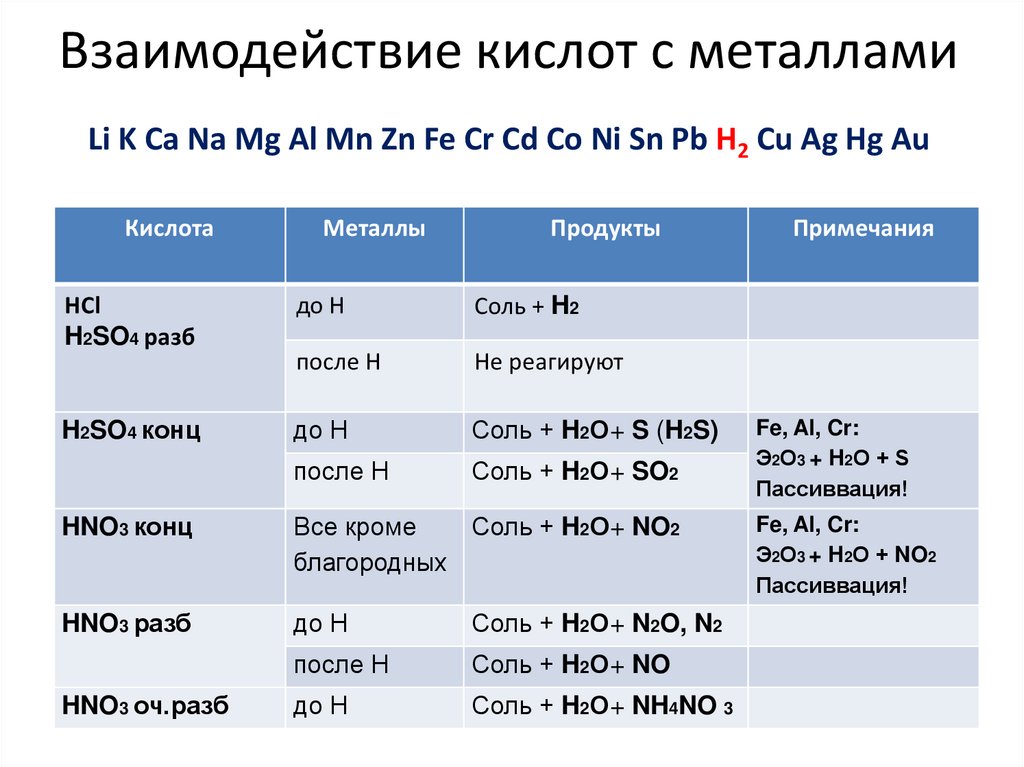
7. Взаимодействие кислот с металлами Li K Ca Na Mg Al Mn Zn Fe Cr Cd Co Ni Sn Pb H2 Cu Ag Hg Au
КислотаМеталлы
Продукты
HCl
H2SO4 разб
до Н
Соль + H2
после Н
Не реагируют
H2SO4 конц
до Н
Соль + H2О+ S (H2S)
после Н
Соль + H2О+ SO2
HNO3 конц
Все кроме
Соль + H2О+ NO2
благородных
HNO3 разб
до Н
Соль + H2О+ N2O, N2
после Н
Соль + H2О+ NO
до Н
Соль + H2О+ NH4NO 3
HNO3 оч.разб
Примечания
Fe, Al, Cr:
Э2О3 + H2О + S
Пассиввация!
Fe, Al, Cr:
Э2О3 + H2О + NO2
Пассиввация!
8. Задание: 1. приведите продукты реакций; 2. уравняйте реакции методом электронного баланса; 3. укажите окислитель и
восстановитель.Zn+ H2SO4 (разб) →
Cu+ H2SO4 (разб) →
Zn+ H2SO4 (конц) →
Cu+ H2SO4 (конц) →
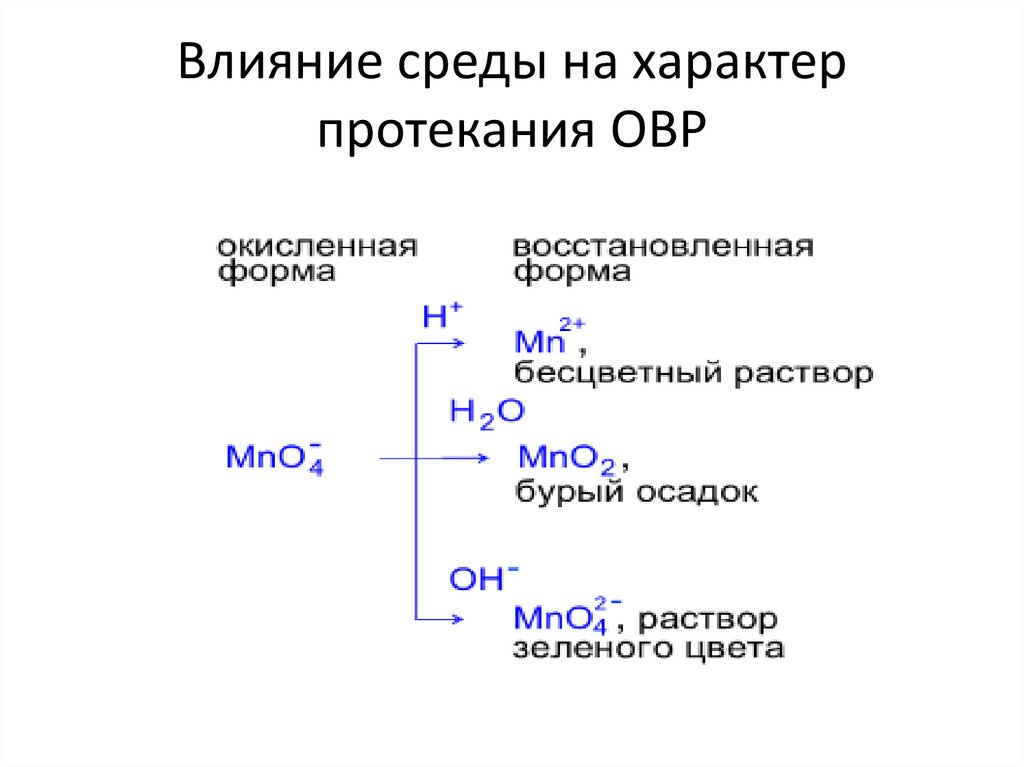
9. Влияние среды на характер протекания ОВР
10. Задание: 1. приведите схему реакций; 2. уравняйте реакции методом электронного баланса; 3. укажите окислитель и восстановитель.
K2SO3 + KMnO4 + ….. → K2SO4 + MnSO4 + H2OK2SO3 + KMnO4 + H2O→ K2SO4 +….. + KOH
K2SO3 + KMnO4 + ….. → K2SO4 +K2MnO4 + H2O
11. Гальванический элемент (химический источник тока)
12. План
1.2.
3.
4.
Понятие электродный потенциал
Уравнение Нернста
Гальванический элемент Якоби-Даниэля
Расчет ЭДС гальванического элемента
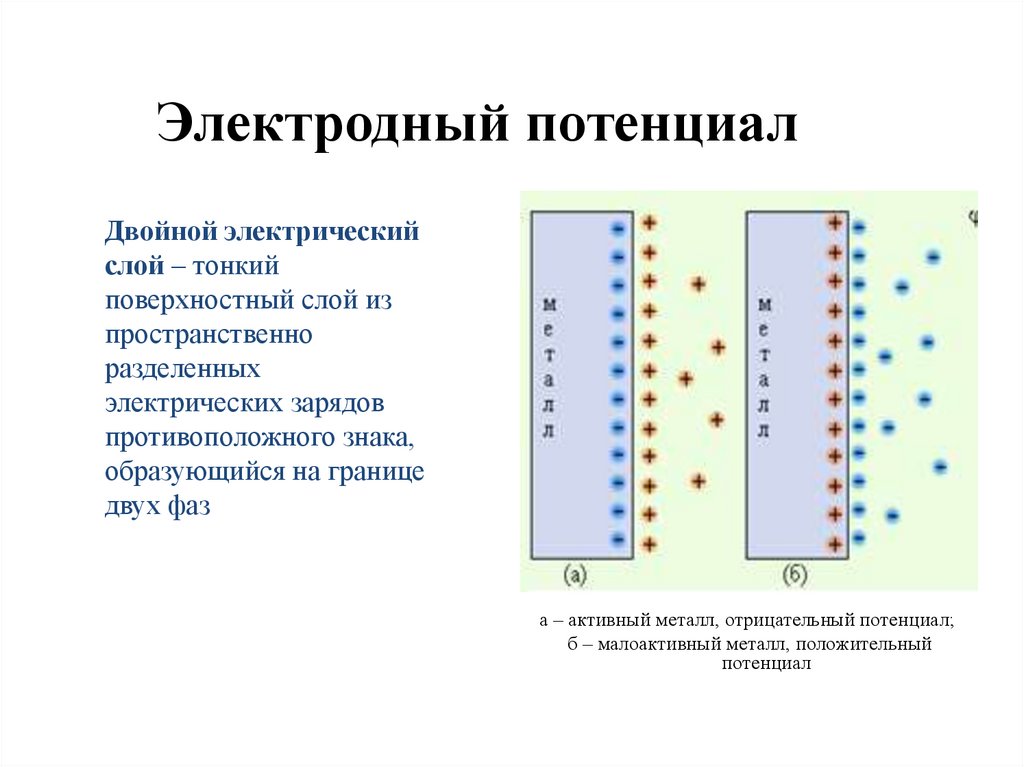
13. Электродный потенциал
Двойной электрическийслой – тонкий
поверхностный слой из
пространственно
разделенных
электрических зарядов
противоположного знака,
образующийся на границе
двух фаз
а – активный металл, отрицательный потенциал;
б – малоактивный металл, положительный
потенциал
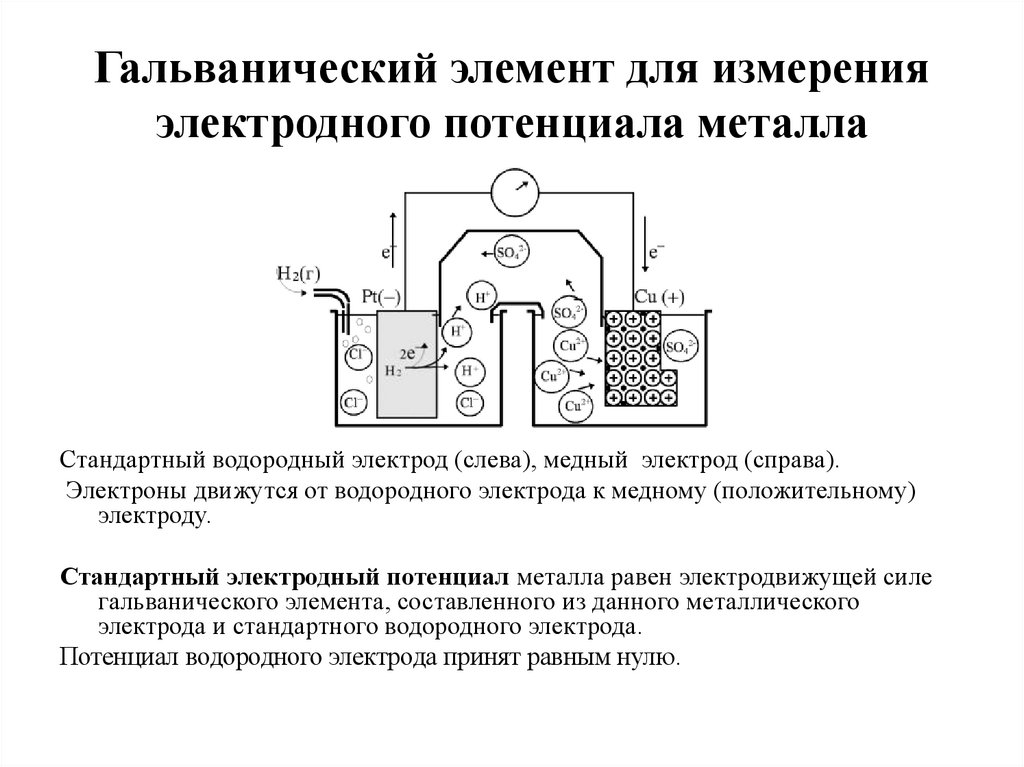
14. Гальванический элемент для измерения электродного потенциала металла
Стандартный водородный электрод (слева), медный электрод (справа).Электроны движутся от водородного электрода к медному (положительному)
электроду.
Стандартный электродный потенциал металла равен электродвижущей силе
гальванического элемента, составленного из данного металлического
электрода и стандартного водородного электрода.
Потенциал водородного электрода принят равным нулю.
15. Уравнение Нернста
φ = φº + (RT/nF) ∙ ln[Mn+]
φ – электродный потенциал металла, В
φº - стандартный электродный потенциал металла, В
R – универсальная газовая постоянная, 8,314 Дж/моль·К
T – абсолютная температура, К
n – заряд иона металла
F – постоянная Фарадея
[Mn+ ] – концентрация ионов металла в растворе, моль/л.
Для стандартной температуры (25ºС):
φ = φº + (0,059/n) ∙ lg[Mn+]
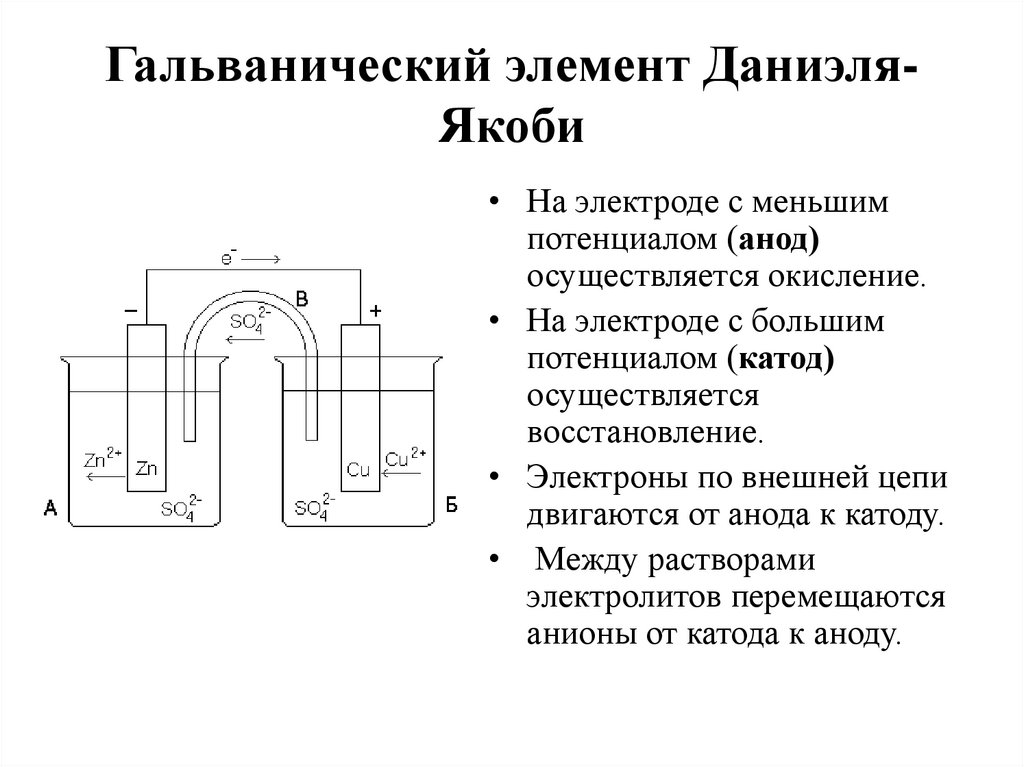
16. Гальванический элемент Даниэля-Якоби
Гальванический элемент ДаниэляЯкоби• На электроде с меньшим
потенциалом (анод)
осуществляется окисление.
• На электроде с большим
потенциалом (катод)
осуществляется
восстановление.
• Электроны по внешней цепи
двигаются от анода к катоду.
• Между растворами
электролитов перемещаются
анионы от катода к аноду.
17.
Процесс возможен, если G<0, тогдаG = -А
G = -n F E
A – полезная работа
n – число электронов , участников ОВР
F =96500 Кл/моль число Фарадея
E – ЭДС
E = φкатода – φанода
Т.к. G<0,то А>0 и, следовательно, φкатода >φанода
Потенциала электродов рассчитывают по уравнению Нернста.
18.
Пример: Химический источник тока (ХИТ) собран по схеме:Рb| Pb(NO3)2||Sn(NO3)2 |Sn
Чему равна ЭДС этого источника, если [РЬ2+ ] = 0,1 моль/л,
a [Sn2+] = 1 моль/л?
Решение: Во всех электрохимических явлениях из всех возможных
процессов
на аноде протекает процесс с меньшим потенциалом,
|
а на катоде - с большим потенциалом.
Напишем уравнения возможных анодных процессов:
Рb - 2 ē = РЬ2+
Sn - 2 ē = Sn2+.
По уравнению Нернста рассчитываем электродные потенциалы:
φ=φо + 0,059nlg[Mn+]
где φ - электродный потенциал, B;
19.
φo - стандартный электродный потенциал (значениястандартных потенциалов некоторых электродов приводятся в
приложении 5), В;
n - заряд иона:
[Mn+ ] - концентрация ионов металла, моль/л.
0,059
φPb= -0,13 +
lg 0,1 = −0,16 B
2
0,059















 Химия
Химия








