Похожие презентации:
Organic chemistry. ساختار و خواص
1.
فصل اولساختار و خواص
2.
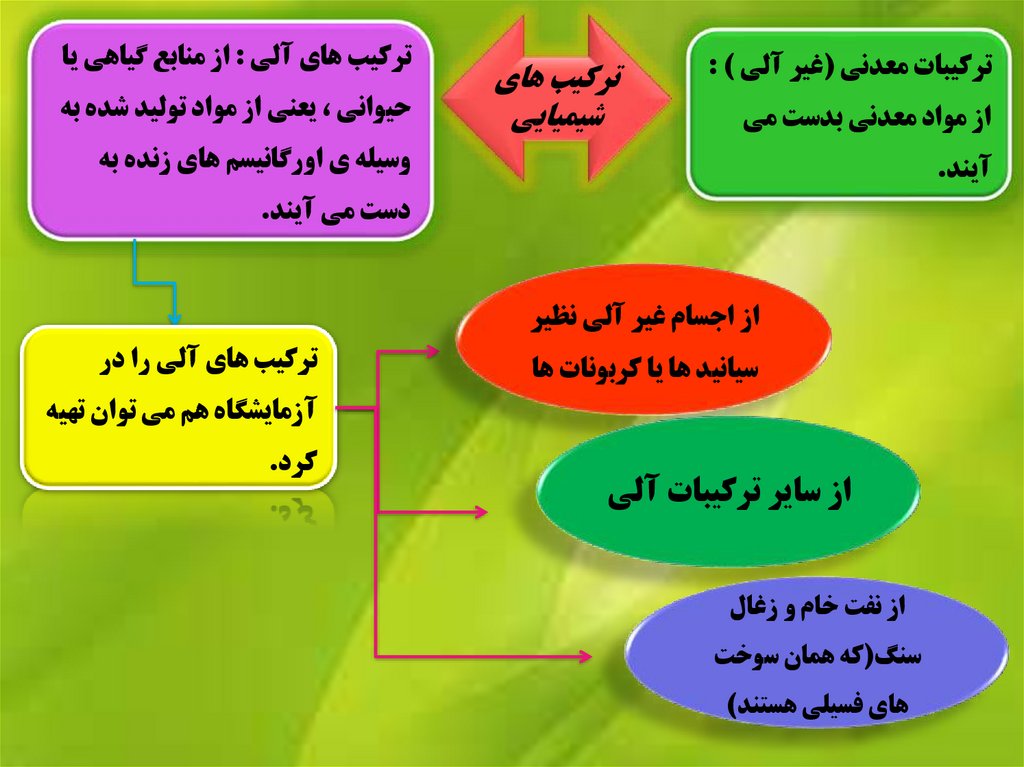
ترکيبات معدني (غير آلي ) :از مواد معدني بدست مي
ترکيب هاي
شيميايي
ترکيب هاي آلي :از منابع گياهي يا
حيواني ،يعني از مواد توليد شده به
وسيله ي اورگانيسم هاي زنده به
آيند.
دست مي آيند.
از اجسام غير آلي نظير
سيانيد ها يا کربونات ها
ترکيب هاي آلي را در
آزمايشگاه هم مي توان تهيه
از ساير ترکيبات آلي
از نفت خام و زغال
سنگ(که همان سوخت
هاي فسيلي هستند)
کرد.
3.
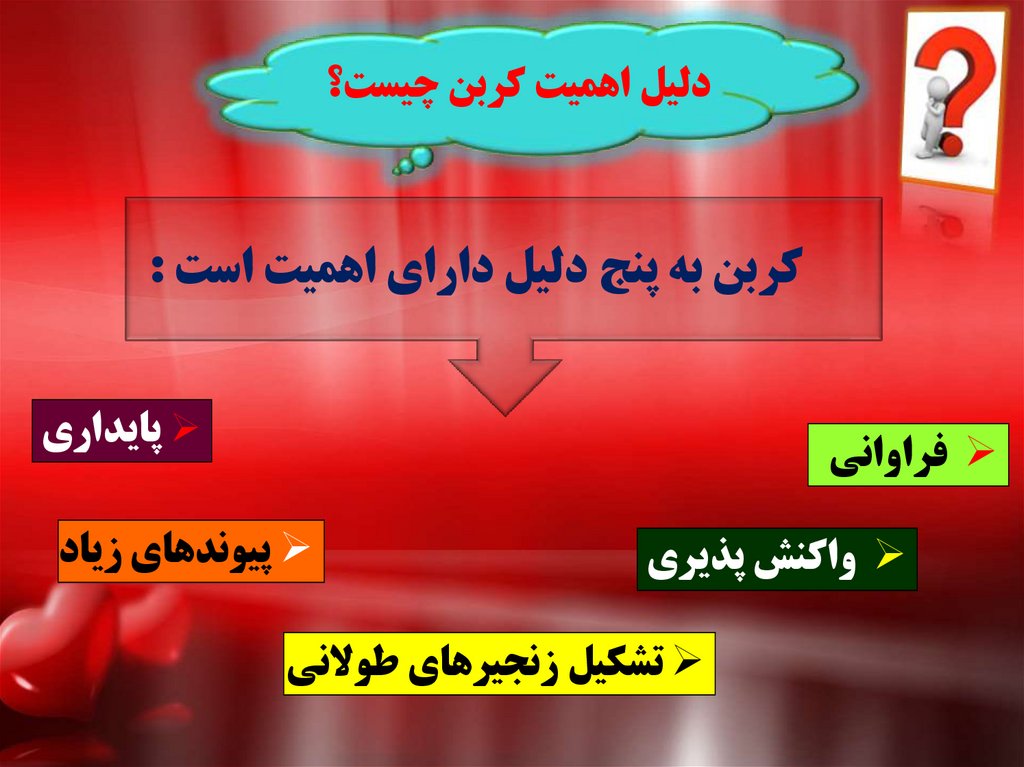
دليل اهميت کربن چيست؟کربن به پنج دليل داراي اهميت است :
پايداري
فراواني
واکنش پذيري
پيوندهاي زياد
تشکيل زنجيرهاي طوالني
4.
نظريه ي ساختاري: چگونه اتم ها گرد هم جمع مي شوند و مولکول ها را مي سازند.
درباره ي چگونگي ترتيب اتصال اتم ها به يکديگر ،والکترون هايي که اتم ها را به يکديگر
متصل نگه مي دارند بحث مي کند.
درباره ي شکل و اندازه ي مولکول هايي که از اين اتم ها تشکيل مي شوند و
چگونگي توزيع الکترون ها بر روي آنها بحث مي کند.
5.
يک مولکول را اغلب با يک تصوير يا يک الگو و گاهي با چندين تصوير و چندين الگونمايش مي دهند .هسته هاي اتمي را با حروف يا گلوله هاي پالستيکي و الکترون هاي
پيوند دهنده آنها را با خطوط يا نقطه يا رابط هاي پالستيکي نمايش مي دهند.
بررسي ساختار مولکول ها بايد با تکيه بر پيوند هاي شيميايي آغاز شود.
پيوند چيست؟
چرا دو اتم تشکيل پيوند مي دهند؟
برآيند نيروهاي جاذبه و دافعه بين دو اتم.
براي ايجاد پايداري.
در سال 1916دو نوع پيوند شيميايي توصيف شد :پيوند کواالنسي
و پيوند يوني.
پيوند کواالنسي و يوني هر دو از تمايل اتم ها براي رسيدن به آرايش
الکتروني پايدار ناشي مي شود.
6.
+Li +e
Li 2
Li
Li 2 1 e
_
F
F +e
2 8
F
27 e
F
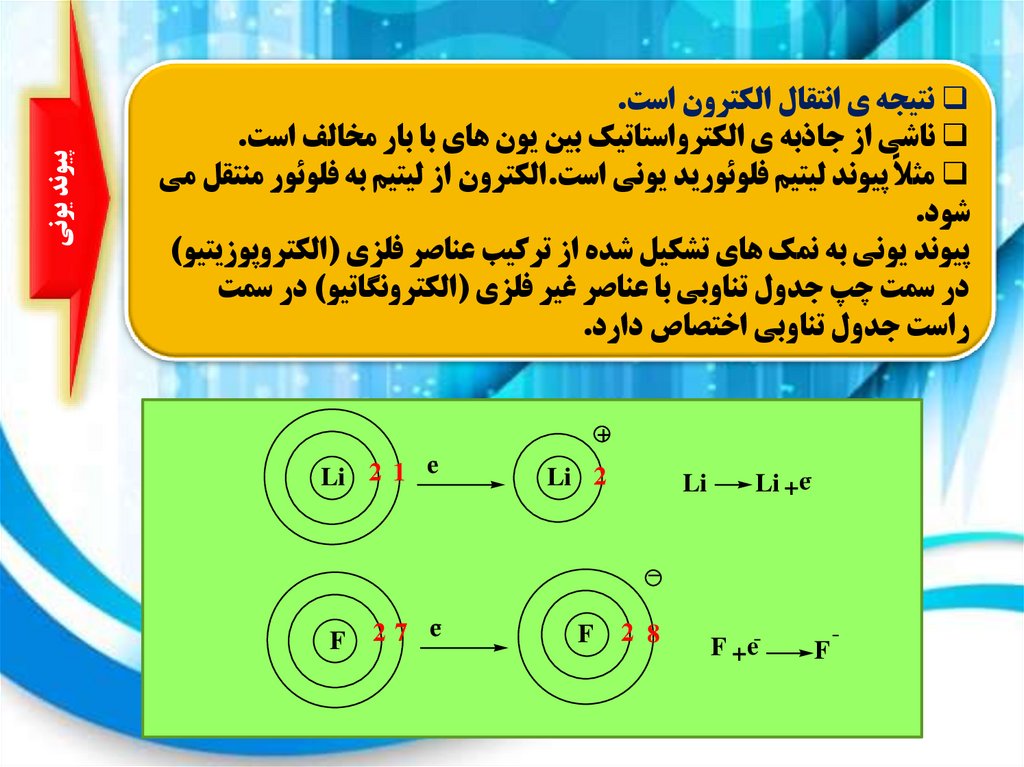
پيوند يوني
نتيجه ي انتقال الکترون است.
ناشي از جاذبه ي الکترواستاتيک بين يون هاي با بار مخالف است.
مثالً پيوند ليتيم فلوئوريد يوني است.الکترون از ليتيم به فلوئور منتقل مي
شود.
پيوند يوني به نمک هاي تشکيل شده از ترکيب عناصر فلزي (الکتروپوزيتيو)
در سمت چپ جدول تناوبي با عناصر غير فلزي (الکترونگاتيو) در سمت
راست جدول تناوبي اختصاص دارد.
7.
پيوندکواالنسي
H
.. .
.
H.N
.. .
H
..
..
H
..
H C H
..
H
..
..
3H . + . N
..
.
..
F.. + . C. .
..
H
.. .
..O
H .. .
.. .
2H . + . O
.. .
H .. H
.. ..
.. F..F ..
.. ..
..
.
H .F.. ..
..
.. F
.. ..
F
F
.. ..
.. C
F
..
..
..
..
.. ..
.. ..
..
.H
.. .
.F .
..
.. .
.
H . + F.. .
H. +
..
.. ..F . +
.
..
. C.
F
+
..
.
..
نتيجه ي به اشتراک گذاشتن الکترون ها است.
نيروي پيوندي از نوع جاذبه ي الکترواستاتيکي بين هر الکترون و دو
هسته.
هنگامي تشکيل مي شود که اتم ها به تعداد برابر الکترون به اشتراک
بگذارند.
معموالً بين دو نافلز تشکيل مي شود.
مشخصه ي ترکيب هاي کربن است.به عبارتي پيوندي است که در
مطالعه شيمي آلي اهميت فراوان دارد.
8.
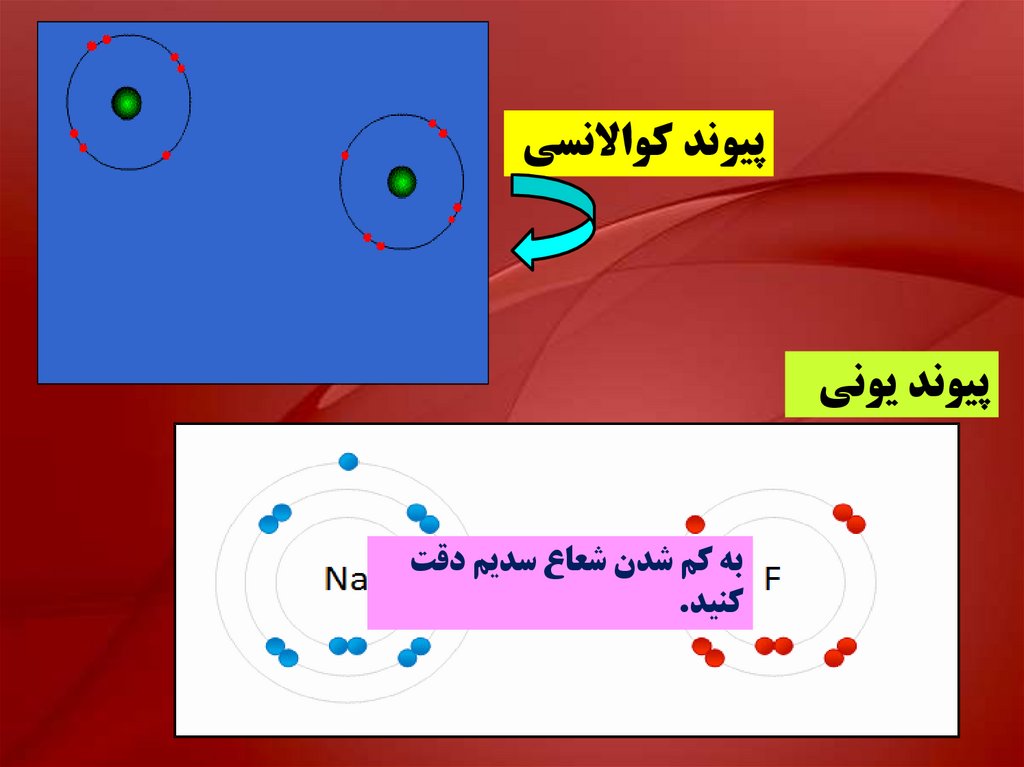
پيوند کواالنسيپيوند يوني
به کم شدن شعاع سديم دقت
کنيد.
9.
مسأله 1-1انتظار داريدکدام يک از ترکيب هاي زير يوني و کدام يک غير يوني باشد؟ساختارالکتروني ساده اي ،که فقط الکترون هاي اليه ظرفيت را نشان دهد رسم کنيد.
ب)H₂S
الف)KBr
ج)NF₃
د)CHCl₃
ه)PH₃
و)CaSO₄
ح)CH₃OH
ز)NH₄Cl
پاسخ:
انتقال الکترون منجر به تشکيل پيوند يوني بين اتم هايي با فاصله ي زياد در جدول تناوبي مي
شود.انتظار مي رود که -به اشتراک گذاشتن الکترون – تشکيل پيوند کواالنسي بين اتم هايي
..
..
..
..
..
..
..
..
.. .. ..
.. .. ..
..
..
..
.. ..
.. ..
..
ز)
H
..
..
H N
.. H Cl
..
H
و)
ح)
H
.. ..
H C
.. H
.. O
H
..
..
H
..
H P
ه) .. H
..
.. .. 22 .. O
.. O
..
Ca O
.. S
O
..
د)
..
صورت گيردکه در جدول فاصله کمتري از هم دارند.
..
.. F
.. ..
H
.. .
..
)
ج
.
F
..F N
.. ..
ب) H .. S.. .
K Br
الف) .. .
.. .
.. .Cl
.. . ... .
. .. . Cl
Cl
.. .
.. C
H
10.
الف)KBrو)CaSO₄
ب)H₂S
ج)NF₃
ز)NH₄Cl
ح)CH₃OH
د)CHCl₃
ه)PH₃
يک ترکيب يوني از نظر بار الکتريکي خنثي است.و پيوند بين يک اتم
الکترونگاتيو و يک اتم الکتروپوزيتيو يوني است.ترکيب الف ترکيب هاي (ه)
(ب) (ج) کواالنسي هستند.
پيوند هاي کربن همگي کواالنسي هستند .ترکيب (ح) و (د)
CaSO₄ اين ترکيب از دو يون Ca²⁺و ¯SO₄²حاصل شده است.و پيوند يوني
دارند Ca²⁺ .يک يون تک اتمي و ¯ SO₄²يک يون چند اتمي است.
توجه
در ساختار يون هاي چند اتمي اتم ها با يکديگر پيوند کواالنسي دارند.و
در واکنش ها به صورت يک واحد مستقل عمل مي کنند.
NH₄Cl يوني است.
11.
?پاسخ:
ساختار الکتروني نسبتاٌساده اي براي هر يک از ترکيب هاي زير با اين
براي رسم ساختار ها به صورت زير عمل مي کنيم:
فرض که کامالٌ کواالنسي نيستند،رسم کنيد .فرض کنيد که هر اتم (البته به استثناي
اتم مرکزي را وسط و اتم هاي ديگر را در اطراف آن قرار مي دهيم.
هيدروژن) داراي هشت تايي کامل است و اينکه دو اتم مي توانند بيش از يک جفت
الکترون ها را طوري مي چينيم که قاعده ي هشت تايي براي همه صدق کند.
الکترون به اشتراک بگذارند.
تعداد الکترون هاي به کار رفته را با تعداد الکترون هاي ظرفيت مقايسه مي کنيم.
CO₂
HCNاضافي را و)
ه)
نقض د)NO₃⁻
HONO₂
قاعده يج)
اينکه)N₂
بدون ب
حالH₂O₂
الف)
مي کنيم
حذف
الکترون هاي
شود،تعداد
هشت تايي
و به تعدادش الکترون به اشتراک مي گذاريم.
..
......
..
..
..
..
..
..
..
..
..
..
..
..
..
....
....
..
و)
..
..
O
H
H O
..
.. C
..
..
O
..
..
.. ..
.. ..
..
..
..
O C O
ز)
ج)
..
.. O
.. ..
H O
.. N O
..
.. ....
.. ..
..
ب)
N N
تعداد الکترونهاي
ظرفيت10:
ح)
د)
H
..
C
.. H
H
..
.. O
.. ..
O
.. N O
H
..
H C
..
H
..
..
..
.. ..
الف)
HO
.. O
.. H
.. ..
HC
.. N
..
.. ..
H C
..
.. N
..
..
..
HC N
حذف4
e
تعداد الکترونهاي
بکار رفته14 :
..
.. ....
.. ..
..
ز)H₂CO₃
ح)C₂H₆
12.
در رسم ساختارهاي لوئيس ،بايد تعداد الکترون هاي بکار رفته با تعداد الکترونهاي ظرفيت برابر باشد.
تا اينجا پيوند ها را بر حسب ترتيب جفت الکترون هاي اتم هاي شرکت کننده مورد
بررسي قرار داديم ،اما اين روش هميشه مناسب نيست!!!
چرا بعضي ساختار هاي لوئيس غلط هستند؟ چرا بعضي پيوند ها قوي هستند؟ چگونه
مي توان گفت که يک پيوند قوي است؟
عبارت هاي رياضي که براي توصيف حرکت يک الکترون ،با تکيه بر انرژي آن
حل مي شوند.اين عبارت هاي رياضي معادله موج ناميده مي شوند .زيرا بر
اين مفهوم که الکترون ها خواصي نه فقط ذره اي بلکه موجي نيز از خود بروز
مي دهند تکيه دارند.
مکانيک کوانتومي پاسخ هايي بدست مي دهد که با واقعيت ها بخوبي
سازگارند.و به عنوان سودمند ترين روش براي درک ساختار اتمي و ملکولي
پذيرفته شده اند.
13.
اوربيتال هاي اتمي:ناحيه اي از فضا که احتمال يافتن الکترون در آن وجود دارد را اوربيتال مي
نامند.
نوع اوربيتالي که يک الکترون اشغال مي کند به انرژي الکترون بستگي دارد.
شکل و آرايش اوربيتال ها ،آرايش فضايي اتم ها را در يک مولکول تعيين مي
کند.
اگر حرکت الکترون را به صورت ابر در نظر بگيريم،شکل اين ابر همان شکل
اوربيتال است .اين ابر يکنواخت نيست چون احتمال يافتن الکترون در همه
جا يکسان نيست.هر جا الکترون بيشتر حضور داشته باشد ،متراکم تر است.
14.
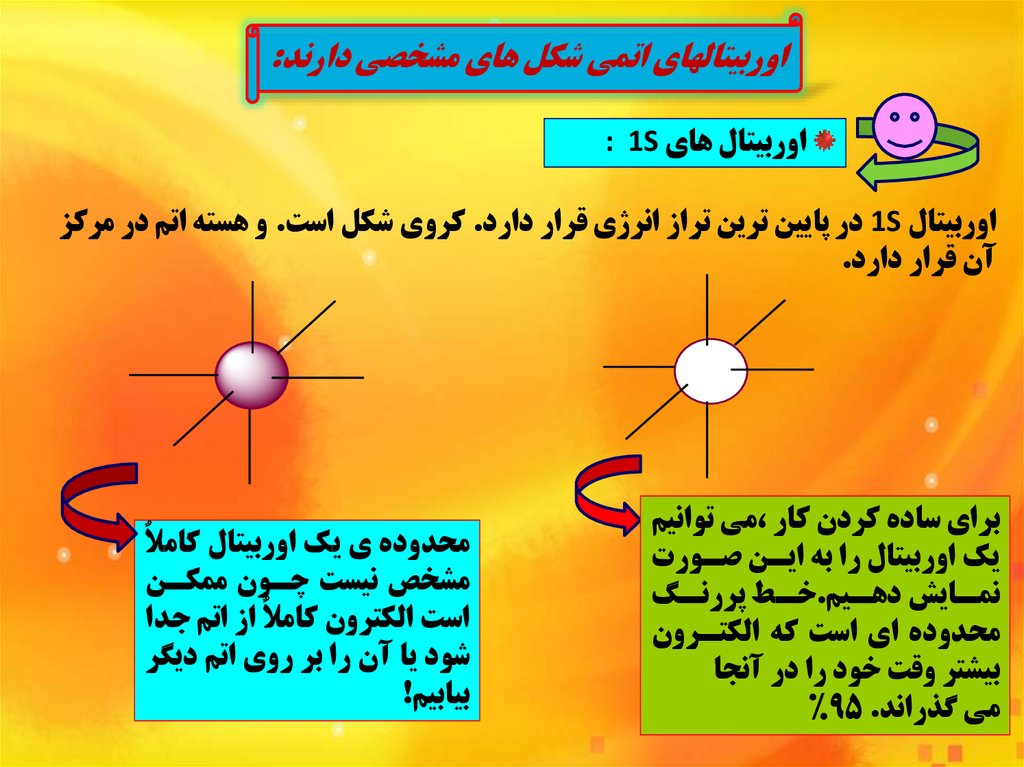
اوربيتالهاي اتمي شکل هاي مشخصي دارند:اوربيتال هاي : 1S
اوربيتال 1Sدر پايين ترين تراز انرژي قرار دارد .کروي شکل است .و هسته اتم در مرکز
آن قرار دارد.
براي ساده کردن کار ،مي توانيم
يک اوربيتال را به اينن صنورت
نگ
نط پررنن
نيم.خن
نايش دهن
نمن
محدوده اي است که الکتنرون
بيشتر وقت خود را در آنجا
مي گذراند%95 .
محدوده ي يک اوربيتال کامالٌ
مشخص نيست چنون ممکنن
است الکترون کامالٌ از اتم جدا
شود يا آن را بر روي اتم ديگر
بيابيم!
15.
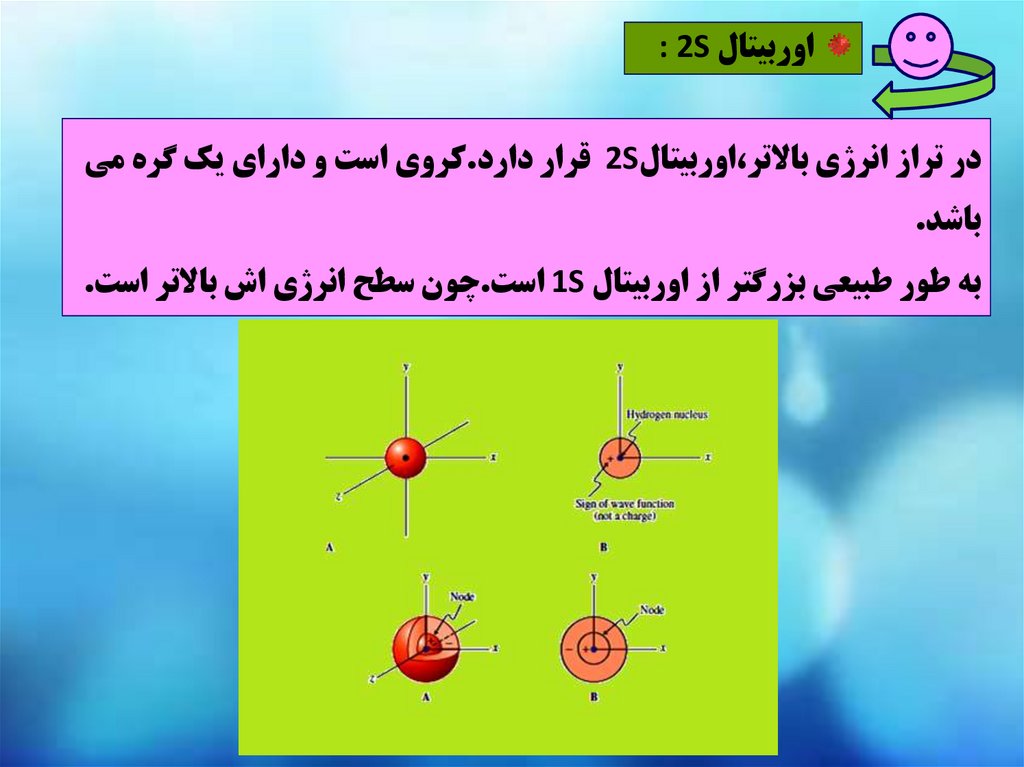
اوربيتال : 2Sدر تراز انرژي باالتر،اوربيتال 2Sقرار دارد.کروي است و داراي يک گره مي
باشد.
به طور طبيعي بزرگتر از اوربيتال 1Sاست.چون سطح انرژي اش باالتر است.
16.
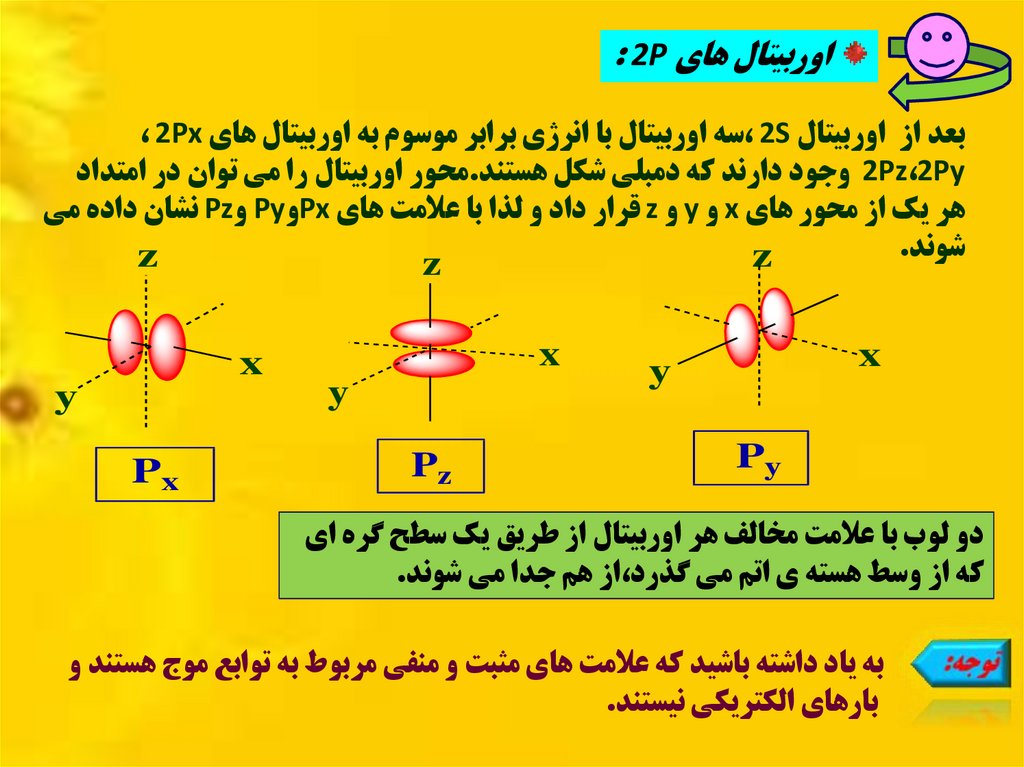
اوربيتال هاي : 2Pبعد از اوربيتال ، 2Sسه اوربيتال با انرژي برابر موسوم به اوربيتال هاي ، 2Px
2Pz،2Pyوجود دارند که دمبلي شکل هستند.محور اوربيتال را مي توان در امتداد
هر يک از محور هاي xو yو zقرار داد و لذا با عالمت هاي Pxو Pyو Pzنشان داده مي
شوند.
z
z
z
x
y
Py
x
y
Pz
x
y
Px
دو لوب با عالمت مخالف هر اوربيتال از طريق يک سطح گره اي
که از وسط هسته ي اتم مي گذرد،از هم جدا مي شوند.
به ياد داشته باشيد که عالمت هاي مثبت و منفي مربوط به توابع موج هستند و
بارهاي الکتريکي نيستند.
17.
جدول 1-1آرايش هاي الکتروني.
H
2s
..
He
.
..
Li
..
..
Be
.
..
..
B
.
.
..
..
C
.
.
.
..
..
N
.
.
..
..
..
O
2p
.
.. ..
..
..
F
..
.. ..
..
..
Ne
18.
آرايش الکتروني -اصلطرد پائولي:
توجه
چگونگي توزيع الکترون ها را در
يک اتم تعيين مي کند.
اوربيتال ها به ترتيب انرژي پر مي شوند(.اول 1sبعد .)2s
در هر اوربيتال اتمي حداکثر دو الکترون و آن هم با اسپين مخالف قرار مي گيرند(.اصل
طرد پائولي).
يک اوربيتال فقط هنگامي به وسيله ي دو الکترون اشغال مي شود که ساير اوربيتال هاي هم
انرژي هر يک به وسيله ي يک الکترون اشغال شده باشند(قاعده هوند).
مثال:
2Pᶟ
مسأله :1-3آرايش الکتروني هشت عنصر در جدول تناوبي،از سديم تا آرگون را نشان دهيد.
1S
2S
2P
3S
3P
.. .. .. .. .
Na ..
.. .. .. .. ..
Mg ..
.. .. .. .. .. .
Al ..
.. .. .. .. .. . .
Si ..
.. .. .. .. .. . . .
P ..
.. .. .. .. .. .. . .
S ..
.. .. .. .. .. .. .. .
Cl ..
.. .. .. .. .. .. .. ..
Ar ..
19.
ب) بين آرايش الکتروني و خانواده ي تناوبي چه رابطه اي وجود دارد؟پاسخ :
عناصر يک خانواده ،در باالترين سطح انرژي خود ،آرايش الکتروني يکساني دارند.
ج)بين آرايش الکتروني و خواص شيميايي عناصر چه رابطه اي وجود دارد؟
پاسخ :
الکترون هاي ظرفيتي اهميت بسياري دارند زيرا به طور عمده ،اين
الکترون ها هستند که خواص شيميايي يک عنصر را تعيين مي کنند ،علت
واکنش پذيري عنصر ها تمايل آنها براي دستيابي به اليه هاي الکتروني پر
است.عناصر فلزي در سمت چپ جدول تناوبي ،الکترون از دست مي دهند تا
به آرايش 2و 8برسند.عناصر غير فلزي در سمت راست ،الکترون مي گيرند
تا به آرايش 2و 8دست يابند.
20.
ترکيب اوربيتال هاي اتمي اتم هاي درگير در پيوند،اوربيتال هاي مولکولي يا پيوندي راايجاد مي کند.که شکل و موضع آنها به شکل و موضع اوربيتال هاي اتمي اوليه وابسته
است و اين اوربيتال هاي مولکولي،متمرکز در اطراف چندين هسته قرار مي گيرند.توزيع
الکترون ها و هسته ها به صورتي است که پايدارترين مولکول ممکن نتيجه شود.و نيز هر
جفت الکترون اشتراکي اساساٌ در نزديکي دو هسته مستقر مي شوند.
پيوند کواالنسي:
براي تشکيل يک پيوند کواالنسي ،دو اتم بايد در وضعيتي قرار گيرند که
اوربيتال يکي با اوربيتال ديگري همپوشاني کند.هر اوربيتال اتمي بايد
يک الکترون داشته باشد.
21.
محدوده اي را در فضا اشغال کنند که پيش از اين به وسيله ي هر دو اوربيتال اتمي اشغالشده بود.در نتيجه الکترون مي تواند در همان محل مناسب پيش نسبت به هسته خود باقي
بماند و محل مناسبي را نيز نسبت به هسته دوم اشغال کند.
به ياد داشته باشيد
همپوشاني اوربيتال هاي اتمي به اين معنا است که اوربيتال هاي پيوندي تشکيل شده،همان
دو اوربيتال اتمي در هم مي آميزند و يک اوربيتال مولکولي (پيوندي)تشکيل مي
شود که بوسيله هر دو الکترون اشغال مي شود .دو الکترون بايد داراي اسپين مخالف
باشند.
هر الکترون به تنهايي تمام اوربيتال مولکولي را در اختيار مي گيرد و بنابراين مي توان تصور
کرد که به هر دو هسته تعلق دارد.
مقدار انرژي آزاد شده به هنگام تشکيل پيوند ،به ازاي هر مول يا مقدار انرژي الزم براي
شکستن پيوند را انرژي تفکيک پيوند مي نامند.
تشکيل پيوند با آزاد شدن انرژي همراه است ،به عبارتي ،نسبت به اتم
هاي اوليه پايداري بوجود مي آيد.
22.
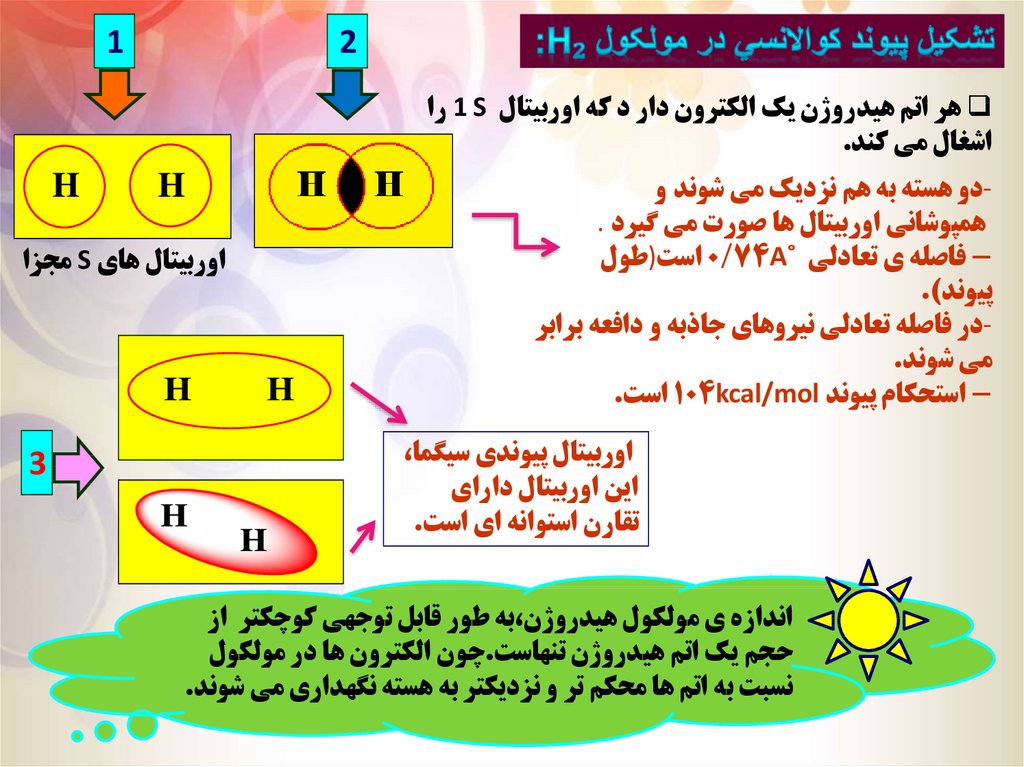
12
هر اتم هيدروژن يک الکترون دار د که اوربيتال 1 Sرا
اشغال مي کند.
دو هسته به هم نزديک مي شوند وهمپوشاني اوربيتال ها صورت مي گيرد .
فاصله ي تعادلي ˚ 0/74Aاست)طولپيوند).
در فاصله تعادلي نيروهاي جاذبه و دافعه برابرمي شوند.
-استحکام پيوند 104kcal/molاست.
اوربيتال پيوندي سيگما،
اين اوربيتال داراي
تقارن استوانه اي است.
H
H
اوربيتال هاي Sمجزا
H
H
3
H
H
اندازه ي مولکول هيدروژن،به طور قابل توجهي کوچکتر از
حجم يک اتم هيدروژن تنهاست.چون الکترون ها در مولکول
نسبت به اتم ها محکم تر و نزديکتر به هسته نگهداري مي شوند.
23.
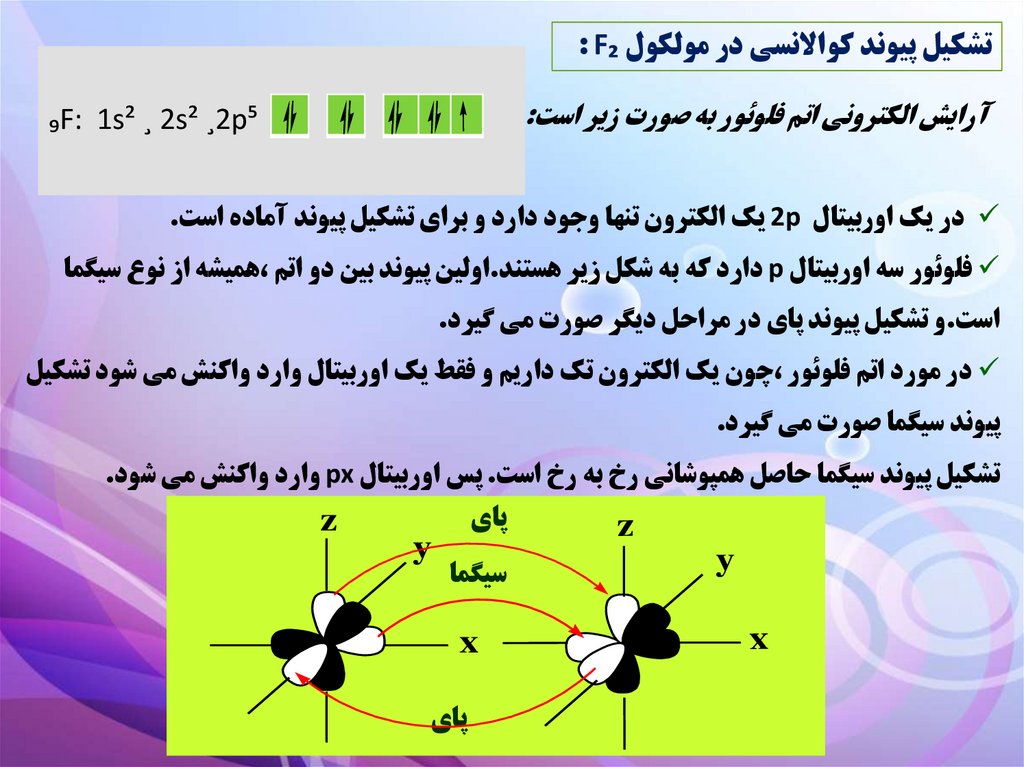
تشکيل پيوند کواالنسي در مولکول : F₂آرايش الکتروني اتم فلوئور به صورت زير است:
₉F: 1s² ¸ 2s² ¸2p⁵
در يک اوربيتال 2pيک الکترون تنها وجود دارد و براي تشکيل پيوند آماده است.
فلوئور سه اوربيتال pدارد که به شکل زير هستند.اولين پيوند بين دو اتم ،هميشه از نوع سيگما
است.و تشکيل پيوند پاي در مراحل ديگر صورت مي گيرد.
در مورد اتم فلوئور ،چون يک الکترون تک داريم و فقط يک اوربيتال وارد واکنش مي شود تشکيل
پيوند سيگما صورت مي گيرد.
تشکيل پيوند سيگما حاصل همپوشاني رخ به رخ است .پس اوربيتال pxوارد واکنش مي شود.
z
y
پاي
سيگما
y
x
پاي
z
x
24.
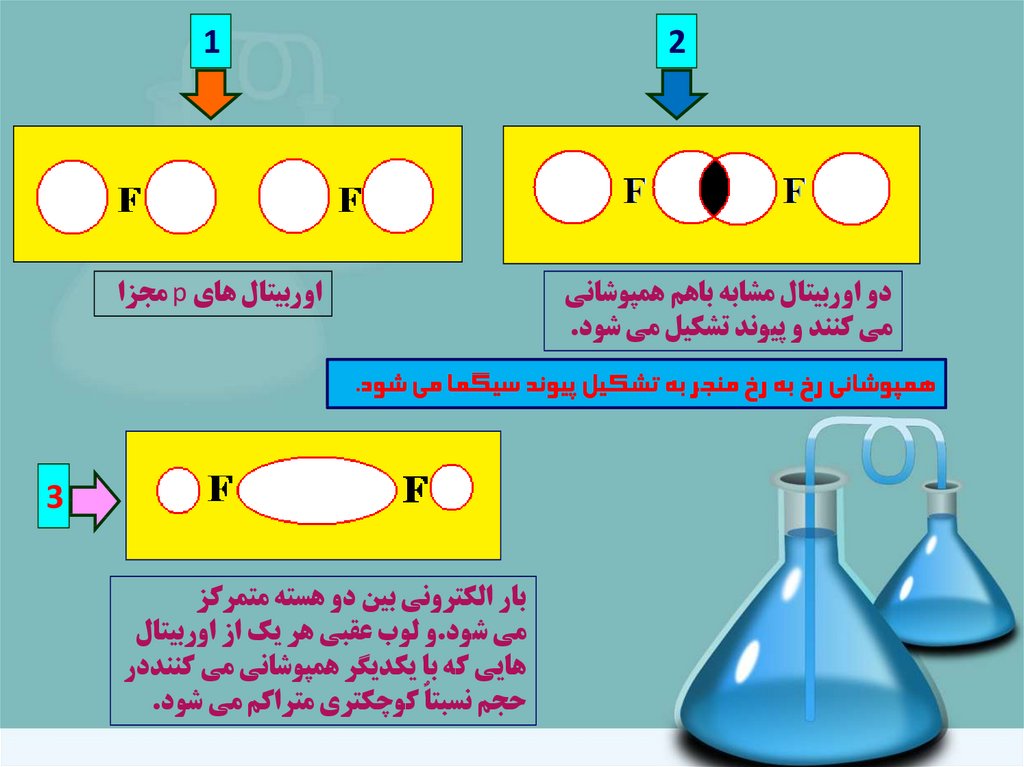
12
اوربيتال هاي pمجزا
دو اوربيتال مشابه باهم همپوشاني
مي کنند و پيوند تشکيل مي شود.
همپوشاني رخ به رخ منجر به تشکيل پيوند سيگما مي شود.
3
بار الکتروني بين دو هسته متمرکز
مي شود.و لوب عقبي هر يک از اوربيتال
هايي که با يکديگر همپوشاني مي کننددر
حجم نسبتاٌ کوچکتري متراکم مي شود.
25.
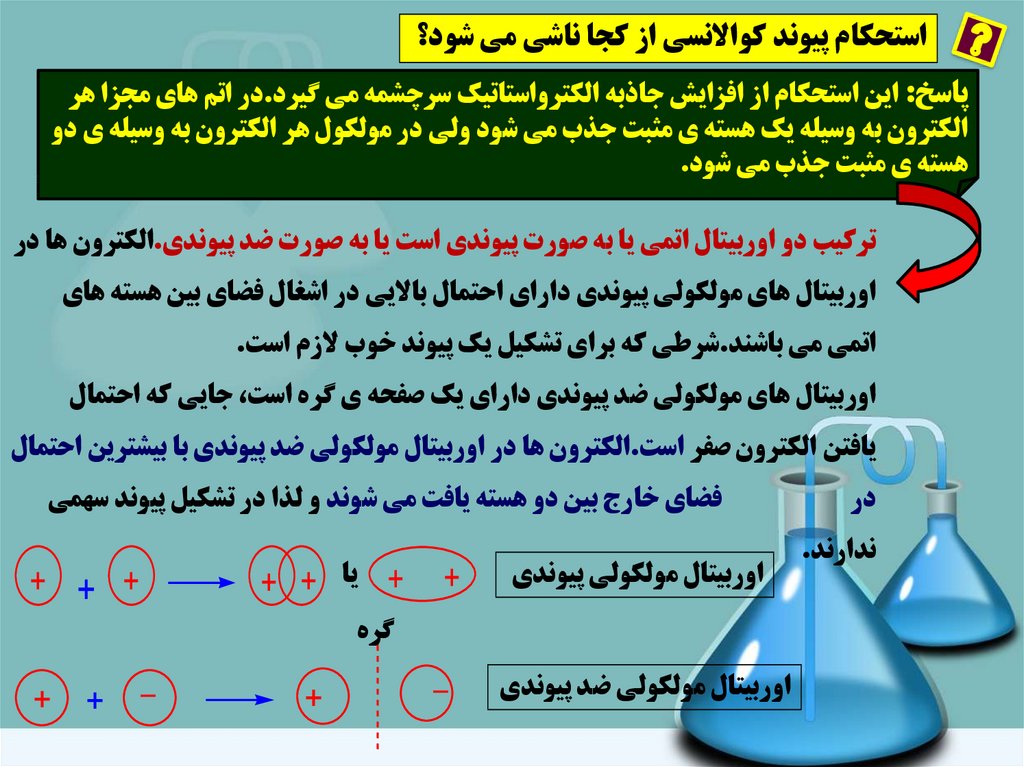
استحکام پيوند کواالنسي از کجا ناشي مي شود؟پاسخ :اين استحکام از افزايش جاذبه الکترواستاتيک سرچشمه مي گيرد.در اتم هاي مجزا هر
الکترون به وسيله يک هسته ي مثبت جذب مي شود ولي در مولکول هر الکترون به وسيله ي دو
هسته ي مثبت جذب مي شود.
ترکيب دو اوربيتال اتمي يا به صورت پيوندي است يا به صورت ضد پيوندي.الکترون ها در
اوربيتال هاي مولکولي پيوندي داراي احتمال بااليي در اشغال فضاي بين هسته هاي
اتمي مي باشند.شرطي که براي تشکيل يک پيوند خوب الزم است.
اوربيتال هاي مولکولي ضد پيوندي داراي يک صفحه ي گره است ،جايي که احتمال
يافتن الکترون صفر است.الکترون ها در اوربيتال مولکولي ضد پيوندي با بيشترين احتمال
در
ندارند.
فضاي خارج بين دو هسته يافت مي شوند و لذا در تشکيل پيوند سهمي
اوربيتال مولکولي پيوندي
+
+يا + +
+ + +
گره
اوربيتال مولکولي ضد پيوندي
_
+
_
+
+
26.
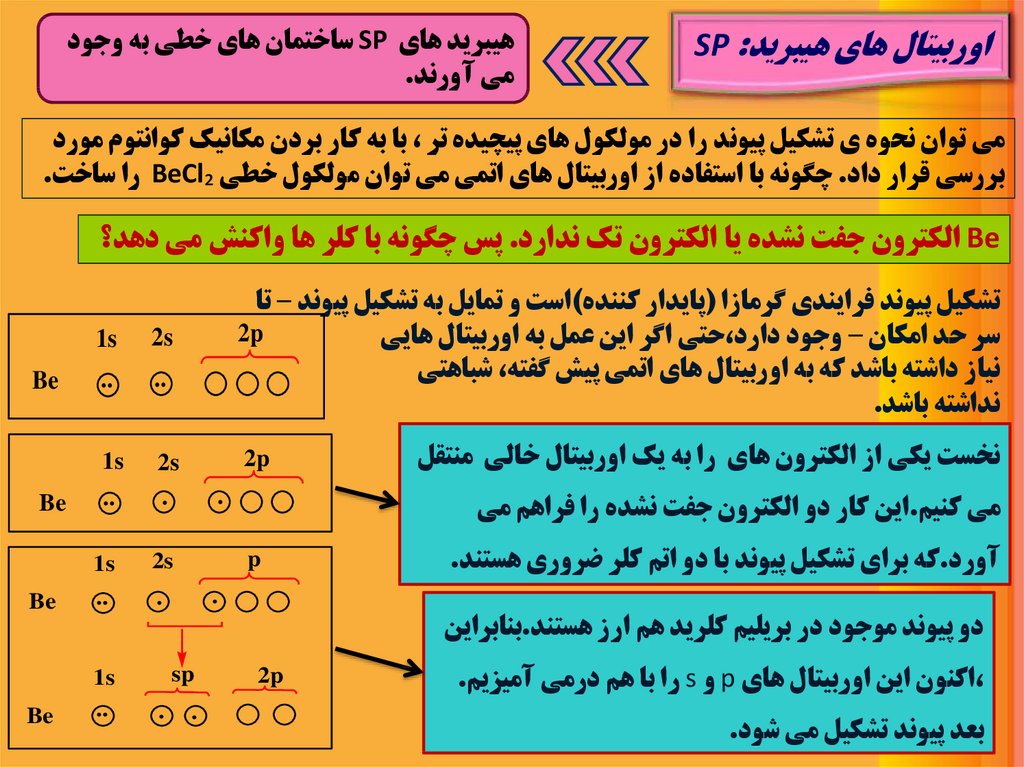
اوربيتال هاي هيبريدSP :هيبريد هاي SPساختمان هاي خطي به وجود
مي آورند.
مي توان نحوه ي تشکيل پيوند را در مولکول هاي پيچيده تر ،با به کار بردن مکانيک کوانتوم مورد
بررسي قرار داد .چگونه با استفاده از اوربيتال هاي اتمي مي توان مولکول خطي BeCl₂را ساخت.
Beالکترون جفت نشده يا الکترون تک ندارد .پس چگونه با کلر ها واکنش مي دهد؟
تشکيل پيوند فرايندي گرمازا (پايدار کننده)است و تمايل به تشکيل پيوند – تا
2p
سر حد امکان – وجود دارد،حتي اگر اين عمل به اوربيتال هايي
نياز داشته باشد که به اوربيتال هاي اتمي پيش گفته ،شباهتي
نداشته باشد.
نخست يکي از الکترون هاي را به يک اوربيتال خالي منتقل
2p
.
مي کنيم.اين کار دو الکترون جفت نشده را فراهم مي
آورد.که براي تشکيل پيوند با دو اتم کلر ضروري هستند.
p
2s
1s
..
..
Be
2s
.
1s
..
Be
2s
.
.
1s
..
Be
دو پيوند موجود در بريليم کلريد هم ارز هستند.بنابراين
،اکنون اين اوربيتال هاي pو sرا با هم درمي آميزيم.
بعد پيوند تشکيل مي شود.
2p
sp
.
.
1s
..
Be
27.
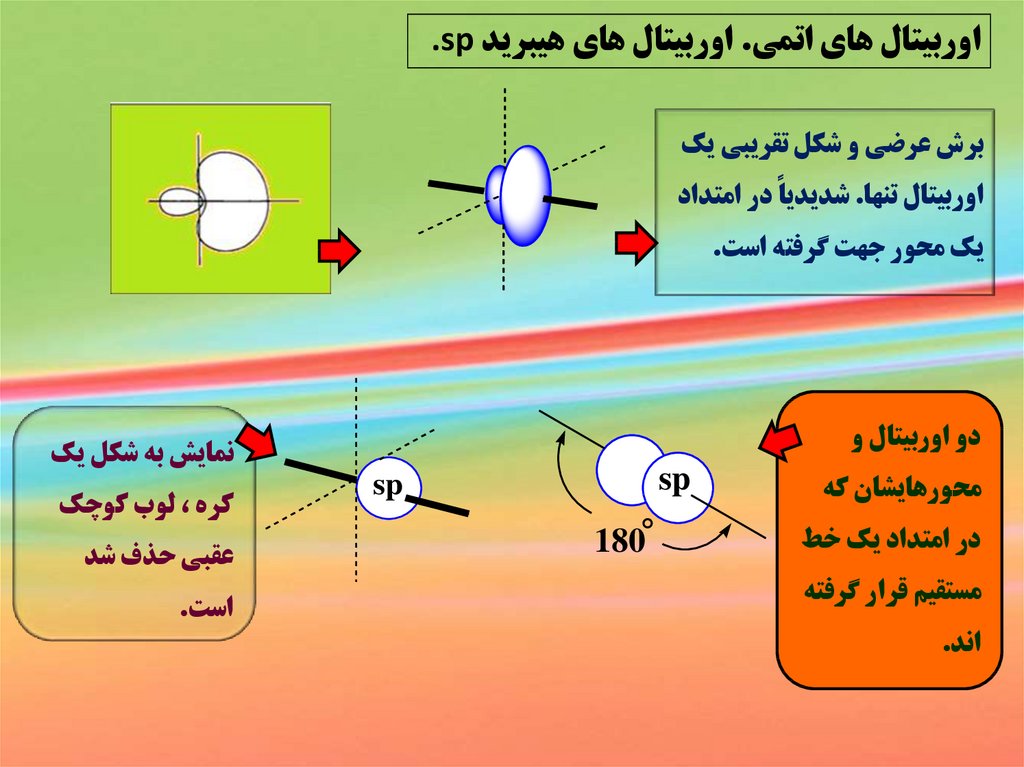
اوربيتال هاي اتمي .اوربيتال هاي هيبريد .spبرش عرضي و شکل تقريبي يک
اوربيتال تنها .شديدياً در امتداد
يک محور جهت گرفته است.
دو اوربيتال و
محورهايشان که
در امتداد يک خط
مستقيم قرار گرفته
اند.
sp
sp
180°
نمايش به شکل يک
کره ،لوب کوچک
عقبي حذف شد
است.
28.
چرا بريليم با استفاده از اوربيتال ،pيک نوع پيوند و با استفاَده ازاوربيتال sيک پيوند از نوع ديگر تشکيل نمي دهد؟
پاسخ :
اوربيتال هاي مخلوط (هيبريد)خصلت جهت داري در آنها در باالترين حد ممکن است.هر
اندازيک اوربيتال اتمي ،در جهت تشکيل پيوند ،بيشتر متمرکز شده باشد ،همپوشاني آن
شديدتر و پيوندي که مي تواند تشکيل دهد ،محکم تر است .اوربيتال هيبريدي خيلي بيشتر از
اوربيتال pيا sجهت دار است.
اين اوربيتال هاي هيبريدي دقيقاٌ در دو جهت مخالف قرار مي گيرند ،اين آرايش به آنها
اجازه مي دهد تا سر حد امکان از يکديگر فاصله بگيرند.
براي اينکه همپوشاني اوربيتال هاي spواوربيتال هاي pکلر ها بيشينه
+
باشد ،دو هسته کلر بايد در امتداد محور اوربيتالهاي spقرار گيرند در
بايد 180باشد.
نتيجه زاويه موجود بين پيوند هاي بريليم – کلر ˚
sp
p
s
29.
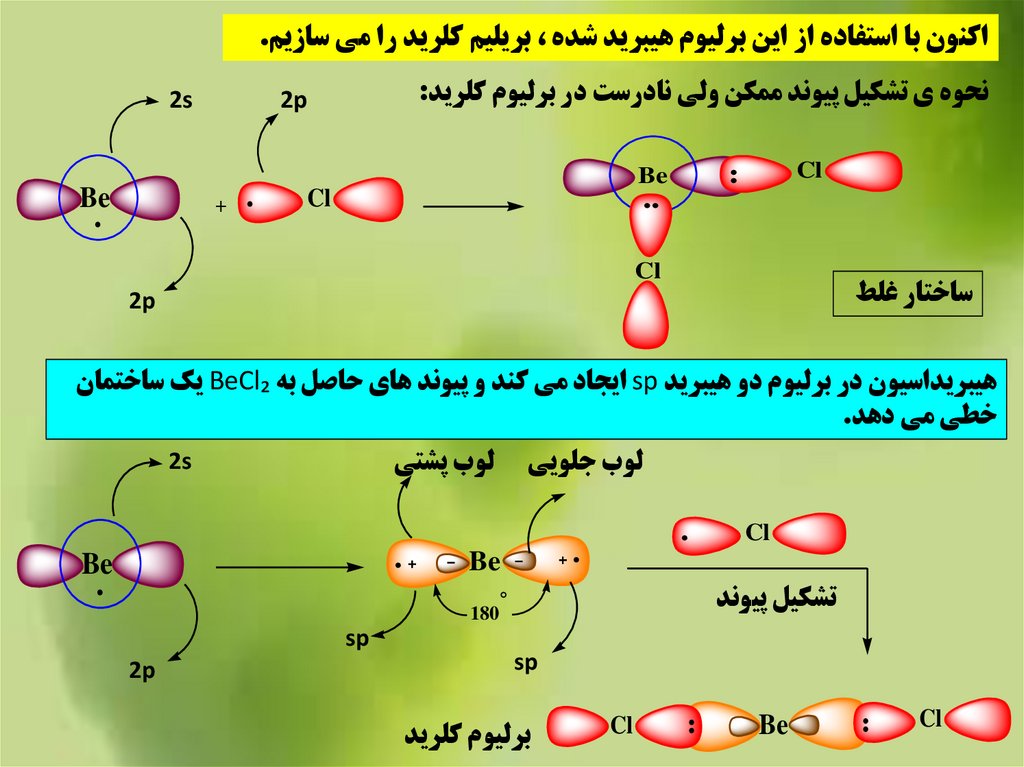
اکنون با استفاده از اين برليوم هيبريد شده ،بريليم کلريد را مي سازيم.نحوه ي تشکيل پيوند ممکن ولي نادرست در برليوم کلريد:
..
Cl
2p
Be
..
Cl
2s
.
Be
+
.
Cl
ساختار غلط
2p
.
هيبريداسيون در برليوم دو هيبريد spايجاد مي کند و پيوند هاي حاصل به BeCl₂يک ساختمان
خطي مي دهد.
لوب جلويي
Cl
.
.
لوب پشتي
Be
تشکيل پيوند
°
..
..
Cl
Be
.
Be
.
180
sp
Cl
2s
برليوم کلريد
sp
2p
30.
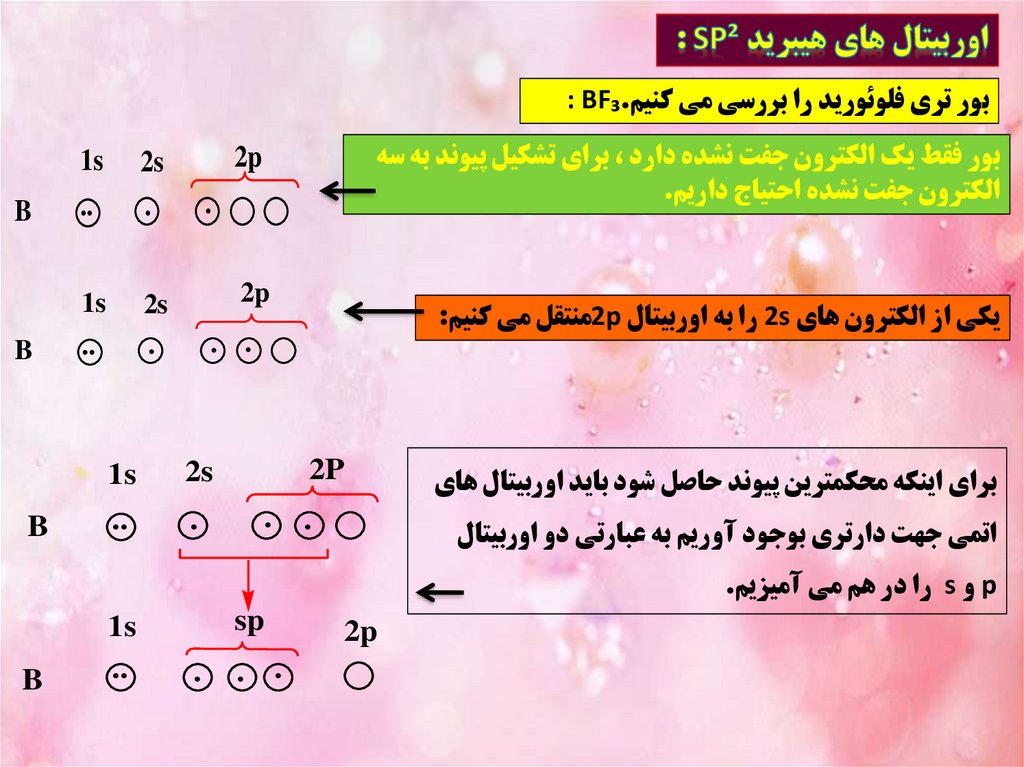
بور تري فلوئوريد را بررسي مي کنيم: BF₃.بور فقط يک الکترون جفت نشده دارد ،براي تشکيل پيوند به سه
الکترون جفت نشده احتياج داريم.
2p
براي اينکه محکمترين پيوند حاصل شود بايد اوربيتال هاي
2s
.
.
2p
يکي از الکترون هاي 2sرا به اوربيتال 2pمنتقل مي کنيم:
.
اتمي جهت دارتري بوجود آوريم به عبارتي دو اوربيتال
2s
.
..
.
B
1s
2s
.
. .
2P
1s
..
1s
..
B
B
pو sرا در هم مي آميزيم.
2p
sp
. .
.
1s
..
B
31.
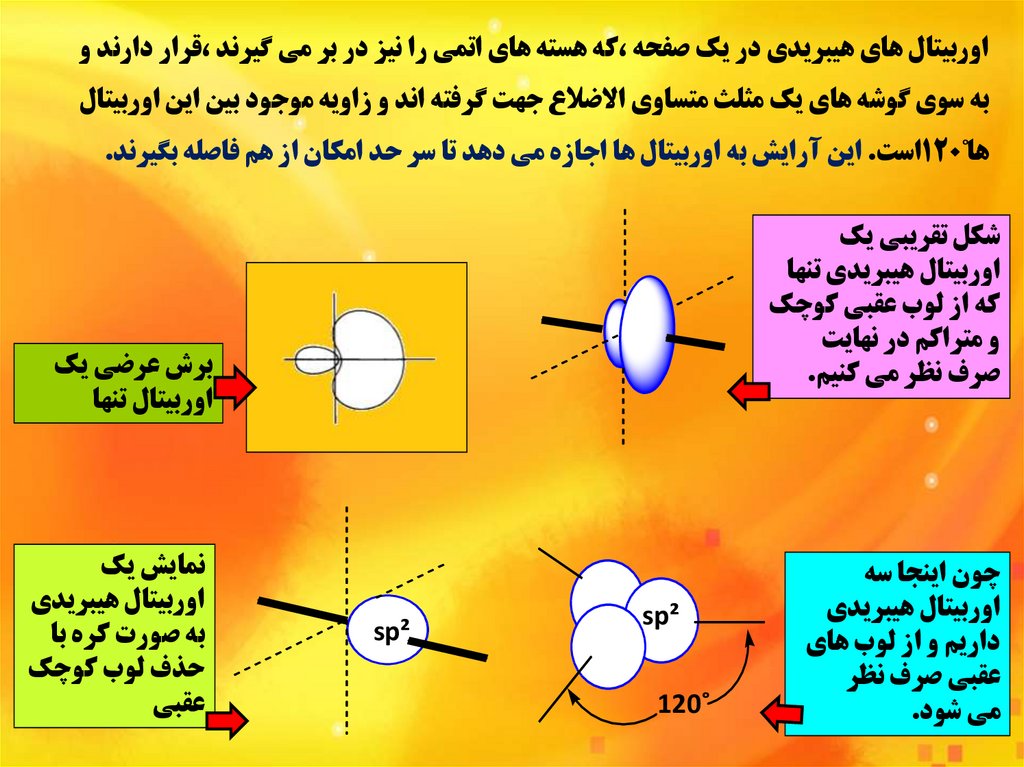
اوربيتال هاي هيبريدي در يک صفحه ،که هسته هاي اتمي را نيز در بر مي گيرند ،قرار دارند وبه سوي گوشه هاي يک مثلث متساوي االضالع جهت گرفته اند و زاويه موجود بين اين اوربيتال
ها˚120است .اين آرايش به اوربيتال ها اجازه مي دهد تا سر حد امکان از هم فاصله بگيرند.
شکل تقريبي يک
اوربيتال هيبريدي تنها
که از لوب عقبي کوچک
و متراکم در نهايت
صرف نظر مي کنيم.
چون اينجا سه
اوربيتال هيبريدي
داريم و از لوب هاي
عقبي صرف نظر
مي شود.
برش عرضي يک
اوربيتال تنها
sp²
˚120
sp²
نمايش يک
اوربيتال هيبريدي
به صورت کره با
حذف لوب کوچک
عقبي
32.
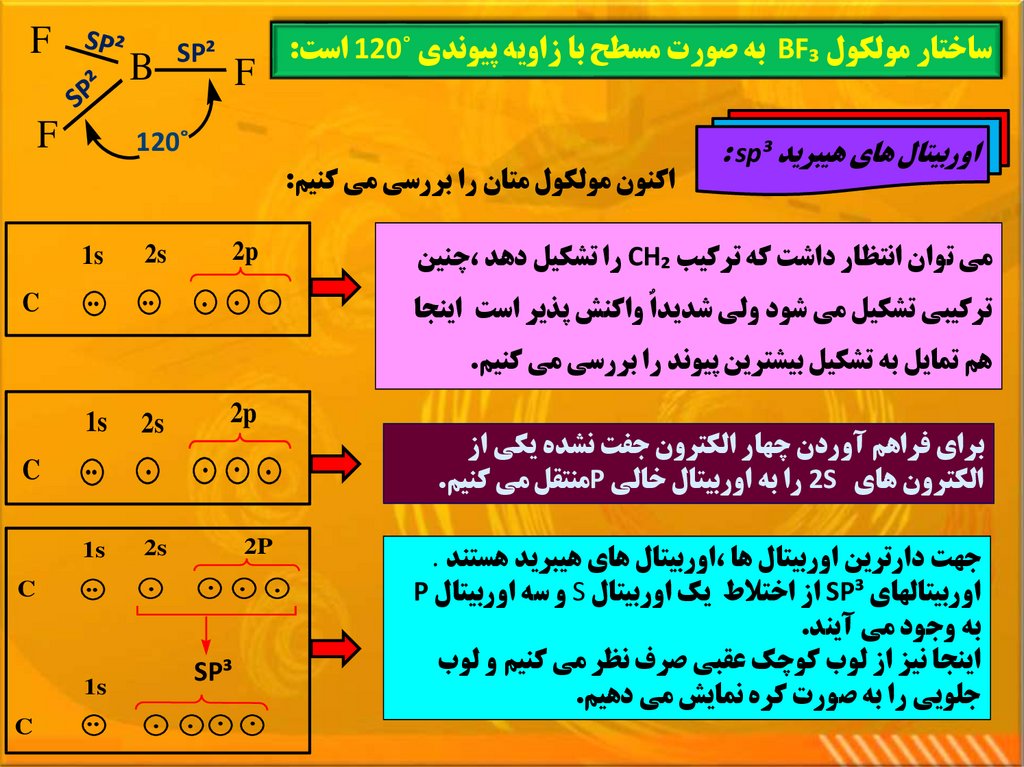
ساختار مولکول BF₃به صورت مسطح با زاويه پيوندي ˚ 120است:اوربيتال هاي هيبريد : sp³
SP²
F
F
B
F
˚120
اکنون مولکول متان را بررسي مي کنيم:
2p
مي توان انتظار داشت که ترکيب CH₂را تشکيل دهد ،چنين
. .
ترکيبي تشکيل مي شود ولي شديداٌ واکنش پذير است اينجا
2s
1s
..
..
C
هم تمايل به تشکيل بيشترين پيوند را بررسي مي کنيم.
2p
براي فراهم آوردن چهار الکترون جفت نشده يکي از
الکترون هاي 2Sرا به اوربيتال خالي Pمنتقل مي کنيم.
جهت دارترين اوربيتال ها ،اوربيتال هاي هيبريد هستند .
اوربيتالهاي SP³از اختالط يک اوربيتال Sو سه اوربيتال P
به وجود مي آيند.
اينجا نيز از لوب کوچک عقبي صرف نظر مي کنيم و لوب
جلويي را به صورت کره نمايش مي دهيم.
. . .
2s
.
1s
..
C
2P
2s
1s
..
C
1s
..
C
.
.
.
.
SP³
.
.
.
.
33.
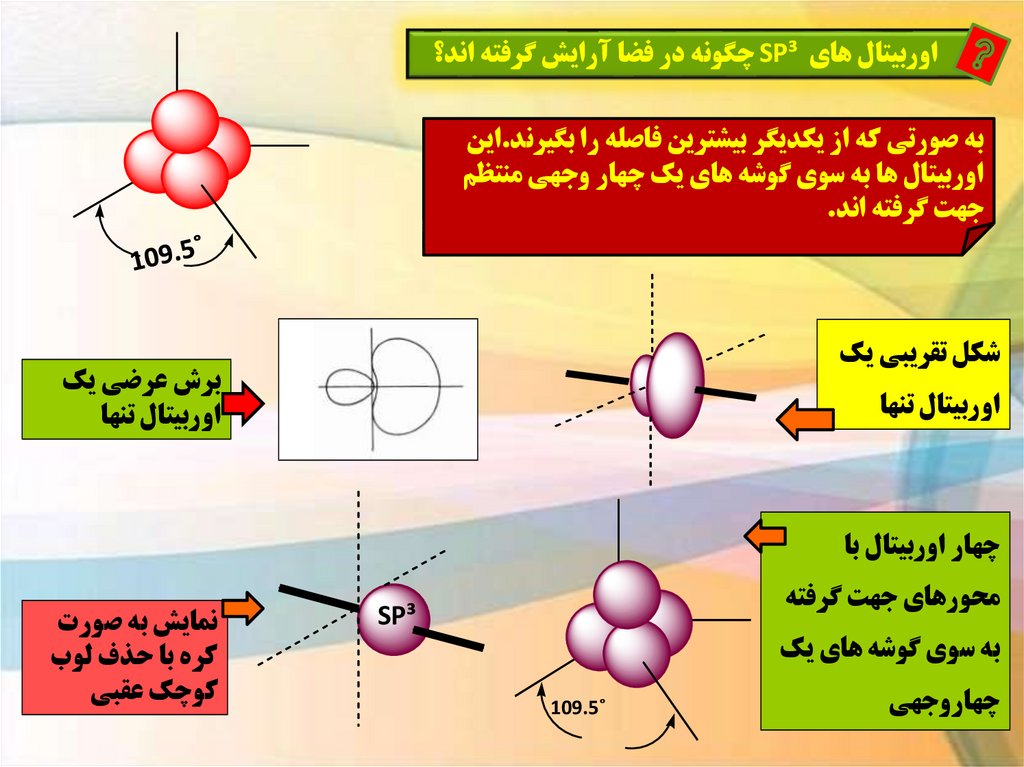
اوربيتال هاي SP³چگونه در فضا آرايش گرفته اند؟به صورتي که از يکديگر بيشترين فاصله را بگيرند.اين
اوربيتال ها به سوي گوشه هاي يک چهار وجهي منتظم
جهت گرفته اند.
شکل تقريبي يک
برش عرضي يک
اوربيتال تنها
اوربيتال تنها
چهار اوربيتال با
محورهاي جهت گرفته
SP³
به سوي گوشه هاي يک
چهاروجهي
˚109.5
نمايش به صورت
کره با حذف لوب
کوچک عقبي
34.
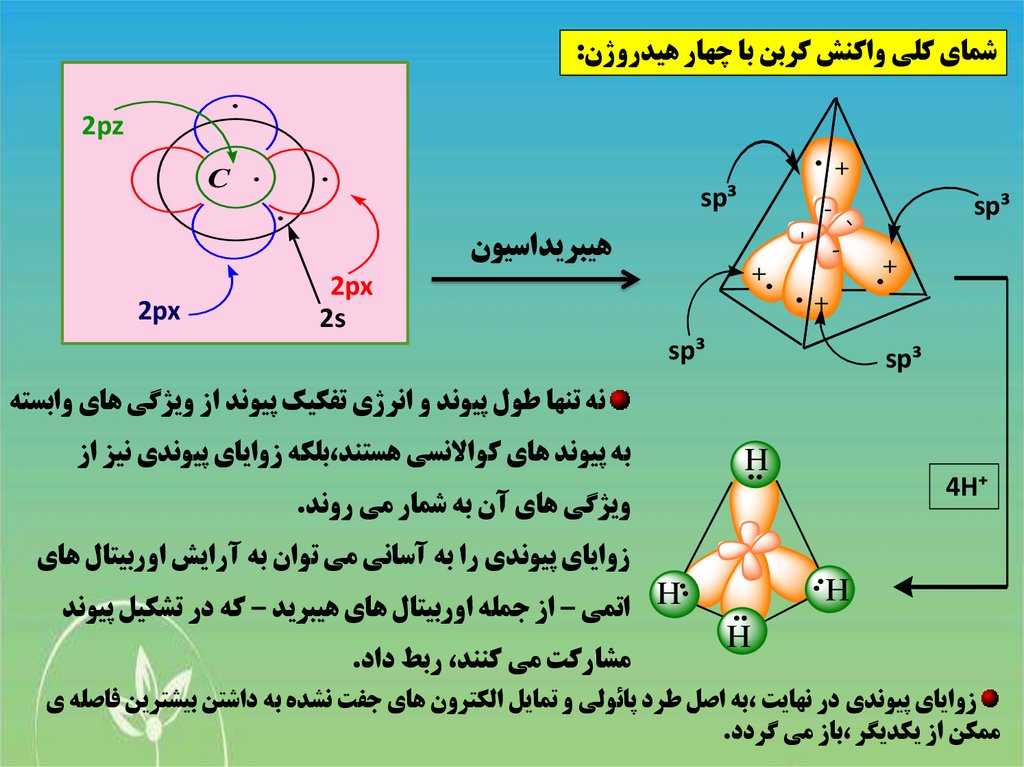
شماي کلي واکنش کربن با چهار هيدروژن:.
.+
sp³
.
-
-
C .
.
sp³
2pᴢ
-
هيبريداسيون
-
. . + .+
+
2px
2s
2px
sp³
sp³
نه تنها طول پيوند و انرژي تفکيک پيوند از ويژگي هاي وابسته
به پيوند هاي کواالنسي هستند،بلکه زواياي پيوندي نيز از
H
..
4H⁺
ويژگي هاي آن به شمار مي روند.
H
Hاتمي – از جمله اوربيتال هاي هيبريد – که در تشکيل پيوند
..
..
زواياي پيوندي را به آساني مي توان به آرايش اوربيتال هاي
..
H
مشارکت مي کنند ،ربط داد.
زواياي پيوندي در نهايت ،به اصل طرد پائولي و تمايل الکترون هاي جفت نشده به داشتن بيشترين فاصله ي
ممکن از يکديگر ،باز مي گردد.
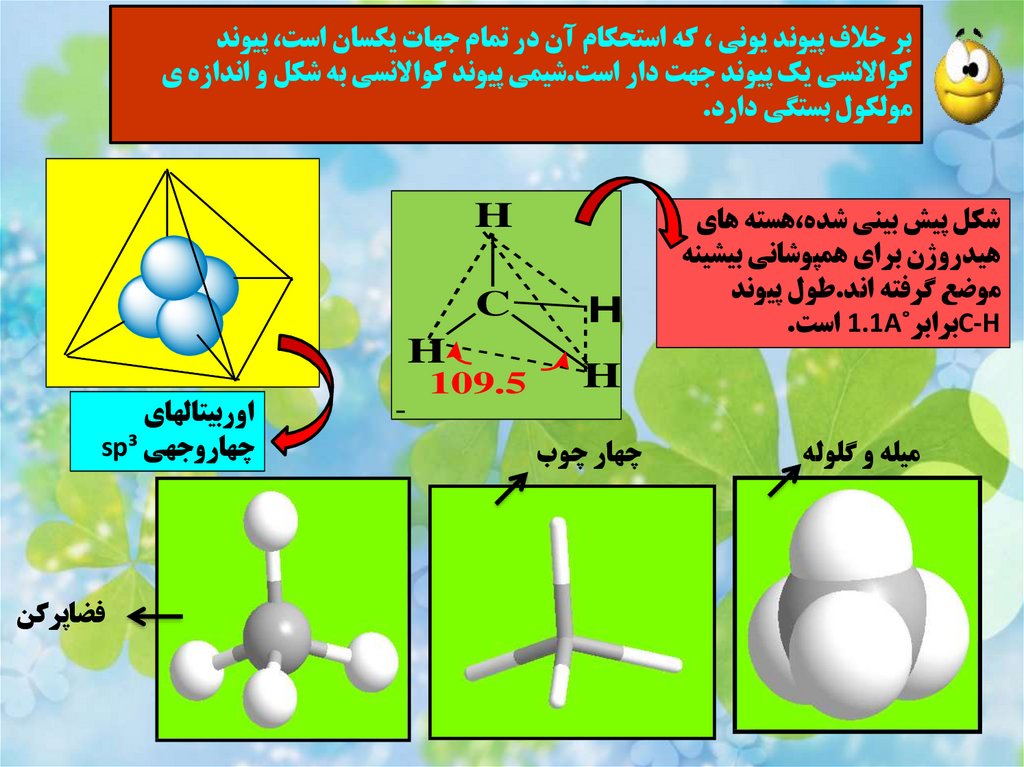
35.
بر خالف پيوند يوني ،که استحکام آن در تمام جهات يکسان است ،پيوندکواالنسي يک پيوند جهت دار است.شيمي پيوند کواالنسي به شکل و اندازه ي
مولکول بستگي دارد.
شکل پيش بيني شده،هسته هاي
هيدروژن براي همپوشاني بيشينه
موضع گرفته اند.طول پيوند
C-Hبرابر˚ 1.1Aاست.
H
H
H
ميله و گلوله
چهار چوب
C
H
109.5
اوربيتالهاي
چهاروجهي sp³
فضاپرکن
36.
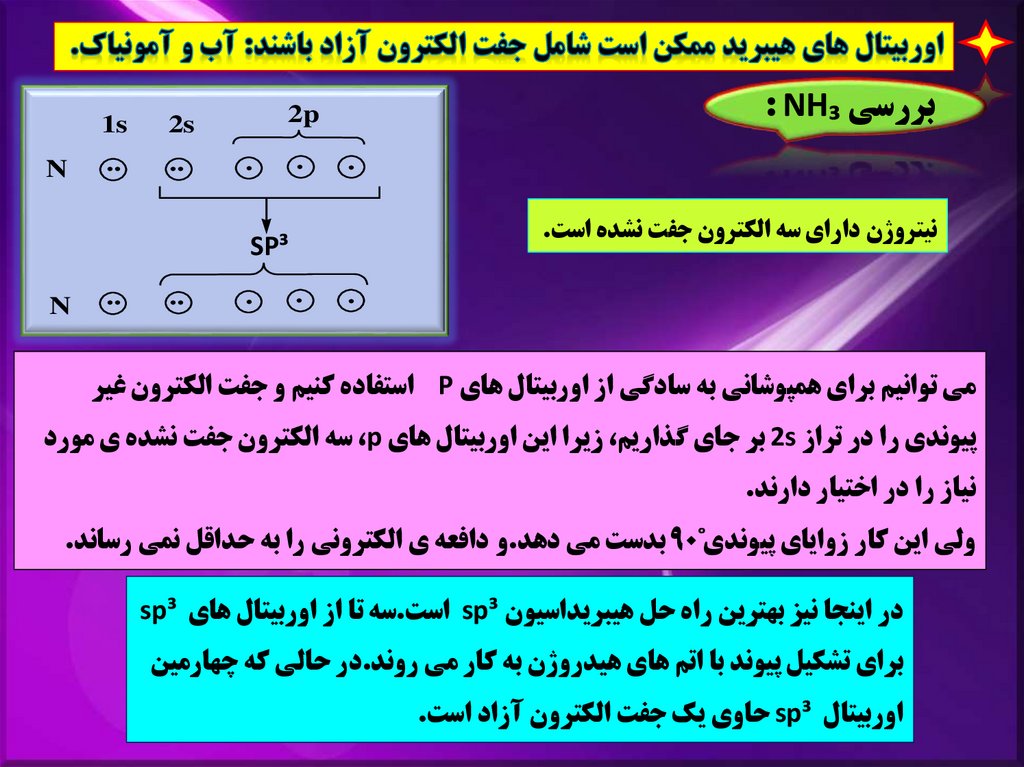
بررسي : NH₃2p
.
.
نيتروژن داراي سه الکترون جفت نشده است.
.
2s
1s
..
..
N
SP³
.
.
.
..
..
N
مي توانيم براي همپوشاني به سادگي از اوربيتال هاي Pاستفاده کنيم و جفت الکترون غير
پيوندي را در تراز 2sبر جاي گذاريم ،زيرا اين اوربيتال هاي ،pسه الکترون جفت نشده ي مورد
نياز را در اختيار دارند.
ولي اين کار زواياي پيوندي˚ 90بدست مي دهد.و دافعه ي الکتروني را به حداقل نمي رساند.
در اينجا نيز بهترين راه حل هيبريداسيون sp³است.سه تا از اوربيتال هاي sp³
براي تشکيل پيوند با اتم هاي هيدروژن به کار مي روند.در حالي که چهارمين
اوربيتال sp³حاوي يک جفت الکترون آزاد است.
37.
...
..
..
.
-
..
H
-
-
..
.+
..
H
-
sp³
sp³
2pᴢ
N .
..
+
+
H
sp³
sp³
2px
2s
2px
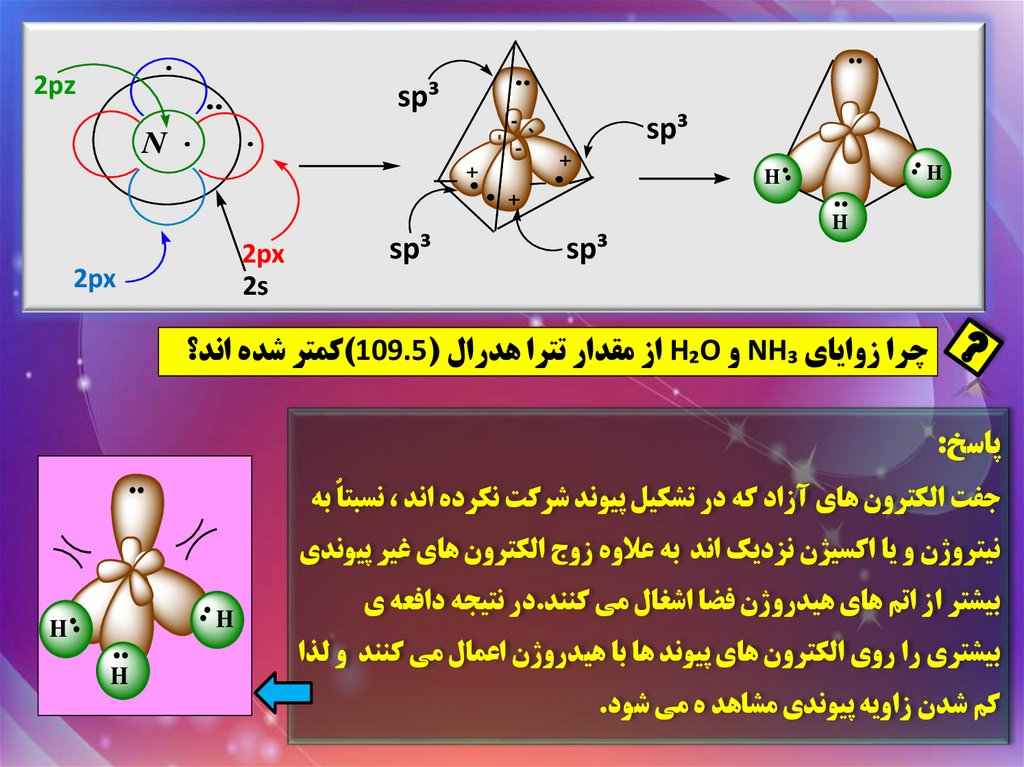
چرا زواياي NH₃و H₂Oاز مقدار تترا هدرال ()109.5کمتر شده اند؟
پاسخ:
..
جفت الکترون هاي آزاد که در تشکيل پيوند شرکت نکرده اند ،نسبتاٌ به
بيشتري را روي الکترون هاي پيوند ها با هيدروژن اعمال مي کنند و لذا
کم شدن زاويه پيوندي مشاهد ه مي شود.
..
بيشتر از اتم هاي هيدروژن فضا اشغال مي کنند.در نتيجه دافعه ي
H
..
H
..
نيتروژن و يا اکسيژن نزديک اند به عالوه زوج الکترون هاي غير پيوندي
H
38.
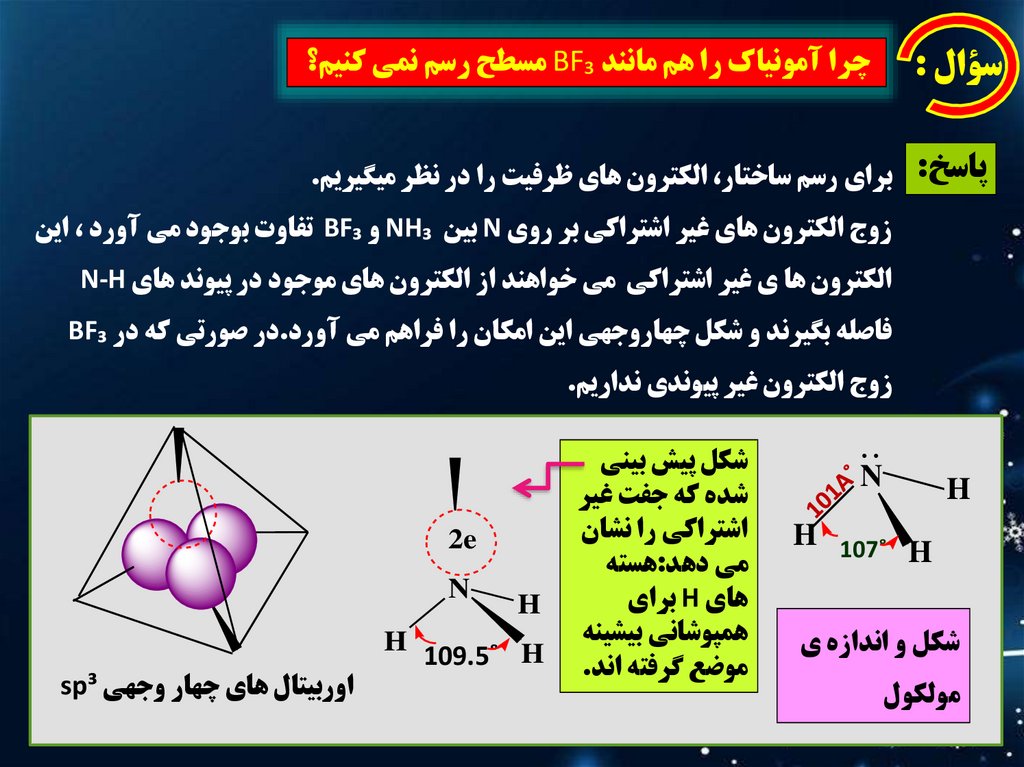
چرا آمونياک را هم مانند BF₃مسطح رسم نمي کنيم؟سؤال :
پاسخ :براي رسم ساختار ،الکترون هاي ظرفيت را در نظر ميگيريم.
زوج الکترون هاي غير اشتراکي بر روي Nبين NH₃و BF₃تفاوت بوجود مي آورد ،اين
الکترون ها ي غير اشتراکي مي خواهند از الکترون هاي موجود در پيوند هاي N-H
فاصله بگيرند و شکل چهاروجهي اين امکان را فراهم مي آورد.در صورتي که در BF₃
زوج الکترون غير پيوندي نداريم.
N
H
˚H 107
H
شکل و اندازه ي
مولکول
شکل پيش بيني
شده که جفت غير
اشتراکي را نشان
مي دهد:هسته
هاي Hبراي
همپوشاني بيشينه
موضع گرفته اند.
2e
H
N
109.5˚ H
H
اوربيتال هاي چهار وجهي sp³
39.
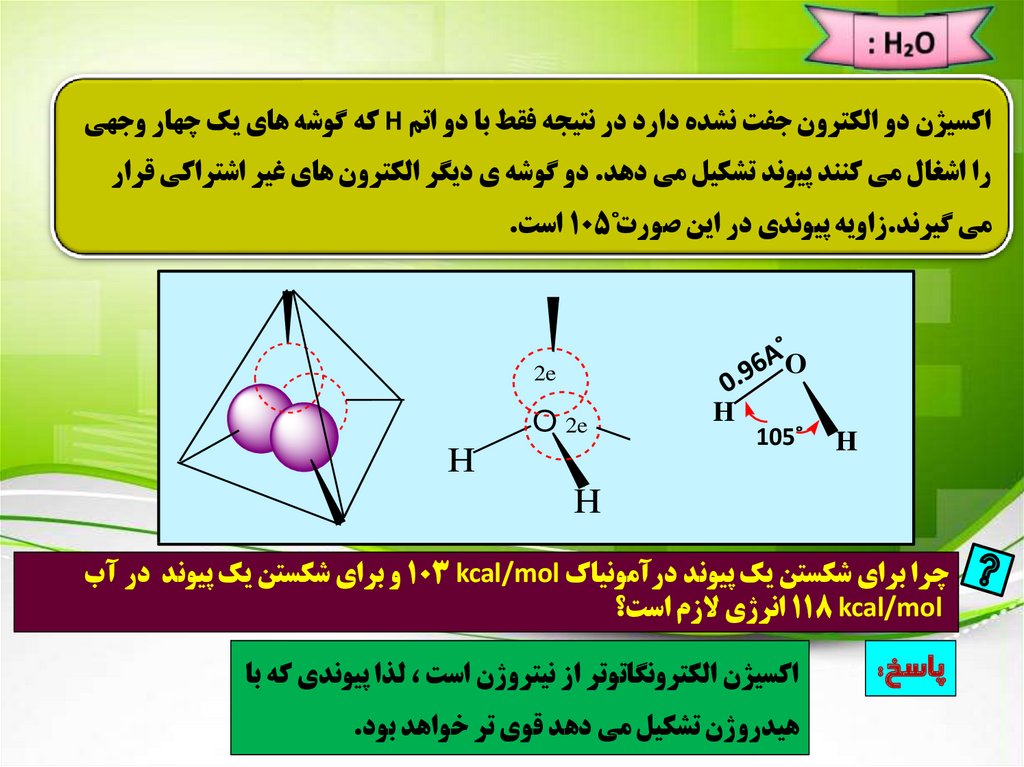
اکسيژن دو الکترون جفت نشده دارد در نتيجه فقط با دو اتم Hکه گوشه هاي يک چهار وجهيرا اشغال مي کنند پيوند تشکيل مي دهد .دو گوشه ي ديگر الکترون هاي غير اشتراکي قرار
مي گيرند.زاويه پيوندي در اين صورت˚ 105است.
O
H
˚105
2e
H
O 2e
H
H
چرا براي شکستن يک پيوند درآمونياک 103 kcal/molو براي شکستن يک پيوند در آب
118 kcal/molانرژي الزم است؟
پاسخ:
اکسيژن الکترونگاتوتر از نيتروژن است ،لذا پيوندي که با
هيدروژن تشکيل مي دهد قوي تر خواهد بود.
40.
Hخصلت بازي آب کمتر از آمونياک است.
H
H
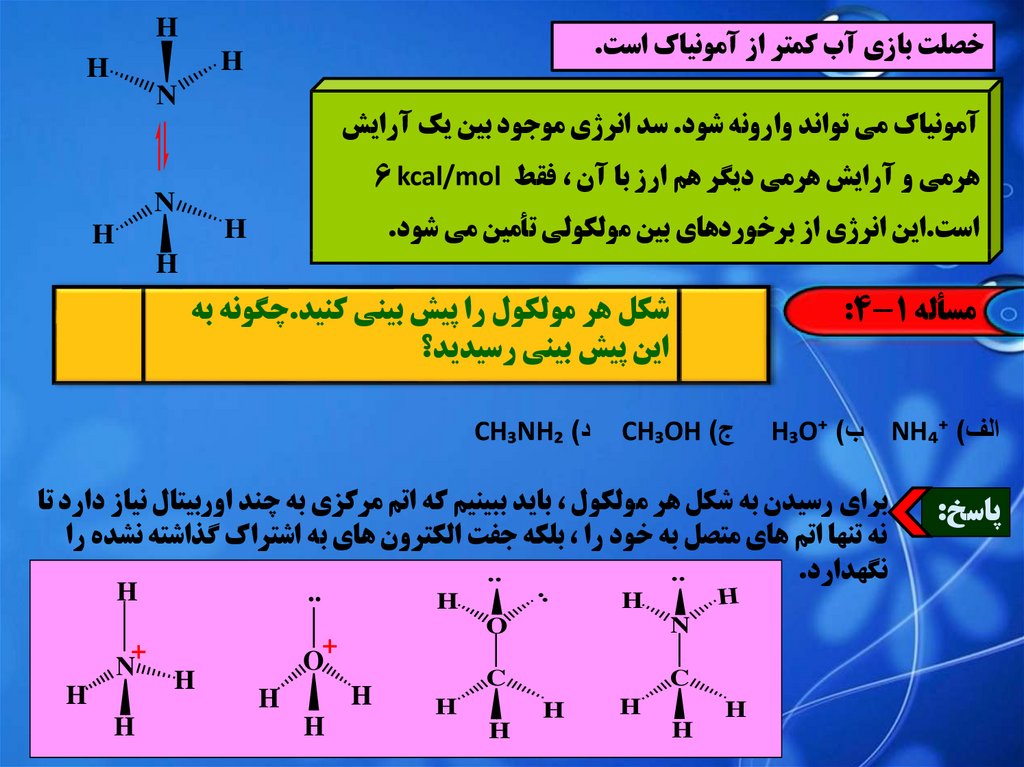
N
آمونياک مي تواند وارونه شود .سد انرژي موجود بين يک آرايش
هرمي و آرايش هرمي ديگر هم ارز با آن ،فقط 6 kcal/mol
N
است.اين انرژي از برخوردهاي بين مولکولي تأمين مي شود.
H
H
H
شکل هر مولکول را پيش بيني کنيد.چگونه به
اين پيش بيني رسيديد؟
مسأله :4-1
الف) NH₄⁺ب) H₃O⁺
براي رسيدن به شکل هر مولکول ،بايد ببينيم که اتم مرکزي به چند اوربيتال نياز دارد تا
نه تنها اتم هاي متصل به خود را ،بلکه جفت الکترون هاي به اشتراک گذاشته نشده را
نگهدارد.
..
..
H
..
H
H
H
..
پاسخ:
ج) CH₃OH
د) CH₃NH₂
N
O
C
C
H
H
H
+
O
H
H
H
H
H
H
H
+
N
H
H
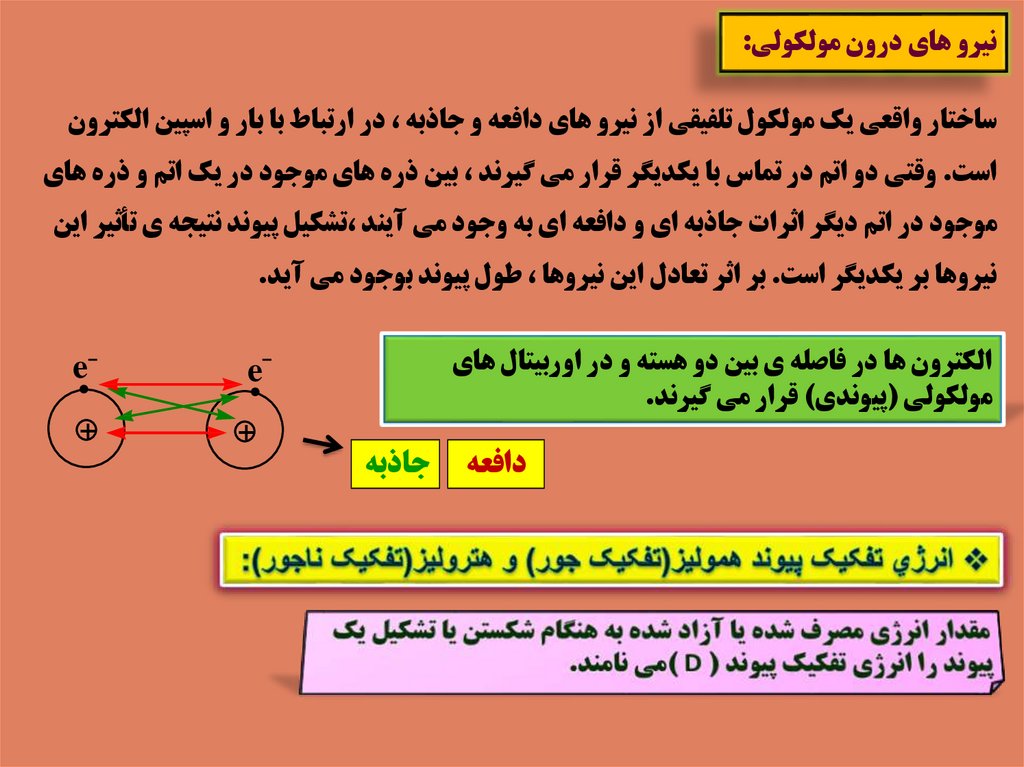
41. نيرو هاي درون مولکولي:
نيرو هاي درون مولکولي:ساختار واقعي يک مولکول تلفيقي از نيرو هاي دافعه و جاذبه ،در ارتباط با بار و اسپين الکترون
است .وقتي دو اتم در تماس با يکديگر قرار مي گيرند ،بين ذره هاي موجود در يک اتم و ذره هاي
موجود در اتم ديگر اثرات جاذبه اي و دافعه اي به وجود مي آيند ،تشکيل پيوند نتيجه ي تأثير اين
نيروها بر يکديگر است .بر اثر تعادل اين نيروها ،طول پيوند بوجود مي آيد.
الکترون ها در فاصله ي بين دو هسته و در اوربيتال هاي
مولکولي (پيوندي) قرار مي گيرند.
دافعه
جاذبه
e.
e.
+
+
42.
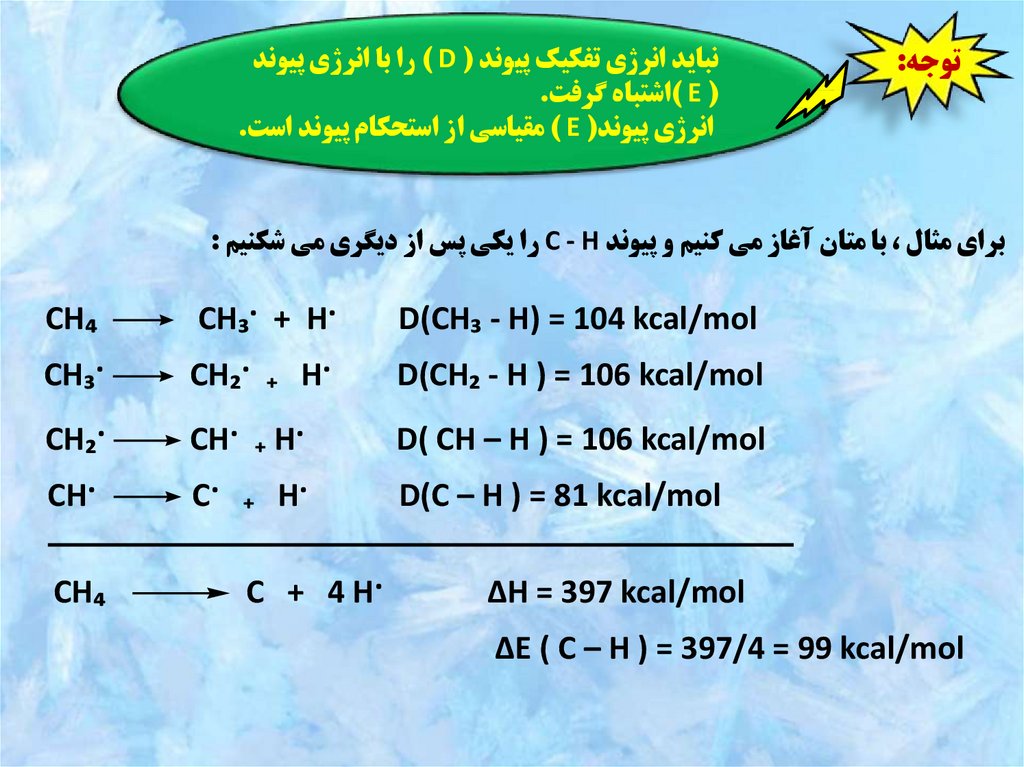
توجه:نبايد انرژي تفکيک پيوند ( ) Dرا با انرژي پيوند
( ) Eاشتباه گرفت.
انرژي پيوند( ) Eمقياسي از استحکام پيوند است.
براي مثال ،با متان آغاز مي کنيم و پيوند C - Hرا يکي پس از ديگري مي شکنيم :
D(CH₃ - H) = 104 kcal/mol
·CH₃· + H
CH₄
D(CH₂ - H ) = 106 kcal/mol
·CH₂· ₊ H
·CH₃
D( CH – H ) = 106 kcal/mol
·CH· ₊ H
·CH₂
D(C – H ) = 81 kcal/mol
·C· ₊ H
·CH
ΔH = 397 kcal/mol
ΔE ( C – H ) = 397/4 = 99 kcal/mol
·C + 4 H
CH₄
43.
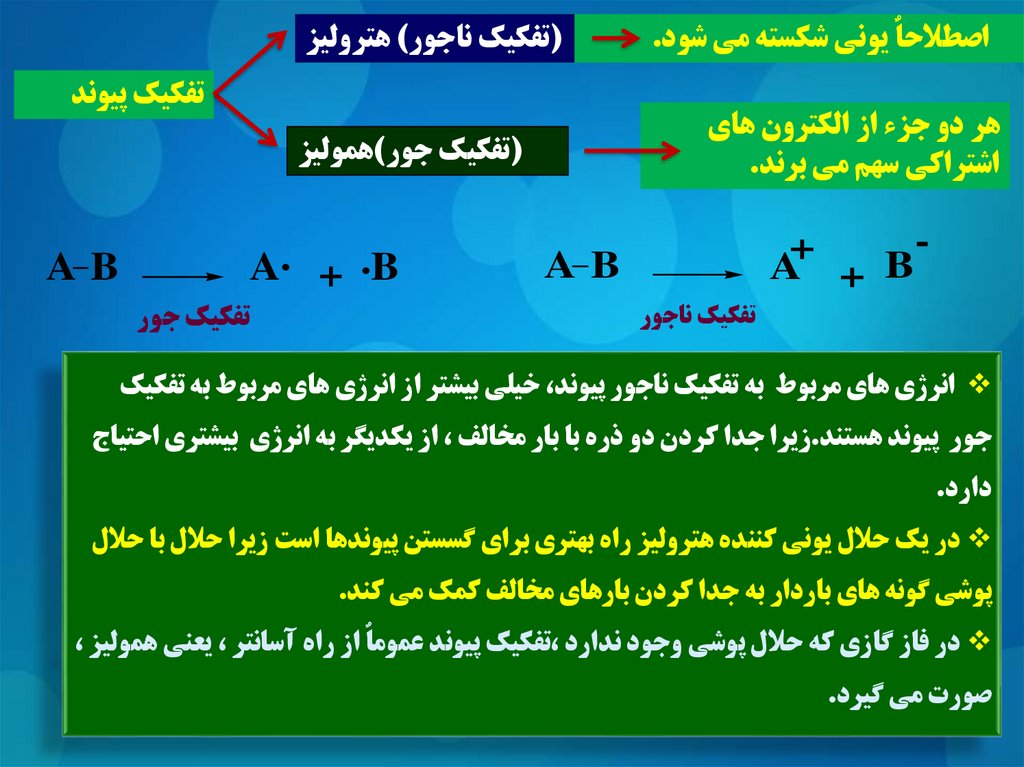
اصطالحاٌ يوني شکسته مي شود.(تفکيک ناجور) هتروليز
تفکيک پيوند
هر دو جزء از الکترون هاي
اشتراکي سهم مي برند.
+
A + B
(تفکيک جور)هموليز
AB
A. + .B
تفکيک ناجور
AB
تفکيک جور
انرژي هاي مربوط به تفکيک ناجور پيوند ،خيلي بيشتر از انرژي هاي مربوط به تفکيک
جور پيوند هستند.زيرا جدا کردن دو ذره با بار مخالف ،از يکديگر به انرژي بيشتري احتياج
دارد.
در يک حالل يوني کننده هتروليز راه بهتري براي گسستن پيوندها است زيرا حالل با حالل
پوشي گونه هاي باردار به جدا کردن بارهاي مخالف کمک مي کند.
در فاز گازي که حالل پوشي وجود ندارد ،تفکيک پيوند عموماٌ از راه آسانتر ،يعني هموليز ،
صورت مي گيرد.
44.
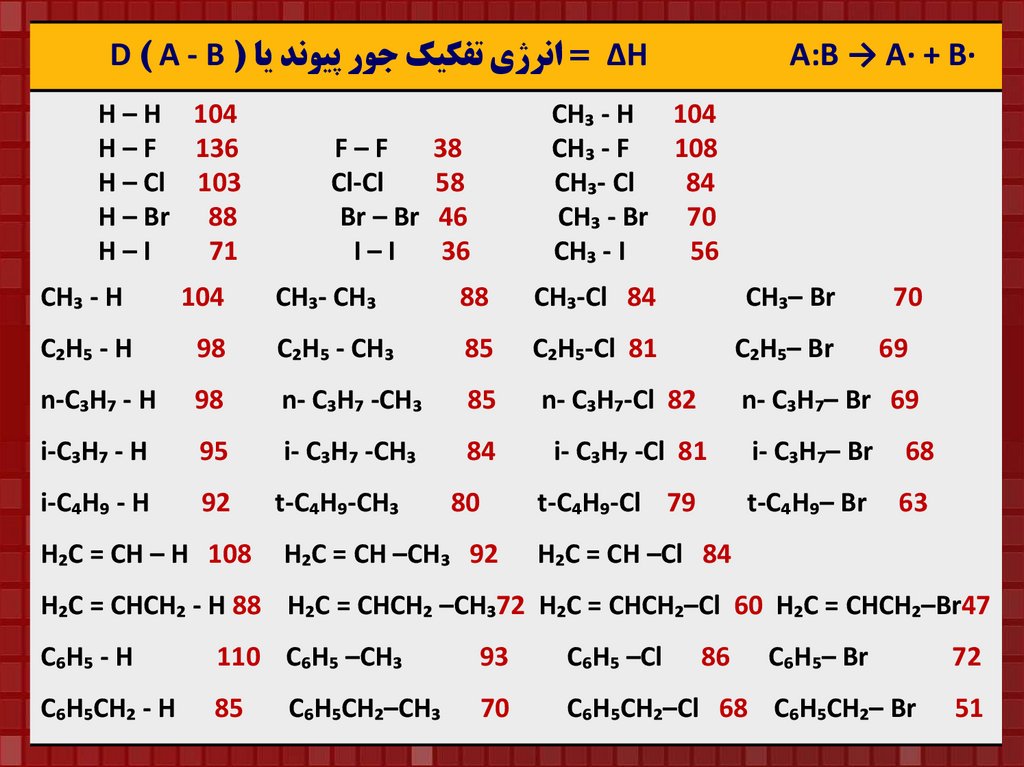
D ) A - B ( ∆ = انرژي تفکيک جور پيوند ياHH – H 104
H – F 136
H – Cl 103
H – Br 88
H–I
71
CH₃ - H
104
F–F
Cl-Cl
Br – Br
I–I
CH₃ - H 104
CH₃ - F
108
CH₃- Cl
84
CH₃ - Br 70
CH₃ - I
56
38
58
46
36
CH₃- CH₃
88
CH₃-Cl 84
CH₃– Br
C₂H₅-Cl 81
C₂H₅– Br
C₂H₅ - H
98
C₂H₅ - CH₃
85
n-C₃H₇ - H
98
n- C₃H₇ -CH₃
85
i-C₃H₇ - H
95
i- C₃H₇ -CH₃
84
i-C₄H₉ - H
92
H₂C = CH – H 108
A:B → A∙ + B∙
t-C₄H₉-CH₃
80
n- C₃H₇-Cl 82
69
n- C₃H₇– Br 69
i- C₃H₇ -Cl 81
t-C₄H₉-Cl 79
H₂C = CH –CH₃ 92
70
i- C₃H₇– Br
68
t-C₄H₉– Br
63
H₂C = CH –Cl 84
H₂C = CHCH₂ - H 88 H₂C = CHCH₂ –CH₃72 H₂C = CHCH₂–Cl 60 H₂C = CHCH₂–Br47
C₆H₅ - H
110 C₆H₅ –CH₃
93
C₆H₅ –Cl
C₆H₅CH₂ - H
85
70
C₆H₅CH₂–Cl 68 C₆H₅CH₂– Br
C₆H₅CH₂–CH₃
86
C₆H₅– Br
72
51
45.
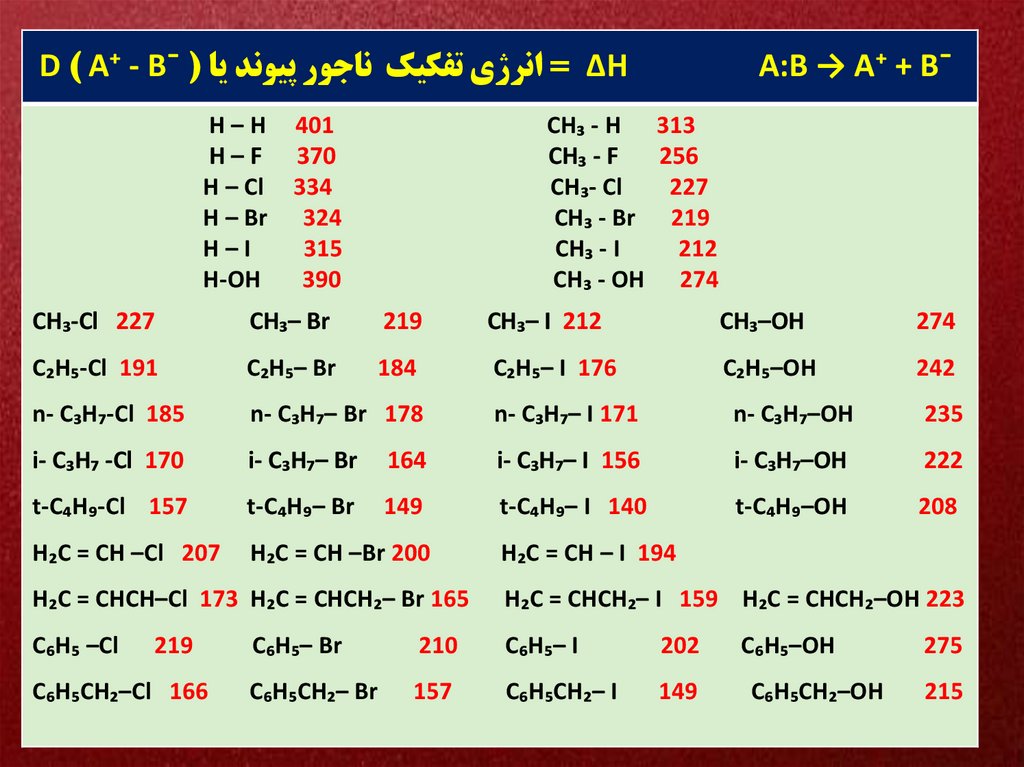
D ) A⁺ - B¯ ( ∆ = انرژي تفکيک ناجور پيوند ياHH–H
H–F
H – Cl
H – Br
H–I
H-OH
401
370
334
324
315
390
A:B → A⁺ + B¯
CH₃ - H 313
CH₃ - F
256
CH₃- Cl
227
CH₃ - Br 219
CH₃ - I
212
CH₃ - OH 274
CH₃-Cl 227
CH₃– Br
219
CH₃– I 212
CH₃–OH
274
C₂H₅-Cl 191
C₂H₅– Br
184
C₂H₅– I 176
C₂H₅–OH
242
n- C₃H₇-Cl 185
n- C₃H₇– Br 178
n- C₃H₇– I 171
n- C₃H₇–OH
235
i- C₃H₇ -Cl 170
i- C₃H₇– Br
164
i- C₃H₇– I 156
i- C₃H₇–OH
222
t-C₄H₉-Cl 157
t-C₄H₉– Br
149
t-C₄H₉– I 140
t-C₄H₉–OH
208
H₂C = CH –Cl 207
H₂C = CH –Br 200
H₂C = CH – I 194
H₂C = CHCH–Cl 173 H₂C = CHCH₂– Br 165
H₂C = CHCH₂– I 159 H₂C = CHCH₂–OH 223
C₆H₅ –Cl
219
C₆H₅CH₂–Cl 166
C₆H₅– Br
210
C₆H₅– I
202
C₆H₅CH₂– Br
157
C₆H₅CH₂– I
149
C₆H₅–OH
C₆H₅CH₂–OH
275
215
46.
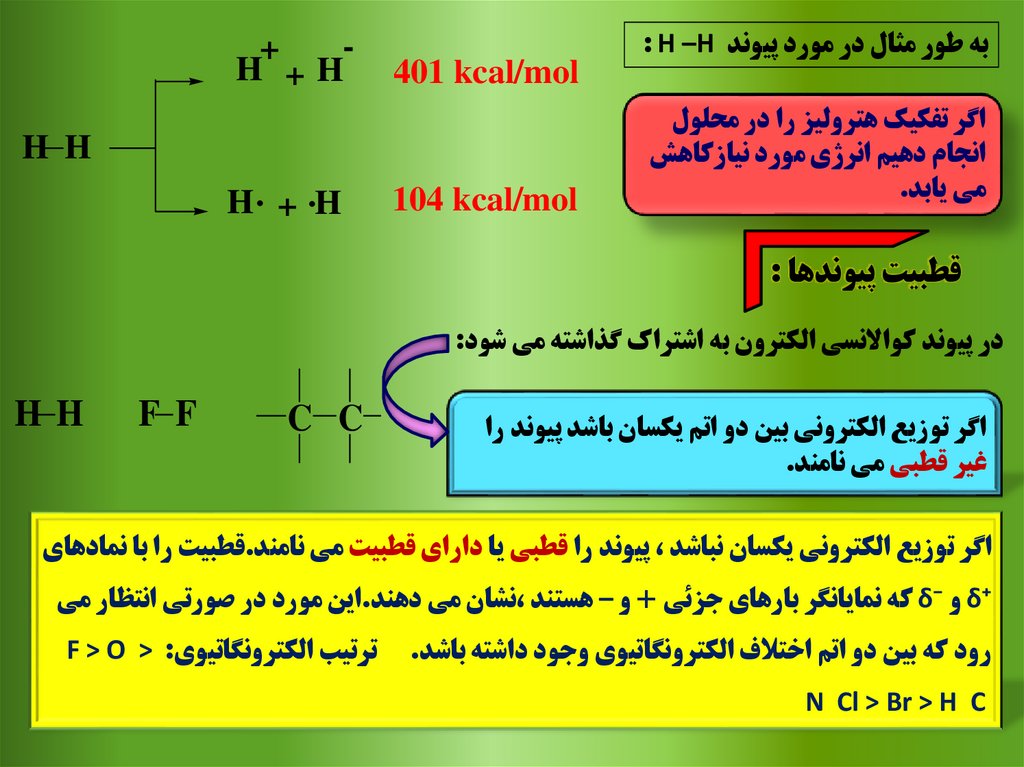
به طور مثال در مورد پيوند : H –Hاگر تفکيک هتروليز را در محلول
انجام دهيم انرژي مورد نيازکاهش
مي يابد.
401 kcal/mol
+
H +H
H H
104 kcal/mol
H . + .H
قطبيت پيوندها :
در پيوند کواالنسي الکترون به اشتراک گذاشته مي شود:
اگر توزيع الکتروني بين دو اتم يکسان باشد پيوند را
غير قطبي مي نامند.
C C
F F
HH
اگر توزيع الکتروني يکسان نباشد ،پيوند را قطبي يا داراي قطبيت مي نامند.قطبيت را با نمادهاي
δ⁺و δ⁻که نمايانگر بارهاي جزئي +و – هستند ،نشان مي دهند.اين مورد در صورتي انتظار مي
رود که بين دو اتم اختالف الکترونگاتيوي وجود داشته باشد.
N Cl > Br > H C
ترتيب الکترونگاتيويF > O > :
47.
نمونه مثال از مولکول هاي قطبي :
N
H H
H
H
O
H
H F
خواص شيميايي و فيزيکي با قطبيت پيوندها رابطه اي تنگاتنگ دارند .قطبيت پيوندها مي توانند :
-1موجب قطبيت مولکول ها شود.
-2بردماي ذوب و دماي جوش و انحالل پذيري تأثير مي گذارد.
-3نوع واکنشي را که بر روي اين پيوند انجام مي شود را تعيين مي کند.
-4بر واکنش پذيري پيوندهاي مجاور تأثير مي گذارد.
قطبيت مولکول:
اگر در يک مولکول ،مرکز بار منفي بر مرکز بار مثبت منطبق نشود ،آن مولکول قطبي
) استفاده مي
است.براي نمايش جهت قطبيت پيوند ،معموالٌ از يک پيکان چليپايي (
شود.الکترون ها در جهت پيکان جابه جا مي شوند.دم پيکان (که به نشانه ي مثبت شباهت دارد)
کم الکترون ( ) δ⁺و سر پيکان پر الکترون( ) δ⁻است.
48.
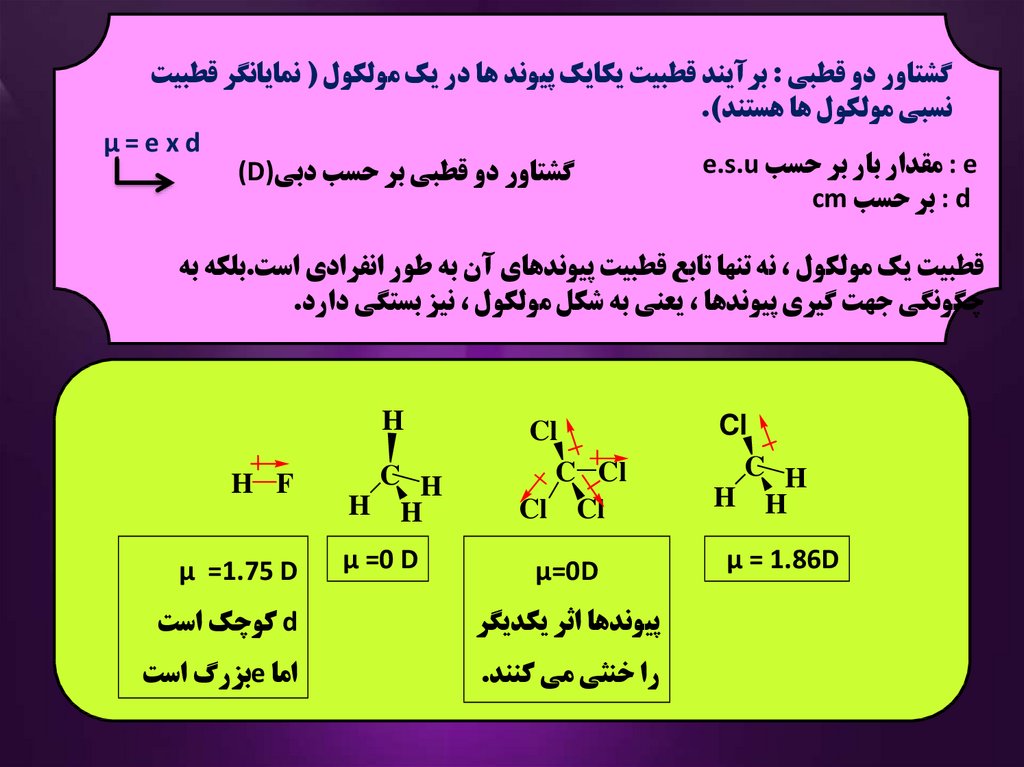
گشتاور دو قطبي :برآيند قطبيت يکايک پيوند ها در يک مولکول ( نمايانگر قطبيتنسبي مولکول ها هستند).
μ=exd
: eمقدار بار بر حسب e.s.u
گشتاور دو قطبي بر حسب دبي)(D
: dبر حسب cm
قطبيت يک مولکول ،نه تنها تابع قطبيت پيوندهاي آن به طور انفرادي است.بلکه به
چگونگي جهت گيري پيوندها ،يعني به شکل مولکول ،نيز بستگي دارد.
Cl
C H
H H
μ = 1.86D
Cl
C Cl
Cl Cl
μ=0D
H
C H
H H
μ =0 D
H F
μ =1.75 D
پيوندها اثر يکديگر
dکوچک است
را خنثي مي کنند.
اما eبزرگ است
49.
کدام مولکول قطبي تر است ؟N
FF F
پاسخ :
N
H
H
H
جفت الکترون هاي غير اشتراکي ،واقع بر روي اتم نيتروژن که دور از هسته ي داراي بار مثبت
قرار گرفته اند ،سهم زيادي در جدايي بار و پيدايش گشتاور دو قطبي دارند.
فلوئور ،الکترونگاتيوترين عنصر است و مطمئناٌ الکترون ها را با شدت از سمت نيتروژن به سوي
خود جلب مي کند.
پيوندهاي N - Fبايد خيلي قطبي باشند ،و جمع برداري آنها نيز بايد خيلي بزرگ باشد.
پيوندهاي N –Hقطبيت متوسطي دارند ،و جمع برداري آنها بايد کوچکتر باشد .جفت الکترونهاي
غير اشتراکي يک گشتاور دوقطبي به سمت باال اعمال مي کنند.برآيند گشتاور يکايک پيوندها با
هم قطبيت مولکول را نشان مي دهد.
در مورد آمونياک گشتاور مشاهده شده ،بيشتر از جفت الکترون ..
N
غيراشتراکي ناشي مي شود ،که با اضافه شدن مجموع
F
FF
گشتاورهاي پيوندي افزايش يافته است.
..
N
H
H
H
50.
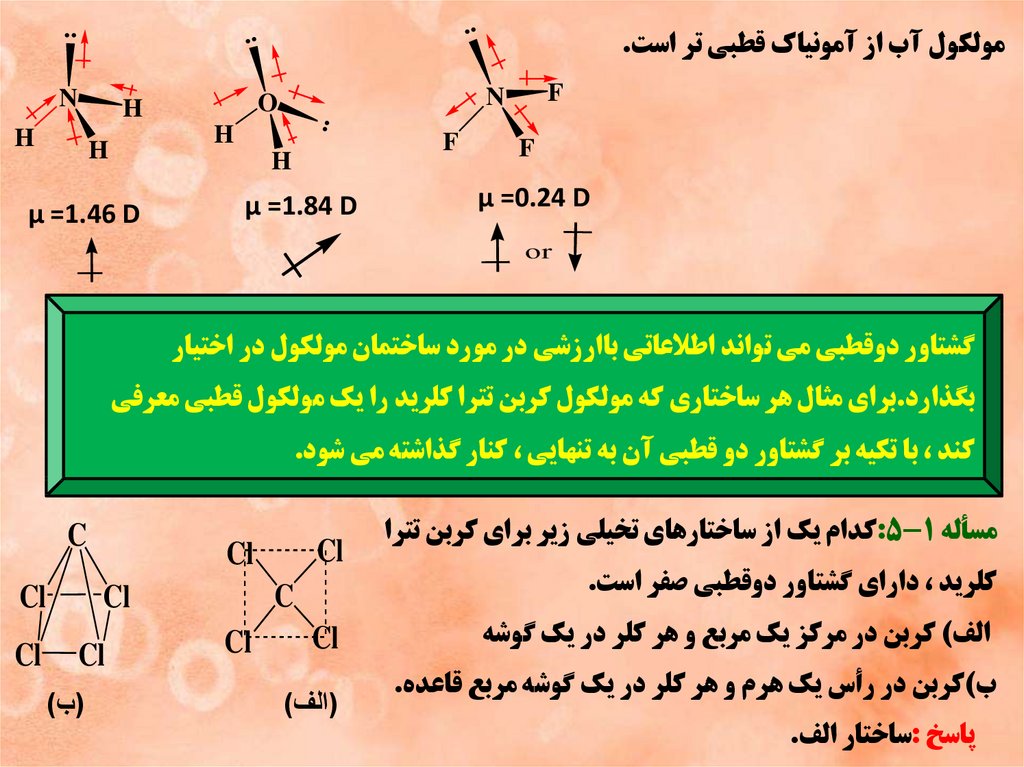
..مولکول آب از آمونياک قطبي تر است.
F
..
N
O
H
F
μ =0.24 D
N
H
..
F
..
H
H
μ =1.84 D
H
μ =1.46 D
or
گشتاور دوقطبي مي تواند اطالعاتي باارزشي در مورد ساختمان مولکول در اختيار
بگذارد.براي مثال هر ساختاري که مولکول کربن تترا کلريد را يک مولکول قطبي معرفي
کند ،با تکيه بر گشتاور دو قطبي آن به تنهايي ،کنار گذاشته مي شود.
مسأله :5-1کدام يک از ساختارهاي تخيلي زير براي کربن تترا
Cl
کلريد ،داراي گشتاور دوقطبي صفر است.
Cl
C
الف) کربن در مرکز يک مربع و هر کلر در يک گوشه
Cl
ب)کربن در رأس يک هرم و هر کلر در يک گوشه مربع قاعده.
(الف)
پاسخ :ساختار الف.
C
Cl
Cl
Cl
Cl
(ب)
Cl
51.
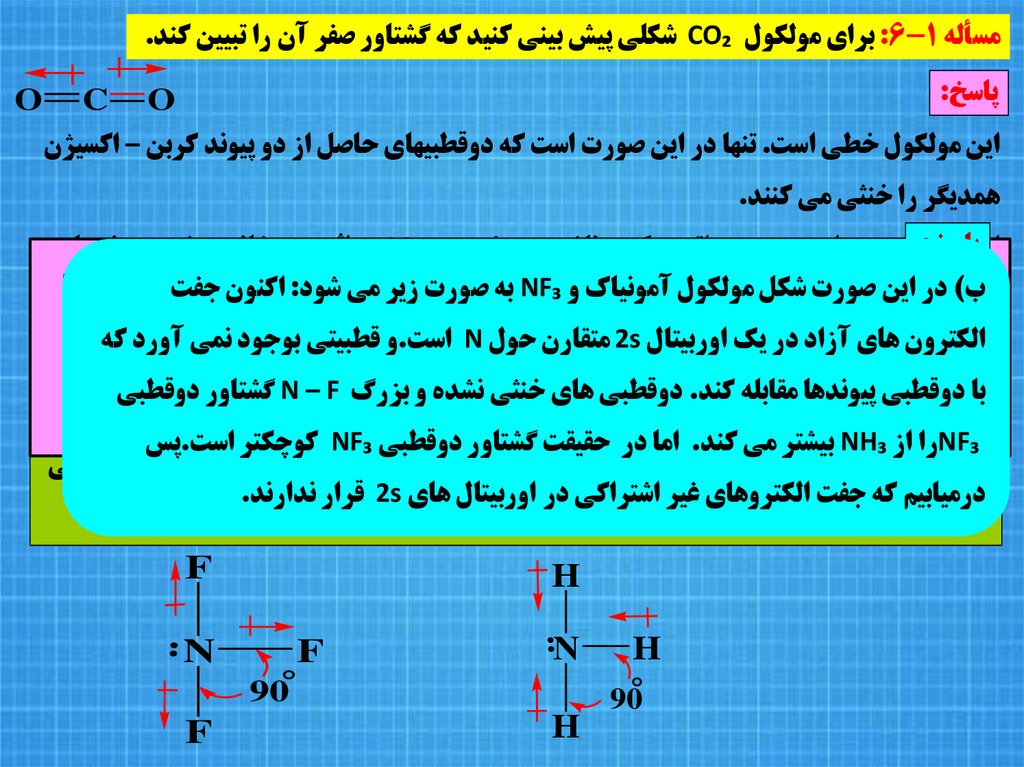
مسأله :6-1براي مولکول CO₂شکلي پيش بيني کنيد که گشتاور صفر آن را تبيين کند.پاسخ:
O
C
اين مولکول خطي است .تنها در اين صورت است که دوقطبيهاي حاصل از دو پيوند کربن – اکسيژن
همديگر را خنثي مي کنند.
اينپاسخ:
خطي بودن از هيبريد spاتم مرکزي ناشي مي شود.در CO₂بر اثر همپوشاني بيشتر ،پيوندهاي
نيتروژن sp²باشد
هيبريدي
صورتاگر
صفر باشد.
دوقطبي
گشتاور
مي رود
انتظار
ب) در اينالف)
اکنون جفت
حالتشود:
زير مي
NF₃به
آمونياک و
مولکول
شکل
صورت
دوگانه تشکيل مي شود.
مولکول مسطح و متقارن خواهد بود.و دوقطبي هاي سه پيوند همديگر را خنثي مي کنند.
الکترون هاي آزاد در يک اوربيتال 2sمتقارن حول Nاست.و قطبيتي بوجود نمي آورد که
مسأله :7-1اگر نيتروژن در آمونياک داراي هيبريد sp²مي بود انتظار چه گشتاوري را براي
در واقع آمونياک داراي μ =1.46 Dاست بنابراين نمي تواند مسطح باشد
با دوقطبي پيوندها مقابله کند .دوقطبي هاي خنثي نشده و بزرگ N – Fگشتاور دوقطبي
آمونياک داشتيد؟ و گشتاور دوقطبي آمونياک چقدر است؟ ب) اگر نيتروژن براي تشکيل پيوند از
و هيبريد sp²داشته باشد.
NF₃را از NH₃بيشتر مي کند .اما در حقيقت گشتاور دوقطبي NF₃کوچکتر است.پس
اوربيتال هاي pاستفاده مي کرد گشتاورهاي آمونياک و نيتروژن تري فلوئوريد چگونه مقايسه مي
درميابيم که جفت الکتروهاي غير اشتراکي در اوربيتال هاي 2sقرار ندارند.
شدند؟
F
90°
..
H
N
F
90°
H
N
..
H
F
O
52.
ساختار و خواص فيزيکي :خواص فيزيکي يک ترکيب جديد اطالعاتي درباره ي ساختار آن بدست مي دهد.و ساختار يک
ترکيب هم از خواص فيزيکي آن اطالعاتي به ما مي دهد.براي مثال در خالص سازي و
جداسازي فرآورده ها ،خواص فيزيکي اهميت پيدا مي کند .جداسازي فرآورده ها از راه
تقطير ،به دماي جوش ترکيب مورد نظر و دماي جوش ناخالصي هاي موجود در آن بستگي
دارد .جداسازي از راه تبلور به انحالل پذيري فرآورده وناخالصي هاي همراه با آن در حالل
هاي موجود در آن بستگي دارد.
خواص فيزيکي يک ترکيب بيشتر وابسته به پيوندهايي است که اتم هاي ترکيب را در
مولکول به هم متصل نگه مي دارد.
ذوب عبارت است از تبديل آرايش بسيار منظم ذرات ،در شبکه بلور ،به آرايشي
تصادفي تر ،که از ويژگي هاي يک مايع است .به عبارتي صرف انرژي براي غلبه بر
پيوندهاي ( درون بلوري ) است.
53.
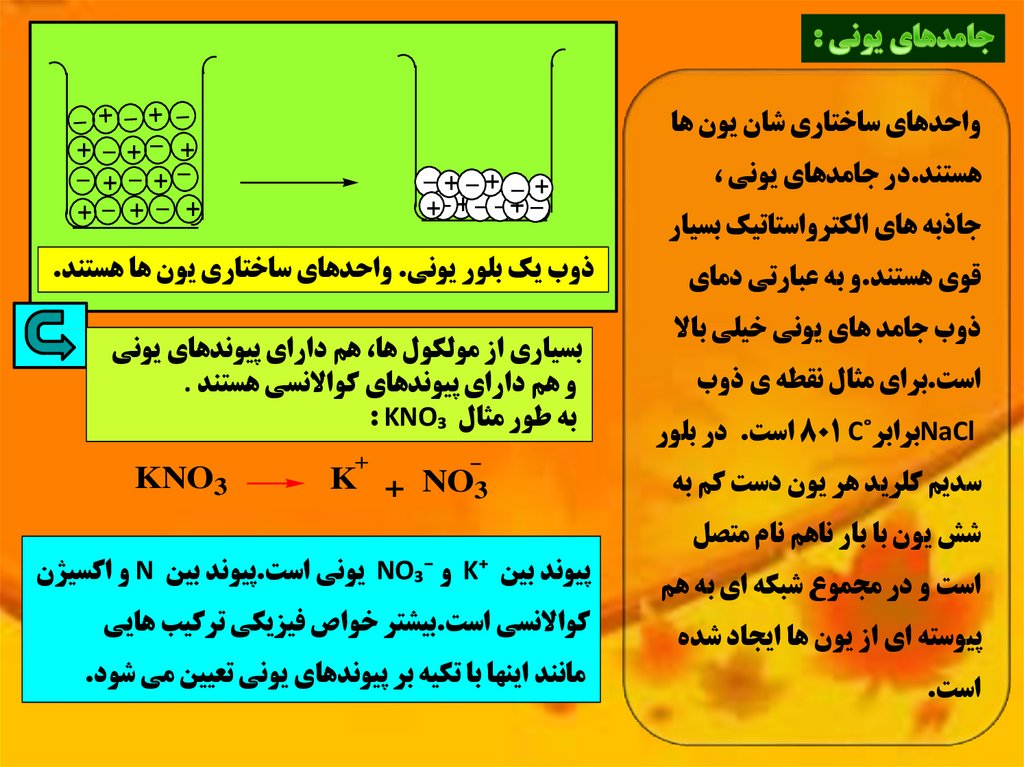
_ _ + _ +واحدهاي ساختاري شان يون ها
هستند.در جامدهاي يوني ،
جاذبه هاي الکترواستاتيک بسيار
قوي هستند.و به عبارتي دماي
ذوب جامد هاي يوني خيلي باال
است.براي مثال نقطه ي ذوب
NaClبرابر˚ 801 Cاست .در بلور
سديم کلريد هر يون دست کم به
شش يون با بار ناهم نام متصل
است و در مجموع شبکه اي به هم
پيوسته اي از يون ها ايجاد شده
است.
_ _+_+
+
_
_
_
_
+
+
+
_
+ _ + +
__ + _ +
+_ + _ +
ذوب يک بلور يوني .واحدهاي ساختاري يون ها هستند.
بسياري از مولکول ها ،هم داراي پيوندهاي يوني
و هم داراي پيوندهاي کواالنسي هستند .
به طور مثال : KNO₃
K + NO3
KNO3
پيوند بين K⁺و NO₃⁻يوني است.پيوند بين Nو اکسيژن
کواالنسي است.بيشتر خواص فيزيکي ترکيب هايي
مانند اينها با تکيه بر پيوندهاي يوني تعيين مي شود.
54.
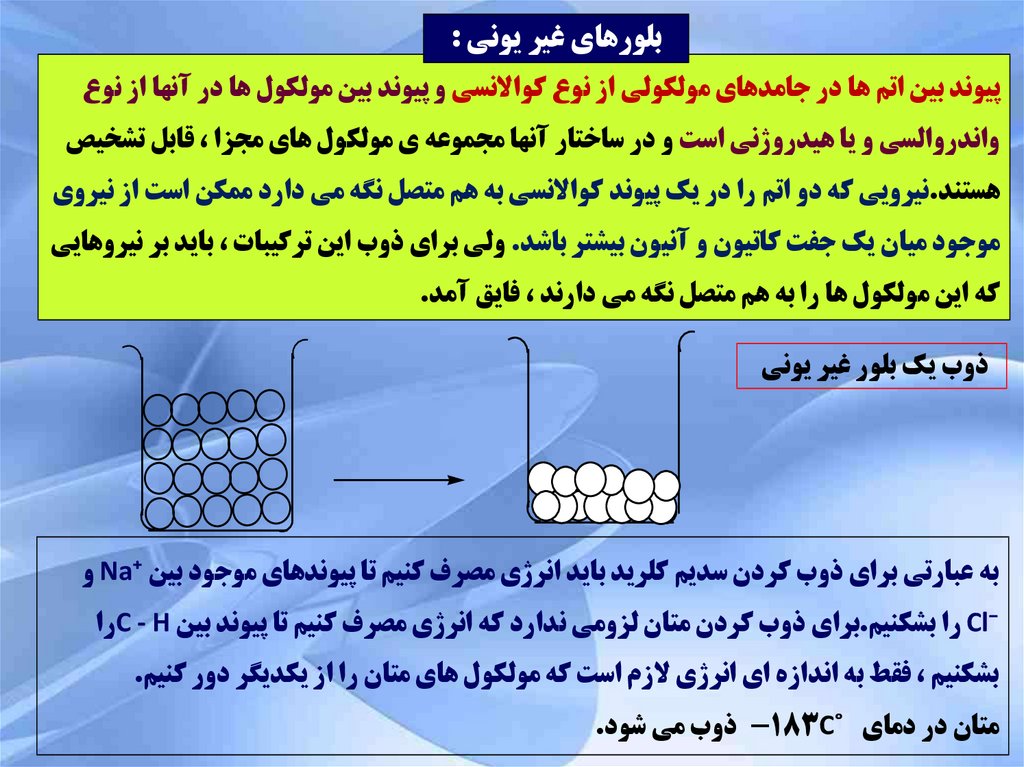
بلورهاي غير يوني :پيوند بين اتم ها در جامدهاي مولکولي از نوع کواالنسي و پيوند بين مولکول ها در آنها از نوع
واندروالسي و يا هيدروژني است و در ساختار آنها مجموعه ي مولکول هاي مجزا ،قابل تشخيص
هستند.نيرويي که دو اتم را در يک پيوند کواالنسي به هم متصل نگه مي دارد ممکن است از نيروي
موجود ميان يک جفت کاتيون و آنيون بيشتر باشد .ولي براي ذوب اين ترکيبات ،بايد بر نيروهايي
که اين مولکول ها را به هم متصل نگه مي دارند ،فايق آمد.
ذوب يک بلور غير يوني
به عبارتي براي ذوب کردن سديم کلريد بايد انرژي مصرف کنيم تا پيوندهاي موجود بين Na⁺و
Cl⁻را بشکنيم.براي ذوب کردن متان لزومي ندارد که انرژي مصرف کنيم تا پيوند بين C - Hرا
بشکنيم ،فقط به اندازه اي انرژي الزم است که مولکول هاي متان را از يکديگر دور کنيم.
متان در دماي ˚ -183Cذوب مي شود.
55.
دو نوع نيروي بين مولکولي وجود دارد :برهم کنش هاي دوقطبي –دوقطبي :همان جاذبه
ي سر مثبت يک مولکول قطبي بر سر منفي يک
مولکول قطبي ديگر است.
H - Cl
H - Cl
نيروهاي واندروالسي :نيروهاي جاذبه ي
ضعيف ،بين مولکول هاي کواالنسي غير
پيوند هيدروژني :يک نوع جاذبه ي دوقطبي –
قطبي هستند و منشأ آنها جاذبه ي هسته ي
دوقطبي قوي است که در آن يک اتم هيدروژن به
اتم هاي يک مولکول بر الکترون هاي
عنوان پلي بين دو اتم الکترونگاتيو عمل مي کند.
ظرفيت مولکول هاي مجاور است .در اينجا
يکي را به وسيله پيوند کواالنسي و ديگري را به
گشتاور برآيند وجود ندارد .حرکت
وسيله ي نيروهاي الکترواستاتيک خالص نگه مي
الکترون ها و ايجاد دوقطبي لحظه اي ،
دارد.
نيروهاي الکترواستاتيک ،قدرت 5kcal/mol
مي تواند بر توزيع الکترون در مولکول
مجاورش تأثير گذارد.
I-I
H-F
I-I
H-F
پيوند کواالنسي ،قدرت 50 – 100 kcal/mol
56.
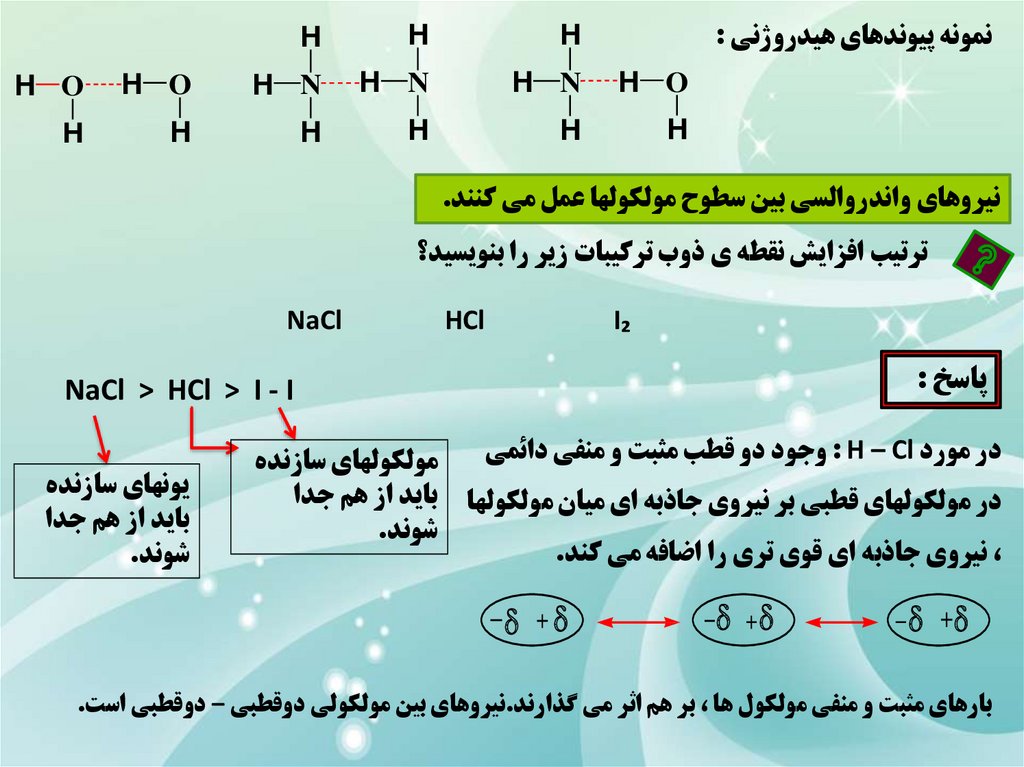
نمونه پيوندهاي هيدروژني :H
H
H
H O
H N
H N
H N
H O
H O
H
H
H
H
H
H
نيروهاي واندروالسي بين سطوح مولکولها عمل مي کنند.
ترتيب افزايش نقطه ي ذوب ترکيبات زير را بنويسيد؟
HCl
I₂
پاسخ :
NaCl > HCl > I - I
در مورد : H – Clوجود دو قطب مثبت و منفي دائمي
در مولکولهاي قطبي بر نيروي جاذبه اي ميان مولکولها
،نيروي جاذبه اي قوي تري را اضافه مي کند.
NaCl
مولکولهاي سازنده
بايد از هم جدا
شوند.
يونهاي سازنده
بايد از هم جدا
شوند.
بارهاي مثبت و منفي مولکول ها ،بر هم اثر مي گذارند.نيروهاي بين مولکولي دوقطبي – دوقطبي است.
57.
اين در حالي است که در مولکولهاي دو اتمي جور هسته مانند I₂که از مولکولهاي ناقطبي بهحساب مي آيد ،به همان نيروهاي ضعيف اوليه يعني نيروهاي واندروالس اکتفا مي کنند.
هر چه نيروهاي بين مولکولي قوي تر باشد نقطه ي ذوب بيشتر است.
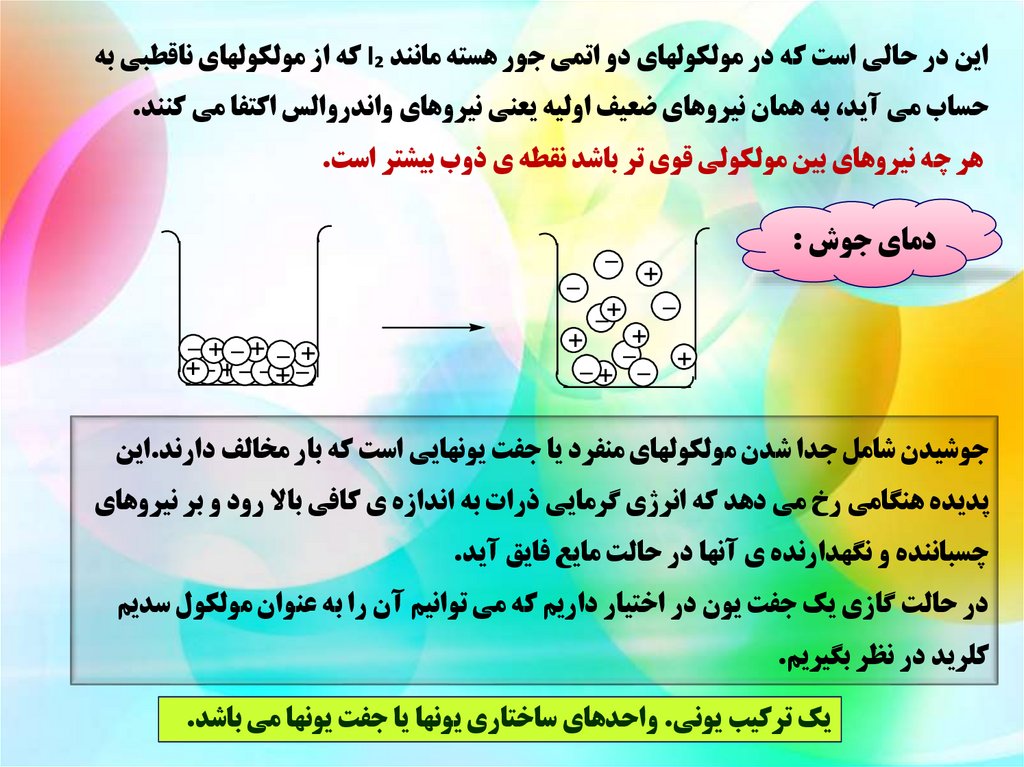
دماي جوش :
+
_
+
_
_
_+
+
_+
_ _+
_ _+_+
+
_ +_ + _ _ +
جوشيدن شامل جدا شدن مولکولهاي منفرد يا جفت يونهايي است که بار مخالف دارند.اين
پديده هنگامي رخ مي دهد که انرژي گرمايي ذرات به اندازه ي کافي باال رود و بر نيروهاي
چسباننده و نگهدارنده ي آنها در حالت مايع فايق آيد.
در حالت گازي يک جفت يون در اختيار داريم که مي توانيم آن را به عنوان مولکول سديم
کلريد در نظر بگيريم.
يک ترکيب يوني .واحدهاي ساختاري يونها يا جفت يونها مي باشد.
58.
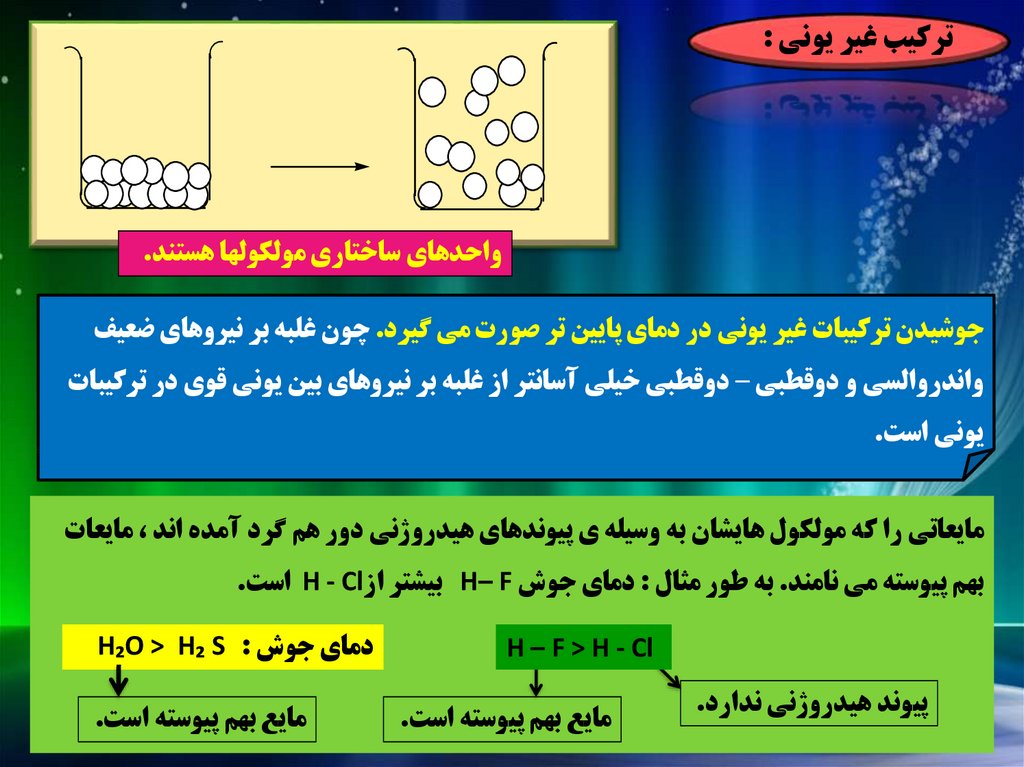
ترکيب غير يوني :واحدهاي ساختاري مولکولها هستند.
جوشيدن ترکيبات غير يوني در دماي پايين تر صورت مي گيرد .چون غلبه بر نيروهاي ضعيف
واندروالسي و دوقطبي – دوقطبي خيلي آسانتر از غلبه بر نيروهاي بين يوني قوي در ترکيبات
يوني است.
مايعاتي را که مولکول هايشان به وسيله ي پيوندهاي هيدروژني دور هم گرد آمده اند ،مايعات
بهم پيوسته مي نامند .به طور مثال :دماي جوش H– Fبيشتر از H - Clاست.
H – F > H - Cl
پيوند هيدروژني ندارد.
مايع بهم پيوسته است.
دماي جوش H₂O > H₂ S :
مايع بهم پيوسته است.
59.
هر چه نيروي بين مولکولي قوي تر باشد ،نقطه ي جوش بيشتر است.وجود پيوند هيدروژني باعث افزايش نقطه ي جوش مي شود.
هر چه سطح مولکول بيشتر باشد نقطه ي جوش بيشتر است.
هر چه انشعابات کمتر باشدو مولکول زنجيري تر باشد ،نقطه ي جوش بيشتر مي شود.
هر اندازه مولکول ها بزرگتر باشند ،نيروهاي واندروالسي قوي
دماي جوش H₂O >CH₃OH :
ترند .اگر عوامل ديگر – قطبيت وپيوند هيدروژني – را يکسان
فرض کنيم ،دماي جوش با افزايش اندازه ي مولکول باال مي رود.
گستره ي دماي جوش ترکيب هاي آلي از دماي جوش مولکول کوچک متان آغاز مي شود و افزايش ميابد.
ولي به ندرت با دماي جوش باالتر از˚ 350 Cبرخورد مي کنيم.در دماهاي باالتر ،پيوندهاي کواالنسي
موجود در درون مولکول ها آغاز به شکستن مي کنند و جوشيدن با تجزيه همراه مي شود .اگر دماي جوش
را پايين بياوريم تجزيه شدن کاهش ميابد .از اين رو تقطير ترکيب هاي آلي را اغلب در فشار کم انجام مي
دهند.
60.
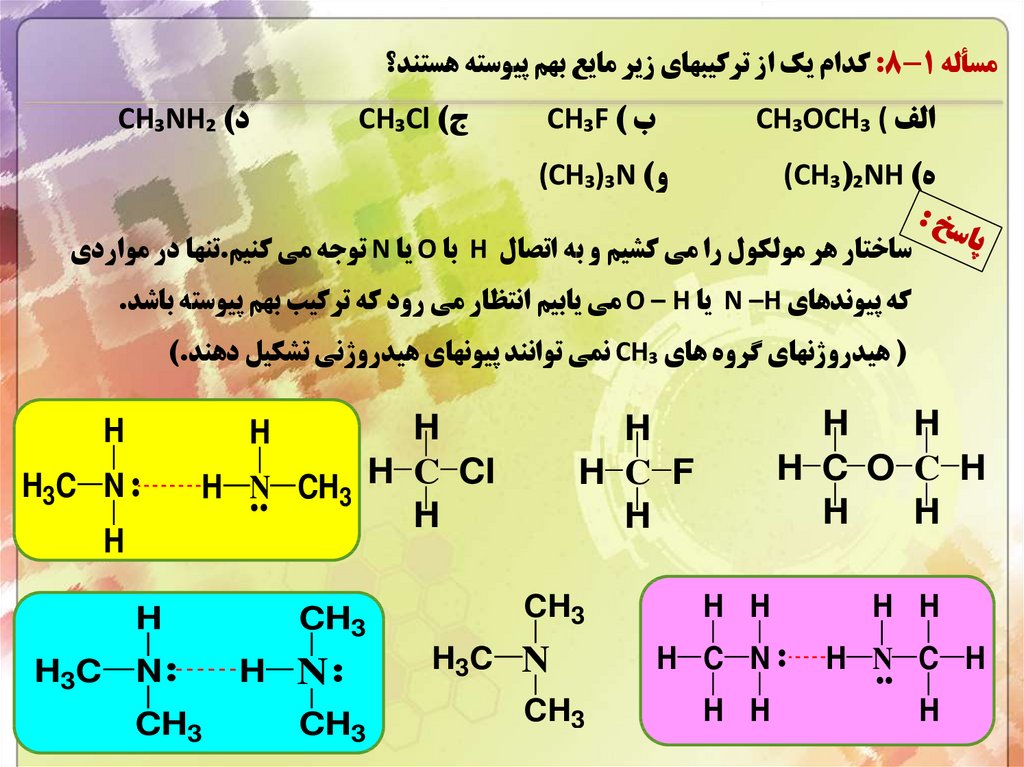
مسأله :8-1کدام يک از ترکيبهاي زير مايع بهم پيوسته هستند؟الف ) CH₃OCH₃
ه) (CH₃(₂NH
ب ) CH₃F
د) CH₃NH₂
ج) CH₃Cl
و) (CH₃)₃N
ساختار هر مولکول را مي کشيم و به اتصال Hبا Oيا Nتوجه مي کنيم.تنها در مواردي
که پيوندهاي N –Hيا O – Hمي يابيم انتظار مي رود که ترکيب بهم پيوسته باشد.
( هيدروژنهاي گروه هاي CH₃نمي توانند پيونهاي هيدروژني تشکيل دهند).
H H
..
..
H
H C N
N
CH3
H3C
H N
..
H N
.. C H
H H
CH3
CH3
CH3
H3C N
H
H
N
..
H H
H
H C F
H
H
..
H
H
H C O C H
H
H
H
H N CH3 H C Cl
H
H
CH3
H3C
61.
حالليت :هنگامي که يک جامد يا يک مايع حل مي شود ،واحدهاي ساختاري – يعني يونها يا
مولکول ها – از يکديگر جدا مي شوند و مولکول هاي حالل فضاي موجود ميان آنها را
اشغال مي کند .بايد انرژي مصرف کرد و بر نيروهاي بين مولکولي يا بين يوني فايق
آمد.
اين انرژي از تشکيل پيوند بين ذرات جسم حل شونده و مولکول هاي حالل تأمين
مي شود.
حل شونده هاي يوني :
در حالل هاي قطبي حل مي شوند.حالل قطبي شامل يک سر مثبت و يک سر منفي است .بين يک
يون مثبت و سر منفي مولکول حالل و همچنين بين يک يون منفي و سر مثبت مولکول حالل ،يک
جاذبه ي الکترواستاتيک وجود دارد که به آن برهم کنش هاي يون – دوقطبي مي گويند ،که نسبتاٌ
ضعيف است .در حالل پوشي يونها در آب جاذبه ي الکترواستاتيک وجود دارد.
احاطه شدن هر يون به وسيله ي مولکولهاي حالل را حالل پوشي مي گويند.اگر حالل آب باشد به آن آب پوشي مي گويند.
62.
آب به سه دليل زير حالل خوبي براي اجسام يوني است: (1قطبيت باال
)2 (2ثابت دي الکتريک باال
(3
)3دارا بودن گروه OHبراي تشکيل پيوند هيدروژني
-حل شونده هاي غير يوني در حالل هاي غير يوني حل ميشوند.
براي مثال متان در کربن تترا کلريد حل مي شود.
متانول در آب حل مي شود .پيوند هاي هيدروژني مولکول هاي آب و
متانول مي توانند به آساني جانشين پيوندهاي هيدروژني بسيار مشابه
موجود بين مولکول هاي مختلف متانول و مولکول هاي مختلف آب
شوند.
حالل ممکن هست در واکنش هايي که در آن صورت
مي گيرد ،دخالت نمايد.
63.
بنا بر تعريف لوري – برونشتد ،اسيد جسمي است که پروتون مي دهد و باز جسمي است که پروتون ميپذيرد.
قدرت يک اسيد به تمايل آن براي پروتون دادن بستگي دارد و قدرت يک باز به تمايل آن براي پروتون
گرفتن وابسته است.
HSO₄⁻و Cl⁻الزاماٌ بازهاي ضعيفي هستند زيرا تمايل آنها براي گرفتن پروتون ضعيف است.
( Cl⁻توانايي پخش بار دارد ،پس مي تواند بار منفي را پايدار کند).
( HSO₄⁻به خاطر ساختارش و توانايي رزونانس مي تواند بار منفي
را پايدار کند).
H3O + HSO4
باز ضعيف تر
Cl
باز ضعيف تر
H2SO4 + H2O
اسيد ضعيف تر
باز قوي تر
NH4
NH3
+
اسيد ضعيف تر
باز قوي تر
اسيد قوي تر
HCl +
اسيد قوي تر
64.
نکته :اگر محلول آبي H₂SO₄با محلول آبي NaOHمخلوط شود:در اين واکنش اسيد H₃0⁺به باز OH⁻پروتون مي دهد تا اسيد جديد H₂O
و باز جديد H₂Oتشکيل شود.
همين طور در واکنش زير :
H2O + H2O
H3O + OH
باز ضعيف تر اسيد ضعيف تر
H2O + NH3
باز ضعيف تر اسيد ضعيف
باز قوي تر اسيد قوي تر
NH4 + OH
باز قوي تر اسيد قوي تر
باز مزدوج حاصل از اسيد قوي ،ضعيف مي باشد ،و اسيد مزدوج باز هاي قوي نيز همين گونه هستند.
اگر اسيدهاي موجود در واکنش هاي قبل را به ترتيب قدرت شان مرتب کنيم داريم :
H₂SO₄ < H₃O⁺ < NH₄⁺ < H₂Oو HCl
در نتيجه اين ترتيب براي بازهاي مزدوج حاصل از اين اسيدها عکس مي شود :
HSO₄⁻ > H₂O > NH₃ > OH⁻و Cl⁻
65.
قدرت اسيدها بستگي به پايداري آنيون حاصل از آنها دارد .اسيدي قوي تر است کهوقتي پروتون از دست داد و تبديل به آنيون شد ،گونه ي حاصل ،توانايي پايدار کردن بارمنفي را داشته باشد.به عبارتي آنيون حاصل از اسيدهاي قوي پايدارتر است پس تمايل
براي واکنش با ترکيبات موجود در محيط را ندارد و واکنش پذيري آن کمتر است.
HClيک اسيد قوي است زيرا تعادل براي ديسوسياسيون آن به H⁺و Cl⁻بسيار مطلوب است (.آنيون
H + Cl
حاصل از اسيد قوي پايدار است).
HCl
فرآيند عکس ،واکنش Cl⁻براي تلفيق با H⁺نامطلوب مي باشد.لذا Cl⁻را به عنوان يک باز
ضعيف
تلقي مي کنيم.
مثالي ديگر :
ديسوسياسيون CH₃OHبراي توليد CH₃O⁻و H⁺نامطلوب است CH₃OH .اسيدي ضعيف مي باشد،
لذا CH₃O⁻را به عنوان يک باز قوي در نظر مي گيريم.
ترکيبات آلي اکسيژن دار ،مي توانند ،مانند آب ،به عنوان باز عمل کنند و پروتون بپذيرند.مثال:
H + CH3O
CH3OH
66.
يک يون اوکسونيوم اتيلالکل
پروتون دار شده
يک يون اکسونيوم دي اتيل اتر
پروتوندار شده
C2H5OH + HSO4
H
C2H5OH + H2SO4
(C2H5)2OH + Cl
(C2H5)2O + HCl
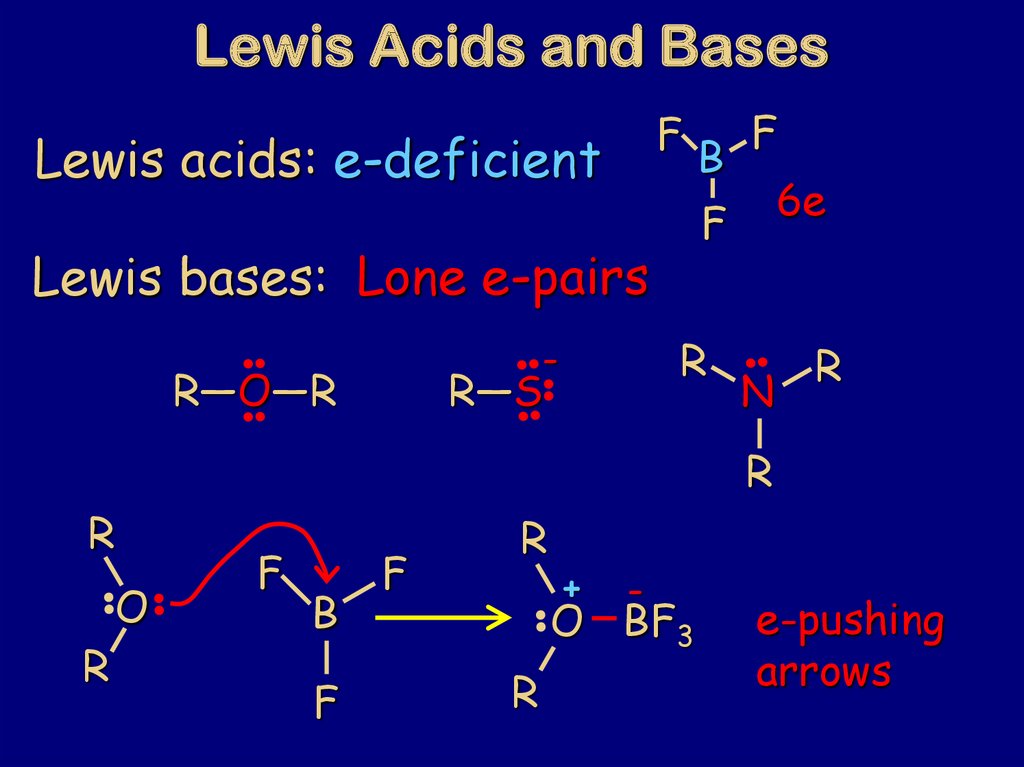
اسيد و باز لوئيس :باز جسمي است که مي تواند يک جفت الکترون در اختيار بگذارد و پيوند
کواالنسي تشکيل دهد(.مانند هيدروکسيد ،آمونياک و آب ،زيرا داراي جفت الکترون آماده
براي به اشتراک گذاشتن مي باشند).
اسيد ،جسمي است که مي تواند جفت الکترون بگيرد و پيوند کواالنسي تشکيل دهد.
( پروتون ،يک اسيد است زيرا کمبود الکترون دارد و نيازمند يک جفت الکترون است تا اليه
ظرفيت خود را کامل کند ).به عبارتي اسيد پذيرنده ي جفت الکترون و باز دهنده ي جفت
الکترون است.
67.
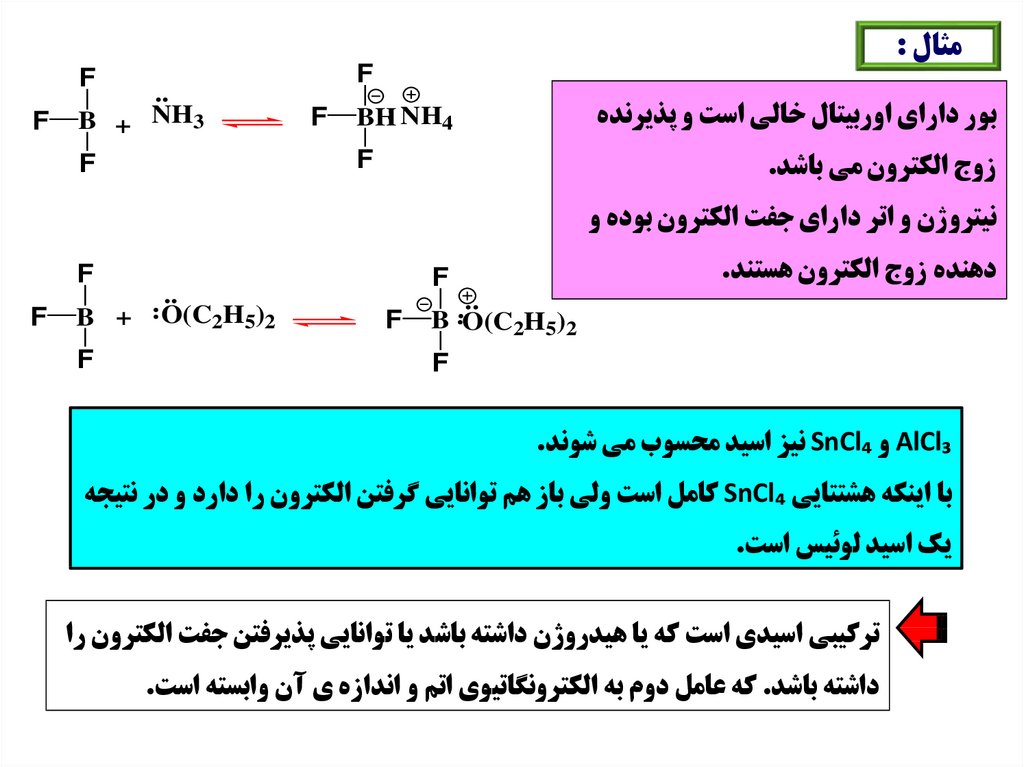
مثال :F
بور داراي اوربيتال خالي است و پذيرنده
..
BH NH4
F
F
..
NH
3
B +
F
زوج الکترون مي باشد.
F
باز
نيتروژن و اتر داراي جفت الکترون بوده و
دهنده زوج الکترون هستند.
F
..
..
O(C2H5)2
..
..
B O(C2H5)2
F
F
اسيد
F
B +
F
F
باز
اسيد
AlCl₃و SnCl₄نيز اسيد محسوب مي شوند.
با اينکه هشتتايي SnCl₄کامل است ولي باز هم توانايي گرفتن الکترون را دارد و در نتيجه
يک اسيد لوئيس است.
ترکيبي اسيدي است که يا هيدروژن داشته باشد يا توانايي پذيرفتن جفت الکترون را
داشته باشد .که عامل دوم به الکترونگاتيوي اتم و اندازه ي آن وابسته است.
F
68.
در يک رديف از جدول تناوبي خصلت اسيدي با افزايش الکترونگاتيوي زياد مي شود.خصلت اسيدي در يک دوره ي معين از جدول :
H - CH₃ >H – NH₂ >H – OH > H – F
: H – SH >H – Clخصلت اسيدي
خصلت اسيدي در يک گروه از جدول تناوبي :
H – F >H – Cl >H – Br >H – I
H - OH >H – SH >H – se
مسأله : 9-1
خصلت اسيدي نسبي ترکيبات زير را دو به دو مقايسه کنيد؟
الف) متيل الکل ( )CH₃OHو متيل آمين ()CH₃NH₂
ب) متيل الکل ( ) CH₃OHو متان تيول )( CH₃SH
ج) H₃O⁺و NH₄⁺
69.
پاسخ :براي مقايسه قدرت اسيدي بايد آنيون حاصل از آنها را با هم مقايسه کرد:در واکنش اول ،بار منفي روي Nاست در واکنش دوم بار منفي روي Oاست.
اسيدي قوي تر است که آنيون حاصل از آن پايدارتر باشد.
اکسيژن الکترونگاتيوتر از نيتروژن است ،پس بار منفي را بهتر پايدار مي کند.
به عبارتي CH₃OHاسيد قوي تري است.
H
+
C
H
N
H
3
C
H
N
H
3
2
H
+
C
H
O
3
C
H
O
H
3
ب) در اين دو ترکيب بار منفي روي اکسيژن و گوگرد قرار مي گيرد.چون Sبزرگتر از Oاست ،
پخش بار روي آن بهتر صورت مي گيرد در نتيجه متيل تيول ،اسيد قوي تري است.
H
C
H
S
C
H
S
H
+
3
3
C
H
O
H
H
C
H
O
3
+
3
70.
ج) به علت اينکه اکسيژن الکترونگاتيوتراز نيتروژن است ،سخت تر از نيتروژن بار مثبت را رويخود نگه مي دارد.در نتيجه با سرعت بيشتري نسبت به ، NH₄⁺هيدروژن از دست مي دهد و
تعادل به سمت تشکيل آب پيش مي رود.
H2O + H
H3O
NH3 + H
مسأله 10-1
NH4
:از هر جفت کدام يک اسيد قوي تري است؟
الف) H₃O⁺يا H₂O
ب) NH₄⁺يا NH₃
ج) H₂Sيا HS⁻
د) H₂Oيا OH⁻
ترکيباتي که داراي بار مثبت بيشتري باشند ،کمبود الکترون دارند ،پس سريع تر از ترکيب خنثي
خود H⁺ ،آزاد مي کنند ،تا کمبود الکترون را جبران کنند .هر چه ترکيبي مثبت تر باشد ،راحت
تر H⁺آزاد مي کند و اسيدي تر است.
الف ) H₃O⁺اسيدي تر است.
H2O + H
H3O
OH + H
H2O
71.
ب)NH₄⁺ > NH₃
NH3 + H
NH4
NH2 + H
NH3
ج) حالت خنثي نسبت به حالت با بار منفي ،راحتتر H⁺آزاد مي کند.هر چه شعاع يوني کمتر
باشد ،خاصيت اسيدي بيشتر است.چون بار منفي ايجاد شده بهتر پايدار مي شود.
HS + H
H2S
H2S + H
HS
2
آب اسيدي تر از ¯ OHاست.
H + OH
2
H + O
H2O
OH
ه) به طور کلي پروتون از مجاورت کاتيوني با بار مثبت بيشتر و شعاع يوني کوچکتر ،راحت تر جدا
مي شود .طبق مفهوم لوري –برونشتد ،ترکيبي بازي است که يک جفت الکترون قابل دسترس براي
به اشتراک گذاشتن ،داشته باشد .که در دسترس بودن اين جفت الکترون ها به الکترونگاتيوي اتم
مرکزي و اندازه آن بستگي دارد.
72.
مسأله : 1-11اعضاي هر گروه را به ترتيب خصلت بازي مرتب کنيد.الف) CH₃⁻،NH₂⁻ ،OH⁻ ، F⁻
ب) NH₃ ،H₂O ، HF
ج) SH⁻ ،Cl⁻
د) I ⁻ ،Br⁻ ،Cl⁻ ،F⁻
ه) seH⁻ ،SH⁻ ،OH⁻
هر چه الکترونگاتيوي اتم مرکزي کمترباشد ،راحت تر الکترون را در دسترس قرار
مي دهد.در نتيجه بازي تر است.
ب) اگر زوج الکترون غير اشتراکي روي اتم هاي با الکترونگاتيويته کمتر قرار گيرد ،در دسترس تر
است و در نتيجه ترکيب بازي تر است.
F⁻> OH⁻>NH₂⁻>CH₃⁻
HF> H₂O>NH₃
ج) Clالکترونگتاتيو تر از Sاست پس زوج الکترون Sدر دسترس تر است.
Cl⁻>SH⁻
د) هر چه ترکيبي الکترونگاتيوي کمتر و شعاع بيشتري داشته باشد بازي تر است.
F⁻>Cl⁻>Br⁻>I ⁻
ه)
OH⁻<SH⁻<seH⁻
73.
مسأله :1-12خصلت بازي نسبي متيل فلوئوريد ( ، )CH₃Fمتيل الکل ( ، )CH₃OHو متيل آمين( ) CH₃NH₂را پيش بيني کنيد.
فلوئور الکترونگاتيوتر از اکسيژن و اکسيژن الکترونگاتيوتر از نيتروژن است.در نتيجه
زوج الکترون نيتروژن در دسترس تر بوده و بازي تر است.
CH₃F < CH₃OH< CH₃NH₂
مسأله :1-13اعضاي هر گروه را به ترتيب خصلت بازي مرتب کنيد.
الف) OH⁻ ،H₂O ،H₃O⁺
ب) NH₂⁻ ،NH₃
ج) S⁻² ،HS⁻ ،H₂S
د) بين بار و خصلت بازي چه رابطه اي وجود دارد؟
الف ) هر چه شعاع يوني بيشتر باشد ،الکترون ها از هسته فاصله ي بيشتري دارند و در دسترس تر
مي باشند در نتيجه :
H₃O⁺>H₂O>OH⁻
ب و ج)
NH₃>NH₂⁻
H₂S>HS⁻>S⁻²
د) به طور کلي هر چه شعاع يوني بيشتر (بار منفي اتم مرکزي بيشتر) و الکترونگاتيوي کمتر باشد ،
ترکيب بازي تر است.
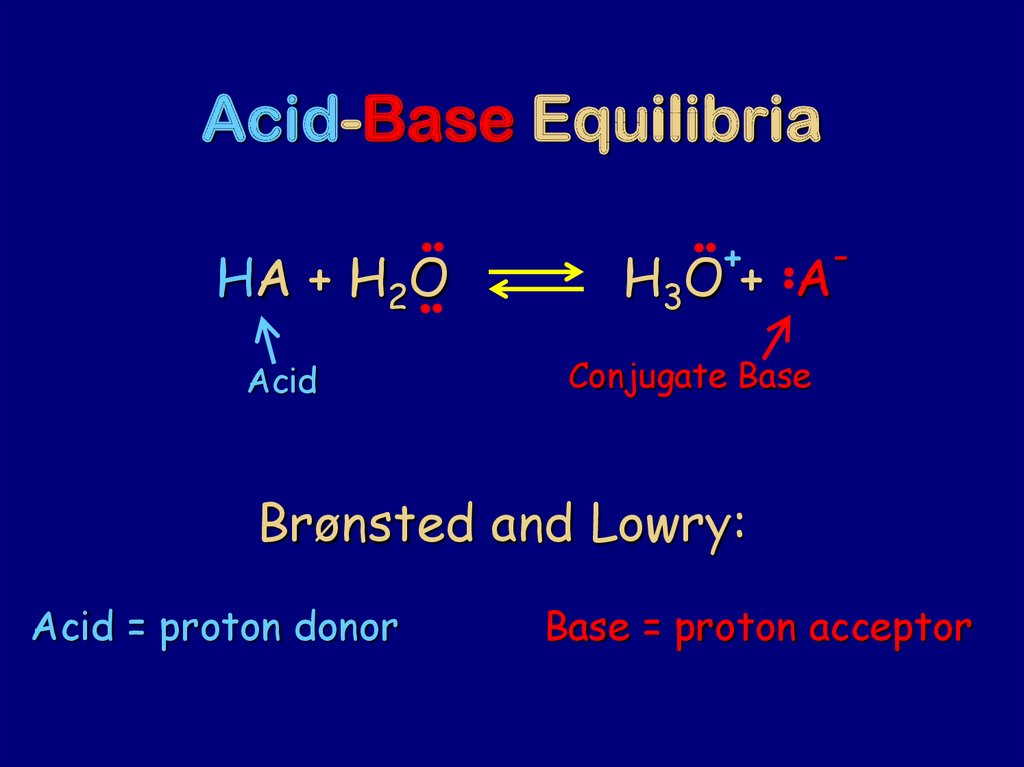
74. Acid-Base Equilibria
HA + H2OAcid
+
-
H3O + A
Conjugate Base
Brønsted and Lowry:
Acid = proton donor
Base = proton acceptor
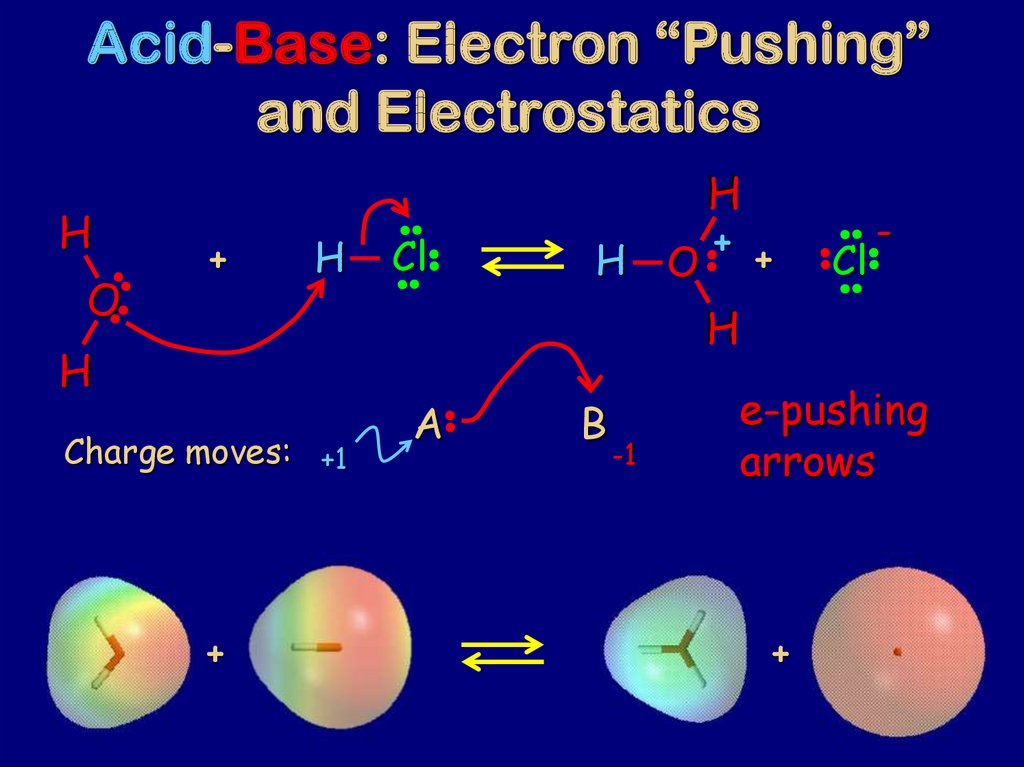
75. Acid-Base: Electron “Pushing” and Electrostatics
+H
Cl
H
+
O +
Cl
-
H
O
H
H
H
Charge moves: +1
+
A
B
-1
e-pushing
arrows
+
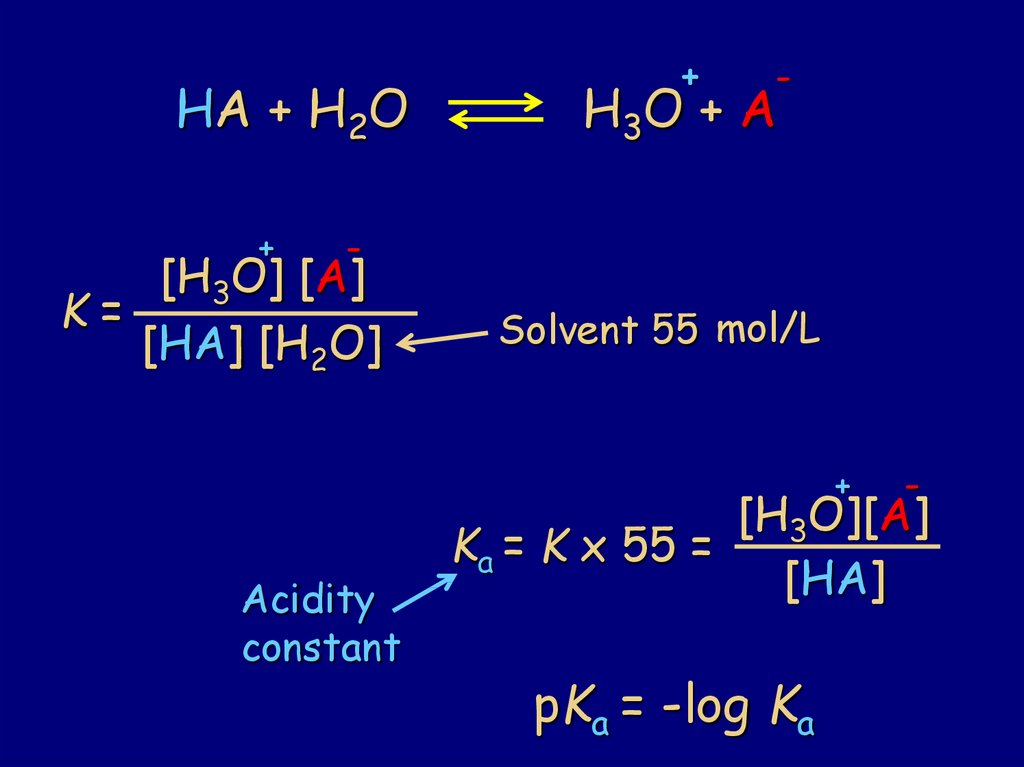
76.
HA + H2O+
+
-
H3O + A
-
[H3O] [A]
K=
[HA] [H2O]
Solvent 55 mol/L
+
Acidity
constant
-
[H3O][A]
Ka = K x 55 =
[HA]
pKa = -log Ka
77. Acidity
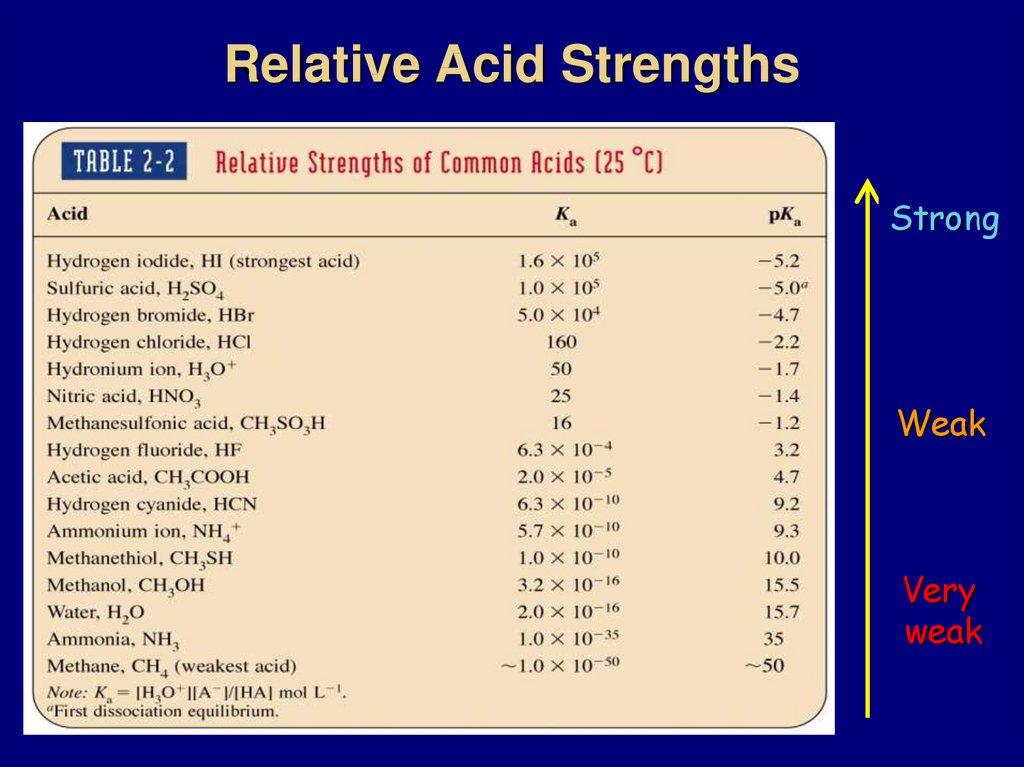
Acidity increases with:1. Increasing size of A (H A gets weaker; charge
is better stabilized in larger orbital; down the PT)
2. Electronegativity (moving to the right in PT)
3. Resonance, e.g.,
-:
O S OH
-5.0
:O :
: :
: :
: :
CH3
C O:
H2SO4
: :
:O :
:O:
CH3COH 4.3
:O:
: :
: :
CH3OH 15.5
-:
CH3O
pKa
78. Relative Acid Strengths
StrongWeak
Very
weak
79. Lewis Acids and Bases
FLewis acids: e-deficient
R
-
R―S
6e
F
Lewis bases: Lone e-pairs
R―O―R
B
F
N
R
R
R
R
O
F
B
F
F
R
+
-
O BF3
R
e-pushing
arrows
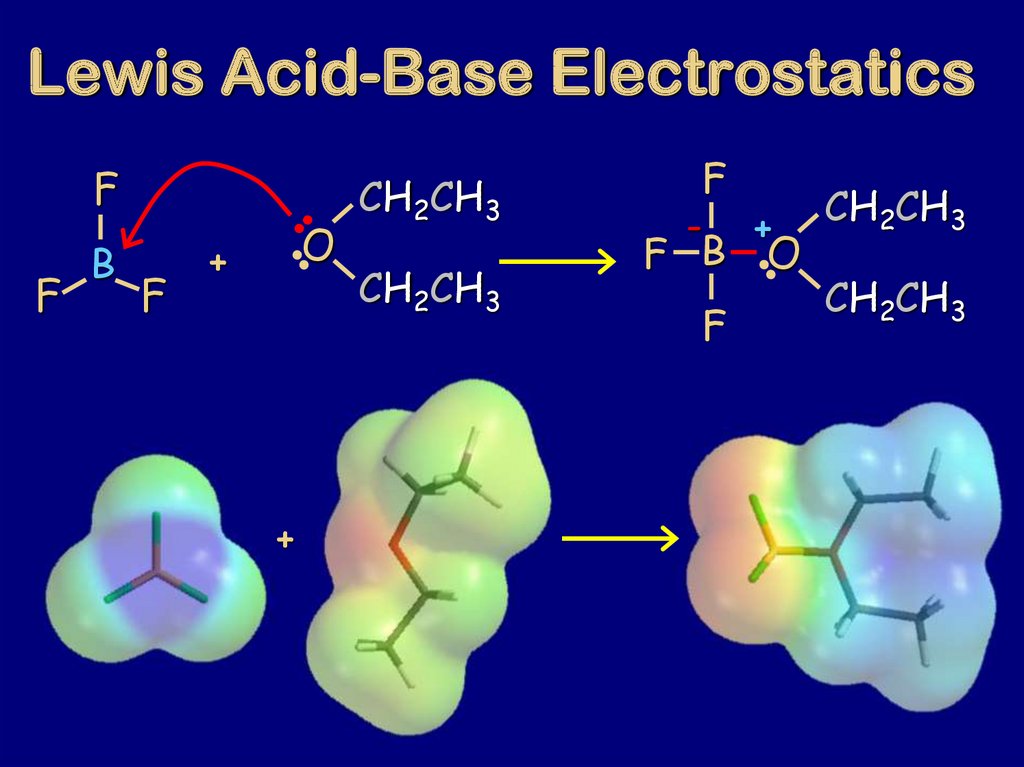
80. Lewis Acid-Base Electrostatics
FF
B
F
O
+
+
CH2CH3
CH2CH3
F
CH
CH
2
3
- +
F B O
CH2CH3
F
81.
ايزومري :ترکيبات متفاوتي را که داراي فرمول مولکولي يکسان باشند ،ايزومر مي
گويند.تعداد و نوع اتم ها در ايزومرها يکسان است ولي اين اتم ها به گونه اي
متفاوت به يکديگر متصل شده اند .که تفاوت در ساختار مولکولي منجر به
تفاوت در خواص مي شود .براي مثال اتيل الکل و دي متيل اتر ايزومرهايي با
خواص شيميايي متفاوت هستند .هر دو داراي فرمول مولکولي C₂H₆Oهستند
ولي ساختار مولکولي متفاوت دارند.
H
H
H C O C H
H
H
دي متيل اتر
H H
H C C O H
H H
اتيل الکل
82.
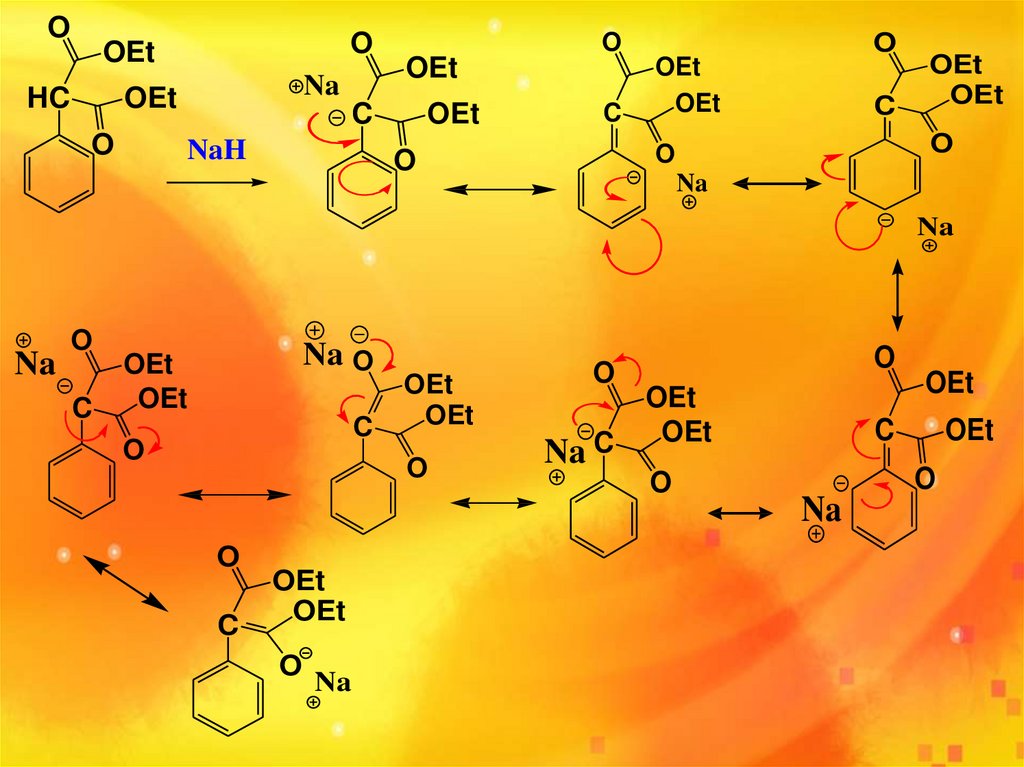
OOEt
HC
OEt
O
Et= -CH2CH3
?
NaH
+
NaHفوق العاده ناپايدار است H⁻ .يک باز قوي است ،با يک اسيد وارد واکنش مي شودH.
موقعيت بنزيلي اسيدي است چون کربانيون حاصل از آن توسط چند عامل پايدار مي
شود.
پايداري آنيون حاصل به چند عامل بستگي دارد:
آروماتيسيته ،خصلت Sبيشتر ( ميزان هم پوشاني Sبيشتر ) ،گروه هاي الکترون کشنده.
براي ايجاد رزونانس:
ترکيب بايد مسطح باشد ،يعني نداشتن هيبريد SP³
بايد همه اتم ها از قاعده هشتايي پيروي کنند.
مجاز به حرکت پروتون نيستيم ،فقط مجاز به حرکت الکترون هستيم.
83.
OO
OEt
HC
Na
OEt
O
O
OEt
C
NaH
OEt
C
O
OEt
OEt
C
O
O
O
OEt
OEt
Na
Na
Na
O
C
Na O
OEt
OEt
C
O
OEt
OEt
O
O
C
OEt
OEt
O
Na
O
Na C
O
OEt
OEt
O
OEt
C
OEt
O
Na




































 Химия
Химия