Похожие презентации:
Ķīmisko reakciju ātruma. Katalīze
1.
Ķīmisko reakcijuātrums.
2.
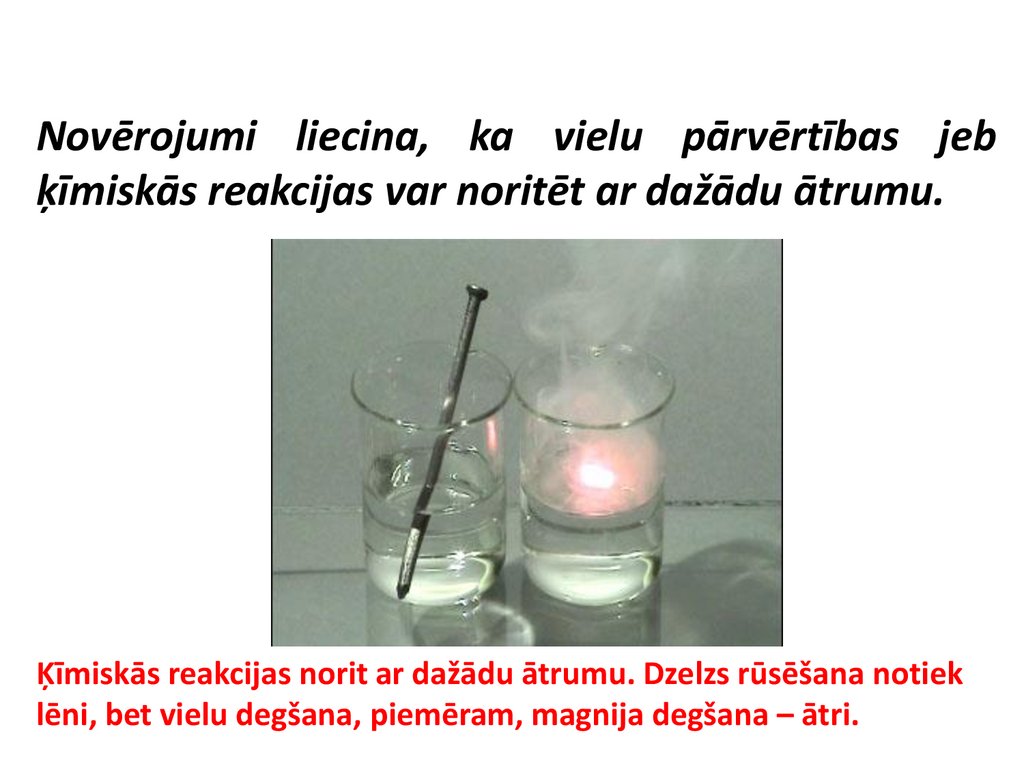
Novērojumi liecina, ka vielu pārvērtības jebķīmiskās reakcijas var noritēt ar dažādu ātrumu.
Ķīmiskās reakcijas norit ar dažādu ātrumu. Dzelzs rūsēšana notiek
lēni, bet vielu degšana, piemēram, magnija degšana – ātri.
3.
Kas ir ķīmiskās reakcijas ātrumsun ar kādiem lielumiem to var
izteikt?
4.
• Ķīmiskā reakcija ir process, kas notiek laikā.Šim procesam var uzrakstīt reakcijas
vienādojumu, kurā norāda reakcijas izejvielas
un produktus.
5.
• Jebkura ķīmiska reakcija var notikt vienā fāzē(homogēnas reakcijas) vai arī uz fāzu
saskarsmes virsmas (heterogēnas reakcijas).
• Homogēnas reakcijas, piemēram, notiek starp
šķīdumiem vai starp gāzveida vielām.
• Heterogēnas reakcijas notiek starp cietām
vielām un šķīdumiem, kā arī starp gāzveida
vielām un šķīdumiem.
6.
Aplūkojot ķīmisko reakciju ātrumu, jāzina,vai reakcijas norisinās homogēnā vai
heterogēnā sistēma.
7.
• Jums ir zināmas arī tādas reakcijas, kurāsreaģējošās vielas nesajaucas un tādējādi
neveidojas viendabīga vide.
• Tādas reakcijas ir piemēram, ogles un citu
vielu
degšana.
Šīs
reakcijas
notiek
neviendabīgā, t.i., heterogēnā vidē.
8.
• Reakcijas ātrums ir vielas (izejvielas vaireakcijas produkta) koncentrācijas izmaiņa
laika vienībā.
9.
• Homogēnas reakcijas ātrumu nosaka pēckoncentrācijas izmaiņām vienai no vielām, kas
iesaistās reakcijā, vai arī vienai no vielām, kas
rodas reakcijas rezultātā laika vienībā.
10.
11.
• Homogēnas reakcijas ātrumu mēra ar vielumolu skaitu, kas iesaistās reakcijā vai rodas
reakcijas rezultātā vienā laika vienībā.
12.
• Vielas A koncentrāciju laikā t0 (sekundes)apzīmēsim ar C0 (mol/L).
• Notiekot ķīmiskajai reakcijai, pēc kāda laika, ko
apzīmēsim ar t1 (t1 > t0), vielas A koncentrācija ir
samazinājusies, jo daļa vielas ir pārvērtusies par
reakcijas produktu B.
13.
• Vielas A koncentrācija būs С1 (С1 < С0 ), betkoncentrācijas maiņa būs negatīva (С1 - С0 < 0).
Savukārt, ja izvēlēsimies produktu B, tad laika
posmā t1 - t0 B koncentrācija būs
palielinājusies un koncentrācijas maiņa būs
pozitīva (С1 - С0 > 0). Tāpēc reakcijas ātruma ϑ
izteiksmē ievieto + un – zīmi, lai ātrums
nebūtu negatīvs lielums.
14.
• Reakcijas ātrums ir pozitīvs lielums, tāpēc šīsizteiksmes priekšā jāliek plus zīme, ka ir
jāmēra reakcijas produkta koncentrācijas
maiņa (jo ∆С > 0).
• Mīnusa zīme jāliek tad, ja ir jāmēra reaģējošo
vielu koncentrācijas maiņa (jo ∆С < 0)
15.
16.
• Reakcijas ātruma atkarību no reaģējošo vielukoncentrācijas nosaka dabīgo (aktīvo) masu
likums, kuru 1867.gadā formulēja norvēģu
zinātnieki Kāto Maksimilians Guldbergs un
Pēters Vāge.
• Ķīmisko reakciju ātrums ir tieši proporcionāls
reaģējošo vielu koncentrāciju reizinājumam.
17.
Proporcionalitātes koeficientu k sauc par reakcijasātruma konstanti.
Reakcijas ātruma konstante rāda, cik liels būs reakcijas
ātrums, ja visu izejvielu koncentrācija būs 1 mol/l. Šī
konstante nav atkarīga no vielu koncentrācijas.
18.
19.
Uzdevums:20.
• Katalizatori ir vielas, kas piedalās ķīmiskajāsreakcijās un maina to ātrumu (daudzos
gadījumos maina arī procesa norises virzienu).
Reakcijas rezultātā katalizatori paliek ķīmiskā
ziņā neizmainījušies un sākotnējā daudzuma.
• Ķīmisko reakciju ātruma maiņa katalizatoru
iedarbībā sauc par katalīzi, bet reakcijas, kuras
noris ar katalizatoru piedalīšanos, - par
katalītiskajām reakcijām.
21.
• Tādas vielas, kuras ķīmiskās reakcijas norisipalēnina vai pavisam pārtrauc, sauc par
inhibitoriem.
22.
Kopsavilkums:reakcijas ātrumu ietekmējošie faktori
Reaģējošo vielu daba
Reaģējošo vielu koncentrācija
Saskarsmes virsmas lielums
Temperatūra
Katalizatora klātbūtne





















 Химия
Химия




