Похожие презентации:
Классификация химических реакций
1.
2.
Химические реакции это процессы, в результате которых из одних веществобразуются другие, отличающиеся от них по составу
и (или) строению.
3.
Классификацияхимических реакций
• По числу и составу реагирующих и
образующихся веществ
• По изменению степени окисления атомов
элементов
•По тепловому эффекту
4.
По числу и составу реагирующих иобразующихся веществ
• Соединение
•Разложение
•Замещение
•Обмен
5.
По числу и составу реагирующих иобразующихся веществ
Реакции соединения – реакции, при которых из двух и более
веществ образуется одно сложное вещество.
S + O2 = SO2
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
6.
По числу и составу реагирующих иобразующихся веществ
Горение серы в кислороде (пример реакции соединения):
7.
По числу и составу реагирующих иобразующихся веществ
Реакции разложения – это такие реакции, при которых из
одного сложного вещества образуется несколько новых
веществ.
2HgO = 2Hg + O2
2KNO3 = 2KNO2 + O2
2KMnO4 = K2MnO4 + MnO2 + O2
8.
По числу и составу реагирующих иобразующихся веществ
Получение кислорода из перманганата калия
(пример реакции разложения):
9.
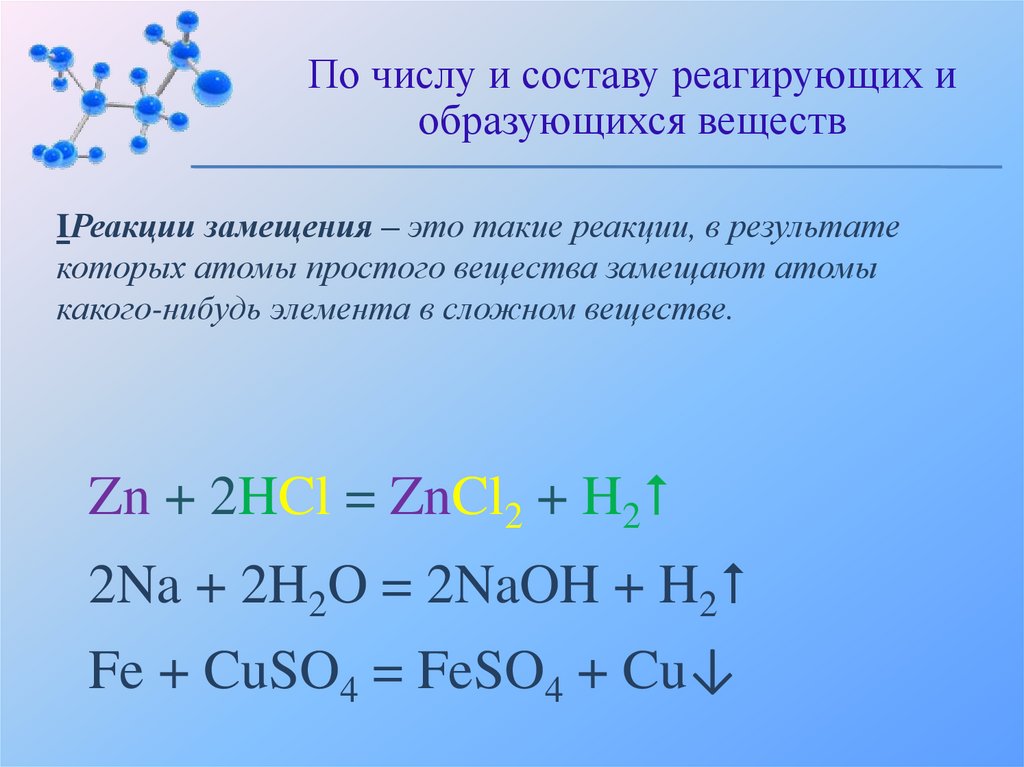
По числу и составу реагирующих иобразующихся веществ
IРеакции замещения – это такие реакции, в результате
которых атомы простого вещества замещают атомы
какого-нибудь элемента в сложном веществе.
Zn + 2HCl = ZnCl2 + H2
2Na + 2H2O = 2NaOH + H2
Fe + CuSO4 = FeSO4 + Cu↓
10.
По числу и составу реагирующих иобразующихся веществ
Взаимодействие натрия с водой
(пример реакции замещения):
11.
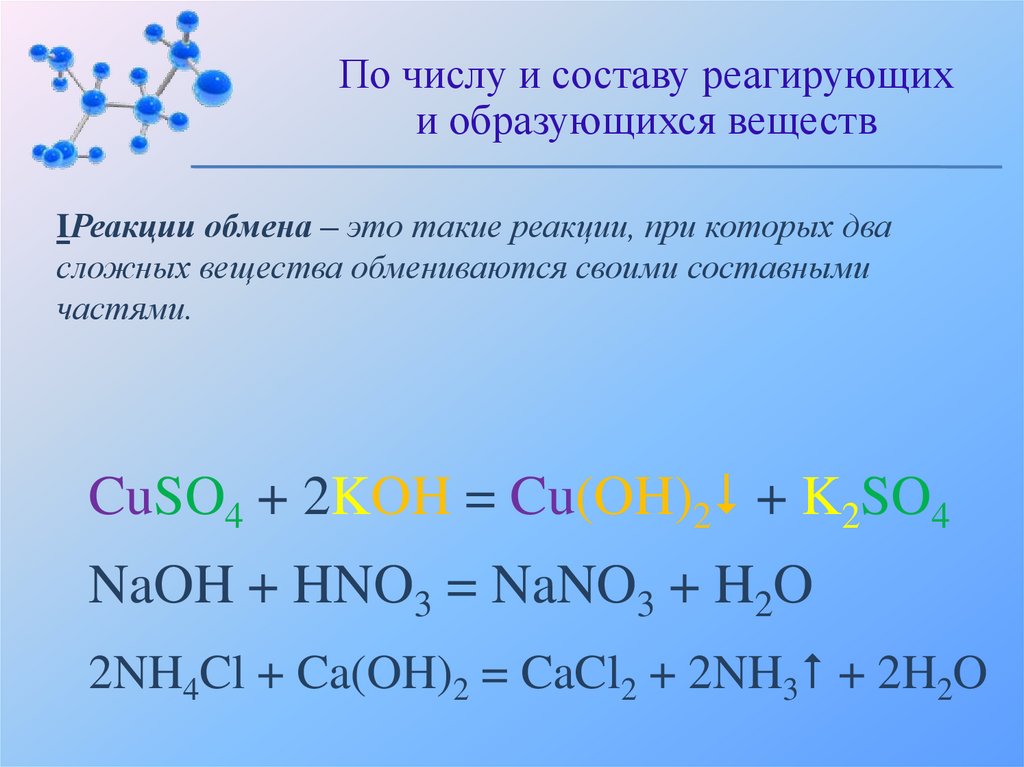
По числу и составу реагирующихи образующихся веществ
IРеакции обмена – это такие реакции, при которых два
сложных вещества обмениваются своими составными
частями.
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
NaOH + HNO3 = NaNO3 + H2O
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
12.
По числу и составу реагирующих иобразующихся веществ
Взаимодействие сульфата меди (II) с гидроксидом калия
(пример реакции обмена)
13.
По изменению степеней окисленияхимических элементов
1. Окислительно-восстановительные реакции
2. Не окислительно-восстановительные реакции
14.
По изменению степеней окисленияхимических элементов
1. Окислительно-восстановительные реакции – реакции,
идущие с изменением степеней окисления элементов (все
реакции замещения, а также реакции соединения и
разложения, в которых участвует хотя бы одно простое
вещество).
CuSO4 + Fe = FeSO4 + Cu↓
Zn + 2HCl = ZnCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
15.
По изменению степеней окисленияхимических элементов
Взаимодействие железа с медным купоросом
(пример окислительно-восстановительной реакции):
16.
По тепловому эффекту1. Экзотермические реакции протекают с выделением
энергии:
4P + 5O2 = 2P2O5 + Q кДж
17.
По тепловому эффектуГорение фосфора в кислороде
(пример экзотермической реакции):
18.
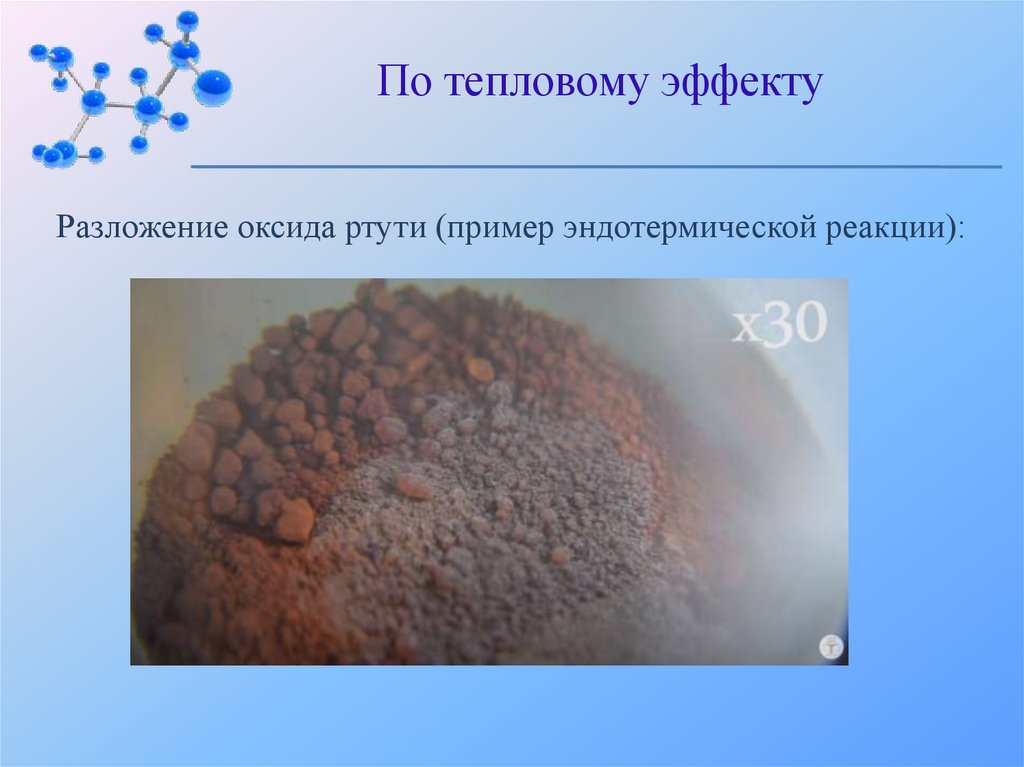
По тепловому эффекту2. Эндотермические реакции протекают с поглощением
энергии:
2HgO = 2Hg↓ + O2↑ - Q кДж
19.
По тепловому эффектуРазложение оксида ртути (пример эндотермической реакции):
20.
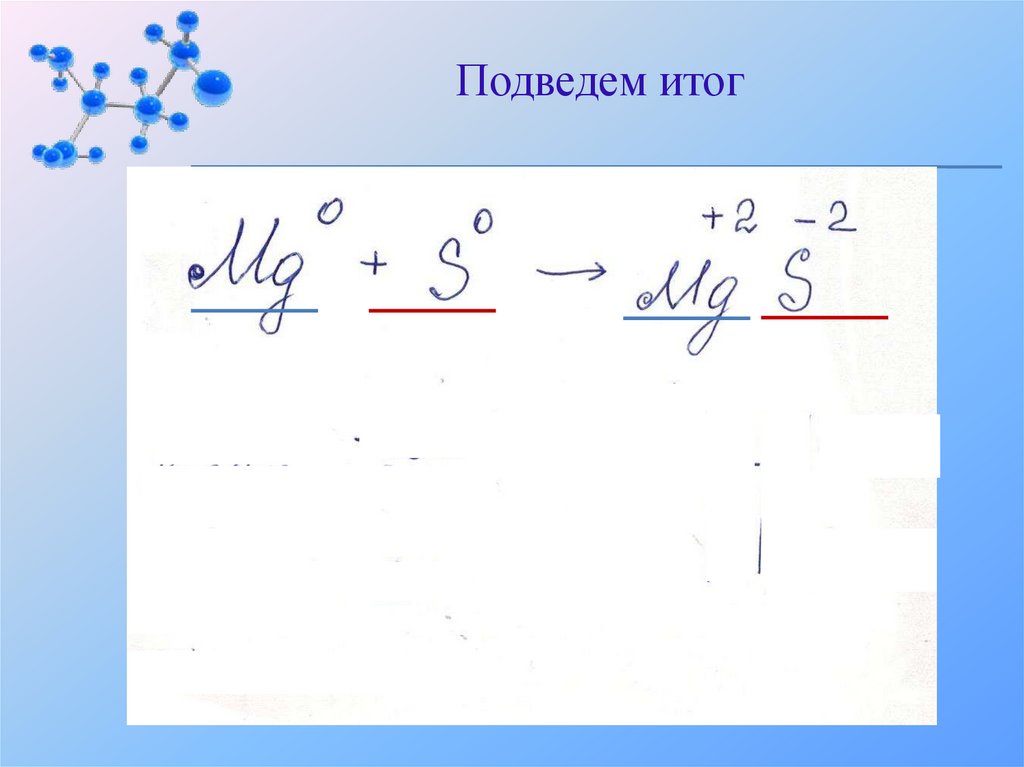
Подведем итог0
0
+2 -2
Mg+S→ MgS +Q
Cоединение,
так как из 2 веществ образуется одно
Экзотермическая,
так как выделяется теплота
Окислительно- восстановительная,
так как магний и сера меняют степень окисления
21.
Подведем итог22.
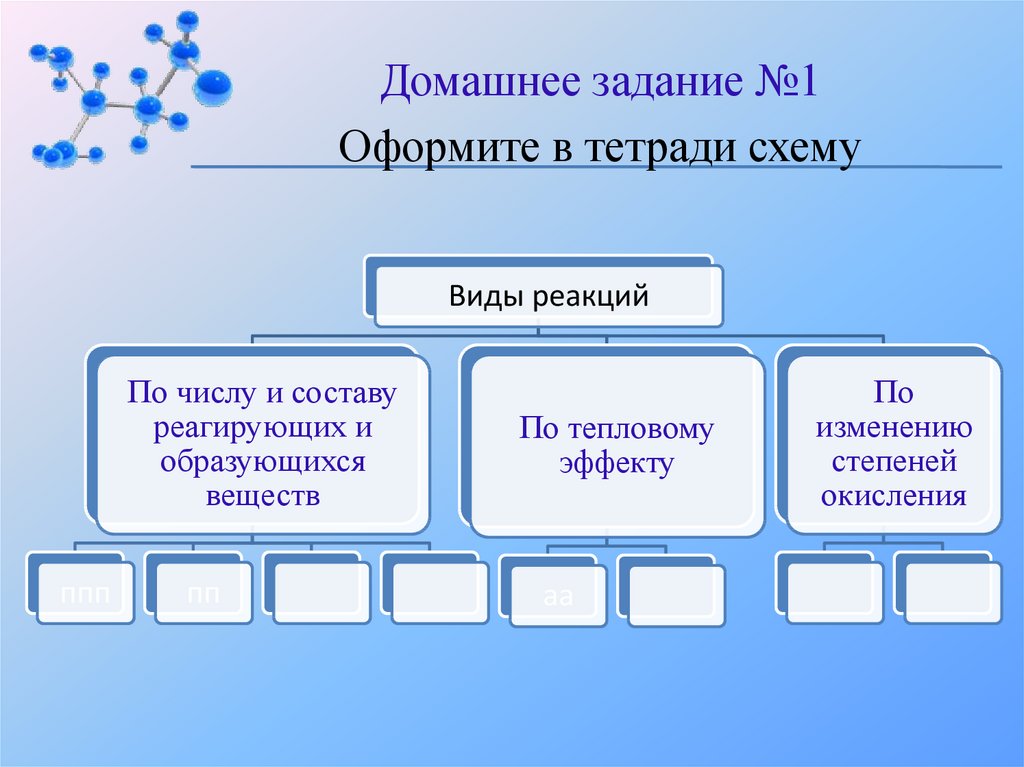
Домашнее задание №1Оформите в тетради схему
Виды реакций
По числу и составу
реагирующих и
образующихся
веществ
ппп
пп
По тепловому
эффекту
аа
По
изменению
степеней
окисления
23.
Домашнее задание №2Для реакции
СаСО3=СаО + СО2 – Q
Приведите все 3
классификации, опираясь на
схему задания 1 и слайд 20
24.
Домашнее задание №3Рассмотрите как окислительновосстановительную реакцию ( по
образцу слайда 21)
Zn +S→ ZnS
Пришлите скан или фото ответов на
почту galinaneshetaeva@yandex.ru
или в контакте


















 Химия
Химия








