Похожие презентации:
Классы неорганических соединений. 8 класс
1. Классы неорганических соединений 8 класс
Составила: Бирюкова С. Е.учитель химии
МОУ «СОШ № 4»
г. Железногорск, Курской
области
2.
Цель урока:Обобщить и систематизировать знания об основных
классах неорганических веществ.
Задачи:
• Закрепить и обобщить знания о классификации,
свойствах оксидов, кислот, оснований и солей;
• Охарактеризовать взаимосвязь между основными
классами веществ в неорганической химии;
• Показать значение неорганических веществ в
повседневной жизни.
3. Ум заключается не только в знании, но и в умении прилагать знание на деле. Аристотель
4.
5.
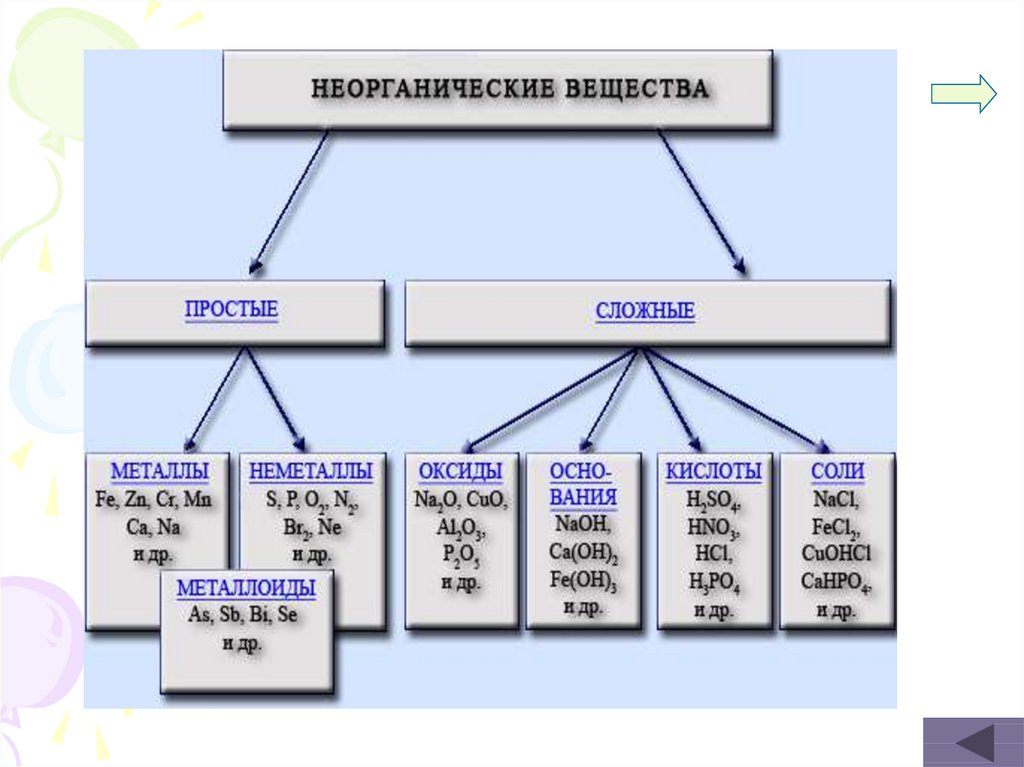
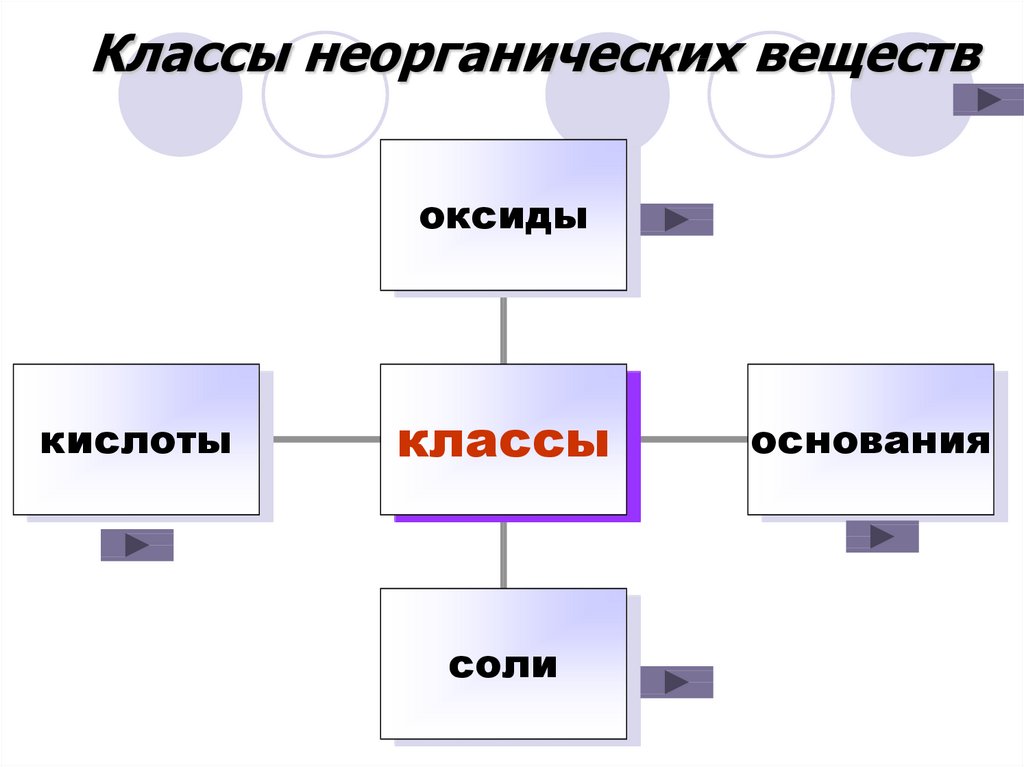
Классы неорганических веществоксиды
кислоты
классы
соли
основания
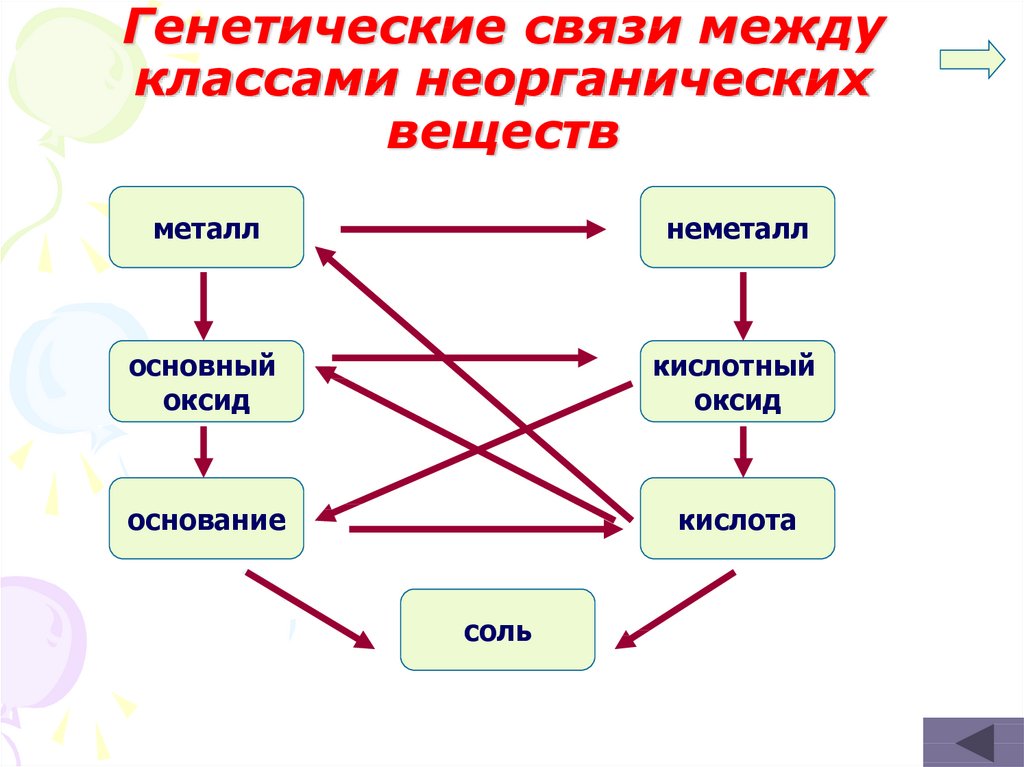
6. Генетические связи между классами неорганических веществ
металлнеметалл
основный
оксид
кислотный
оксид
основание
кислота
соль
7. Оксиды
• Состав• Классификация
• Физические свойства
• Химические свойства
• Получение
• Применение
8. Основания
• Состав• Классификация
• Физические свойства
• Химические свойства
• Получение
• Применение
9. Кислоты
• Состав• Классификация
• Физические свойства
• Химические свойства
• Получение
• Применение
10. Соли
• Состав• Классификация
• Физические свойства
• Химические свойства
• Получение
• Применение
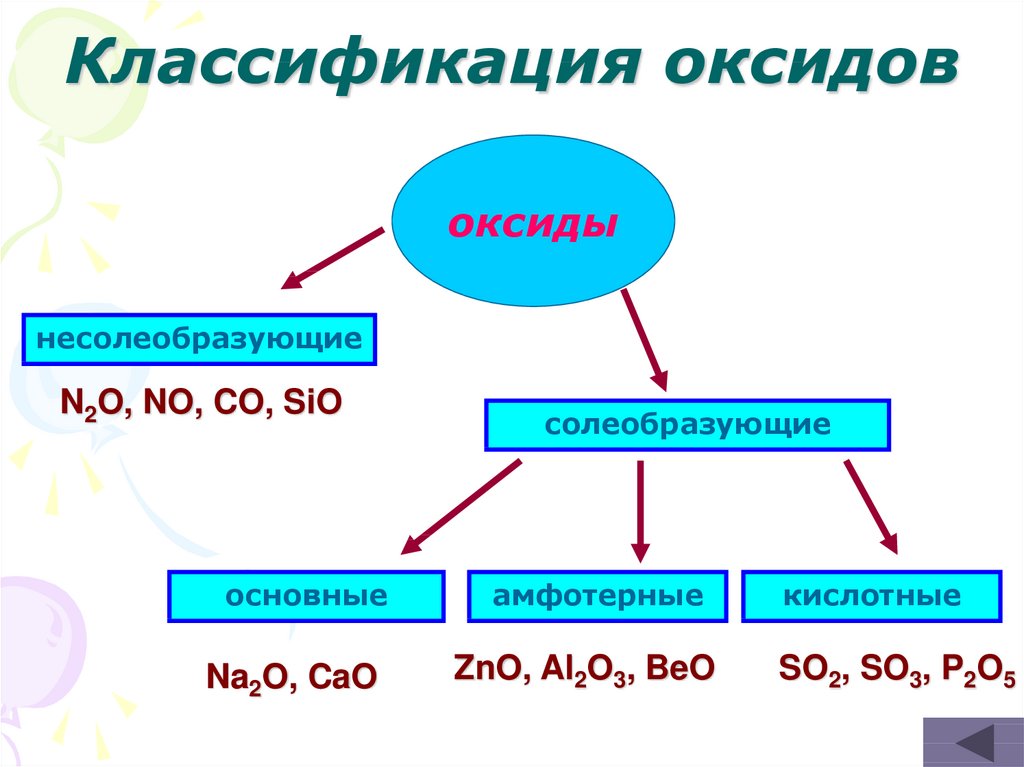
11. Классификация оксидов
оксидынесолеобразующие
N2O, NO, CO, SiO
основные
Na2O, CaO
солеобразующие
амфотерные
ZnO, Al2O3, BeO
кислотные
SO2, SO3, P2O5
12. Классификация оснований
Основания (по растворимости)растворимые
(щелочи)
KOH, NaOH
нерастворимые
основания
Fe(OH)2, Pb(OH)2
Основания (по кислотности)
Однокислотные
KOH, NaOH
Двухкислотные
Fe(OH)2, Pb(OH)2
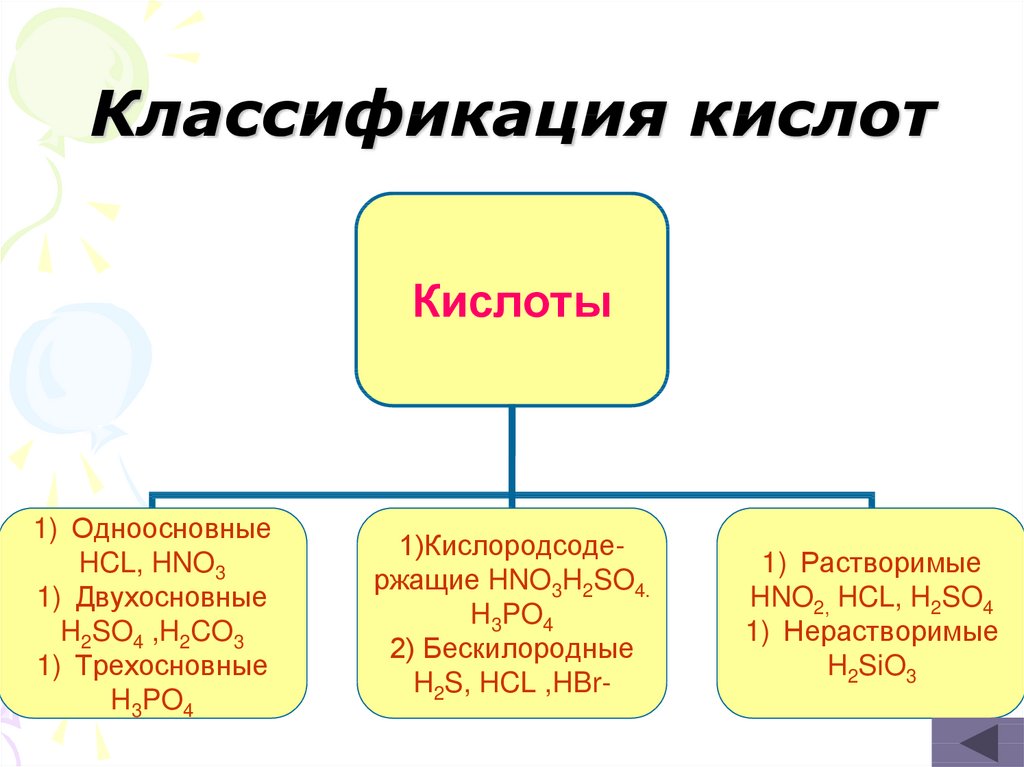
13. Классификация кислот
Кислоты1) Одноосновные
HCL, HNO3
1) Двухосновные
H2SO4 ,H2CO3
1) Трехосновные
H3PO4
1)Кислородсодержащие HNO3H2SO4.
H3PO4
2) Бескилородные
H2S, HCL ,HBr-
1) Растворимые
HNO2, HCL, H2SO4
1) Нерастворимые
H2SiO3
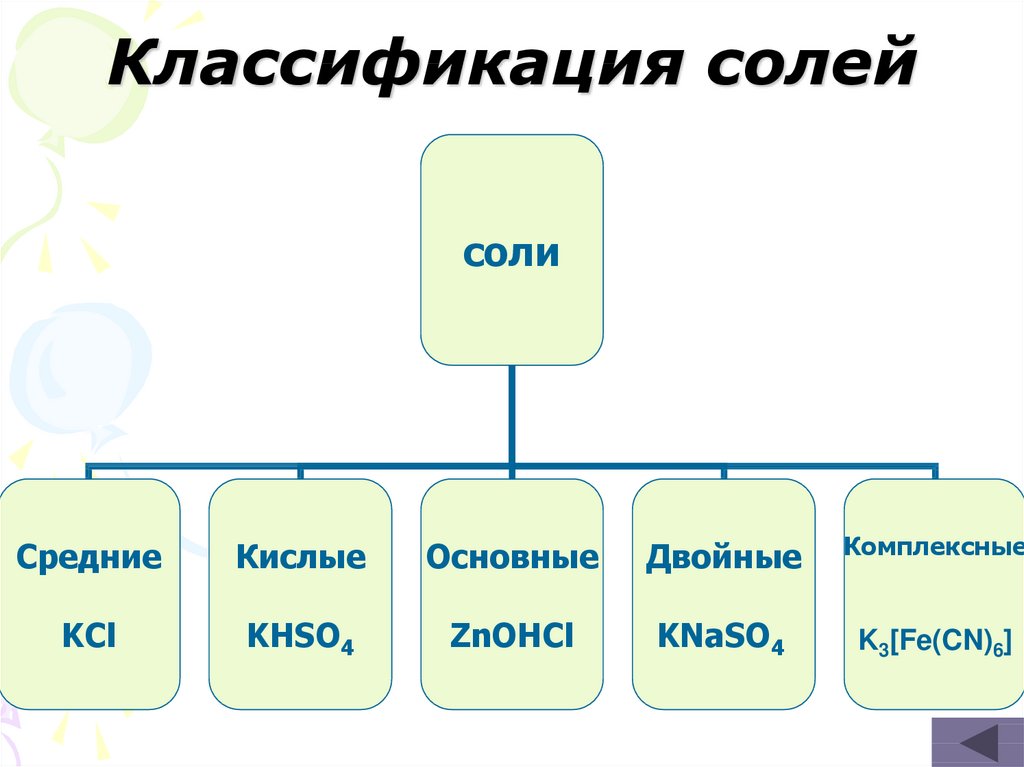
14. Классификация солей
солиСредние
Кислые
Основные
Двойные
Комплексные
KCl
KHSO4
ZnOHCl
KNaSO4
K3[Fe(CN)6]
15. Оксиды
• Сложные вещества, состоящие из двуххимических элементов, один из которых
– кислород в степени окисления -2.
H2O; AI2O3; CaO;
P2O5
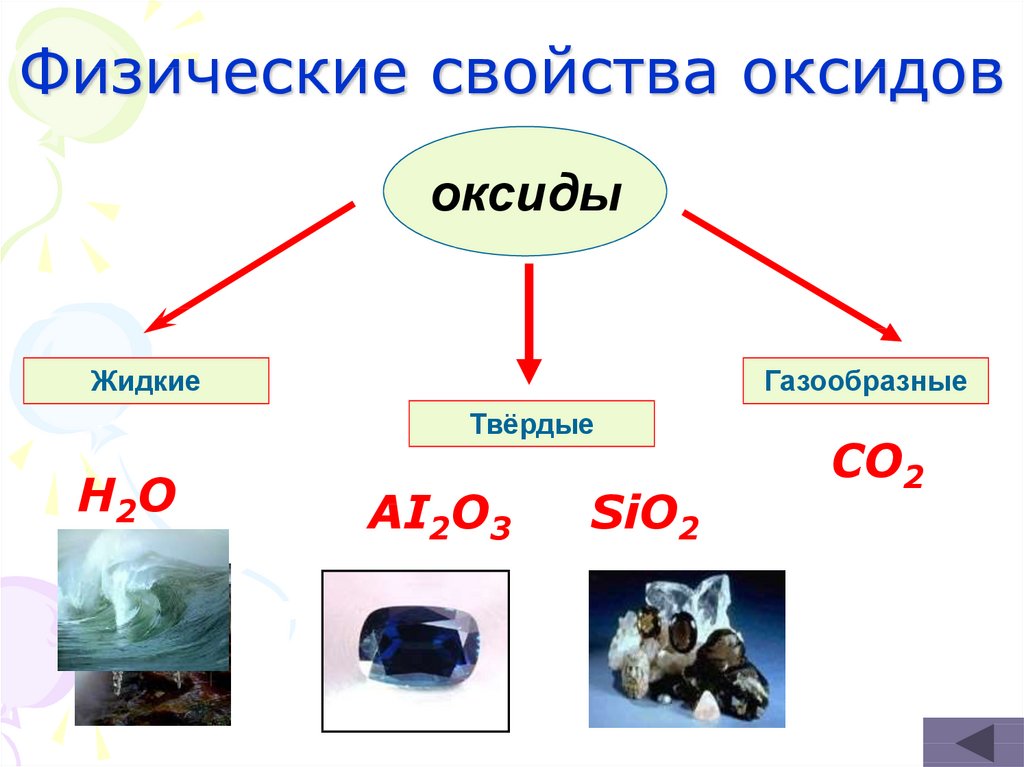
16. Физические свойства оксидов
оксидыЖидкие
Газообразные
Твёрдые
H 2O
AI2O3
SiO2
CO2
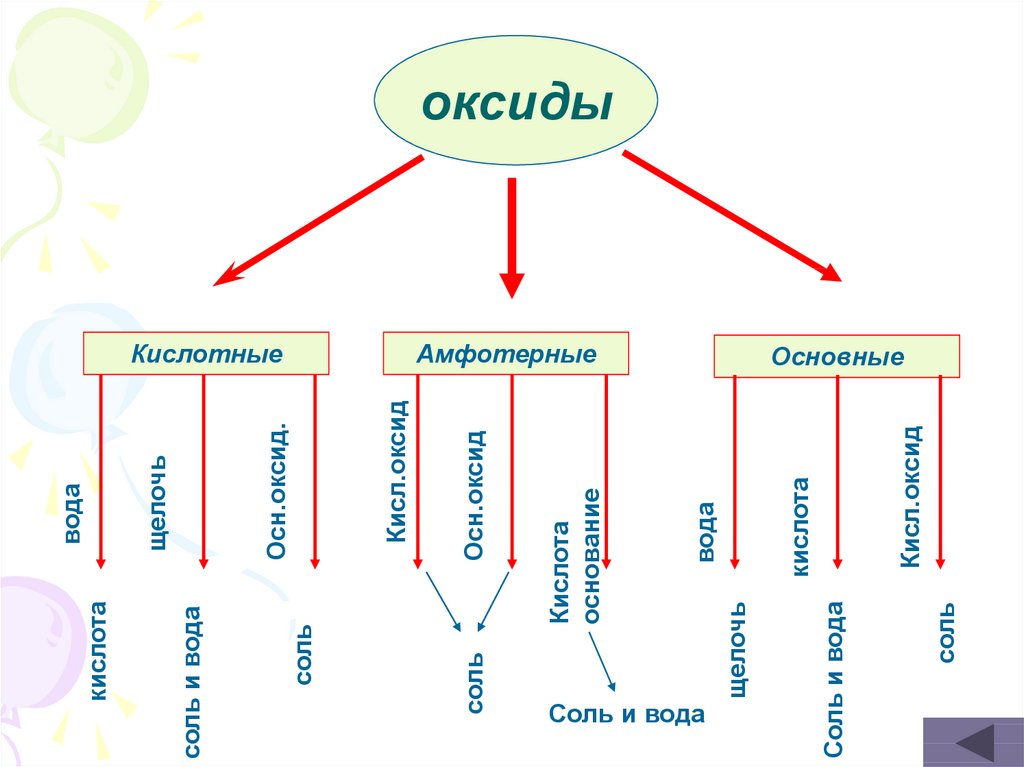
17.
сольКисл.оксид
кислота
Амфотерные
Соль и вода
Соль и вода
щелочь
вода
Кислота
основание
Осн.оксид
Кисл.оксид
Осн.оксид.
щелочь
Кислотные
соль
соль
соль и вода
кислота
вода
оксиды
Основные
18. Получение оксидов
• Окисление кислородом простых веществ2MgO +O2=2MgO
• Окисление кислородом cложных веществ
2H2S+3O2=2H2O+2SO2
• Разложение нагреванием солей
СaCO3=CaO+CO2
• Нагреванием оснований Cu (OH)2=CuO+H20
• Нагреванием кислородсодержащих кислот
H2SO3=H2O+SO2
• Нагреванием высших оксидов 4CrO3=Cr2O3+3O2
• Вытеснение летучего оксида менее летучим
Na2CO3+SiO2=Na2SiO3+CO2
19. Применение оксидов
• Оксид цинка ZnO –вещество белого
цвета, используется
для приготовления
белой масляной
краски (цинковые
белила).
Оксид хрома(III) – Cr2O3 –
кристаллы зеленого цвета,
нерастворимые в воде.
Cr2O3 используют как
пигмент при изготовлении
декоративного зеленого
стекла и керамики.
20. Оксид кремния (IV) SiO2
• Кварц, кремень,горный
хрусталь,
аметист, яшма,
опал — все это
оксид кремния
(IV).
21. Основания
• Сложные вещества,состоящие из атомов
металлов и
соединённых с ним
одной или нескольких
гидроксидных групп.
Меn+(ОН)n
22. Физические свойства оснований
• Твердыекристаллические
вещества.
• В воде растворимы
щелочи:LiOH, NaOH,
KOH, CsOH, RbOH,
Ca(OH)2,
Sr(OH)2,Ba(OH)2
• Другиемалорастворимы
23.
• Щелочи - едкиевещества. Они
разъедают кожу и ткани.
Поэтому технические
названия некоторых из
них указывают на это
свойство. Например:
NаОН - едкий натр, КОНедкий кали. Обращаться
со щелочами нужно
очень осторожно.
24. Химические свойства оснований
Щелочи1.
Нерастворимые основания
Реагируют с кислотой с образованием соли и воды
2NaOH + H2SO4 = Na2SO4 + 2H2O
2.
при условии, что соль растворима
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
Реагируют с кислотным оксидом 2.
с образованием соли и воды
2NaOH + SO3 = Na2SO4 + H2O
Реагируют с солью с образованием новой соли и нового основания при условии, что
выпадает осадок
2NaOH + FeSO4 = Na2SO4 + Fe(OH)2
3.
4. Окрашивают индикаторы
лакмус
метилоранж
фенолфталеин
Разлагаются при нагревании
t0
Fe(OH)2 = FeO + H2O
25. Получение оснований
Щелочи получают:
а) взаимодействием активных
металлов с водой
2Na + 2H2O = 2NaOH + H2
б) взаимодействием основных
оксидов с водой
CaO + H2O + Ca(OH)2
Нерастворимые основания
получают
взаимодействием солей со
щелочами
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
26. Применение оснований
Гидроксид натрия NaOH(едкий натр, каустическая
сода),применяется в
производстве бумаги, мыла,
волокон, очистке
нефтепродуктов
Гидроксид кальция Ca(OH)2
(гашеная известь),применяется
в строительстве
27. Кислоты
• Кислотаминазываются сложные
вещества, состоящие
из атомов водорода,
способных замещаться
на металл, и
кислотного остатка.
H2SO4 HCl
28. Физические свойства
• Большинство кислот не имеютцвета и запаха , кислые на
вкус, хорошо растворяются в
воде (кроме H2SiO3 )
• При обычных условиях кислоты могут
быть
Твердыми: H2SiO3 ;H3PO4
Жидкими: HClO4 ;H2SO4
• Сильные кислоты очень едкие.
Это означает, что они могут
выжигать кожу или другую
поверхность .
29. Химические свойства кислот
Кислота + основание = соль + вода
H2SO4 +2 NaOH = Na2SO4 + 2H2O
Кислота + оксид металла = соль + вода
CuO + 2 HCL = CuCL2 + H2O
Кислота + металл = водород + соль
2HCL +Zn = ZnCL2 + H2
Условия: - в ряду напряжений металл должен стоять до водорода
- в результате реакции должна получиться растворимая соль
Кислота + соль = новая кислота + новая соль
Условия: - в результате реакции должны получиться газ, осадок
или вода.
BaCL2 + H2SO4 = BaSO4 + 2HCL
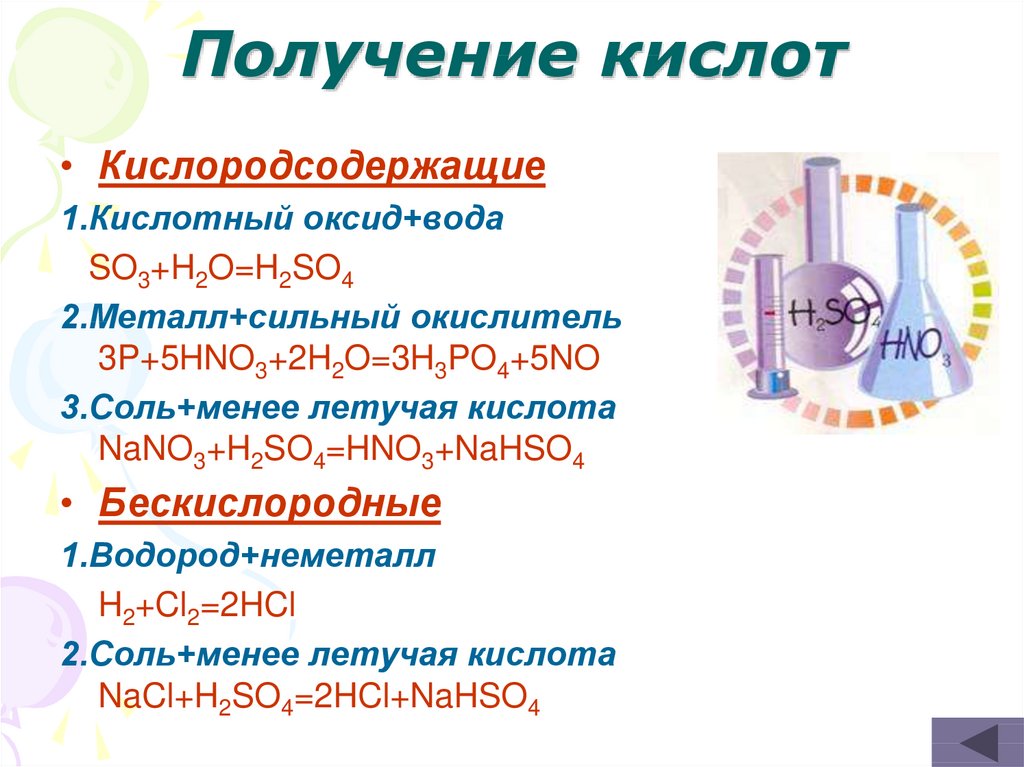
30. Получение кислот
• Кислородсодержащие1.Кислотный оксид+вода
SO3+H2O=H2SO4
2.Металл+сильный окислитель
3P+5HNO3+2H2O=3H3PO4+5NO
3.Cоль+менее летучая кислота
NaNO3+H2SO4=HNO3+NaHSO4
• Бескислородные
1.Водород+неметалл
H2+Cl2=2HCl
2.Cоль+менее летучая кислота
NaCl+H2SO4=2HCl+NaHSO4
31. Применение кислот
1- производство кислот, 2-взрывчатых веществ,3-минеральных удобрений, 4- электролитической меди,
5-эмали, 6-солей, 7- искусственного шелка,
8- лекарств
32. Соли
• Солями называютсясложные вещества,
представляющие собой
продукты полного или
частичного замещения
водорода в кислоте на
металл или
гидроксильной группы в
основании на кислотный
остаток
K2SO4; КHSO4; ZnOHCl
33. ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
• Соли-твердыекристаллические вещества.
Многие из них имеют высокие
температуры плавления и
кипения. По растворимости
делятся на:
• Растворимые NaCI; K2SO4
• Нерастворимые CaCO3;
BaSO4
34. ХИМИЧЕСКИЕ СВОЙСТВА CОЛЕЙ
• Разложение при прокаливанииCaCO3 = CaO + CO2
• Cоль+металл
Cu + Hg(NO3)2 = Hg+ Cu(NO3)2
• Соль+соль
CaCl2 + Na2SiO3 = CaSiO3 + 2NaCl
• Соль+щелочь
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
• Соль+кислота
AgNO3 + HCl = AgCl + HNO3
35. Получение солей
металл+неметалл 2Mg+Cl2=MgCl2
металл+кислота Zn+2HCl=ZnCI2+H2
металл+соль
Hg(NO3)2+Cu=Hg+Cu(NO3)2
основной оксид+кислота CaO+2HCl=CaCl2+H2O
кислотный оксид+основание
CO2+Ca(OH)2=CaCO3+H2O
кислотный+основной оксиды CaO+CO2=CaCO3
основной+амфотерный оксиды
Al2O3+CaO=Ca(AlO2)2
кислота+основание H2SO4+2NaOH=Na2SO4+2H2O
соль+соль AgNO3+NaCl=AgCl+NaNO3
соль+щелочь CuSO4+2NaOH=Cu(OH)2+Na2SO4
соль+кислота Na2CO3+2HCl=2NaCl+H2O+CO2
36. Применение солей
1-5- производство химических веществ (соляной кислоты,гидроксида натрия, хлора, натрия, соды), 6- для
консервирования, 7- приправа к пище, 8- производство
мыла
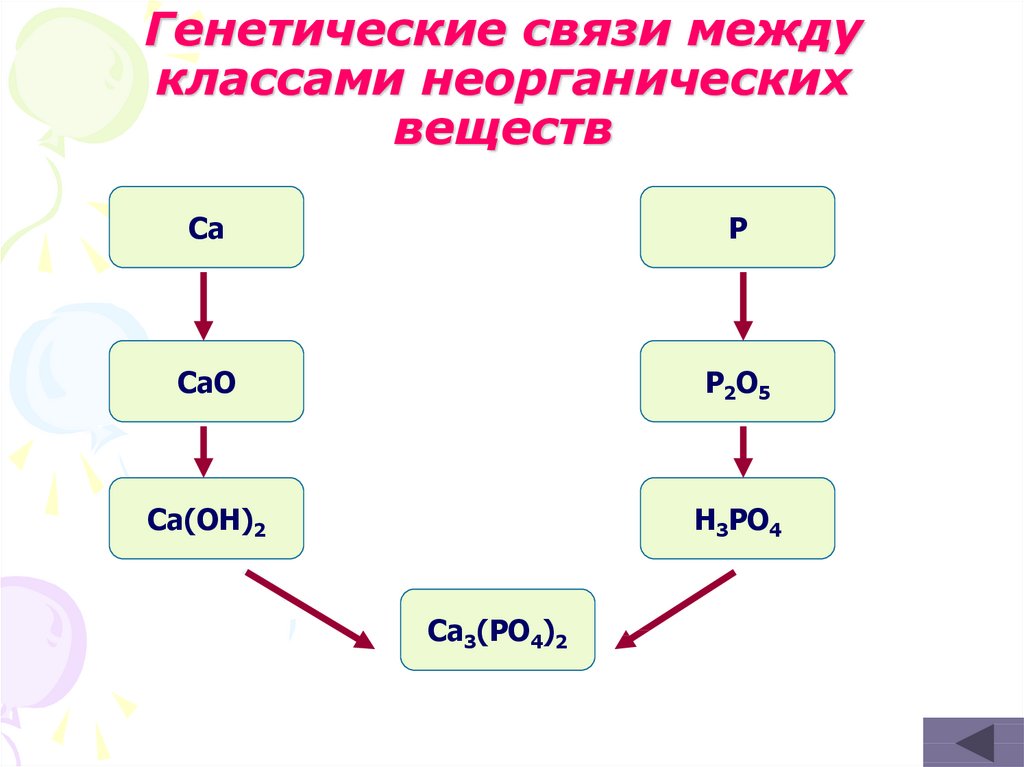
37. Генетические связи между классами неорганических веществ
CaP
CaO
P2O 5
Ca(OH)2
H3PO4
Ca3(PO4)2
38.
Дальтон Джон(1766–1844)
Предложил систему химических знаков
для «простых» и «сложных» атомов.
Йёнс Якоб
Берцелиус
(1779–1848)
Создал современный химический
язык: символы химических
элементов, предложенные им,
сохранились до настоящего времени
39.
Лавуазье АнтуанЛоран
(1743–1794)
Разработал новую химическую номенклатуру
и классификацию тел, разделив все
известные вещества на простые и сложные.
Ломоносов Михаил
Васильевич
(1711–1765)
В труде «Первые основания металлургии,
или рудных дел» (1763) рассмотрел свойства
различных металлов, дал их классификацию
и описал способы получения.
40. Домашнее задание
• 1 уровень. Осуществите превращения:Ba → BaO → Ba(OH)2 →BaCI2 → BaSO4
• 2 уровень. Из предложенных формул веществ
составьте два любых генетических ряда и
напишите уравнения реакций: Cu, AI2(CO3)3,
Na2SO4, AI(OH)3, AI2O3, CuO, NaOH, CuCI2, AI,
S, O2, Cu(OH)2, CO2, HNO3, H2CO3, MgO, SO2.
• 3 уровень. Составьте уравнения реакций,
иллюстрирующих взаимосвязь между различными
классами неорганических соединений (цепочка из
4-6 звеньев), которая начинается неметаллом и
заканчивается металлом.
41. Рефлексия
• Красный – я узнал многоинтересной и полезной
информации
• Жёлтый – было интересно,
но трудно.
• Синий – урок меня не
заинтересовал
































 Химия
Химия








