Похожие презентации:
Acizii nucleici
1.
Acizii nucleici2. Obiectivele:
1.2.
3.
4.
5.
6.
Tipurile de acizi nucleici, funcţiile şi repartizarea lor
în celulă.
Constituienţii acizilor nucleici; bazele azotate,
pentozele, acidul fosforic.
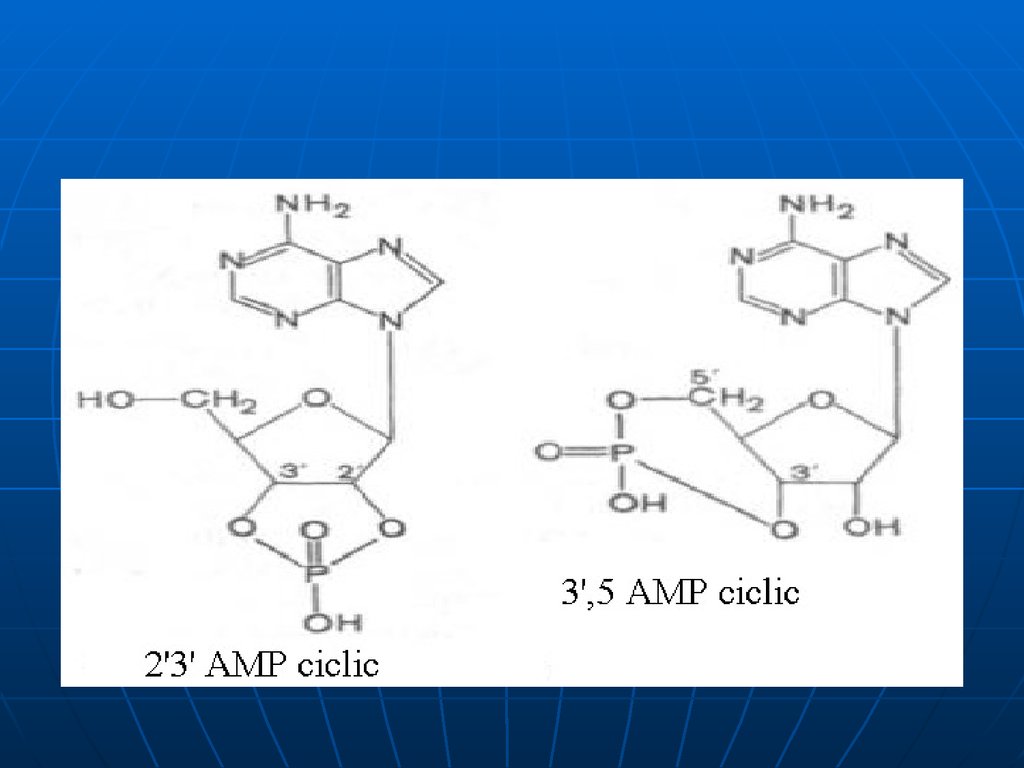
Nucleozidele şi nucleotidele. 3 , 5 - cAMP
Structura primară, secundară şi terţiară a acizilor
dezoxiribonucleici Cromatina. Nucleosomul.
Structura acizilor ribonucleici (tRNA, mRNA, rRNA).
Denaturarea şi hibridizarea acizilor nucleici.
3. Acizi nucleici
1.2.
Acizi nucleici –sunt polinucleotide,
alcătuite din mononucleotide, unite
prin legături 3’, 5’-fosfodiesterice.
ADN - acidul dezoxiribonucleic;
ARN - acidul ribonucleic.
4. ADN
a.b.
Localizarea:
97-99% - concentrat în nucleu
1-3% - situat în mitocondrii.
Rolul: păstrează şi transmite
informaţia genetică de la ADN
parental la ADN fiică sau ARN.
5. ARN
1.2.
3.
Localizarea:
11% - în nucleu
15% -în mitocondrii
50% - în ribosomi
24% - în hialoplasmă
Deosebim:i:
ARN mesager
ARN ribozomal
ARN de transport
ARN cromosomial
ARN nuclear
6.
ARN mesager (mARN) constituie 25% dintotalul ARN-lui.
Localizat -în nucleu şi citozol.
Prezintă copia sectorului de ADN şi conţine
informaţia despre structura catenei
polipeptidice a proteinei.
Rolul:Transmite informaţia de la ADN spre
ribozomi, sediul de sinteză a proteinei.
ARN ribozomal (rARN) constituie 60% din
totalul ARN-ului.
Localizat- în ribozomii citoplasmei.
Rolul - formează scheletul ribozomilor.
Joacă un rol auxiliar în procesul de
asamblare a proteinelor.
7.
ARN de transport (tARN) constituie15% din totalul ARN-lui.
Localizat: în citoplasmă, ribosomi,
mitocondrii.
Rolul: participă la activarea şi
transportul AA spre ribozomi şi
asamblarea lor în polipeptide.
ARN cromosomial – activarea genelor
ADN
ARN nuclear – formarea scheletelor
particulei proteice care transportă
ARN din nucleu în citoplasmă
8. Structura chimică a AN
La hidroliză AN degradează înmononucleotide, care la rândul lor, la
hidroliza completă degradează în BA,
pentoze şi acid fosforic.
ADN----A; G; C; T+dR+H2PO3
ARN----A; G; C; U+ R+H2PO3
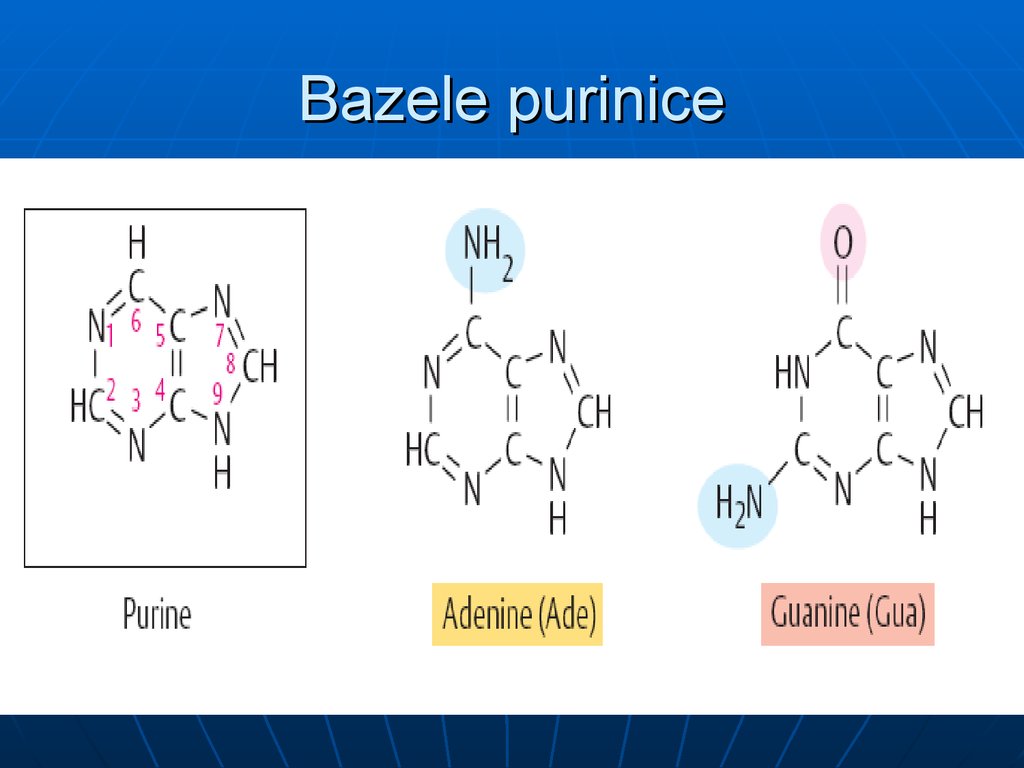
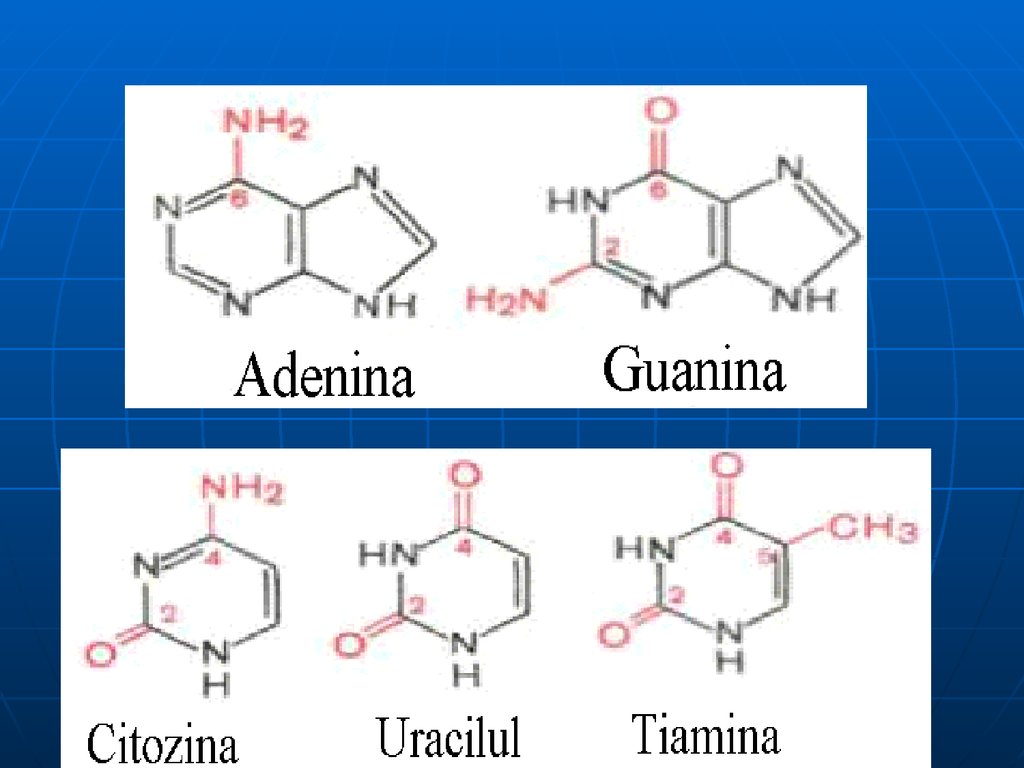
9. Bazele azotate
a. BA se clasifică în :1.
majore: purinice: A, G şi pirimidinice: C,T,U
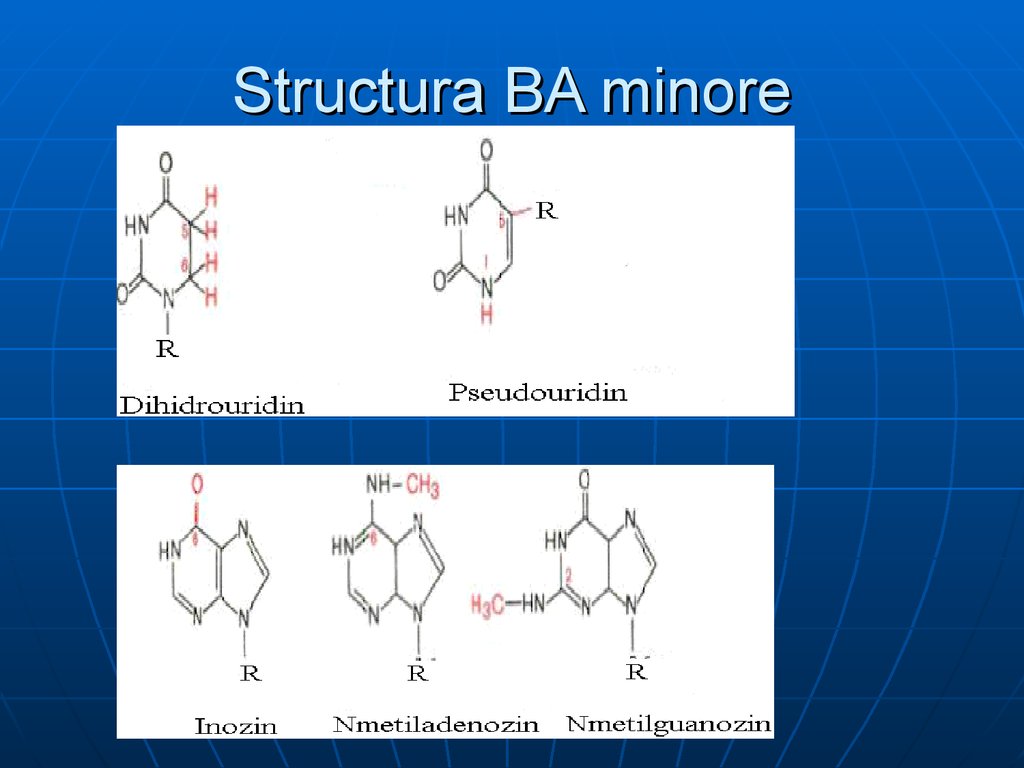
2.
minore:purinice (2metil A; 1 metilG) şi
pirimidinice (5 metil C;5 hidroximetil C)
b. Sunt slab solubile în H2O
c. Prezintă fenomenul de tautomerie (forme lactimlactam)
d. Sunt responsabile de informaţia genetică
e. BA purinice- au structură plană; cele pirimidiniceaproape plană, puţin plată
j. Max capacităţii de absorbţie în ultraviolet este
între 260-280 nm
10. Bazele purinice
11. Bazele pirimidinice
12.
13.
Molecular BiologyC1 Nucleic Acid Structure-1
Bases
Bicyclic
Purines
:
Monocyclic
pyrimidine:
Thymine (T) is a 5-methyluracil (U)
14. Structura BA minore
15.
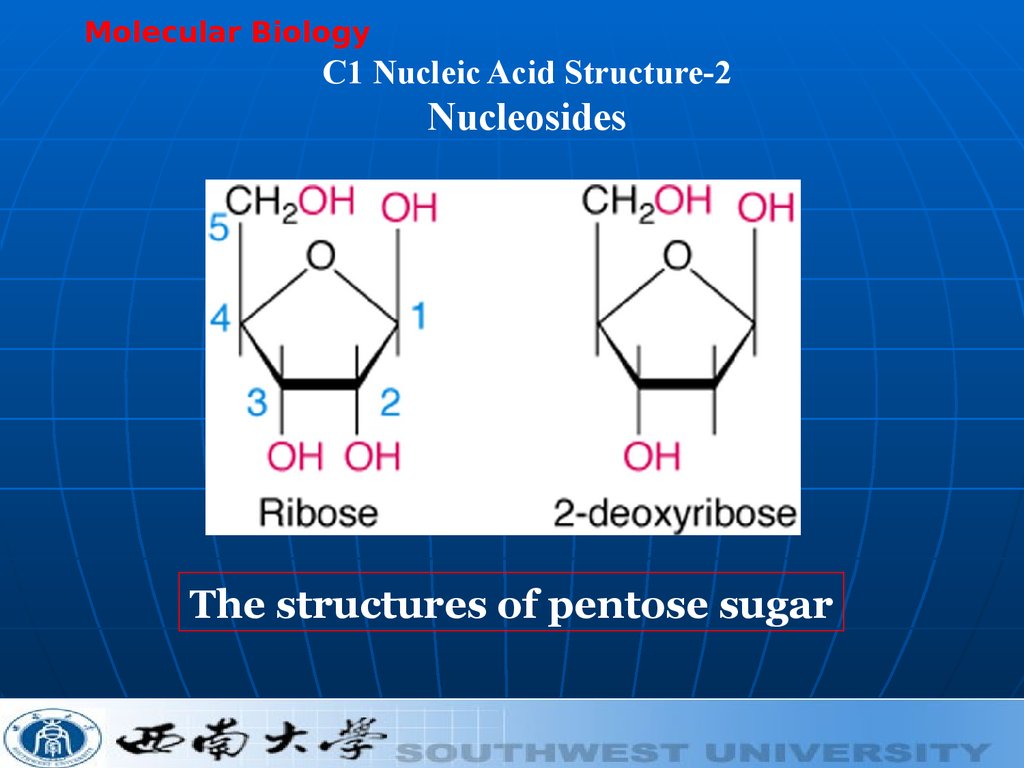
Molecular BiologyC1 Nucleic Acid Structure-2
Nucleosides
The structures of pentose sugar
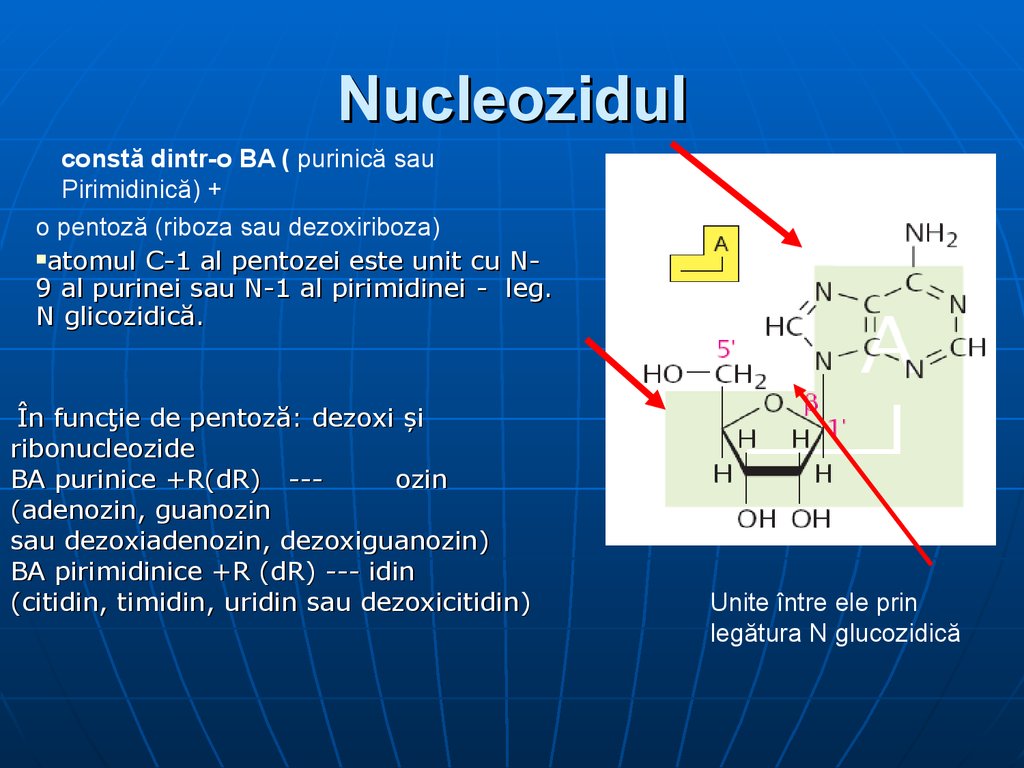
16. Nucleozidul
constă dintr-o BA ( purinică sauPirimidinică) +
o pentoză (riboza sau dezoxiriboza)
atomul C-1 al pentozei este unit cu N9 al purinei sau N-1 al pirimidinei - leg.
N glicozidică.
În funcţie de pentoză: dezoxi şi
ribonucleozide
BA purinice +R(dR) --ozin
(adenozin, guanozin
sau dezoxiadenozin, dezoxiguanozin)
BA pirimidinice +R (dR) --- idin
(citidin, timidin, uridin sau dezoxicitidin)
Unite între ele prin
legătura N glucozidică
17. Nucleozidele
Proprietăţile:Mai solubile în H2O decât
BA
Mai stabile în soluţii
alcaline
Uşor se hidrolizează la
încălzire cu acid
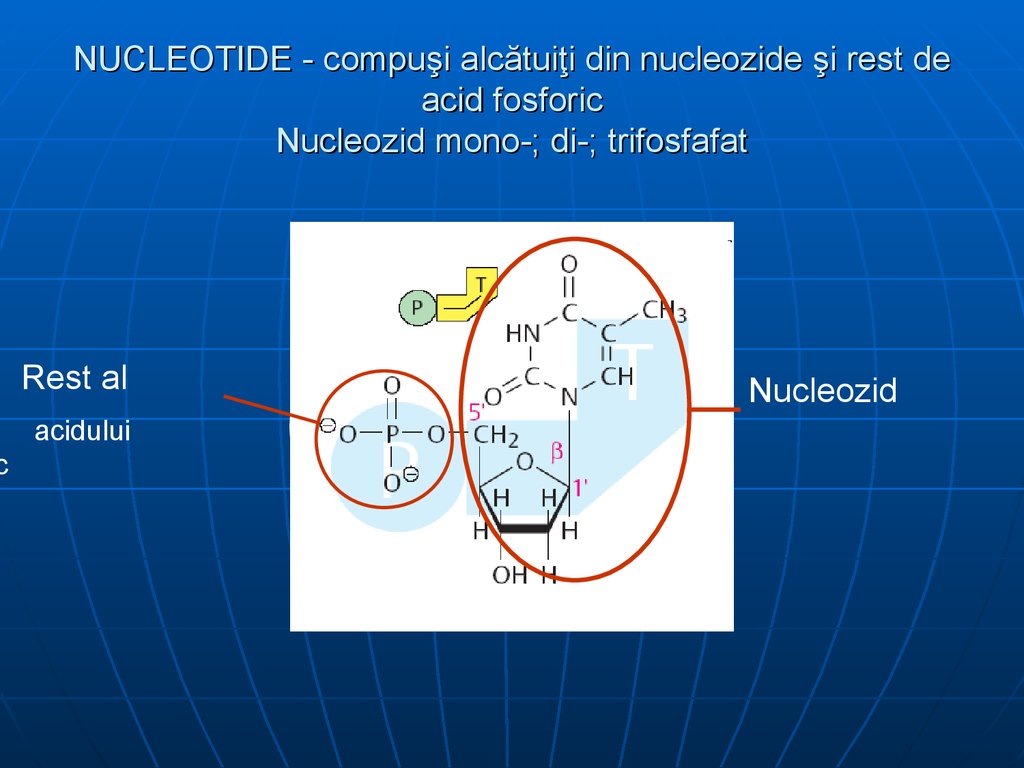
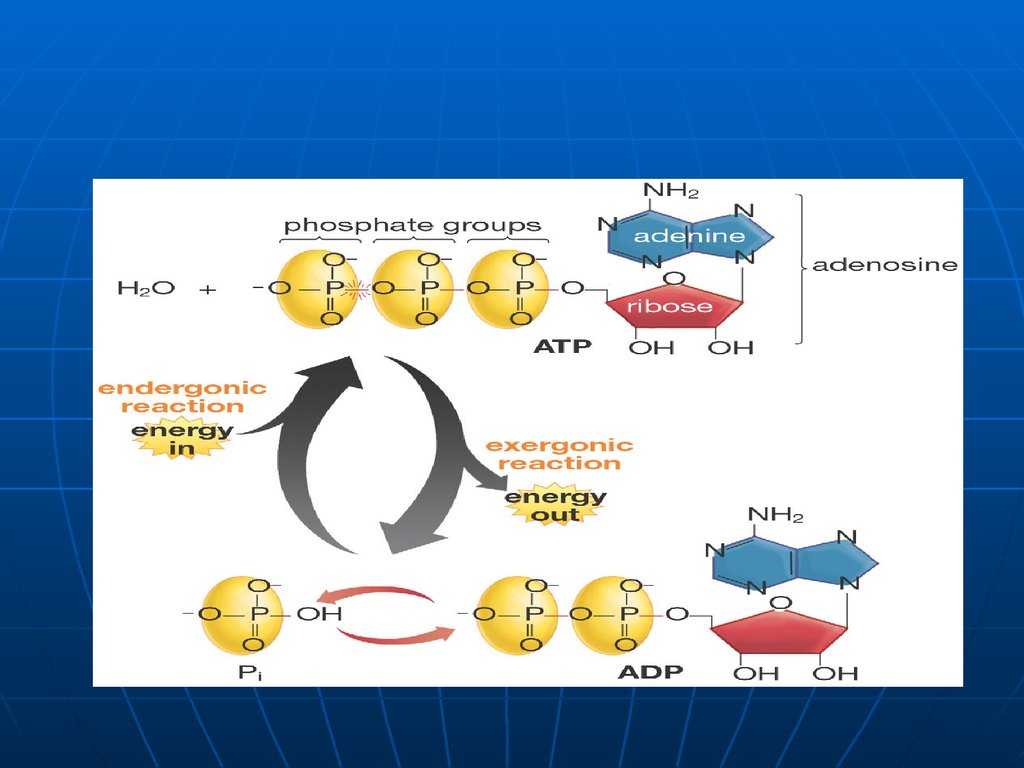
18. NUCLEOTIDE - compuşi alcătuiţi din nucleozide şi rest de acid fosforic Nucleozid mono-; di-; trifosfafat
cNUCLEOTIDE - compuşi alcătuiţi din nucleozide şi rest de
acid fosforic
Nucleozid mono-; di-; trifosfafat
Rest al
acidului
Nucleozid
19. Nucleotide - Rolul
1.2.
3.
4.
5.
Element structural al AN
Intermediari energetici
(ATP- purtătorul energiei
chimice în organism)
Intră în componenţa Co
Servesc ca activatori ai
unor molecule (UDP-Gl;
CDP-colina)
Servesc ca mesageri
secunzi intracelulari ai
hormonilor (AMPc;
GMPc)
20.
Molecular BiologyC1 Nucleic Acid Structure-3
Nucleotides
A nucleotide is a nucleoside with one or more phosphate groups
bound covalently to the 3’-, 5’, or ( in ribonucleotides only) the 2’position. In the case of 5’-position, up to three phosphates may be
attached.
Phosphate ester bonds
Deoxyribonucleotides
(containing deoxyribose)
Ribonucleotides
(containing ribose)
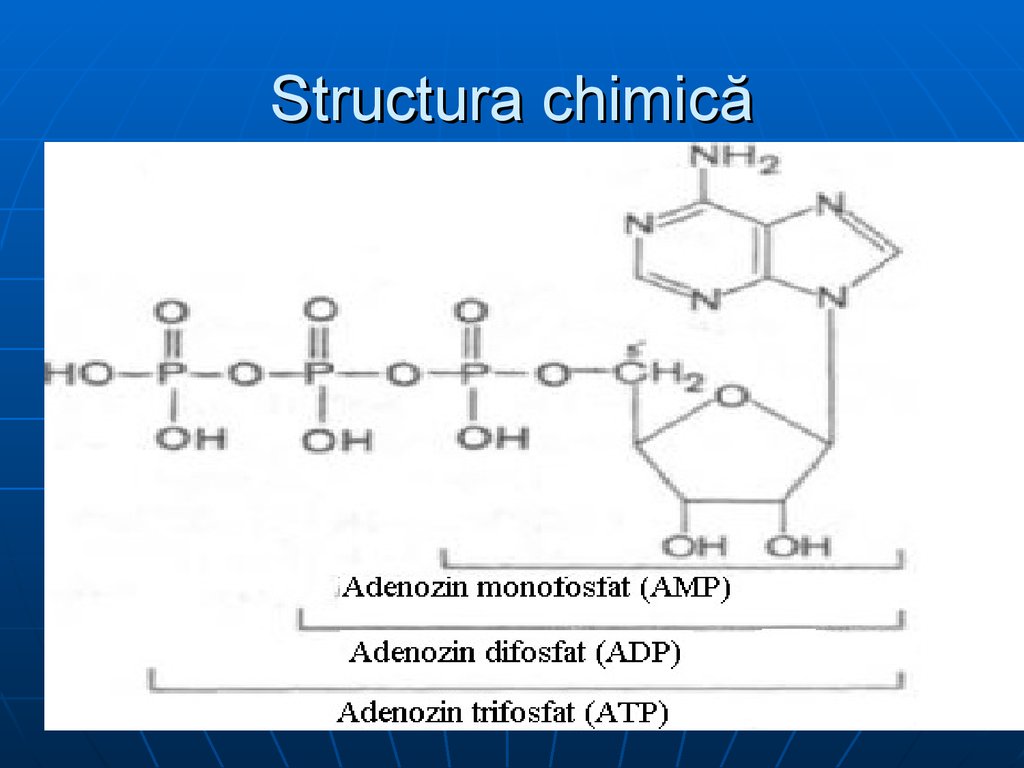
21. Structura chimică
22.
23.
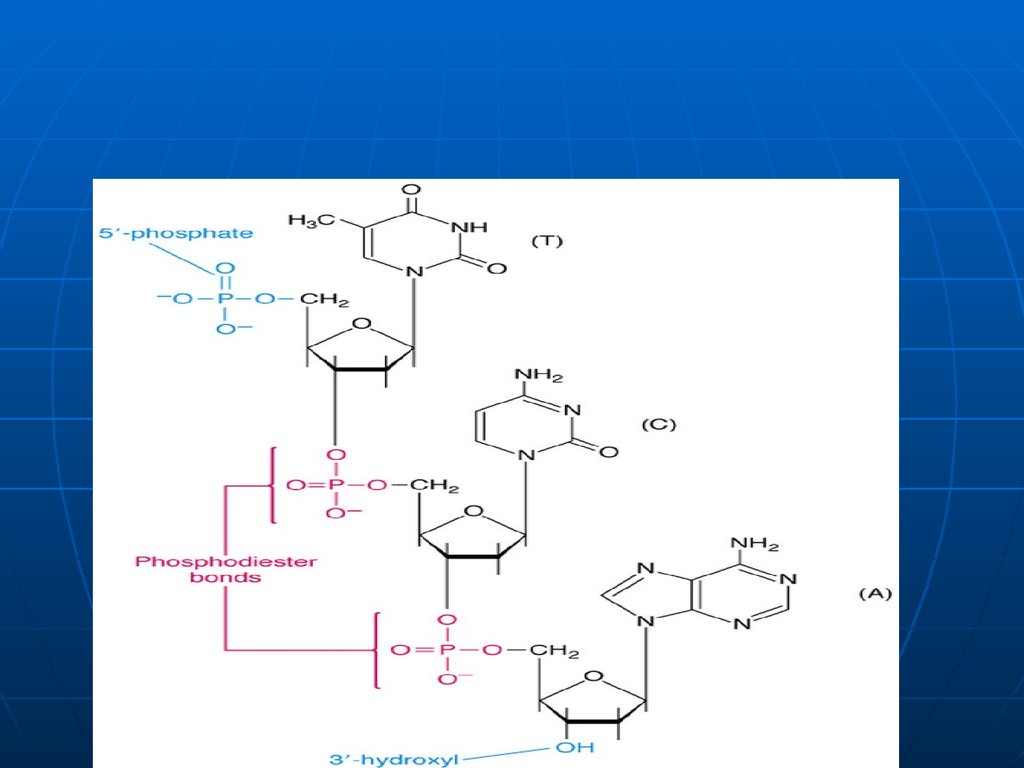
24. Structura primară a AN
Reprezintă secvenţamononucleotidelor în lanţul
polinucleotidic liniar, legate între ele
prin legăturile 3' - 5' fosfodiesterice
Catenele au două capete:
5‘ – nucleozid tri fosfatul;
3‘ – gr. OH liberă
25.
26.
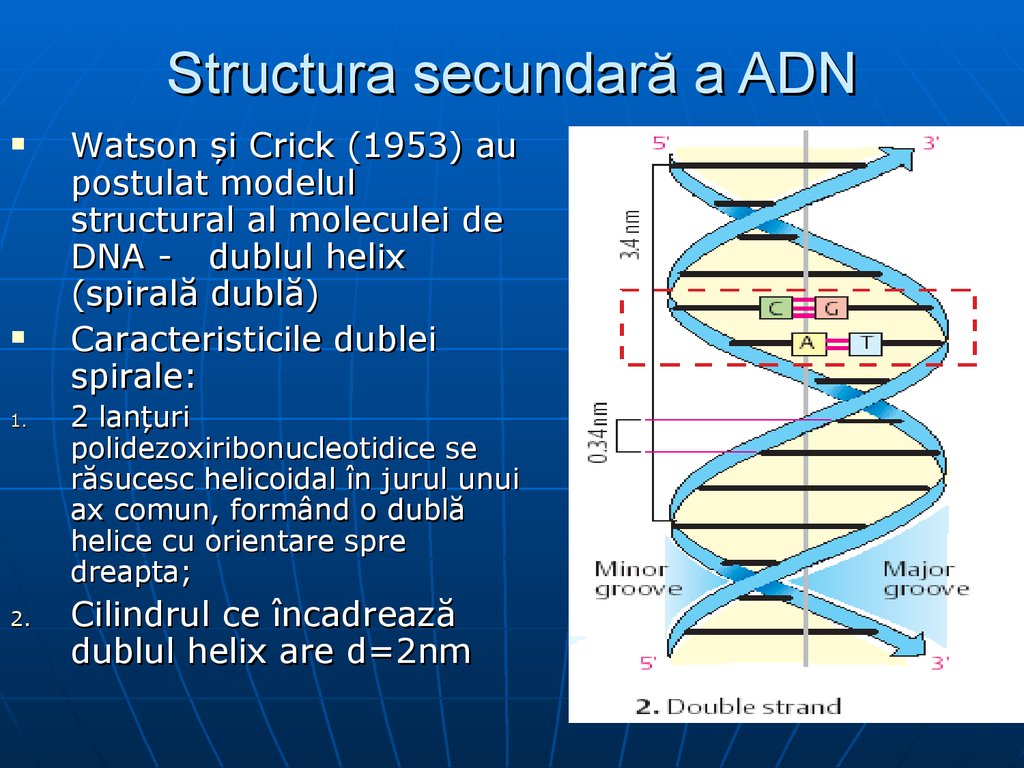
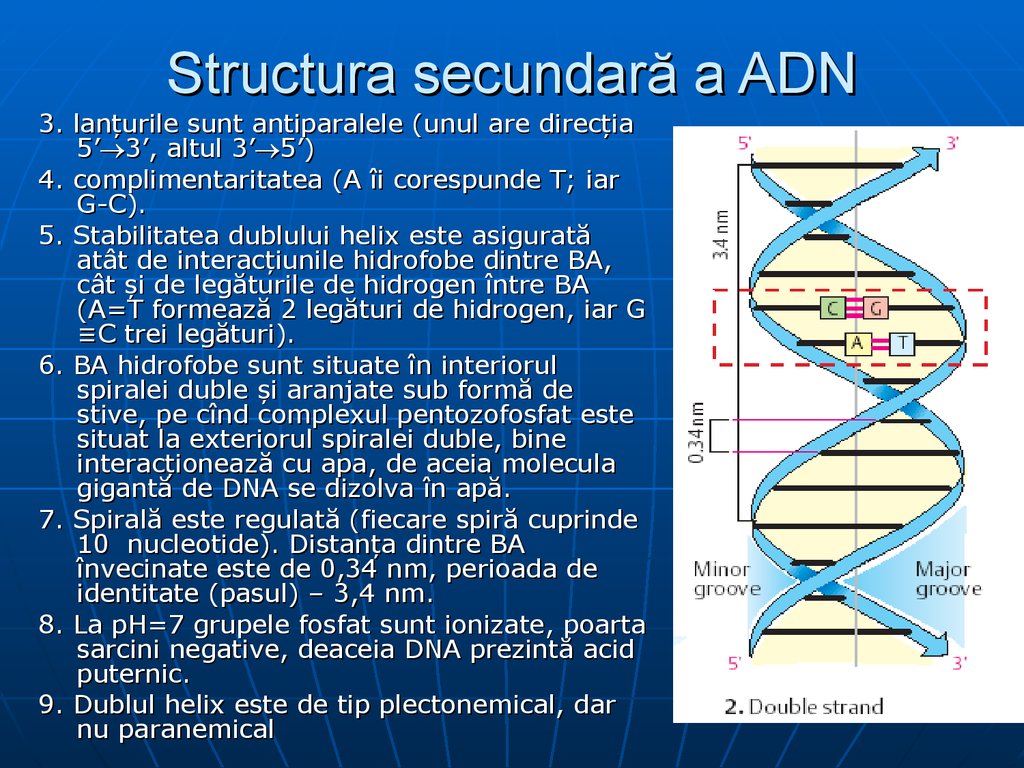
27. Structura secundară a ADN
1.2.
Watson şi Crick (1953) au
postulat modelul
structural al moleculei de
DNA - dublul helix
(spirală dublă)
Caracteristicile dublei
spirale:
2 lanţuri
polidezoxiribonucleotidice se
răsucesc helicoidal în jurul unui
ax comun, formând o dublă
helice cu orientare spre
dreapta;
Cilindrul ce încadrează
dublul helix are d=2nm
28. Structura secundară a ADN
3. lanţurile sunt antiparalele (unul are direcţia5’ 3’, altul 3’ 5’)
4. complimentaritatea (A îi corespunde T; iar
G-C).
5. Stabilitatea dublului helix este asigurată
atât de interacţiunile hidrofobe dintre BA,
cât şi de legăturile de hidrogen între BA
(A=T formează 2 legături de hidrogen, iar G
≡C trei legături).
6. BA hidrofobe sunt situate în interiorul
spiralei duble şi aranjate sub formă de
stive, pe cînd complexul pentozofosfat este
situat la exteriorul spiralei duble, bine
interacţionează cu apa, de aceia molecula
gigantă de DNA se dizolva în apă.
7. Spirală este regulată (fiecare spiră cuprinde
10 nucleotide). Distanţa dintre BA
învecinate este de 0,34 nm, perioada de
identitate (pasul) – 3,4 nm.
8. La pH=7 grupele fosfat sunt ionizate, poarta
sarcini negative, deaceia DNA prezintă acid
puternic.
9. Dublul helix este de tip plectonemical, dar
nu paranemical
29.
30. Legităţile lui Chargaff
1.2.
3.
4.
5.
6.
7.
8.
9.
Conţinutul adeninei este egal cu al timinei, iar al guaninei
cu al citozinei (A=T, iar G=C)
În orice preparat de DNA independent de specie suma
bazelor purinice este egală cu cea a bazelor pirimidinice
(A+G=T+C)
Preparatele de DNA separate din diferite ţesuturi a uneia
şi aceeiaş specie de organisme sunt absolut identice
privind componenţa nucleotidică.
Componenţa nucleotidică a DNA la aceeaşi specie nu se
modifică odată cu vârstă, nu depinde de regimul
alimentar şi modificările mediului.
dacă A+T este mai mare decît G+T avem DNA de tip AT
dacă G+T este mai mare decît A+T avem DNA de tip GT
t de topire este mai mica cînd predomină perechile A-T
t de topire este mai mare cînd predomină perechile G-C
la eucariote DNA mitocondrial este circular
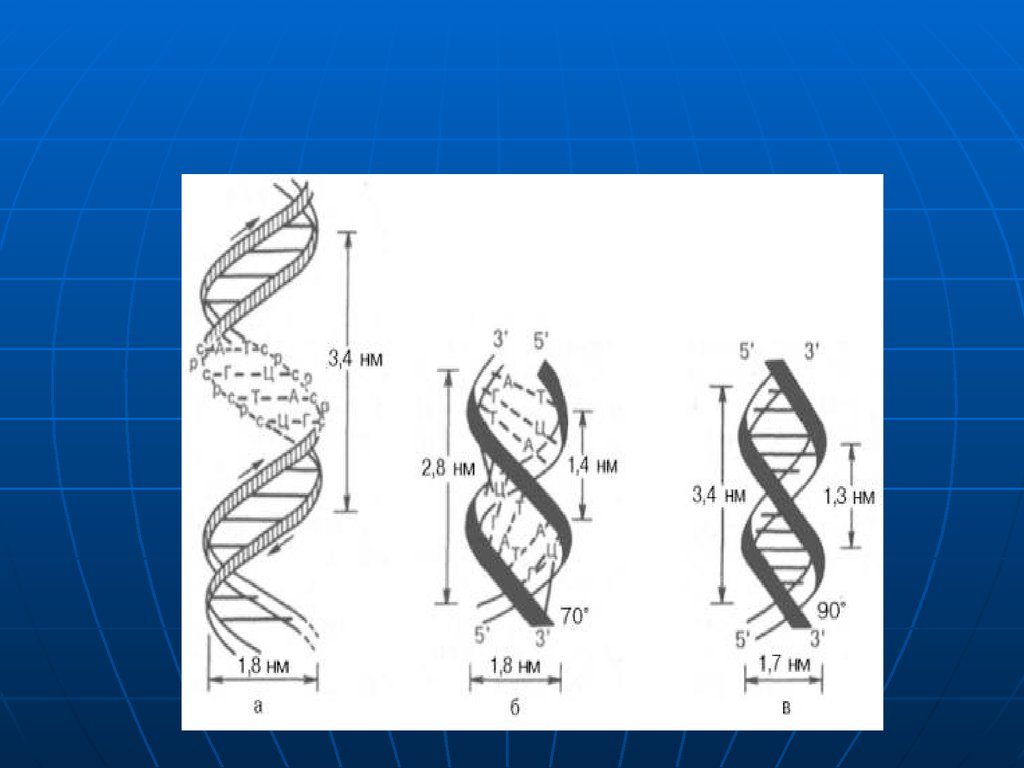
31. Există diferite forme de DNA
care sunt determinate de gradul dedehidratare a acizilor nucleici: A,B şi Z.
Modificările în dublul helix sunt
dependente de anturajul extern ai
moleculei de DNA.
Dublul helix posedă dinamism.
forma A:
conţine 11 resturi la o spiră,
este răsucită spre dreapta.
forma clasica B:
conţine 10 mononucleotide la o spiră.
este răsucită spre dreapta.
- 10 nucleotide ocupă 34 A (3,4 nm).
- o nucleotidă cuprinde 3,4A (0,34 nm).
conformatia Z spre deosebire de A
şi B este răsucită spre stînga.
-
32.
33. Structura terţiară
Reprezintă superspiralizarea dublului helix la careparticipă proteinele histonice şi formează cromatina
Unitatea structurală a cromatinei este nucleosomul
Nucleosomul – este un octamer histonic (2H2A;
2H2b; 2H3; 2H4) înfăşurat de aproximativ de 2 ori
de dublul helix cu o lungime de 146 perechi de
nucleotide.
Între 2 nucleosmi se conţin porţiuni de ADN alcătuit
din 20-60 perechi de nucleotide asociate cu H1
Lanţul polinucleosomic formează un superhelix
(solenoid), fiecare spiră are 10 nucleosomi,
d=30nm şi pasul de 10nm
34.
Compactizareacromatinei
DNA
Firul de
cromatină?
~ 1,000
30 nm Solenoid ~40 / 50
Nucleosoma
= оctamer de
histone
H2a, H2b, H3, H4
146 / 200 bp DNA
Compactizare
~10 ori
Cromosoma metafazică/
cromatina interfazică
~ 10,000
35. Structura secundară şi terţiară a ARNm
ARNm – fiecărei gene îi corespundemolecula sa de ARNm, de aceea el este
foarte heterogen
Elementul de codificare al ARNm este
tripletul nucleotidic – numit codon. Fiecare
codon corespunde unui anumit AA
Structura secundară a ARNm – o catenă
curbată
Structura terţiară – se aseamănă cu un fir
înfăşurat pe bobină, rolul căreia îl
îndeplineşte o proteină de transport
numită informer
36.
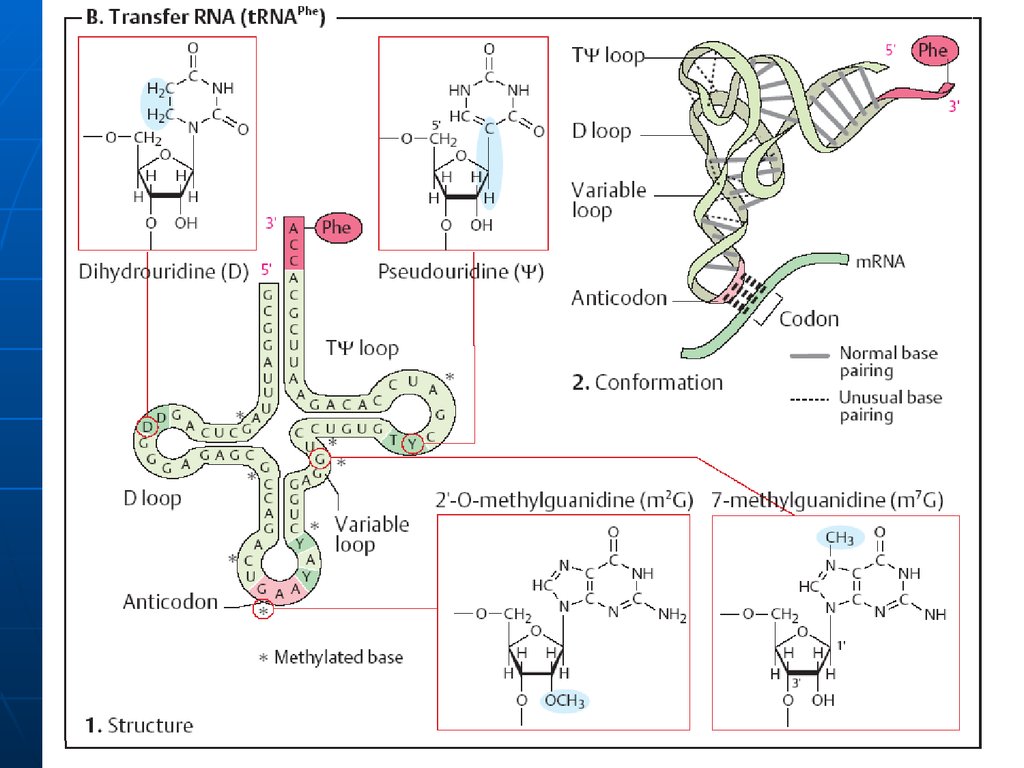
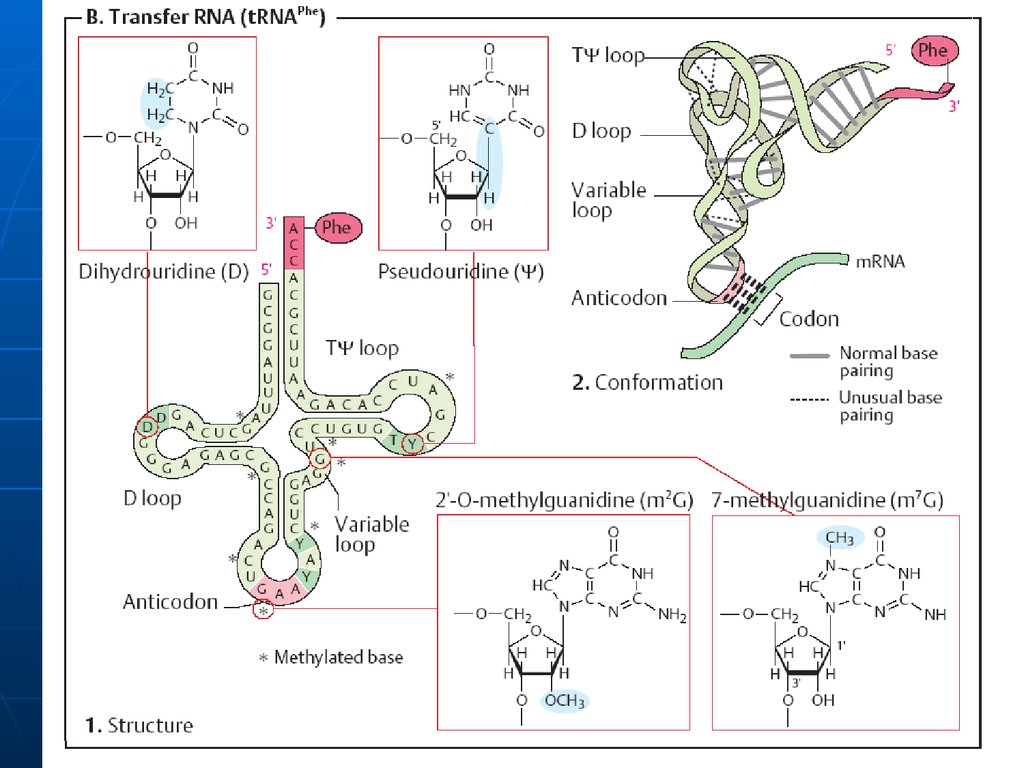
37. Structura secundară a t-RNA
1.2.
3.
4.
are infăţişarea unei "frunze de trifoi" - se formează în
urma imperecherii complementare intracatenare a
nucleotidelor anumitor sectoare.
Sectoarele, care nu sunt încadrate în formarea legăturilor
de H formează lanţuri sau bucle
Sectorul de acceptare (4 nucleotide, 3 din care au
aceeaşi succesiune- CCA cu hidroxilul 3’OH liber la care se
fixează grupa COOH al AA.
Bucla anticodonică - formată din 7 nucleotide. Conţine
un triplet nucleotidic specific pentru fiecare t-RNA numit
anticodon. Anticodonul t-RNA după principiul
complementaritătii se împerechează cu codonul respectiv
din RNAm. Interacţiunea codon-anticodon determină
ordinea aranjării aminoacizilor în catena polipeptidică.
Bucla pseudouridilică - constă din 7 nucleotide (restul
acidului pseudouridilic este obligatoriu), participă la
interacţiunea cu ribozomii.
Bucla dihidrouridinic ă - constă din 8-12 resturi
nucleotidice ( resturi de dihidrouridină ), interactiunează
cu E- aminoacil-RNAt-sintetaza, care contribuie la
recunoaşterea de către aminoacid a ARN-t specific.
38. Structura terţiară a tRNA
Are forma LInclude 2 segmente de dublu helix
situate perpendicular (fiecare helix10 perechi de baze)
În afara spiralei bazele formează
legături de hidrogen. Interacţiuni
apar între bazele necomplementare
(A-A; A-C).Multe baze sunt aranjate
în stive (hidrofobe)
39. Structura terţiară a tRNA
Are forma LInclude 2 segmente de dublu helix
situate perpendicular (fiecare helix10 perechi de baze)
În afara spiralei bazele formează
legături de hidrogen. Interacţiuni
apar între bazele necomplementare
(A-A; A-C).Multe baze sunt aranjate
în stive (hidrofobe)
40. ARNr
Structura secundară – e prezentatăprin sectoare spiralate unite între ele
cu ajutorul unei catene curbate
Structura terţiară – prezintă
scheletul ribosomului. Are forma unui
bastonaş sau ghem pe suprafaţa
căruia sunt înfăşurate proteinele
ribosomului.
41. Proprietăţile fizico-chimice ale acizilor nucleici
- masa moleculară mare.- proprietatile coloidale si osmotice, tipice
pentru toţi compuşii macromoleculari.
- Proprietăţile lor hidrofile depind de fosfaţi.
- viscozitatea şi densitatea înaltă a soluţiilor,
capacitatea de denaturare.
- la pH fiziologic toti AN sunt polianioni (-)
42. Denaturarea şi renaturarea
Denaturarea –sub acţiunea temperaturii, mediuluiPH, substanţelor chimice are loc ruperea legăturilor
de hidrogen şi forţelor hidrofobe ce stabilizează
structura secundară şi terţiară a DNA.
La denaturare DNA îşi pierde proprietăţile biologice.
Ex. încălzirea DNA-duce la desfacerea spiralei duble
în două catene ( are loc transformarea „spirală ghem“).
Degradarea unei jumătăţi de structură de ADN are
loc la temperatura de topire. ADN bogat în C şi G au
o t mai înaltă decît cele bogate în A şi T.
La răcirea treptată catenele din nou se reunesc
după principiul complementaritătii, formînd spirala
dublă nativă. Acest fenomen se numeşte renaturare
(atunci cînd t e mai mică decît cea de topire) .
La racirea bruscă renaturarea nu are loc.
Denaturarea şi renaturarea acizilor nucieici este
însoţită de schimbarea activitătii lor optice.
43. Hibridizarea AN
1.2.
3.
Pe capacitatea de renaturare a AN este bazată
metoda de determinare a gradului de înrudire a
AN, care poartă denumirea de hibridizare
moleculară.
La baza ei stă împerecherea complementară a
sectoarelor unicatenare ale AN cu formarea unui
heteroduplex
Hibridizarea se efectuează în felul următor:
AN se denaturează separat;
se incubează împreună ambele tipuri de DNA (ori
DNA şi RNA).
În condiţiile unui grad relativ crescut de
complementaritate a acestora se formează
moleculele hibride (DNA-DNA sau DNA-RNA).
Aceste molecule constau din sectoare spiralate şi
nespiralate. Cu cît gradul de înrudire este mai
înalt, cu atît hibridizarea este mai complectă.
44.
Această metodă a permisdescoperirea particularităţilor
structurii primare a DNA. S-a stabilit,
că în componenţa DNA a animalelor
se află sectoare cu o succesiune
nucleotidică identică, care de multe
ori se repetă. Hibridizarea decurge
foarte repede. Restul DNA este
prezentat printr-o succesiune unicală
a nucleotidelor, care nu se dublează.
45.
46. Obiectivele:
Dogma centrală a geneticii moleculare. Concepţia: ogenă - un polipeptid.
Replicarea ADN- mecanismul, substratele, matricea,
enzimele şi factori proteici, etapele biosintezei ADN.
Telomeraza. Rolul şi structura..
Reparaţia ADN.
Transcripţia sau biosinteza ARN: matricea,
substratele, enzimele, mecanismul
Trsanscripţia inversă.
Biosinteza ARN pe matrice de ARN
Modificările posttranscripţionale (processing)
Inhibitorii sintezei acizilor nucleici.
Ingeneria genetică şi semnificaţia ei practică. Sinteza
anticorpilor
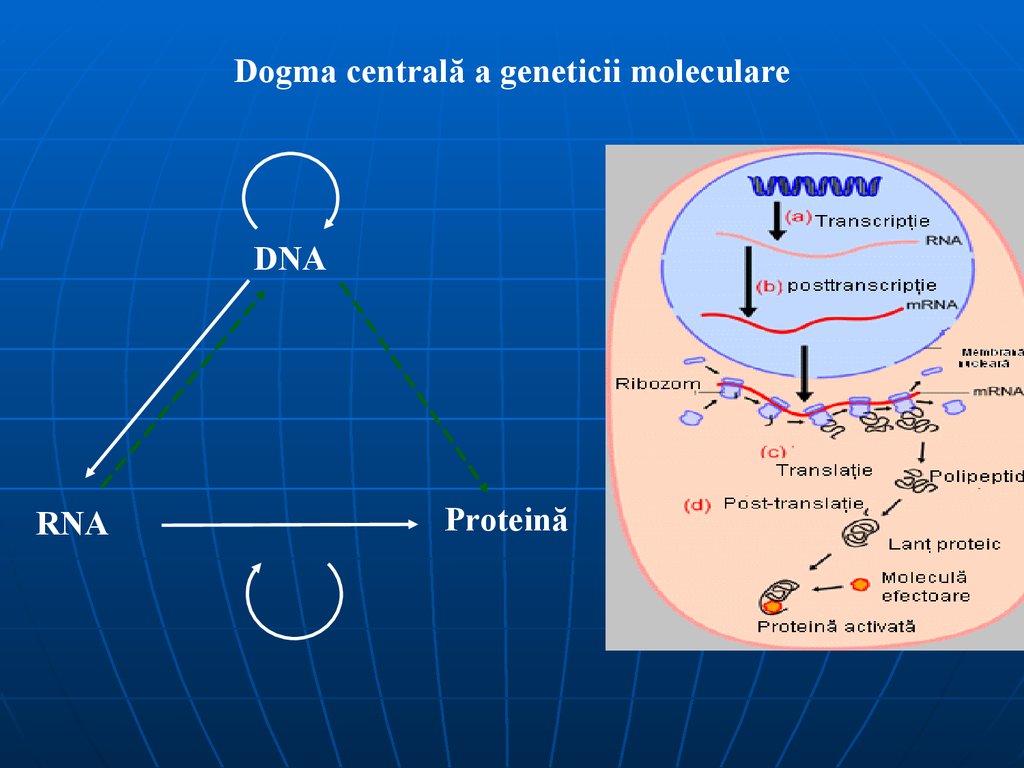
47. Dogma centrală a geneticei moleculare
Postulatul de bază a geneticei moleculare a fostformulat de Watson şi Crick (Meselson, Stahl):
este transmiterea informaţiei genetice de la ADN la
proteină. Sînt încluse trei procese:
replicarea;
transcripţia;
translaţia.
Primele două procese au loc în nucleu, iar al treilea – în
citozol.
Procesul de transcripţie este reversibil. Enzima care
catalizează transcripţia inversă se numeşte revertaza
(reverstranscriptaza) şi a fost descoperită la oncoviruşi.
Sinteza ARN-ului pe baza ARN se numeşte replicarea ARN,
ea are loc la viruşi, care nu au ADN. Procesul de translaţie
este ireversibil şi se numeşte biosinteza proteinei.
48.
Dogma centrală a geneticii moleculareDNA
RNA
Proteină
49. Structura genelor- dimensiuni, GS; GR
1.2.
Gene- porţiunile ADN ce conţin informaţia genetică cu
privire la sinteza unei proteine
Fiecărei gene îi corespunde un lanţ polipeptidic- de aici şi
conceptul: o genă –un lanţ polipeptidic
GS- genele ce codează polipeptide şi ARN. Porţiunile GS
ce conţin informaţie (transductibile) –exoni; iar
secvenţele ce nu sunt traduse în ARNm – introni
GR – segmente de ADN, repetabile, relativ mici ce au un
rol reglator.
Rolul lor:
Pot fi semnale ce ne arată începutul şi sfârşitul GS
Participă în iniţierea şi terminarea transcripţiei GS
Dimensiunile genelor – f. variabile. Ex. Proteina ce
conţine 350 AA--- 350X3=1050 nucleotide. Ştiind că BA
sunt localizate la 0,34 nm_---0,34 nm X 1050=357 nm =0,36μm
50. Replicarea
Replicarea – transmiterea informaţiei genetice de la ADN parentalla ADN fiică.
Caracteristicile:
1.
Se petrece în nucleu
2.
Proces semiconservativ
3.
se desfăşoară în trei etape : iniţiere, elongare, terminare
4.
prezenţa praimerului este obligatorie
5.
replicarea este cuplată cu desfăşurarea DNA parental (necesită
energie)
6.
replicarea decurge în ambele direcţii cu aceeaşi viteză.
7.
Pe catena întîrziată se sintetizează fragmentele Okazaki.
8.
Este bazată pe împachetarea complementară a BA
9.
Catena-fiică este antiparalelă cu catena parentală dar nu
identică după secvenţa nucleotidică
10.
Forţa motrice a procesului este hidroliza pirofosfatului
11.
angajeaza simultan intregul cromozom .
51.
52. Componentele necesare replicării:
1.2.
3.
4.
a.
b.
c.
Matriţă -Componentele
ADN bicatenar
necesare replicării:
Substrat: dATP, dTTP, dGTP, dCTP; ATP, GTP, CTP,
UTP
prezenţa ionilor de Mg, Mn; Zn
Sistemul multienzimatic complex:
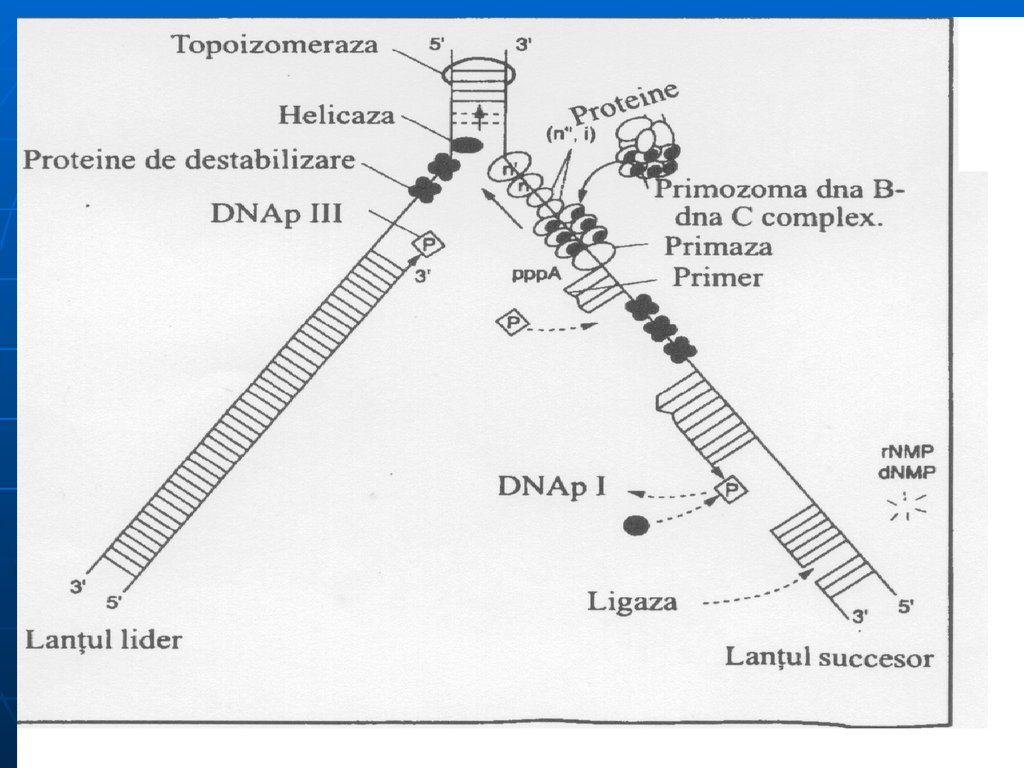
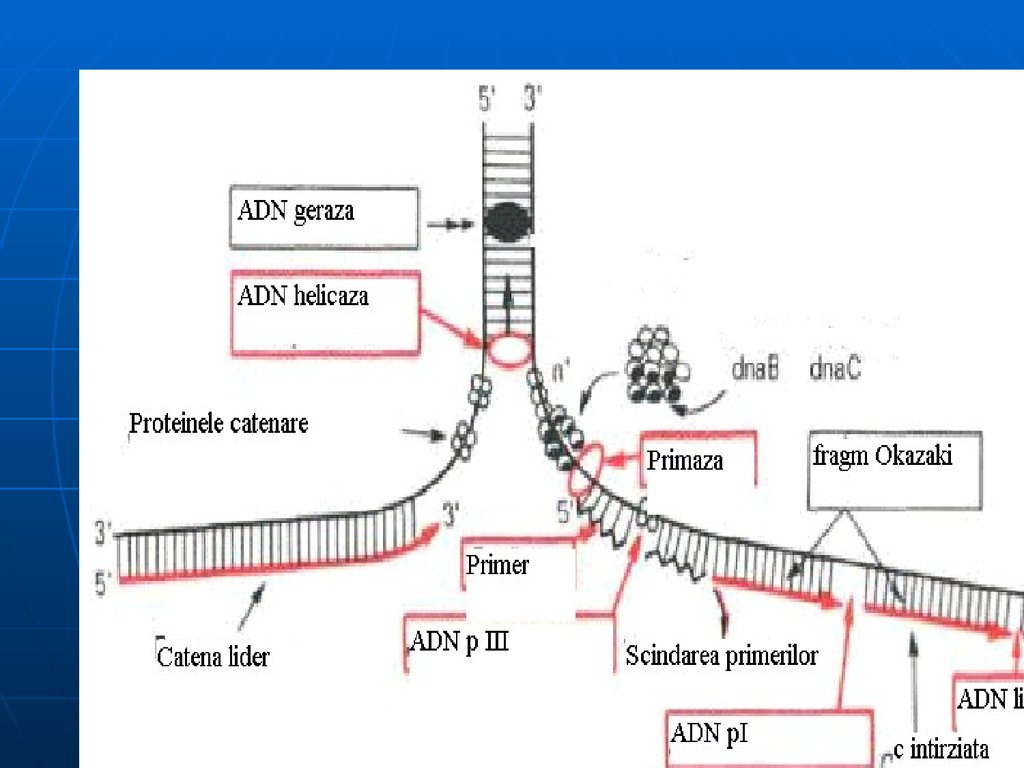
Helicaza-desfacerea dublului helix, treptat, pe
porţiuni mici. Cele 2 catene rămân separate ca
urmare a intervenţiei proteinelor de stabilizare
(SSB).
Topoizomerazele I şi II – înlătură supertorsiunile
ADN, rezolvă problemele topologice apărute în
cursul desfacerii lui. (I – introduce supertorsiuni
negative; II – scindează o leg. fosfodiesterică pe
una din catene şi permite celor 2 catene să se
rotească una faţă de alta)
ARN primază - sintetizează primerul în direcţia 5'3‘ .
53.
d. ADN polimeraza ( ADNp I, II, III)sinteza catenei fiice în direcţia 5'→3' .ADN p III:
– acţiune polimerazică (5'- 3‘) sintetizează în direcţia 5‘- 3' lanţul
polidezoxiribonucleotidic, preluînd instrucţii
de la ADN-matriţă,
- acţiune exonucleazică (3'- 5‘)
- ADN pII - rol neclar.
ADN pI - posedă activitate 5'- 3‘
exonucleazică, înlătură primerul şi-l
înlocuieşte cu fragmente de ADN
e. ADN ligaza- uneşte fragmentele Okazaki
de pe catena întîrziată. Catalizează
formarea unei legături fosfat diesterice
între 3'-OH a unui fragment de ADN şi
extremitatea 5' monofosfat al altuia.
54. Mecanismul replicării
a.3 etape: iniţierea, elongarea, terminarea
Originea replicării este reprezentată de o secvenţă specifică
de nucleotide – secvenţa ori.
Replisoma (complex proteic) recunoaşte punctul de
origine.
Iniţierea parcurge două etape:
Formarea furcii de replicaţie- ataşarea replisomului la
punctul de origine al replicării şi sub acţiunea helicazelor are
loc desfacerea duplexului parental pe anumite porţiuni –
replicatori (la scindarea leg. de H dintre BA - se utilizează
min 2 mol. de ATP). La desfacerea duplexului parental apar
regiuni superhelicoidale, care se reglează cu ajutorul girazei
(topoizomerazei).
Topoizomeraza efectuează rupturi monocatenare apoi
sudează legătura fosfodiesterică şi favorizează relaxarea
structurii DNA
55.
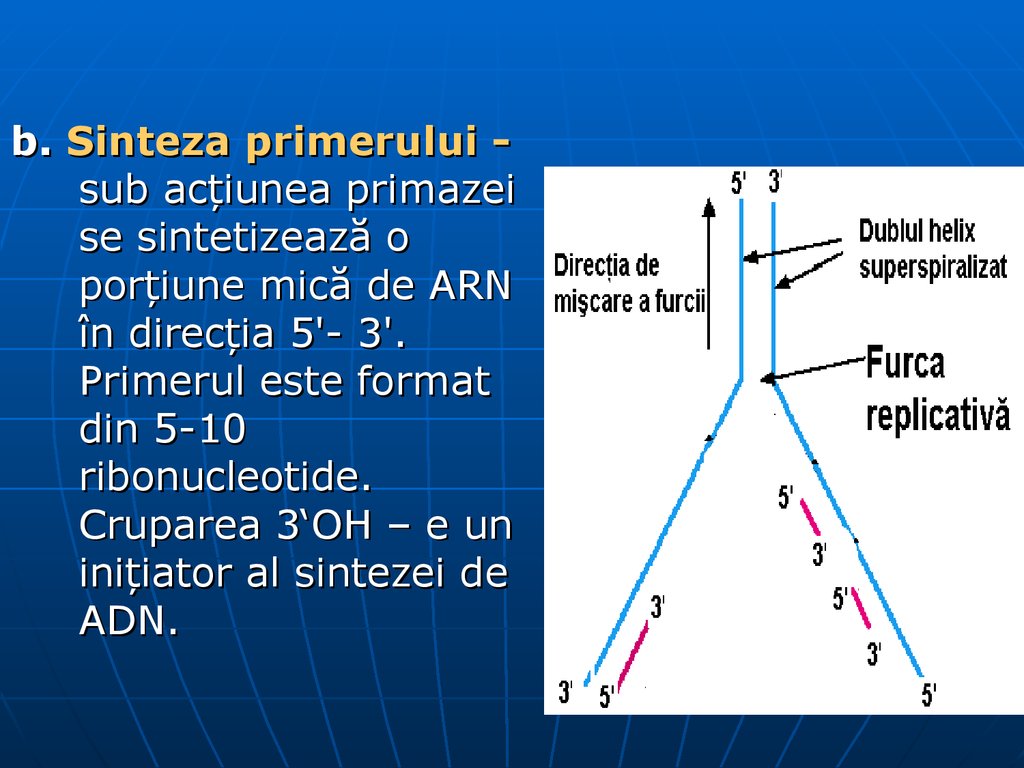
b. Sinteza primerului sub acţiunea primazeise sintetizează o
porţiune mică de ARN
în direcţia 5'- 3'.
Primerul este format
din 5-10
ribonucleotide.
Cruparea 3‘OH – e un
iniţiator al sintezei de
ADN.
56. Elongarea
ADN polimeraza III unindu-se lacapătul 3' OH al primerului începe
sinteza ADN fiică. Reacţia decurge
prin atacul nucleofil al grupei 3' OH al
primerului asupra unui dRNTP
complementar catenei de ADN
matriţă. Se formează legătura
fosfodiesterică şi se eliberează PP;
hidroliza PP determină polimerizarea
propriu zisă.
Elongarea decurge în direcţia 5'→ 3‘,
şi parcurge cu aceeaşi viteză pe
ambele catene
Catena de bază se va sintetiza
continuu, iar cea întîrziată discontinuu: va fi formată din
fragmente Okazaki (dimensiuni de
1000 – 2000 nucleotide la procariote
şi 150-200 la eucariote).
ADN polimeraza I exclude primerii şi
sintetizează complementar ADN.
Fragmentele sînt unite cu enzima ADN
ligaza (necesită ATP la eucariote şi
NAD la procariote).
57. Terminarea
Terminarea replicării are loc atunci,cînd cele două bifurcaţii de replicare
se întîlnesc într-o regiune opusă
regiunii "ori". Proteinele speciale
semnalizează oprirea repilcării
prevenind acţiunea helicazelor.
58.
59.
60. Replicarea la eucariote
Particularităţi:ADN polimerazele: αβγδ
α- implicată în replicarea ADN nuclear- responsabilă de
sinteza catenei întârziată – sinteza primerilor
δ – răspunde de sinteza catenei lider. Ea manifestă
acţiune exonucleazică
β – implicată în reparaţia ADN
γ - implicat în replicarea ADN mitocondrial, acţiune
exonucleazică
Bifurcaţia replicii este de 3000 baze pe minut comparativ
cu 16.000 la procariote
Pe o moleculă de ADN există mai multe origini de
replicare (3X104 - 3X105 separate prin perechi de
baze). În aceste origini multiple de replicare se
organizează bifurcaţii- ce se deplasează biderecţional pe
cromosomul eucariot în curs de replicare.
Fragmentele Okazaki 150-200 nucleotide
61. Telomer Telomeraza
Replicarea capetelor 5’ alecatenelor este incompletă (teoria
lui Olovnicov, 1971), deoarece
după înlăturarea primerului
ultimului fragment Okazaki, ADN p
I nu e e capabilă să completeze
aceste goluri. Astfel la fiecare
replicare, capetele ADN se
scurtează.
Aceasta nu afectează informaţia
genetică deoarece catenele conţin
fragmente repetitive neinformative
– telomere.
Telomerele sunt replicate de o E
specifică – telomeraza
Telomeraza - reprezintă o
ribonucleoproteidă: ARN şi proteină
Subunitatea proteică TRT
(telomeraze revers transcriptase)
posedă activitate catalitică
62.
Telomeraza – fiind o revertază (ADNpolimeraza ARN dependentă)
foloseşte ca matriţă propria coenzimă
– un fragment de ARN.
I etapă – are loc asocierea
telomerazei la capătul 3’ al catenei
lider din regiunea telomerică- TTAGGG
II – E extinde catena, utilizând ca
matriţă ARN telomeric (se repetă)
III – Catena complementară a ADN
telomeric e sintetizată după principiul
catenei întârziate de ADNp
63. Mecanismul elongării capetelor cromozomului la eucariote
64.
65. Mecanismul elongării capetelor cromozomului la eucariote
cromozomaGGGTTAG 3’
AUCCCAAUC 5’
Fixarea telomerei TTAGGG
elongarea
GGGTTAGGGTTAG
5’
AUCCCAAUC
translocarea
GGGTTAGGGTTAG
5’
AUCCCAAUC
66.
Structura şi funcţia RNAtelomerazice.
Structura primară: la majoritatea
RNA telomerice, regiunea matricială
se află la depărtarea de 50
nucleotide de la capătul 5’, şi are
următoarea succesiune de nucleotide
5’-CUAACCCUA-3’.
Structura secundară e compusă
din 4 bucle şi un fragment
unicatenar, ce conţine matriţa pentru
sinteza DNA telomerice.
67. Inhibitorii telomerazei
oligonucleotidele modificate,complementare regiunii matrice a RNA –
telomerazice. Aşa nucleotide specific se
fixează de matriţa RNA –telo a omului,
inhibînd activitatea telomerazică in vitro.
In vivo apare problema transportului
inhibitorilor prin membrana celulară şi
mişcarea dirijată în nucleul celular.
Ca inhibitori au fost testaţi şi inhibitorii
reverstranscriptazelor – azidotimidina,
didezoxiguanozina.
68.
La om telomeraza e activă numai încelulele embrionale, în epiteliul
intestinului, spermatozoizi şi celule
canceroase.
69.
Numărul telomerilor determinădurata vieţii fiecărei celule şi
condiţionează reducerea critică a
numărului lor, induce moartea
programată a celulei deci pierderea
motivelor telomerice este cauza
imbătrînirii (telomera conţine mii de
motive TTAGGG).
lungimea telomerei este marcherul
biologic al îmbătrînirii.
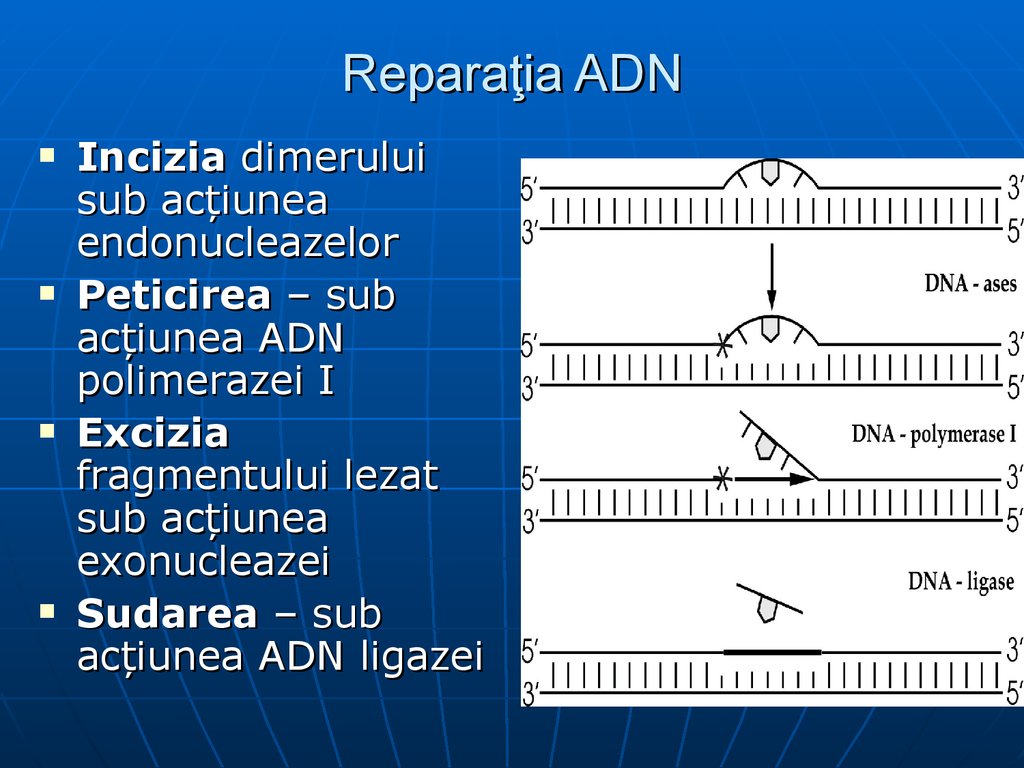
70. Reparaţia ADN
1.2.
3.
4.
Erorile în timpul replicării sunt reduse la
minimum datorită DNA polimerazei ce
posedă funcţie endonucleazică
Tipuri de deteriorări:
Formarea de breşe
Modificarea BA
Pierderea de BA
Formarea dimerilor de pirimidină sub
acţiunea razelor ultraviolete
71. Reparaţia ADN
Incizia dimeruluisub acţiunea
endonucleazelor
Peticirea – sub
acţiunea ADN
polimerazei I
Excizia
fragmentului lezat
sub acţiunea
exonucleazei
Sudarea – sub
acţiunea ADN ligazei
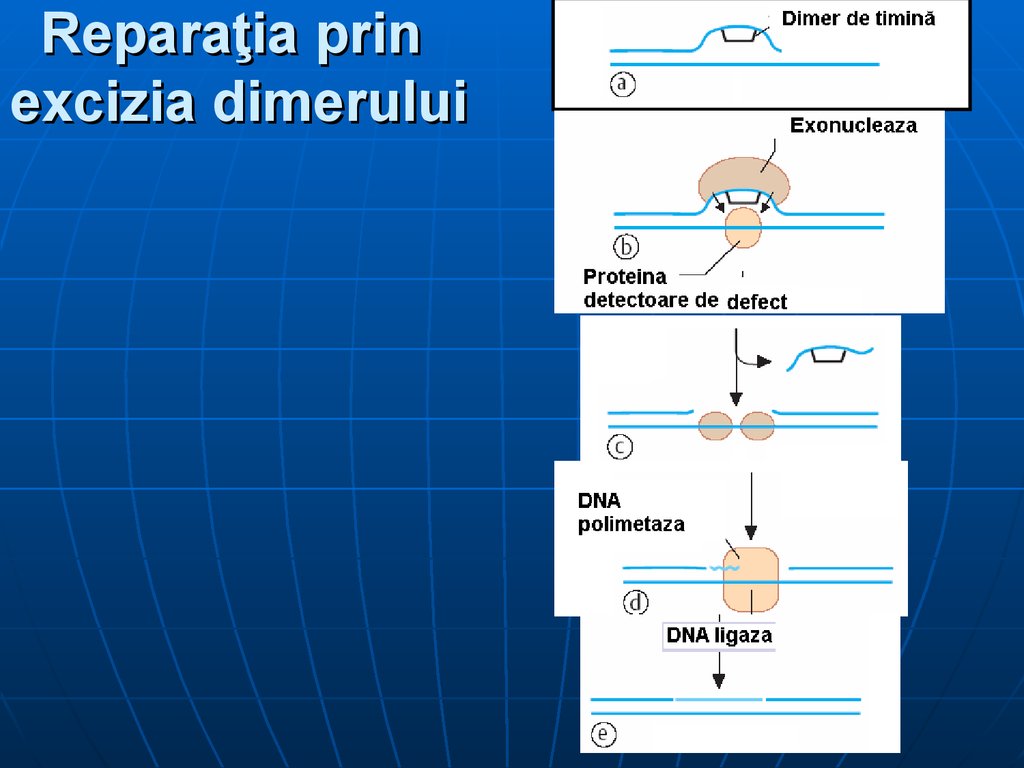
72. Reparaţia prin excizia dimerului
73. Reparaţie prin fotoreactivare
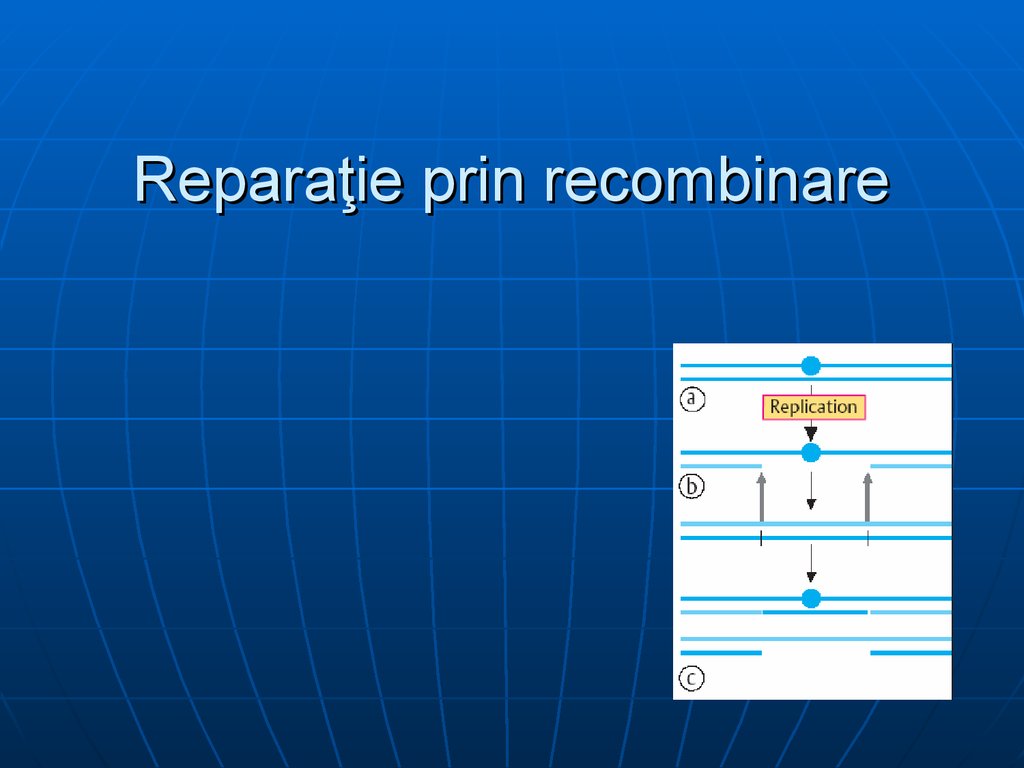
74. Reparaţie prin recombinare
75. Transcripţia
biosinteza ARN pe matriţă de ADNParticularităţi:
Matriţă - DNA dublu helicoidal (prezenţa
catenei anticodogene de ADN) (catena+),
Substrat - ribonucleozidtrifosfaţi (ATP, GTP,
CTP, UTP)
Sinteza are loc în direcţia 5’ 3’
Este asimetrică – copierea catenei
necodificătoare
Este incompletă –are loc copierea doar a
unei porţiuni de ADN (transcripton:
promotor, operator, GS, terminator)
Forţa motrice a procesului e hidroliza PP
Enzima - ARN polimeraza
76. ARN polimeraza
este o holoenzimă2.
la procariote - este oligomer din 5 protomeri
(2 , , 1 şi sigma ).
subunităţile – centre catalitice;
- fixează substratul;
1 – se leagă de ADN,
- are rol în recunoaşterea secvenţelor
matriţei numit promotor, unde aderă enzima
la eucariote:
1.
RNApI sintetizeaza RNA ribozomal (28S si 18S)
2.
RNApII sintetizeaza RNAm
3.
RNApIII sintetizeaza RNAt, RNAr 5S şi molecule mai mici
1.
3. Nu necesită prezenţa primerului
4. Nu posedă funcţie nucleazică, doar polimerazică
5. ADN polimeraza conţine Zn2+ şi necesită
prezenţa în mediu a ionilir de Mg2+, Mn2+
77. Etapele transcripţiei
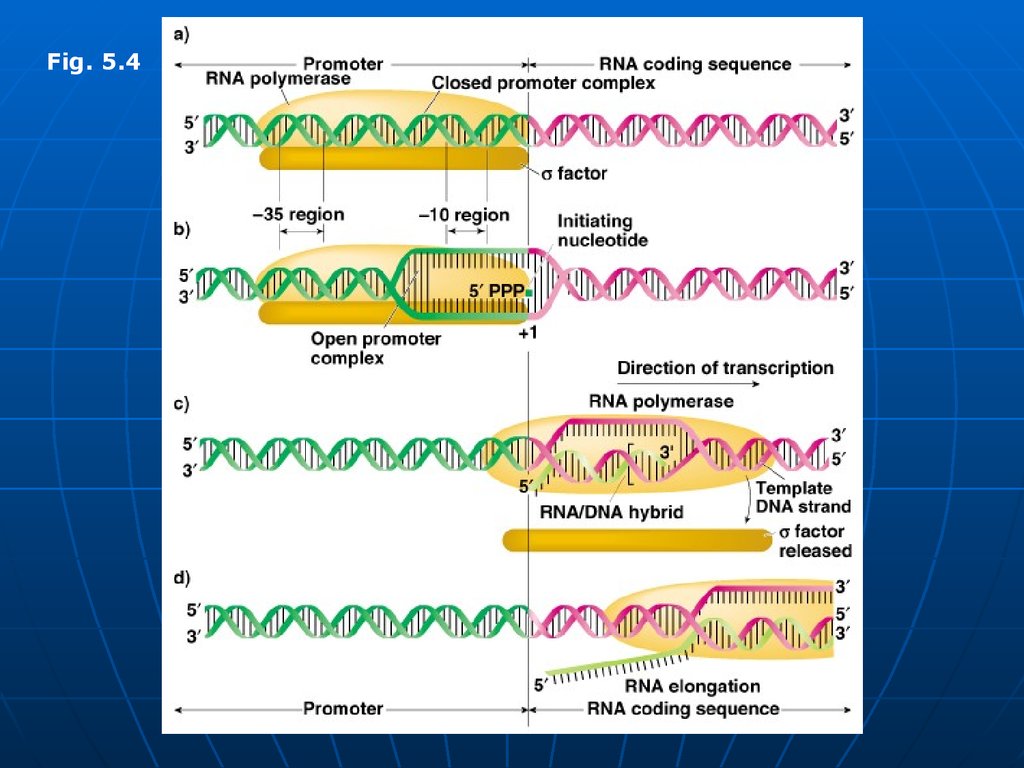
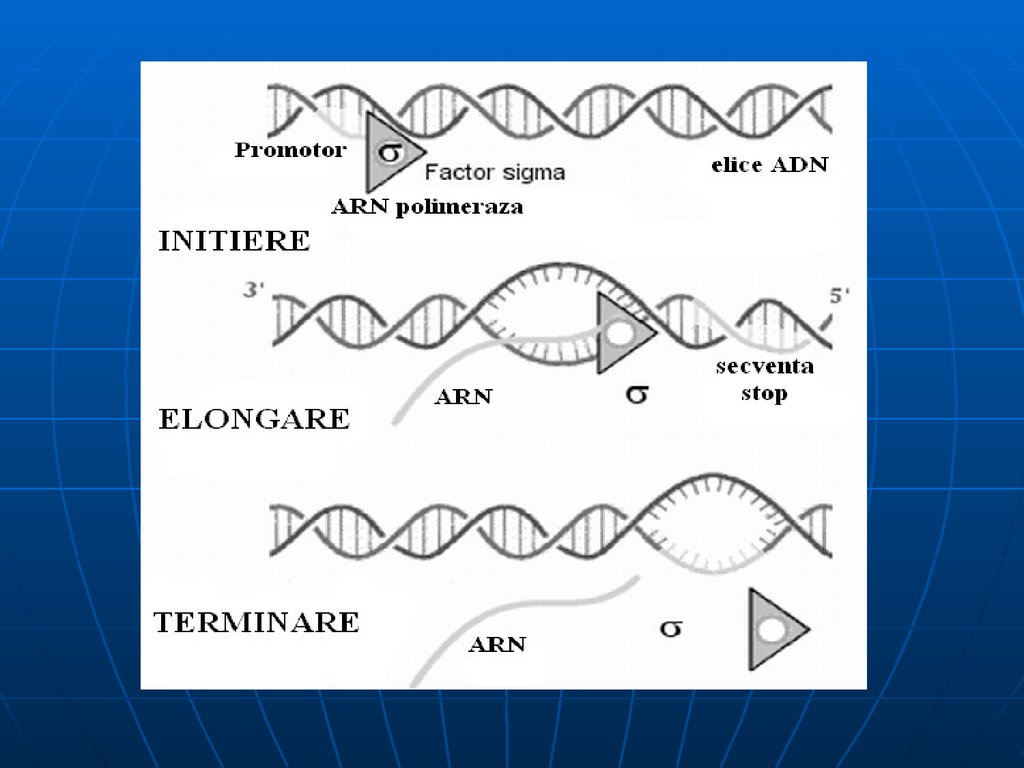
Sinteza decurge în 3 etape: iniţierea, elongarea, terminarea.Iniţierea – începe în anumite secvenţe de ADN numite
promotor (P – 40 nucleotide).
Pe P deosebim 2 locusuri: de recunoaştere (depistat cu
ajutorul sigmei) şi locusul de legare laxă a ARN
polimerazei. Locusul de recunoaştere e situat la o distanţă
de 25 nucleotide de locusul de legare şi 10 nucleotide de la
punctul de iniţiere (+1)
Toţi P bacterieni au 2 secvenţe consens situate pe catena
codificătoare:
Caseta Pribnow (-10) 5’ TATAAT 3’ –responsabilă de
iniţierea denaturării locale a ADN
Caseta -35
5’ TTGACA 3’ - la care are loc asocierea
primară a ARN polimerazei
subunitatea recunoaşte caseta -35 şi se leagă la ea. E.
alunecă de-a lungul ADN şi în jurul casetei -10 (Pribnow)
deschide dublul helix – formând complexul deschis de iniţiere
ARN p catalizează formarea primei leg. fosfodiesterice între
nucleotidul +1 şi +2 - disociază, iar E-cor continuă sinteza.
78.
Fig. 5.479. Etapele transcripţiei
Sinteza decurge în 3 etape: iniţierea, elongarea, terminarea.Iniţierea – începe în anumite secvenţe de ADN numite promotor (P – 40
nucleotide). ARN – polimeraza recunoaşte cu ajutorul sigma
Toţi P bacterieni au 2 secvenţe consens situate pe catena codificătoare:
1.
Caseta Pribnow 5’ TATAAT 3’
2.
Caseta 35
5’ TTGACA 3’
P la eucariote:
1.
GC casete GGGCG
2.
CAAT casete CCAAT
3.
Caseta Hogness –TATAT/AT
Primele 2 sunt responsabile de frecvenţa transcripţiei (când începe), a 3 - implicată în iniţiere – semnal (unde). Toate sunt responsabile de exacitatea
iniţierii
Pe P deosebim 2 locusuri: de recunoaştere (depistat cu ajutorul sigmei) şi
locusul de legare laxă a ARN polimerazei. Locusul de recunoaştere e
situat la o distanţă de 25 nucleotide de locusul de legare şi 10 nucleotide de
la punctul de iniţiere (+1)
80.
Sigma subunitatea găseşte punctul de iniţiere şi:1. Activează identificarea secvenţelor de RNA
polimerază
2. Ia parte la desfacerea dublului helix de ADN
3. Ia parte la formarea primei legături
fosfosiesterice
Astfel complexul de iniţiere este format, sigma
subunitatea e disociată de la holoenzimă şi ia
parte la iniţierea unui alt ciclu de transcriere.
81. Elongarea şi Terminarea
Elongarea - alunecarea ARN polimerazei pematrţa de ADN – sinteza transcriptului (50
nucleotide pe secundă) . RNAp nu controlează
catena sintetizată – erorile sunt mai multe faţă de
replicare. Pe măsură înaintării ARNp are loc
desprinderea ARN de la ADN şi refacerea dublului
helix
Terminarea – RNAp recunoaşte secvenţele
nucleotidice specifice de pe ADN, ce conţin un
număr mare de G, C . Proteina ρ - se asociază la
E şi se mişcă împreună cu ea, însă la identificarea
semnalelor de terminare coboară de pe matriţă şi
încetineşte acţiunea E,producând transcriptul cu
folosirea energiei – ATP
82.
83. Transcripţia la eucariote
RNA p alcătuită din 9-11 subunităţi2.
Folosesc mai multe tipuri de ARN p:
a.
ARN polimeraza I – ARNr (18S, 28S, 5,8S; 45S) –în nucleoli;
b.
ARN polimeraza II – ARNm;
c.
ARN polimeraza III –ARNt şi ARNr (5S)
d.
ARN polimeraza IV (mitocondrială)- toate tipurile de ARN
mitocondrial
P la eucariote:
GC casete GGGCG (-90)
CAAT casete – 5-GGCCAATCT -3 (-75)
Caseta Hogness –TATAT/AT (-35)
Primele 2 sunt responsabile de frecvenţa transcripţiei (când începe),
a 3 - - implicată în iniţiere – semnal (unde). Toate sunt
responsabile de exacitatea iniţierii
Secvenţele alcătuite din 10-20 nucleotide “enhancers” şi “silencers” –
cresc şi scad respectiv V transcrierii; pot fi situate la distanţe
mari de gena transcrisă.
1.
84. Procesingul
Toţi precursorii de ARN în nucleu trec etapa dematurizare posttranscripţională. Pe parcursul
procesingului - pre-ARN se transformă în ARN
matur.
Procesingul înclude:
1. Modificarea fragmentelor terminale 5’ şi 3’
ale ARN:
a. “Cap”-area: la capătul 5’ -este adiţionată
guanozina metilată (5’- 5’ trifosfat - protejarea
mARN de atacul 5’-exonucleazelor şi pentru
recunoaşterea de către ribosomi ca semnal de
iniţiere);
b. la capătul 3’ – se adaugă o secvenţă mare de
poli A (200 A -coadă). Ea serveşte la exportul
moleculelor de ARN din nucleu în citoplasmă.
85.
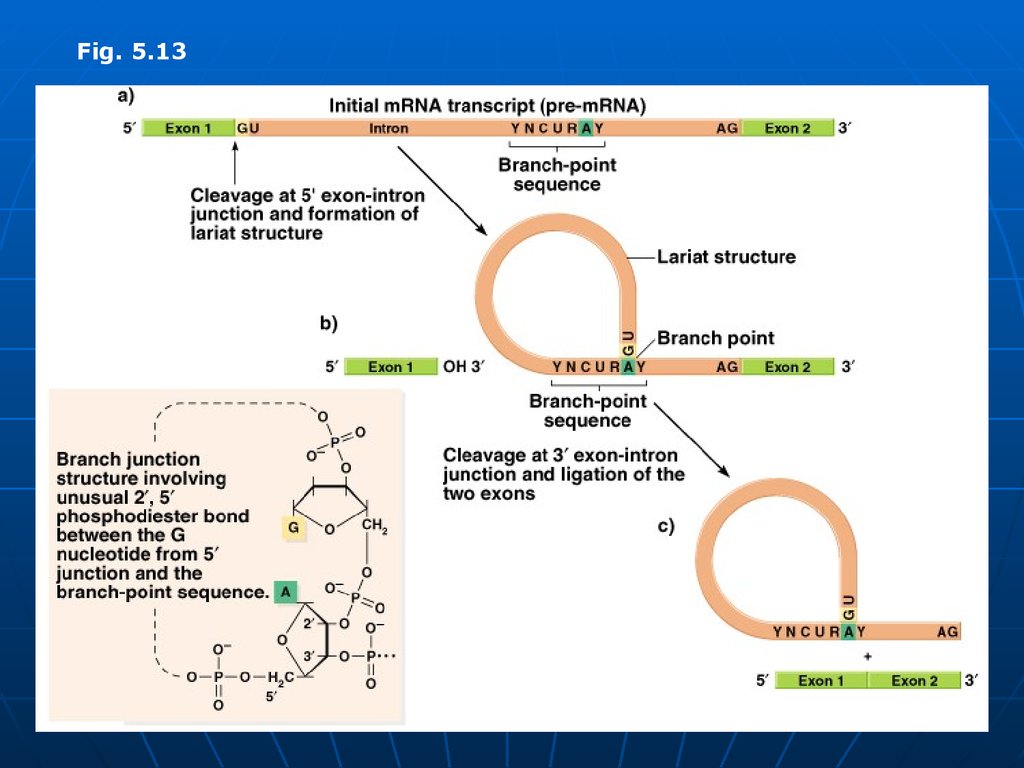
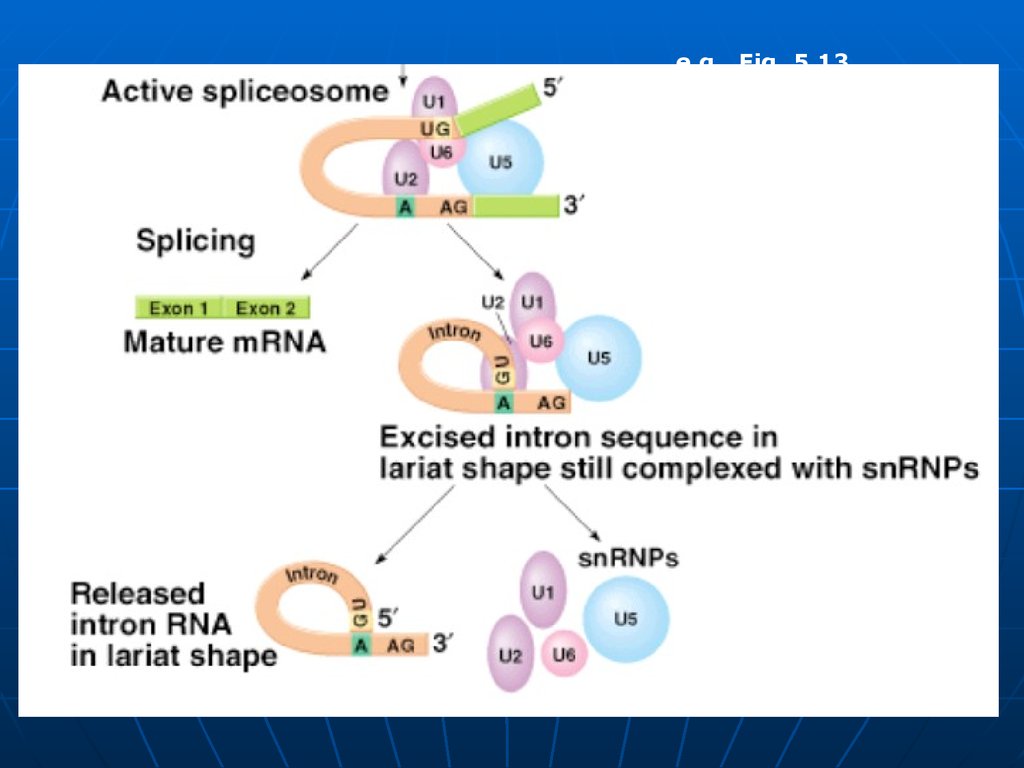
Fig. 5.1186.
2.Splisingul - excizia intronilor şisudarea exonilor. Aşa numitul splising
are loc în nucleul celulei.
a.ARN nuclear (ARN U) identifică secvenţele
de baze la joncţiunea intron – exon,
b. se fixează complementar la ele, buclează
intronul, astfel apropiind capetele exonilor.
c. Are loc scindarea legăturilor
fosfodiesterice dintre exoni şi introni,
capetele exonilor sunt juxtapuse, apoi
sudate de RNA ligazele
87.
Fig. 5.1388.
e.g., Fig. 5.1389.
90. Transcripţia inversă
sinteza ADN pe catena de ARNMatriţa – ARN
Substrat – dRNTP:dATP, dGTP, dCTP, TTP
Enzima – revers transcriptaza
Caracteristic viruşilor oncogeni
Mecanismul:
a. Revers transcriptaza sintetizează pe ARN viral
catena de ADN- hibrid: ADN_ARN
b. Scindarea ARN viral de o nuclează
c. Autoreplicarea ADN – cu formarea unui duplex de
ADN
91. Codul genetic Translaţia Reglarea sintezei proteinei
92. Obiectivele:
Codul genetic. Proprietăţile.Ribozomii - sediul sintezei proteinelor, structura lor.
Procesul de translare (sinteza proteinelor). Modificările
posttranslaţionare ale proteinelor.
Reglarea biosintezei proteinelor. Inducţia şi represia
enzimelor.
Inhibitorii sintezei proteice.
Polimorfismul proteinelor (variantele hemoglobinei,
enzimelor, grupelor sanguine).
Bolile ereditare şi diagnosticul lor biochimic.
93. Codul genetic
Informaţia genetică referitor labiosinteza proteinelor se transmite cu
ajutorul codului genetic - dicţionar
ce traduce secvenţa nucleotidelor din
ADN în succesiunea AA din lanţul
polipeptidic.
94. Proprietăţile codului genetic
--
-
-
Proprietăţile codului genetic
Este triplet -64 codoni: 3 nonsens:UAG; UGA;
UAA; 61 – codifică AA corespunzători
este degenerat - unui AA poate să-i corespunda
mai mulţi codoni (Ex. Arg, Leu, Ser - codificate de
6 codoni; Met- şi Trp - un codon). Codonii unui
aminoacid sint sinonime. Specificitatea codonului
e determinată de primele două litere.
Degenerarea se referă la nivelul nucleotidului 3
din codon sau 1 din anticodon care oscileaza .
nu este ambiguu- acelaşi triplet nu semnifică 2
AA diferiţi
Are o structură liniară (colinear) – o
concordanţă liniară între genă şi proteina
codificătoare
Nu se suprapune (excepţie- viruşii)
95.
--
1.
2.
3.
4.
5.
6.
Este universal – toate veţuitoarele utilizează
acelaşi mecanism de traducere (abatere prezintă
codul genetic al mitocondriilor);
nu are virgule, semne de punctuatie - ce ar indica
începutul şi sfîrşitul fiecarui codon.
AUG - este codonul de initiere
UAG, UAA,UGA - codoni stop (non sens)
Toţi codonii cu U (în pozitia 2) codifica AA hidrofobi
codonii cu A în pozitia -2 codifică AA polari
Uracilul în poziţia 1 prezintă codonul nonsens
dacă în anticodon în directia (5'->3') prima bază
nucleotidică e:
a) Citozina sau Adenina, el va citi un singur
codon;
b) Uracilul sau Guanina el va citi 2 codoni;
c) inozina respectiv va citi 3 codoni
96. Ribozomii
Reprezintă sediul de traducere a ARNm şi sintezaproteinelor.
Structura- complexe ribonucleoproteice şi sunt formaţi din
două subunităţi de mărime inegală (mare şi mică)
Structura ribozomilor procariotici:
subunitatea 30 S – conţine ARNr 16S şi 21 proteine.
subunitatea 50S – ARN r 5S, 23S şi 31 proteine.
Sinteza ARNr şi formarea subunităţilor are loc în citoplasmă.
Structura ribosomilor eucariotici:
subunitatea 40S – ARNr 18S şi 33 proteine.
subunitatea 60S – ARN r 5S, 5,8S, 28S şi 49 proteine. ARNr
– se formează în nucleol.
Ribozomul va avea constanta de sedimentare 70S la
procariote si 80S la eucariote.
S – este coeficientul de sedimentare Svedberg, care
depinde de forma, densitatea şi dimensiunea particulelor.
97. Centrele catalitice ale ribosomilor
Situsul A - aminoacil – responsabil de unireacomplexului aminoacil- ARNt
Situsul P – peptidil – găzduieşte ARNt legat de
un lanţ polipeptidic deja sintetizat
Situsul E – e responsabil de eliminarea ARNt
Procesul de sinteză proteică poate fi schiţat sumar
prin interacţiunea celor 3 tipuri de ARN informaţia din ARNm este citită in ribozom si
transpusă în proteine, AA necesari fiind adu şi de
ARNt.
În starea complet nedisociată ribozomii sunt
activi.
Deplasarea lberă a ribozomilor în diferite sectoare
ale celulei, sau combinarea lor în diferite locuri cu
membranele reticulului endoplasmatic oferă
posibilitatea de asamblare a proteinei în celulă.
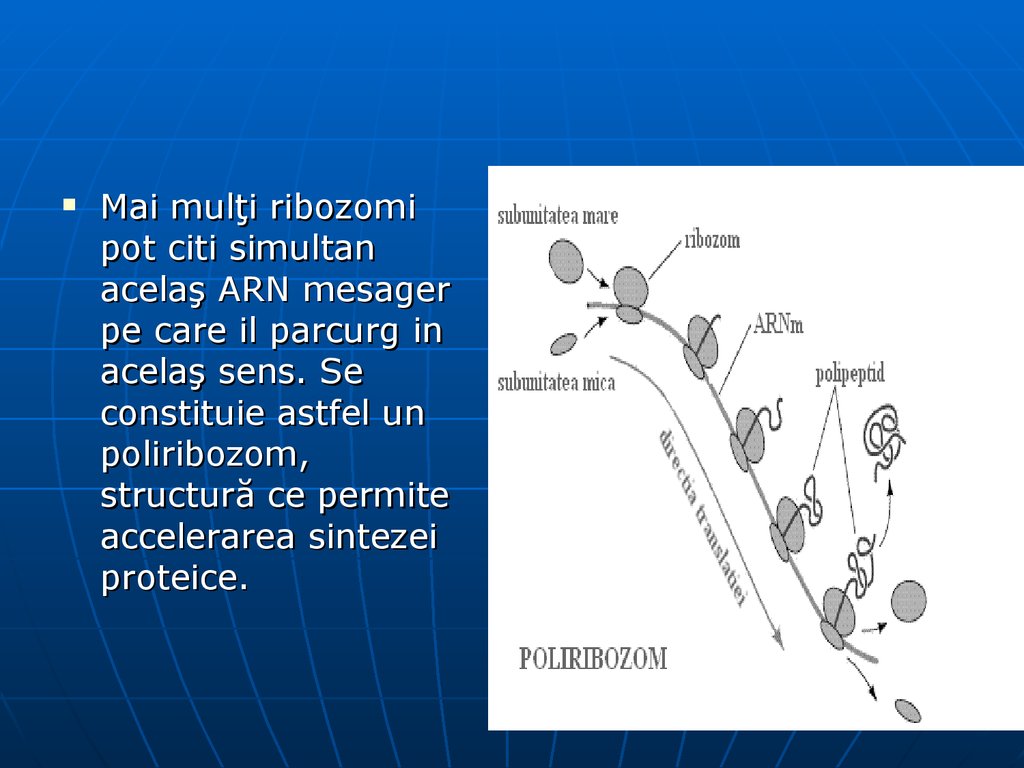
98.
Mai mulţi ribozomipot citi simultan
acelaş ARN mesager
pe care il parcurg in
acelaş sens. Se
constituie astfel un
poliribozom,
structură ce permite
accelerarea sintezei
proteice.
99. Translaţia
1.2.
3.
4.
5.
6.
Translaţia sau biosinteza proteinelor propriu
zisă.
Bazele moleculare ale translaţiei:
m-RNA ca matriţă genetică, programul căreia
determină succesiunea AA în proteină;
aminoacil – tRNA;
ribozomii ca maşini moleculare pentru unirea
succesivă a AA în catena polipeptidică conform
programului mRNA;
GTP ca sursă de energie;
“factorii” proteici care vin în ajutor în diferite
etape ale asamblării proteinei în ribozomi;
unii ioni ca cofactori (Mg 2+, K+).
100. Etapele
se realizeaza in 5 etape:Activarea AA.
Iniţierea lanţului polipeptidic.
Elongarea lanţului polipeptidic.
Terminarea lanţului polipeptidic si
eliberarea acestuia.
Prelucrări post traducere ale
proteinei sintetizate.
101. Activarea AA
1.2.
3.
4.
a.
b.
c.
d.
e.
are loc în citozol
Sunt necesare:
AA (procariote – Nformil-Met; la eucariote – Met)
ARNt
ATP, Mg, K
E – aminoacil ARNt sintetaza (există nu mai puţin de 20 –
indentificate 32 de tipuri de ARNt):
Posedă 4 centre: pentru AA, ATP, ARNt, H 2O
Specificitatea E e determinată de structura ARNt
Fidelitatea e asigurată de capacitatea de autocontrol
Conţine grupări libere sulfhidrilice
sunt ligazele, care au o specificitate absolută.
102.
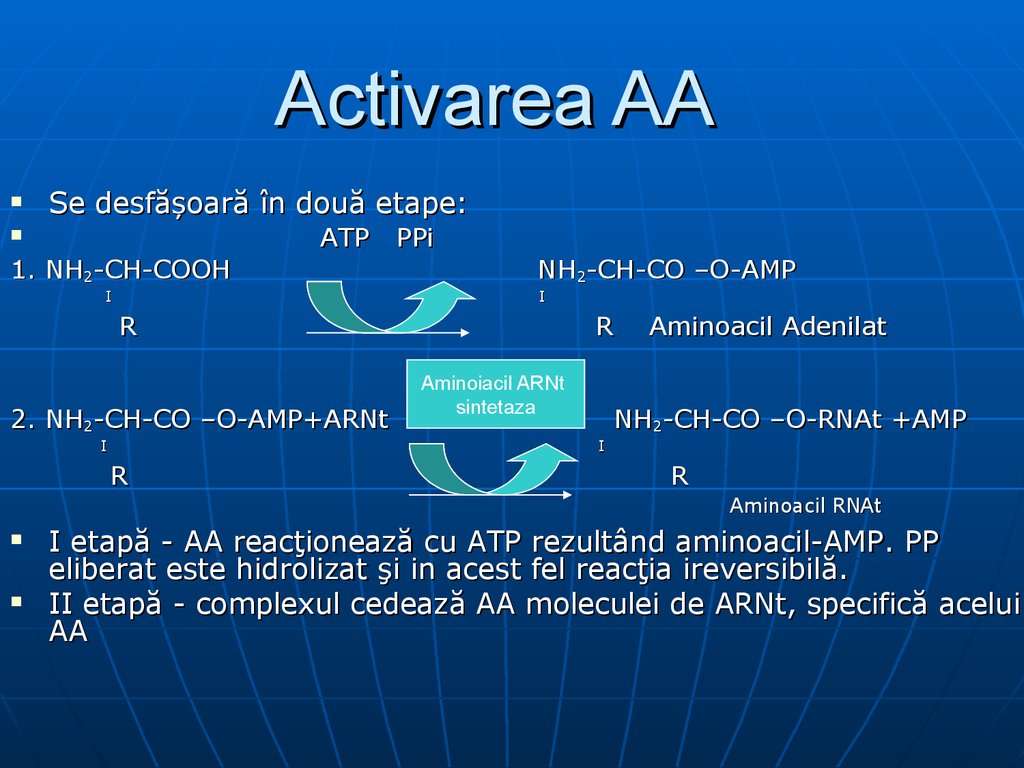
Activarea AASe desfăşoară în două etape:
1. NH2-CH-COOH
ATP
I
PPi
NH2-CH-CO –O-AMP
I
R
2. NH2-CH-CO –O-AMP+ARNt
I
R
Aminoiacil ARNt
sintetaza
Aminoacil Adenilat
NH2-CH-CO –O-RNAt +AMP
I
R
R
Aminoacil RNAt
I etapă - AA reacţionează cu ATP rezultând aminoacil-AMP. PP
eliberat este hidrolizat şi in acest fel reacţia ireversibilă.
II etapă - complexul cedează AA moleculei de ARNt, specifică acelui
AA
103. Activarea AA
Parcurge în 2 etape:104. Activarea AA
Esenţa procesului de activare estefixarea AA la ARNt propriu acestui AA, în
zona acceptorie la 3' CCA –OH (sau 2'
OH) al ribozei restului adenilic
Enzima poate recunoaste daca un AA
gresit s-a fixat pe ARNt, situatie in
care il elimina si il inlocuieste cu AA
corespunzator deoarece prezinta si
un locus hidrolitic.
105. Activarea AA
Activarea AA consumă 2 legăturimacroergice
ARNt pe calea difuziunii simple
transferă AA adiţionat la el - la
ribozomi, unde are loc asamblarea
proteinei din AA.
106.
107. Translaţia propriu zisă
Citirea ARNm se face în direcţia 5‘- 3'iar proteina se sintetizează de la
capătul “N”terminal la “C” terminal
se desting trei etape:
Iniţierea
Elongarea
terminarea.
108. Iniţierea
1.2.
3.
4.
5.
Necesar:
ARNm (AUG)
Ribosomul cu subunităţile
disociate
ARNt f-met (Met)
GTP, Mg
IF1, IF2, IF3
Scopul: formarea
complexului de iniţiere
109. Formarea complexului de iniţiere:
Subunitatea mică leagă IF3 şiprevine reasocierea ribosomilor
La subunitate adiţionează ARNm
(AUG) – fixarea codonului e
determinat de un fragment de
pe ARNm compus din 6-8 resturi
de A-G şi este complementar cu
succesiunea OH al ARNr
La complex adiţionează IF1, mai
apoi IF2 legat de GTP şi formil
Met-ARNt
Îndată cum are loc fixarea
anticodonului fMet-ARNt cu
codonul AUG (ARNm), are loc
hidroliza GTP, eliberarea FI şi
unirea subunităţilor
Formil Met-ARNt –e fixată în
centrul P
FI2
FI3
30S
P
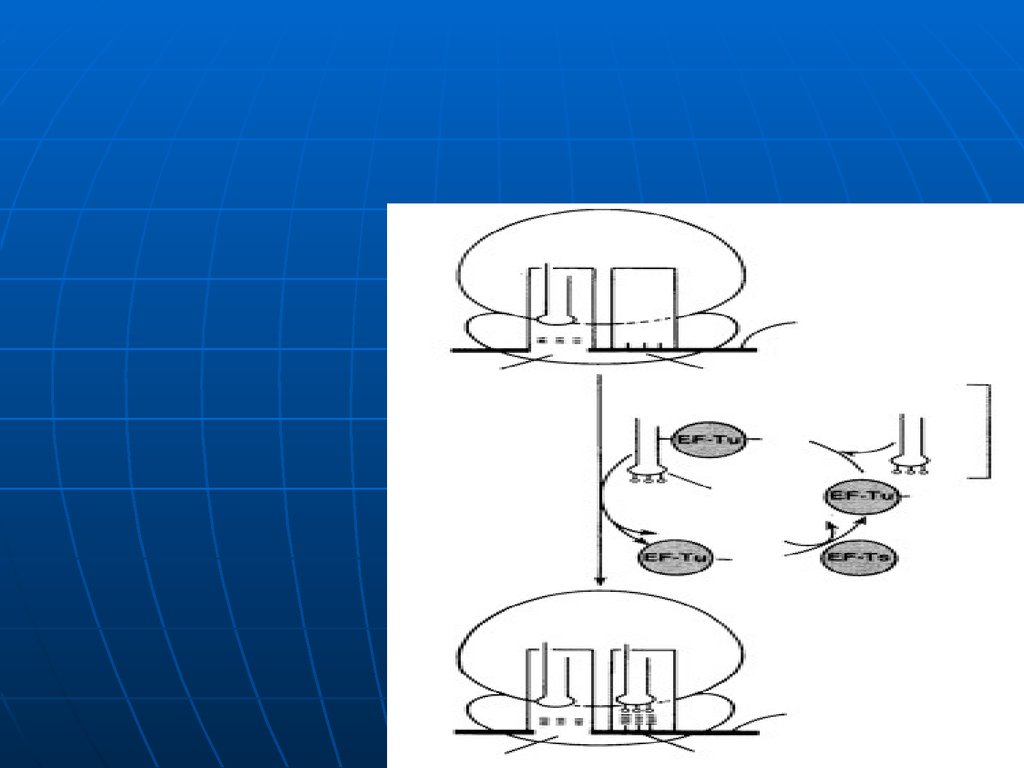
FI1
50S
A
110.
111. Elongarea
1.2.
3.
4.
1.
2.
3.
Necesar:
ARNm cu următorul codon
ARNt cu următorul AA
GTP
FE: Tu, Ts, G
Elongarea translaţiei include trei etape:
Legarea aminoacil – ARNt;
Transpeptidarea- formarea legăturii peptidice,
Translocarea (deplasarea ARNm cu un codon).
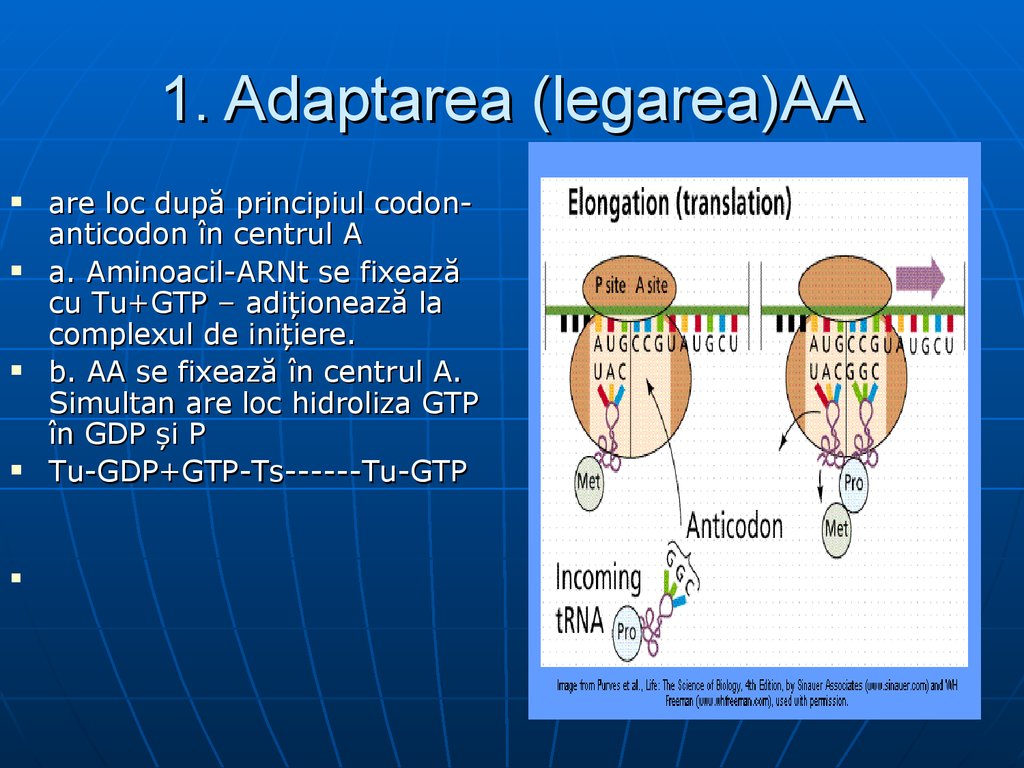
112. 1. Adaptarea (legarea)AA
are loc după principiul codonanticodon în centrul Aa. Aminoacil-ARNt se fixează
cu Tu+GTP – adiţionează la
complexul de iniţiere.
b. AA se fixează în centrul A.
Simultan are loc hidroliza GTP
în GDP şi P
Tu-GDP+GTP-Ts------Tu-GTP
113.
114. 2. Transpeptidarea
este formarea legăturii peptidiceîntre doi aminoacizi.
AA din centrul P sub acţiunea
peptidiltransferazei trece în centrul
A.
Se formează dipeptida
În centrul P rămîne ARNt liber
115.
116. 3. Translocarea
deplasarea ARNm cu un triplet îndirecţia 5‘- 3' .
Dipeptida din centrul A trece în
centrul P sub acţiunea factorului G
(translocazei) şi GTP
ARNt din P părăseşte ribosomul
117. Elongarea
Decurge în 3 etape :1 fixareanoului Aminoacil ARNt
complexul: aminoacil-ARNt,
factorul de elongare T (FE-T) şi
GTP.
se fixează pe situsul A, după ce
are loc hidroliza GTP la GDP
care se eliberează împreună cu
FE-T.
2. formarea legăturii peptidice.
Enzima peptidil-transferaza
catalizează formarea legăturii
peptidice între doi AA din situsul
A şi P.Peptida rămîne ataşată
de RNAt de pe situsul A.
translocaţia
ribozomul se deplasează la
următorul codon de pe ARNm şi
peptidilARNt trece de pe situsul
A pe P
această etapă necesită factorul
de elongare G (FE-G) şi GTP
(necesar pentru realizarea
modificărilor conformaţionale
care deplasează ribozomul).
FE-G
30S
P
50S
A
FE-T
E-PT
FE-T
118. Terminarea
are loc cînd sunt întîlniţi codonii UAA, UGA,UAG şi factorii proteici de terminare: R1,
R2, S.
Nici un tRNA nu se poate lega cu codonii
de terminare.
Factorii de terminare:
eliberează lanţul polipeptidic
Elimină ARNt din centrul P
Disocierea ribosomului în subunităţile
respective
119.
La formarea unei legături peptidicese consumă patru legături
macroergice:
2 în etapa de activare a AA (ATP) şi
2 în elongare: legare şi translocare GTP.
120. Prelucrările posttraducere
1.2.
3.
4.
5.
Modificarea capătului N- şi C-terminal; capătul N se
acetilează;
Îndepărtarea secvenţei semnalizante cu ajutorul unei
peptidaze;
modificarea unor AA:
hidroxilarea enzimatică a Pro, Lyz – obţinerea
hidroxiprolinei, hidroxilizinei .
Metilarea (Lyz în muşchi)
Carboxilarea Glu - -carboxil-glutamatului (protrombină)
oxidarea reziduuriilor de Cis - cistinei;
iodurarea reziduurilor de Tir ale tireoglobulinei.
ataşarea unor gr. funcţionale: fosfat, glicozil, metalelor
pentru formarea fosfoproteinelor,glicoproteinelor,
metaloproteinelor ş.a.
Formarea punţilor disulfurice
Proteina se autoasamblează – formând conformaţia nativă
– structura tridimensională
121. Inhibitori ai sintezei proteinei
1.2.
la nivelul replicării:
Mitomicina –împiedica separarea
catenelor de ADN
Acid nalidixic –inhiba ADN giraza
la nivelul transcriptiei:
- Actinomicina D - se fixeaza pe ADN
– Rifampicina - inhiba ARN polimeraza
122. Inhibitorii sintezei proteinei
la nivelul translatiei:Streptomicina –inhiba legarea ARNt initiator la
subunitatea 30S
Cloramfenicol -inhiba peptidil transferaza
Tetraciclina - inhiba legarea ARNt la ribozomi
Eritromicina,Azitromicina – blocheaza subunitatea
50S
Puromicina – blocheaza elongarea inhibând
competitiv ARNt
Streptomicina - interferă cu legarea formil-MetARNt la locul de iniţiere.
Neomicina, Kanamicină - erori în reproducerea
codului genetic
Toxina difterică - inhibă translocaza
123. Reglarea sintezei proteinelor
1.2.
3.
Sinteza proteinelor nu e constantă – ea trebuie
să se adapteze cerinţelor vitale
Celulel dispun de 3 tipuri de enzime :
Constitutive - se sintetizează în celulă cu o viteză
constantă.
Inductible - sunt E a căror concentraţie depinde
de prezenţa sau absenţa din mediu a unui
compus denumit inductor. Sunt implicate în căile
catabolice,
Represible - sunt E a căror concentraţie depinde
de prezenţa sau absenţa din mediu a unui
compus denumit corepresor. Sunt implicate în
căile anabolice.
În mod normal cantitatea de E inductibile în
celule este foarte mică,dar ea poate creşte atunci
cînd apare necesitatea utilizării substratului E
respective ( S care se comportă ca inductor).
124. Teoria lac-operonului
Schema reglării biosintezei proteinei la procariote a fost descrisă în 1961de către Jacob şi Monod - poartă denumirea de teoria lac-operonului .
Modelul e bazat pe studiul reglării mtabolismului lactozei în Escheria coli.
Exprimarea GS (conţin informaţia cu privire la biosinteza E impicate în
utilizarea lactozei: -galactozidaza, permeaza şi transacetilaza –1,2,3) e
controlată de un fragment de ADN denumit genă reglatoare (GR) codifică represorul (R). R se leagă de un fragment de ADN denumit
operator (O).
Legarea R la O blochează accesul ARN – polimerazei la promotor avînd ca
rezultat suprimarea transcrierii GS.
125.
Ce se întâmplă dacă bacteria dispunesimultan de glucoză şi lactoză?
Bacteria nu consumă energie pentru
sinteza lac-operonului, atâta timp cât
dispune de glucoză.
Bacteria creşte pe seama glucozei - şi
numai atunci când c% acesteea devine
minimă începe să utilizeze lactoza.
Metabolizarea simultană a glucozei şi
lactozei sunt excluse.
Cum se comută activitatea bacteriei pe
utilizarea lactozei când c% glucozei
scade?
126. Bacteria are ca sursă glucoza
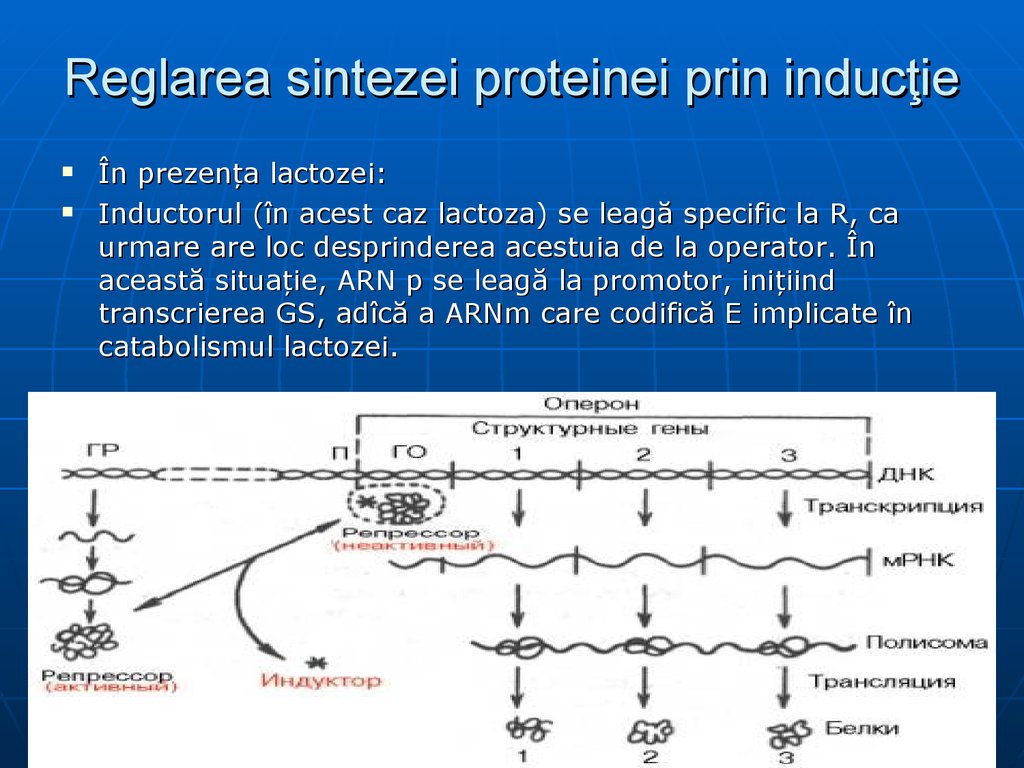
127. Reglarea sintezei proteinei prin inducţie
În prezenţa lactozei:Inductorul (în acest caz lactoza) se leagă specific la R, ca
urmare are loc desprinderea acestuia de la operator. În
această situaţie, ARN p se leagă la promotor, iniţiind
transcrierea GS, adîcă a ARNm care codifică E implicate în
catabolismul lactozei.
128. Bacteria are ca sursă lactoza
129.
În lipsa glucozei se măreşte c% AMPc – ce reprezintă semnalulfoamei la bacterii.
Ca urmare, AMPc se leagă de o proteină receptoare specifică
(proteina activatoare a genei catabolice – CAP) - formează
complex (CAP- AMPc), apt să se lege de promotor (p-locus)
Acest proces favorizează pătrunderea ARNp în locusul de
reglare. Dacă lactoza este prezentă în mediu, operatorul este
liber şi ARNp efectuează transcrierea genelor lac.
CAP dispune de 2 centre: pentru AMPc şi pentru ADN
130. Reglarea lac-operonului într-un mediu ce conţine glucoză
Cu cât c% glucozei e mai mare, c%AMPc –e mai mică. Lipseşte şi complexul CAPAMPc. În final ARNp nu se leagă de P şi GS
nu sunt transcrise, indiferent dacă există
sau nu lactoză, indiferent de faptul dacă
operatorul este sau nu ocupat de R.
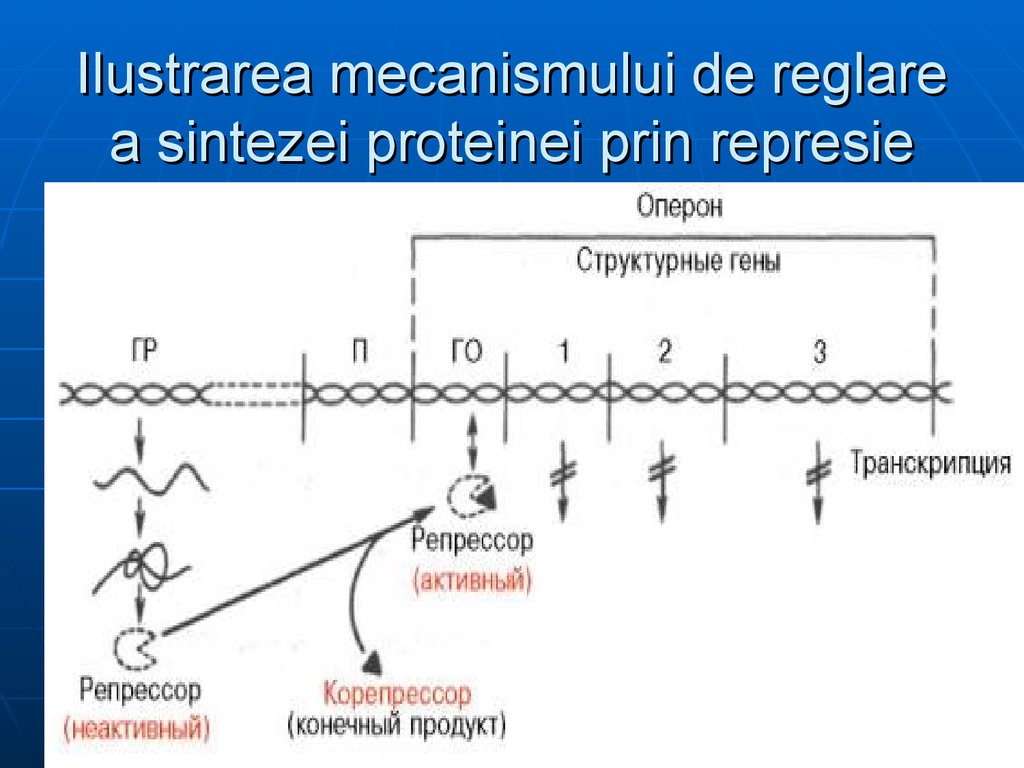
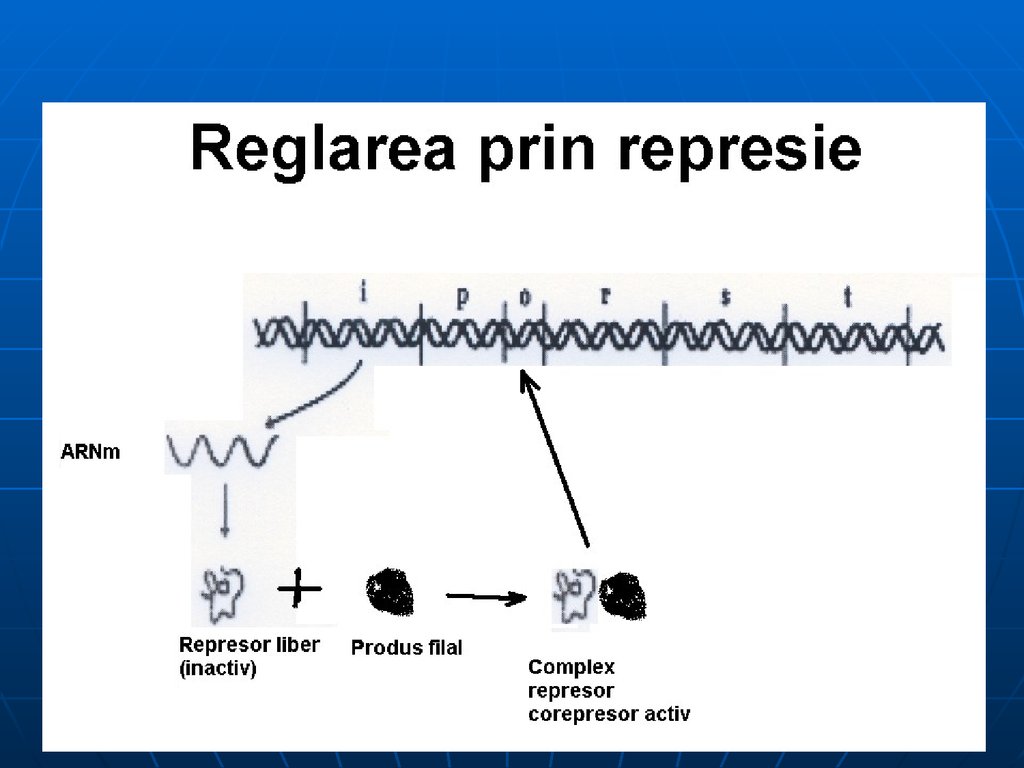
131. Ilustrarea mecanismului de reglare a sintezei proteinei prin represie
Teoria operonului explică şi represiaprin produs final al biosintezei E
Ex: sinteza His: la c% mari de His
(corepresor) – se leagă de R,
modificându-i conformaţia –
activându-l – în rezultat favorizează
legarea R la O.
His – produs final, CoR- sistează
transcrierea genelor ce codifică E
implicate în propria sa sinteză
132. Ilustrarea mecanismului de reglare a sintezei proteinei prin represie
133.
134. REZUMĂM:
GR controlează exprimarea anumitor GS prinintermediul unei proteine – R
Ra – suprimă sinteza de ARNm, deci de proteine;
R inactivat – permite transcrierea GS şi sinteza
proteinei
E inductibile – Ra – nu are loc transcrierea. Când
în mediul apare I – R se inactivează – are loc
sinteza ARNm- proteinei
E represibile – R este inactiv – are loc transcripţia
şi translaţia. Când în mediu se acumulează
produsul final al căii anabolice (CoR)- R se
activează, formarea complexului R-CoR – şi
sistarea transcripţiei şi translaţiei.
135. Reglarea sintezei la eucariote
Atât la nivelul transcripţiei cât şi la nivelultranslaţiei
Reglarea hormonală (cortizol- sinteza E
gluconeogenezei; estrogenii, androgenii, vitamina
D – sinteză de proteine specifice)
Reglarea exspresiei genetice prin moleculele
proteice legate de ADN (histonele) – sinteza ARN
pe ADN e inhibată prin adaosul de histone
Reglarea proteinei la nivelul translaţiei – e
posibilă prin acţiunea factorilor proteici, care
contribuie iniţierea, elongarea, terminarea.
136. Ingineria genetică
ştiinta, preocupată de crearea noilor fenotipuriprin transplantarea genei unui organism în
genomul altuia în scop de a lichida defectele
ereditare ale genomului, adică tratarea
afectiunilor ereditare (gena întrodusă nu gurează
în patrimoniul ereditar al genomului -gazd ă)
Se obtin molecule hibride (himerice)
În linii marl procedura include etapele:
1. Căpătarea genei
2. Căpătarea ADN-ului recombinat
3.Clonarea ADN-ului recombinat
Căpătarea genei:Stiind structura primară a proteinei în
laborator se poate obline gena respectivă (se oblin gen e
pînă la 250 codoane)- mai greu e obtinerea genei din
genomul celulei (genele se despart prin introni)- mai
uşor e căpătarea genelor din virusuri cu enzima
revertaza.
137. Căpătarea ADN-ului recombinat-
Căpătarea ADN-ului recombinatgena necesară se întroduce în celulă pentru a se integra cu
genomul acestuia. Pentru aceastaîn vitro gena se uneşte cu ADNvector(plasmide ce conţin ADN inelar (cîteva gene).
De regulă se foloseşte E Coli, ce contine un cromozom şi plasmide,
ce plutesc în citozol (plasmida este de 1000 ori mai mica decît
cromozomul).
Plasmidele
se replica independent de
replicarea materialului genetic. Unele plasmide se pot include în
cromozom şi apoi din nou să-l părăsească. Plasmidele pot trece
dintr-o celulă în alta în procesul decon jugare. Plasmidele se separă
din E.Coli şi li se înlătură o parte de ADN inelar cu
ajutorulenzimelor restrictaze, care recunosc şi taiediferite sectoare.
Folosind restrictaze diferite se poate de tăiat ADN în locusurile
necesare. Inrezultat se formează capete lipicioase
(sectoaremonocatenare, capabile de a uni nucleotide
complimentare. La fel se procedează şi cu gena,care trebuie
întrodusă (se formează capete lipicioase complimentare capetelor
plasmidei). Dacă se amestecă gena şi plasmida ele se vor uni cu
capetele lipicioase. Enzima ligaza va uni capetele şi se va căpăta
molecula ADN inelara, care contine gena menită pentru
transplantare.
138. 3.Clonarea
ADN-ului recombinat- obtinerea cantităţilor doritede proteină codificată de gena eucariotă întrodusă
în plasmid. Dacă în cultura E.Coli se întroduc
plasmide recombinate, se formează bacterii
recombinate. In celulă plasmidele se replică.
Bacteriile înmulţindu-se formează celule, care
conţin aceste plasmide. Acum din masa
bacteriană se poate de capatat cantităti
sufuciente de ADN recombine
139.
Ranadamentul sintezei bacterieneeste
impresionabil: Ex- 100 celule E.Coli produc
prin clonare 5 mg somatostatină (cantitate, ce
se obţine prin prelucrarea a 100 tone de creier
de bovine). Prin tehnica ingineriei genetice sau obtinut cantităţi mari de insulinâ
(Humulună), Interferon, vaccine.
Diversitatea formelor în Iimita uneia şi
aceaşi specie se datoreşte mutaţiilor şi
într-o măsura mai mare recombinării
genetice.
140. Mutaţiile.
Modificările genomului organismului, care sepăstrează şi se transmit prin ereditate
se transmit apoi de la o generaţie la alta.
Modificările pot interesa o pereche de baze
(mutatii punctiforme) sau un grup de baze pe una
sau pe ambele catene ale unei molecule de DNA.
141.
Mutatiile punctiforme: pot decurge prin:l. substitutie (misens mutatii, unde deosebim 2 tipuri):
a. Tranzitie - o BA purinică este înlocuită
tot cu una purincă, una pirimidinică -tot cu una pirimidinică.
b.Transversie - o pereche de baze purinice
este înlocuită cu una pirimidinică sau invers.
2. Inserţie - acest
mecanism
constă în întroducerea unei
perechi de baze suplimentare în catena de DNA.
3. Deleţia constă în excluderea unei perechi de baze în aşa mod ca
ea nu mai poate fî complementară şi la replicare apare "golul" în
ambele catene. Unele modificări în secventa nucleotidică pot duce
la formarea codonului sinonim şi succesiunea aminoacizilor nu se
va schimba (mutatii benigne).
La afectarea segmentelor mari de genă apar mutatii întinse. In
dependentă de consecinţele modificărilor deosebim mutaţie
benignă, neutră, nocivă.
Agenţii mutageni pot provoca mutaţiile spontane cît şi mutaţiile
induse.
142. Anticorpii sunt
constituiti din:- 2 lanturi polipeptidicegrele identice (H446 AA)
Anticorpii sunt
•şi două uşoare (L-214AA),
fiecare dintre ele
contin cite o porţiune:
varîabilă „V".
şi una
constantă „C"
143.
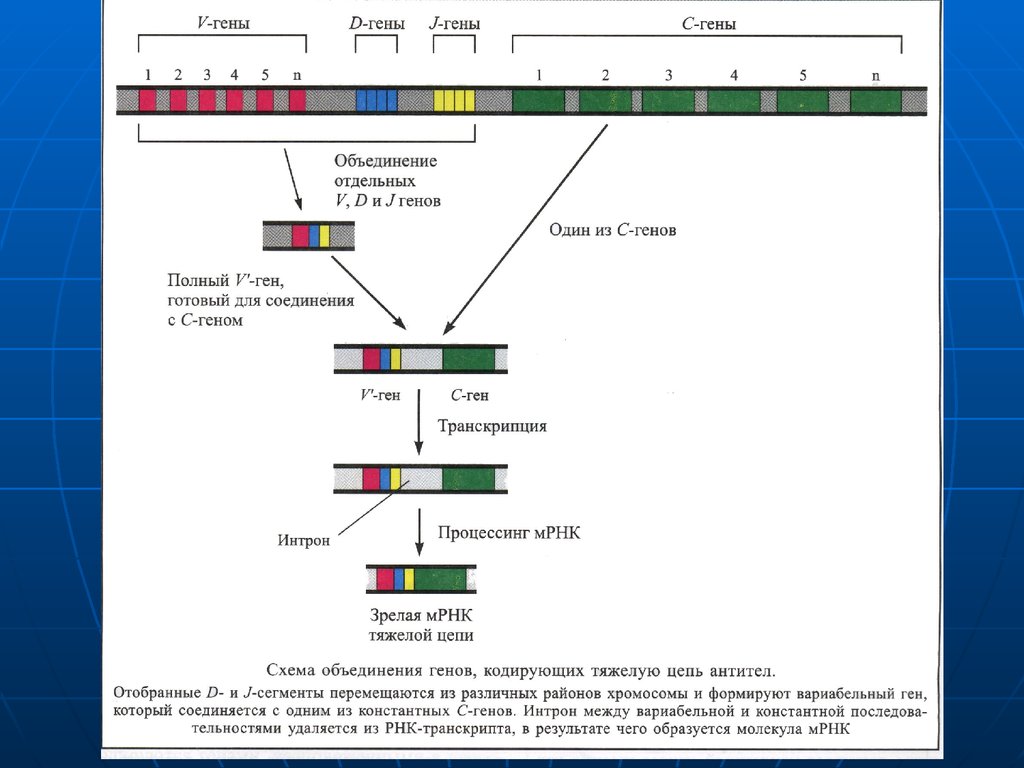
Secvenţa de AA în porţiunea variabilă este diferităpentru fiecare anticorp. Lanţurile sunt unite între
ele prin legături disulfidice.
Genele ce corespund porţiunilor „V" şi „C“ ale unui
anumit tip de lanţ uşor sunt foarte apropiate în
ADN al imunocitelor care produc acest tip de lanţ
uşor, dar se găsesc departe una de alta în ADN al
celulelor ce produc alte tipuride anticorpi.
De aici reiese, că în imunocit se selectează un
anumit segment de ADN, ce codifică porţiunea
variabilă a unui anumit lant uşor, care se transferă
prin transpoziţie în vecinătatea secvenţei
codificatoare a porţiunii constante a lantului uşor.
Deci ADN ce codifică sectoarele „V" ale lanţurilor
„H" şi "L" constă din cîteva gene de tip diferit
care-şi pot schimba locurile proprii şi asocia cu
formarea imenselor combinaţii.
144. Sinteza Anticorpilor
Fiecare dintre milioanele de anticorpiproduşi leagă unul dintre milioanele de
antigene posibile. Este greu de crezut că
organismul are în patrimoniul său
genetic cîte o genă pentru fiecare
anticorp pe care-l produce întrucât
aceasta ar presupune o
supradimensionare a genomului
eucariot.
145.
Gradul de diversificare în obţinerea lanţurilor „H"şi „L" este crescut prin faptul că o porţiune
variabilă este rezultatul asamblării a 3 regiuni.
Deci ADN ce determină porţiunea variabilă a
anticorpului este constituită din:
1.
Porţiunea variabilă (V) constituită din - 400 de
gene.
2.
Porţiunea de diversitate (D) ce cuprinde -12 gene
3.
Portiunea de articulare sau jonciune ţ(J) - 4 gene
Asamblarea acestor gene în diferite combinaţii
permite construirea a 20000 de sectoare V - fapt
ce asigură extrema varietate a anticorpilor.














































































































 Химия
Химия





