Похожие презентации:
Анализ соединений висмута, цинка, меди и железа
1. Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям по фармацевтической химии для студентов 3 курса
Анализ соединенийвисмута, цинка,
меди и железа
2.
ПодлинностьОбщие реакции подлинности
Сравнительная характеристика химических свойств
солей цинка, меди(II), железа(II), висмута
Приготовление растворов субстанций
лекарственных средств
Около 0,05-0,1 г цинка сульфата, меди сульфата, железа
сульфата растворяют в 5 мл воды. Около 0,05-0,1 г
висмута нитрата основного растворяют в 1-2 мл азотной
кислоты разведенной 16% и добавляют воду до общего
объема 5 мл. Для проведения реакций берут по 1 мл
раствора субстанции каждого лекарственного средства.
3.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором натрия
гидроксида
Висмута ион
Методика. К 1 мл раствора соли висмута
прибавляют по каплям 10% раствор натрия
гидроксида; образуется белый осадок висмута
гидроксида, нерастворимый в избытке реактива.
Bi3+ + 3NaOH
Bi(OH)3
+ 3Na+
4.
белыйосадок
висмута
гидроксида
Висмута ион
Реакция осаждения с
раствором натрия
гидроксида
5.
изб. NaOHВисмута ион
Прибавление избытка реактива к осадку
висмута гидроксида
6.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором натрия гидроксида
Цинка ион
Методика. К 1 мл раствора соли цинка прибавляют 1-2 капли
10% раствора натрия гидроксида; образуется белый
студенистый осадок, растворимый в избытке реактива.
Zn2+ + 2NaOH
Zn(OH)2 + 4NaOH
избыток
Zn(OH)2
+ 2Na+
Na2[ Zn(OH)4] + 2Na+
Бесцветный
прозрачный раствор
7.
Цинка ионРеакция осаждения с
раствором натрия
гидроксида
белый
студенистый
осадок
8.
изб.NaOHЦинка ион
Растворение цинка
гидроксида в избытке
натрия гидроксида
9.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором натрия гидроксида
Меди(II) ион
Методика. К 1 мл раствора соли меди(II) прибавляют
1-2 капли 10% раствора натрия гидроксида; образуется
голубой осадок, растворимый в избытке реактива.
Полученный раствор имеет синее окрашивание.
CuSO4 + 2NaOH
Cu(OH)2 + 2NaOH
Cu(OH)2
+ Na2SO4
Na2[Cu(OH)4]
синий раствор
10.
голубойосадок
меди(II)
гидроксида
Меди(II) ион
Реакция осаждения с
раствором натрия
гидроксида
11.
Меди(II) ионРастворение осадка меди(II)
гидроксида в избытке
натрия гидроксида
изб. NaOH
12.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором натрия гидроксида
Железа(II) ион
Методика. К 1 мл раствора соли железа(II) прибавляют 2-3
капли 10% раствора натрия гидроксида. Образуется серозеленый осадок железа(II) гидроксида, переходящий в
темно-коричневый осадок железа(III) гидроксида. При
добавлении избытка раствора натрия гидроксида
осадок не растворяется.
Fe(OH)2 +Na2SO4
FeSO4 + 2NaOH
Fe(OH)2
(O2)
Fe(OH)3
13.
темнокоричневыйосадок смеси
железа(II) и
железа(III)
гидроксида
Железа ион
Реакция осаждения с
раствором натрия
гидроксида
14.
Темнокоричневыйосадок
(смесь железа(II) и
железа(III)
гидроксида)
нерастворим в
избытке реактива
изб.NaOH
15.
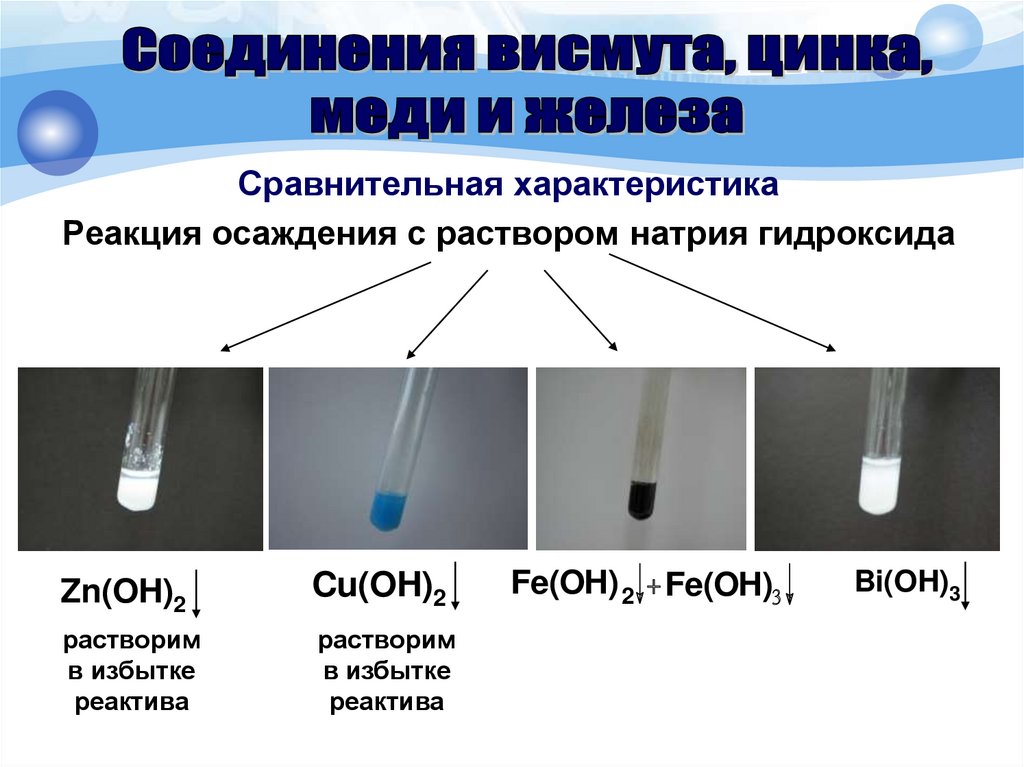
Сравнительная характеристикаРеакция осаждения с раствором натрия гидроксида
Zn(OH)2
Cu(OH)2
растворим
в избытке
реактива
растворим
в избытке
реактива
Fe(OH) 2 + Fe(OH)3
Bi(OH)3
16.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором аммония
гидроксида
Висмута ион
Методика. К 1 мл раствора соли висмута по каплям
прибавляют 10% раствор аммиака; образуется белый
осадок висмута гидроксида, нерастворимый в избытке
реактива.
Bi3+ + 3NH4OH → Bi(OH)3↓ + 3NH4+
17.
Висмута ионРеакция осаждения с раствором аммония
гидроксида
18.
изб. NH4OHВисмута ион
Прибавление избытка
раствора аммиака к осадку
висмута гидроксида
19.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором аммония
гидроксида
Цинка ион
Методика. К 1 мл раствора соли цинка прибавляют 1-2
капли 10% раствора аммиака; образуется белый
студенистый осадок, растворимый в избытке реактива.
Zn2+ + 2NH4OH
Zn(OH)2 + 4NH4OH
избыток
Zn(OH)2 +2NH4+
[Zn(NH3)4](OH)2 + 4H2O
Бесцветный
прозрачный раствор
20.
белыйстуденистый
осадок цинка
гидроксида
Цинка ион
Реакция осаждения с раствором аммония
гидроксида
21.
изб. NH4OHЦинка ион
Растворение осадка цинка
гидроксида в избытке
раствора аммиака
22.
Общие реакции подлинностиРеакция образования осадка с раствором
аммония гидроксида
Меди(II) ион
Методика. К 1 мл соли меди(II) прибавляют 1-2
капли10% раствора аммиака; образуется голубой
осадок, растворимый в избытке реактива. Полученный
раствор имеет темно-синее окрашивание.
2CuSO4 + 2NH4OH → Cu2(OH)2SO4↓ + (NH4)2SO4
Cu2(OH)2SO4↓+ 6NH4OH + (NH4)2SO4 → 2[Cu(NH3)4]SO4 + 8H2O
избыток
темно-синий раствор
23.
голубойосадок
меди(II)
дигидроксосульфата
Меди(II) ион
Реакция осаждения с
раствором аммония
гидроксида
24.
изб. NH4OHМеди(II) ион
Растворение осадка меди(II)
дигидроксосульфата в избытке аммония
гидроксида
25.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором аммония
гидроксида
Железа(II) ион
Методика. К 1 мл раствора соли железа(II) прибавляют
2-3 капли 10% раствора аммиака. Образуется белый в
момент получения осадок железа(II) гидроксида, который
быстро окисляется до красновато-коричневого осадка
железа(III) гидроксида.
Fe(OH)2 + 2NH4+
Fe2+ + 2NH4OH
Fe(OH)2
(O2)
Fe(OH)3
26.
Железа(II) ионРеакция осаждения с раствором аммония
гидроксида
изб. NH4OH
27.
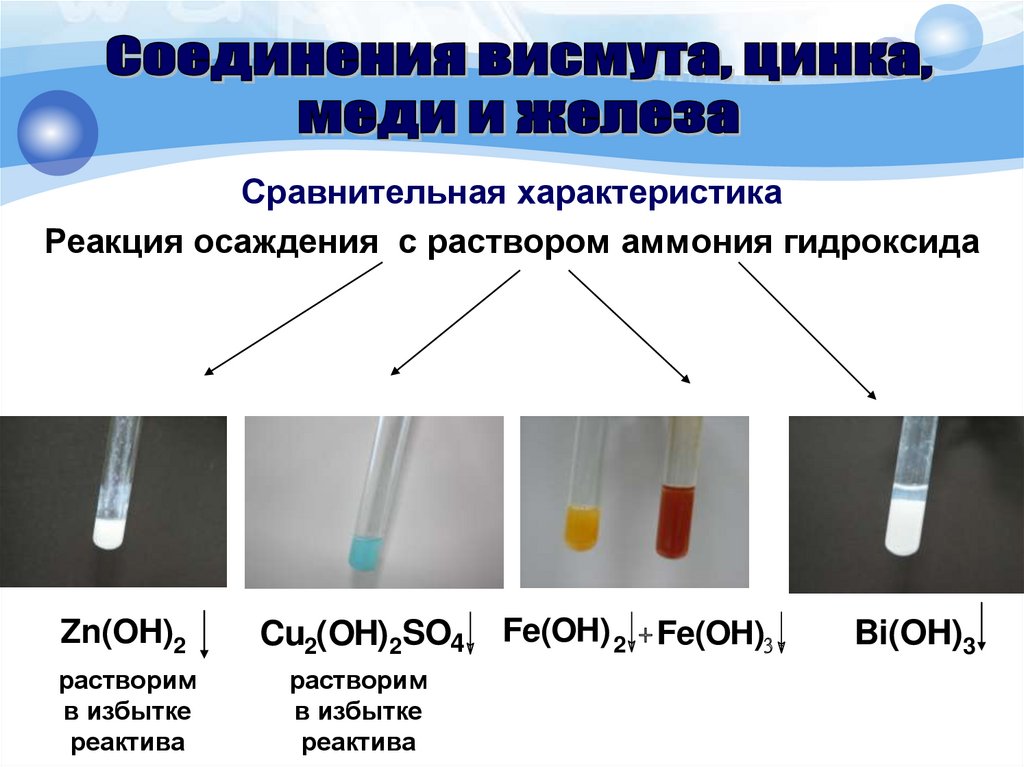
Сравнительная характеристикаРеакция осаждения с раствором аммония гидроксида
Zn(OH)2
Cu2(OH)2SO4
растворим
в избытке
реактива
растворим
в избытке
реактива
Fe(OH) 2 + Fe(OH)3
Bi(OH)3
28.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором натрия
сульфида
Висмута ион
К 1 мл раствора соли висмута прибавляют по
каплям 2% раствор натрия сульфида; образуется
коричневато-черный осадок висмута сульфида,
нерастворимый в избытке реактива.
2Bi3+ + 3Na2S → Bi2S3↓ + 6Na+
29.
Коричневаточерныйосадок
висмута
сульфида
Висмута ион
Реакция осаждения с раствором натрия сульфида
30.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором натрия сульфида
Цинка ион
Методика. К 1 мл раствора соли цинка прибавляют по
каплям 2% раствор натрия сульфида; образуется
белый осадок цинка сульфида, нерастворимый в
избытке реактива.
ZnSO4 + Na2S → ZnS↓ + Na2SO4
белый
осадок
31.
Цинка ионРеакция осаждения с раствором натрия
сульфида
32.
ПодлинностьОбщие реакции подлинности
Меди(II) ион
Реакция осаждения с раствором натрия сульфида
Методика. К 1 мл раствора соли меди(II)
п р иб а вля ю т п о ка п л ям 2% р а ст во р н а т ри я
сульфида. Образуется осадок меди(II) сульфида
черного цвета, нерастворимый в избытке реактива.
СuSO4 + Na2S → CuS↓ + Na2SO4
33.
Меди(II) ионРеакция осаждения с
раствором натрия
сульфида
Черный
осадок
меди(II)
сульфида
34.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором натрия
сульфида
Железа(II) ион
Методика. К 1 мл раствора соли железа(II) прибавляют по
каплям 2% раствор натрия сульфида. Образуется осадок
черного цвета, состоящий из смеси железа(II) сульфида и
железа(III) сульфида, нерастворимый в избытке реактива.
FeSO4 + Na2S FeS + Na2SO4
FeS
(O2)
Fe2S3
35.
Железа(II) ионРеакция осаждения с
раствором натрия
сульфида
Черный
осадок
железа(II)
сульфида
36.
Сравнительная характеристикаРеакция осаждения с раствором натрия сульфида
ZnS
CuS
FeS
+
Fe2S3
Bi2S3
37.
ПодлинностьОбщие реакции подлинности
Реакция осаждения с раствором калия йодида
Висмута ион
Методика. К 1 мл раствора соли висмута прибавляют 1-2
капли 10% раствора калия йодида; образуется черный
осадок висмута йодида, растворимый в избытке реактива
с образованием раствора желтовато-оранжевого цвета.
Bi(NO3)3 + 3KI → BiI3↓ + 3KNO3
BiI3 + KI → KBiI4
изб. желто-оранжевое
окрашивание
38.
черныйосадок
висмута
йодида
Висмута ион
Реакция осаждения с раствором
калия йодида
39.
черныйосадок
висмута
йодида
оранжевый
раствор калия
тетрайодовисмутата
изб. KI
Висмута ион
Реакция осаждения с раствором калия йодида
40.
ПодлинностьОбщие реакции подлинности
Реакция с раствором калия йодида
Меди(II) ион
Методика. К 1 мл раствора соли меди(II) прибавляют
1-2 капли 10% раствора калия йодида. Образуется
осадок меди(II) йодида белого цвета. При дальнейшем
добавлении реактива образуется
осадок меди(I)
йодида,
выделяется
йод;
реакционная
смесь
окрашивается в красно-бурый цвет.
2CuSO4 + 4KI 2CuI2 + 2K2SO4
2CuI2 2CuI + I2
______________________________________________________
2CuSO4 + 4KI 2CuI + I2 +2K2SO4
41.
Меди(II) ионРеакция осаждения с раствором калия йодида
+ KI
(изб.)
42.
Сравнительная характеристикаРеакция осаждения и комплексообразования с
раствором калия йодида
CuI2
Cu2I2
BiI3
KBiI4
43.
ПодлинностьОбщие реакции подлинности
Реакция с раствором калия йодида
Цинка ион
При добавлении к 1 мл
раствора соли цинка
1-2 капель 10% раствора
калия йодида раствор
остается прозрачным,
осадок не образуется,
т.к. цинка йодид
растворим в воде.
44.
ПодлинностьОбщие реакции подлинности
Реакция с раствором калия йодида
Железа(II) ион
При добавлении к 1 мл
раствора соли
железа(II) 1-2 капель
10% раствора калия
йодида раствор
остается прозрачным,
осадок не образуется,
т.к. железа(II) йодид
растворим в воде.
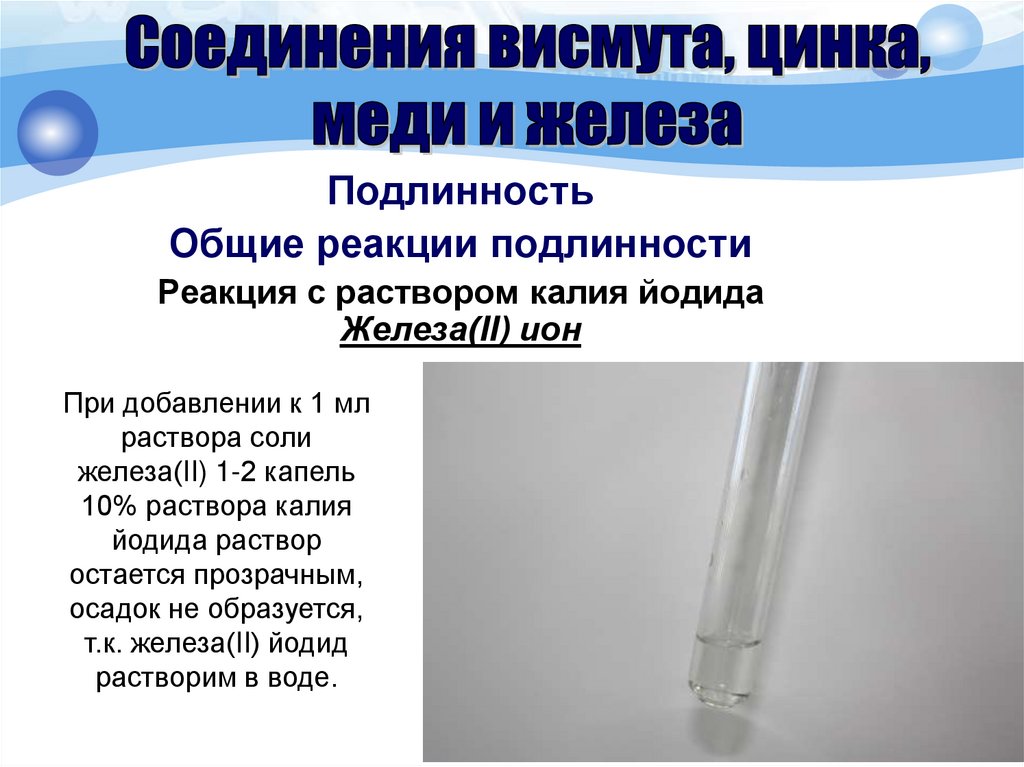
45.
ПодлинностьСпецифические реакции подлинности
Реакция осаждения с раствором натрия
сульфида
Висмута ион
Соль висмута (около 0,05 г иона висмута)
взбалтывают с 3 мл хлористоводородной кислоты
разведенной 8,3% и фильтруют. К фильтрату
прибавляют 1 мл 2% раствора натрия сульфида;
образуется
коричневато-черный
осадок,
растворимый при прибавлении равного объема
азотной кислоты концентрированной.
Bi 3+ + 3Na2S
Bi2S3
+ 6Na+
46.
Висмута ионРеакция осаждения с раствором натрия сульфида
Коричневаточерный
осадок
висмута
сульфида
47.
Висмута ионРеакция осаждения с раствором натрия сульфида
конц. HNO3
Растворение осадка висмута сульфида в азотной
кислоте концентрированной
48.
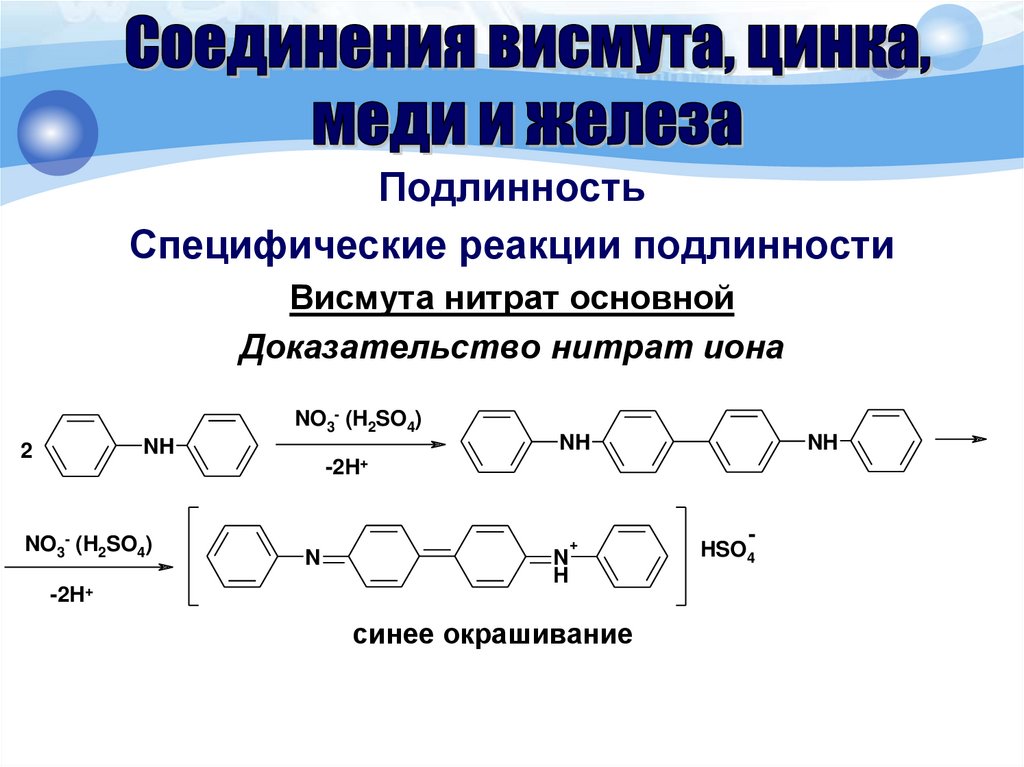
ПодлинностьСпецифические реакции подлинности
Висмута нитрат основной
Доказательство нитрат иона
К субстанции (около 0,001 г иона нитрата), помещенной на
фарфоровую чашку, прибавляют 2 капли раствора дифениламина;
появляется синее окрашивание.
49.
ПодлинностьСпецифические реакции подлинности
Висмута нитрат основной
Доказательство нитрат иона
NO3- (H2SO4)
NH
2
NO3- (H2SO4)
-2H+
NH
NH
-2H+
N
N
H
+
синее окрашивание
HSO4
-
50.
ПодлинностьСпецифические реакции подлинности
Реакция осаждения с раствором натрия сульфида
Цинка ион
К 2 мл нейтрального раствора соли цинка (0,005-0,02 г
иона цинка) прибавляют 0,5 мл 2% раствора натрия
сульфида или сероводорода; образуется белый осадок,
нерастворимый в уксусной кислоте разведенной 30% и
легко растворимый в хлористоводородной кислоте
разведенной 8,3%.
ZnSO4 + Na2S → ZnS↓ + Na2SO4
51.
Цинка ионРеакция осаждения с
раствором натрия сульфида
52.
Цинка ионРастворимость осадка цинка сульфида
+ CH3COOH разв.
Осадок нерастворим
в уксусной кислоте
разведенной
+ HCl разв.
Осадок легко
растворим в
хлористоводородной
кислоте
разведенной
53.
ПодлинностьСпецифические реакции подлинности
Реакция осаждения с раствором калия
гексацианоферрата(II)
Цинка ион
Методика. К 2 мл раствора соли цинка (0,005-0,02 г
иона цинка) прибавляют 0,5 мл 5% раствора калия
гексацианоферрата(II); образуется белый осадок,
нерастворимый
в
хлористоводородной
кислоте
разведенной 8,3%.
2ZnSO4 + 2K4[Fe(CN)6] K2Zn3[Fe(CN)6]2 + 3K2SO4
54.
Цинка ионРеакция осаждения с раствором калия
гексацианоферрата(II)
Картинка
55.
Цинка ионРеакция осаждения с раствором калия
гексацианоферрата(II)
+ HCl разв.
Осадок нерастворим в хлористоводородной кислоте
разведенной
56.
ПодлинностьСпецифические реакции подлинности
Меди(II) ион
Реакция восстановления меди(II) до меди
Методика. Раствор соли меди (1:20) при соприкосновении
с железом покрывает его красным налётом
металлической меди.
CuSO4 + Fe → Cu↓ + FeSO4
57.
красныйналет меди
на
железном
гвозде
Меди(II) ион
Реакция восстановления
меди(II) до меди
58.
Меди(II) ионРеакция восстановления меди(II) до меди
59.
ПодлинностьСпецифические реакции подлинности
Железа(II) ион
Реакция комплексообразования с раствором калия
гексацианоферрата(III)
Методика. К 2 мл раствора соли железа(II) (около 0,02 г
иона железа) прибавляют 0,5 мл хлористоводородной
кислоты разведенной 8,3% и 1 мл 5% раствора калия
гексацианоферрата( III); образуется синий осадок.
3FeSO4 + 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓ + 3K2SO4
синий осадок
60.
Железа(II) ионРеакция комплексообразования с раствором
калия гексацианоферрата(III)
61.
ПодлинностьСпецифические реакции подлинности
Реакция осаждения с раствором аммония
сульфида
Железа(II) ион
Методика. К раствору соли железа(II) (около 0,02 г иона
железа) прибавляют 5% раствор аммония сульфида;
образуется черный осадок железа(II) сульфида,
растворимый в разведенных минеральных кислотах.
FeSO4 + (NH4)2S → FeS↓ + (NH4)2SO4
черный осадок
62.
ПодлинностьРеакция на меди(II) ион
Методика. К 1 мл препарата прибавляют по каплям
10% раствор аммония гидроксида; образуется голубой
осадок, растворимый в избытке реактива. Полученный
раствор имеет синее окрашивание.
2CuSO4 + 2NH4OH Cu2(OH)2SO4 + (NH4)2SO4
Cu2(OH)2SO4↓ + 6NH4OH + (NH4)2SO4 2[Cu(NH3)4]SO4 + 8H2O
избыток
синий раствор
63.
Раствор меди сульфата5%-50,0 мл
Реакция на меди(II) ион
голубой
осадок
меди(II)
дигидроксосульфата
64.
Осадок меди(II) дигидроксосульфата растворим визбытке раствора аммиака
изб. NH4OH
Раствор меди сульфата 5%-50,0 мл
Реакция на меди(II) ион с раствором аммония
гидроксида
65.
ПодлинностьРеакция на сульфат ион
Методика. К 0,5 мл препарата прибавляют по 2-3 капли
хлористоводородной кислоты разведенной 8,3% и 5%
раствора бария хлорида. Образуется белый осадок,
нерастворимый в разведенных минеральных кислотах.
(HCl)
CuSO4 + BaCl 2
BaSO4
+ CuCl 2
66.
Вставить картинку реакцииРаствор меди сульфата
5%-50,0 мл
Реакция на сульфат ион
67.
Осадок бария сульфата нерастворим в разведенныхминеральных кислотах
+ HCl разв.
Раствор меди сульфата 5%-50,0 мл
Реакция на сульфат ион
68.
Количественное определениеКосвенный йодометрический метод
(прямое титрование)
Титрант: 0,1М раствор натрия тиосульфата.
Индикатор: раствор крахмала.
2CuSO4 + 4KI → I2 + 2CuI↓ + 2K2SO4
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Cu2+ + 1ē → Cu+
69.
Количественное определениеКосвенный йодометрический метод
(прямое титрование)
5 мл препарата помещают в колбу с притертой пробкой,
прибавляют 25 мл воды, 2 мл серной кислоты
разведенной 16%, 5 мл 10% раствора калия йодида и
выделившийся йод титруют 0,1М раствором натрия
тиосульфата (индикатор-крахмал).
70.
Отмериваютпипеткой
навеску
препарата
71.
Прибавляют воду очищенную72.
Прибавляют серную кислоту разведенную73.
Прибавляют раствор калия йодида74.
Окраска раствора до начала титрования75.
Выделившийся йодтитруют
раствором натрия
тиосульфата до
светло-желтого
окрашивания
(за 1 мл до точки
эквивалентности)
76.
Окраска раствора за 1 мл до точкиэквивалентности
77.
Прибавляют индикатор крахмал78.
Окраска раствора после добавленияиндикатора
79.
Продолжаюттитровать
раствором
натрия
тиосульфата
до
исчезновения
фиолетовой
окраски
раствора
80.
Окраска раствора в конце титрования81.
1. Беликов, В.Г. Фармацевтическая химия / 4-е изд., перераб. и доп. – М.,МЕДпрессинформ", 2008. – 613 с.
2. Государственная фармакопея СССР [Текст] / М-во Здравоохранения
Рос. Федерации. – 10-е изд. – М.: Медицина, 1968. – 1079 с.
3. Государственная фармакопея СССР [Текст] / М-во Здравоохранения
Рос. Федерации. – 11-е изд., доп. – М.: Медицина, 1987. Вып. 1. – 336 с.
4. Государственная фармакопея СССР [Текст] / М-во Здравоохранения
Рос. Федерации. – 11-е изд., доп. – М.: Медицина, 1989. Вып. 2. – 400 с.
5. Государственная фармакопея Российской Федерации [Текст]. – 12-е изд.
– М.: Науч. центр экспертизы средств мед. применения, 2007. – Ч. 1. –
696 с.
6. Практическое
руководство
к
лабораторным
занятиям
по
фармацевтической химии для студентов III курса / Т.И. Ярыгина, О.Л.
Визгунова, В.А. Дубовик и др. / под ред. Л.М. Коркодиновой – Пермь,
2011. – 102 с.
7. Руководство к лабораторным занятиям по фармацевтической химии:
учеб. пособие / Э.Н. Аксенова, О.П. Андрианова, А.П. Арзамасцев и др. /
под. ред. А.П. Арзамасцева. – 3-е изд., перераб. и доп. – М., Медицина,
2001. – 384 с. : ил.1.
82. Иллюстрированные методики подготовили:
Саттарова Ольга Евгеньевна,доцент кафедры фармацевтической
химии факультета очного обучения
ГБОУ ВПО ПГФА,
кандидат фармацевтических наук,
директор Центра дистанционного обучения.
Ярыгина Татьяна Ивановна,
профессор кафедры фармацевтической химии
факультета очного обучения ГБОУ ВПО ПГФА,
доктор фармацевтических наук.














































































 Химия
Химия








