Похожие презентации:
Классы неорганических веществ. Соли
1.
Классынеорганических
веществ
СОЛИ
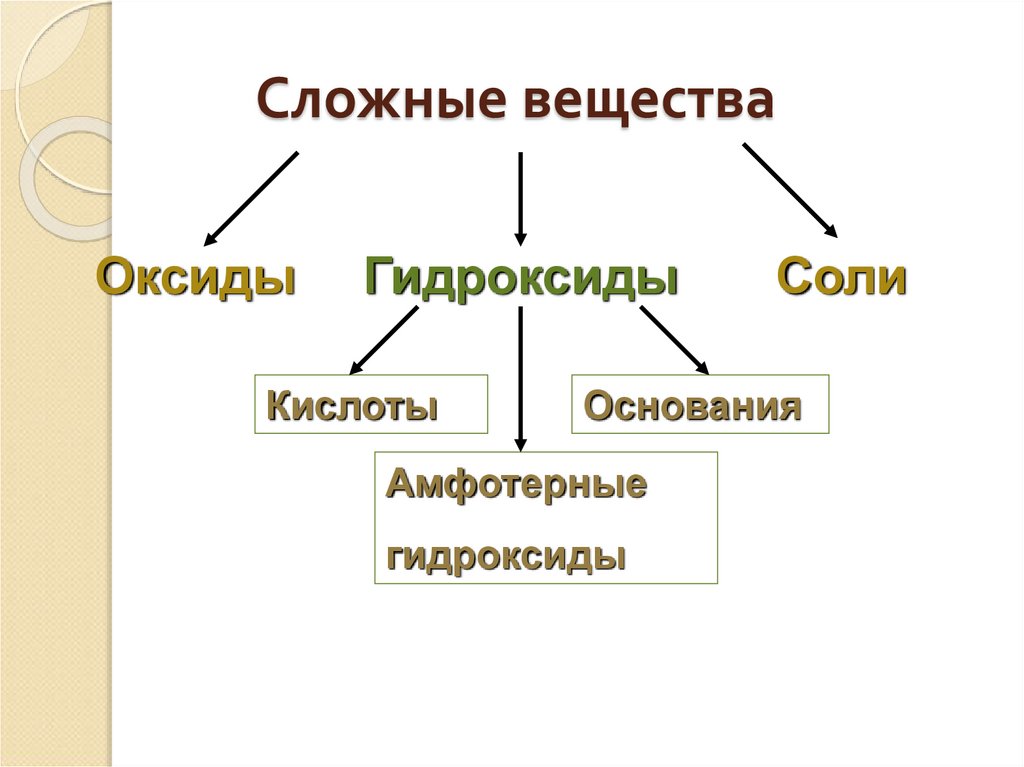
2. Сложные вещества
ОксидыГидроксиды
Кислоты
Соли
Основания
Амфотерные
гидроксиды
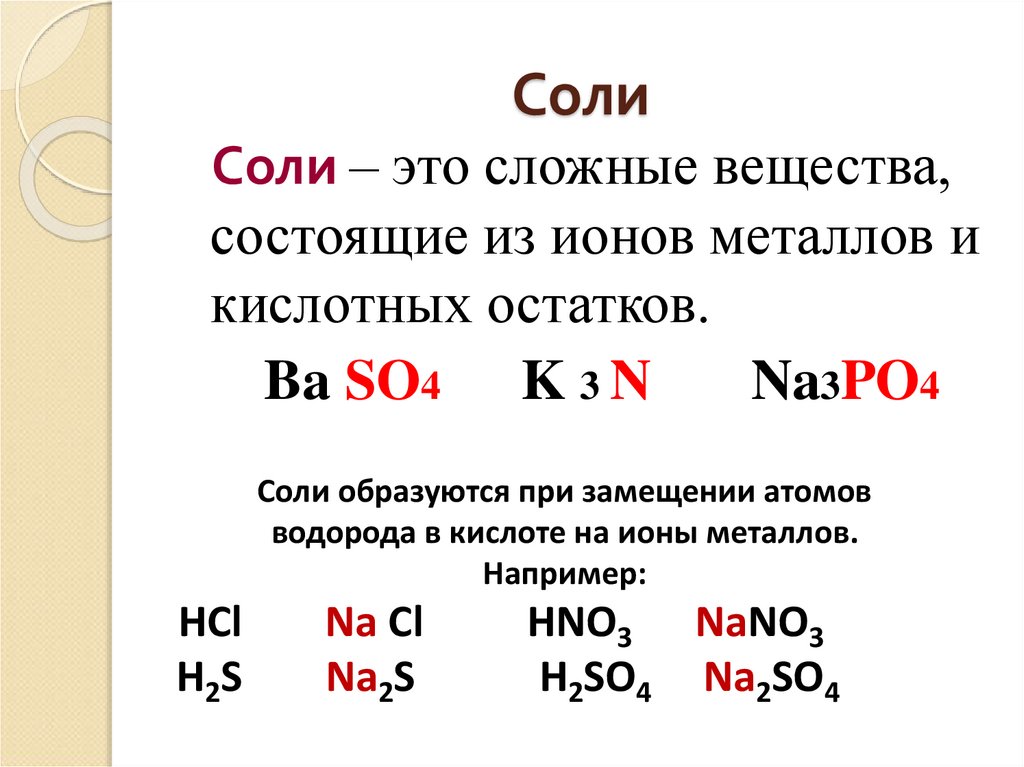
3. Соли
Соли – это сложные вещества,состоящие из ионов металлов и
кислотных остатков.
Ba SO4 K 3 N
Na3PO4
Соли образуются при замещении атомов
водорода в кислоте на ионы металлов.
Например:
HCl
H2S
Na Cl
Na2S
HNO3 NaNO3
H2SO4 Na2SO4
4. Номенклатура солей
НазваниеСоли
Название
кислотного
остатка
Название
металла в
родительном
падеже
5. Названия солей бескислородных кислот
называем неметалл ( латинское название) ссуффиксом – ид (в им. падеже);
Металл (в род. падеже).
NaCl – хлорид натрия
Al2S3 – сульфид алюминия
FeBr2 – бромид железа (II)
FeBr3 – бромид железа (III)
6. Названия солей кислородсодержащих кислот
Называем ион кислотного остатка (в именительномпадеже);
с суффиксами:
-ат
для высшей степени окисления;
-ит
для низшей степени окисления.;
Называем металл (в родительном падеже).
Na2SO4– сульфат натрия
Na2SO3 - сульфит натрия
Fe (NO2)2 – нитрит железа (II)
Fe (NO3) 3 – нитрат железа (III)
7. Номенклатура солей
F–Cl –
Br –
I–
S 2SO3 2SO4 2CO3 2SiO3 2NO3 –
NO2 –
PO4 3PO3 –
ClO4 –
Na F
NaCl
NaBr
Na I
Na2S
Na2SO3
Na2SO4
Na2CO3
Na2SiO3
Na NO3
Na NO2
Na3PO4
Na PO3
NaClO4
Фторид натрия
Хлорид натрия
Бромид натрия
Иодид натрия
Сульфид натрия
Сульфит натрия
Сульфат натрия
Карбонат натрия
Силикат натрия
Нитрат натрия
Нитрит натрия
Ортофосфат натрия
Метафосфат натрия
Хлорат натрия
8. Алгоритм составления формулы соли бескислородной кислоты
Первое действие: записываемстепени окисления элементов,
находим наименьшее общее кратное
6
Al3+ S2Второе действие: находим
индекс алюминия
6:3=2
Третье действие: находим
индекс серы
6:2=3
+3
2-
Al2 S3
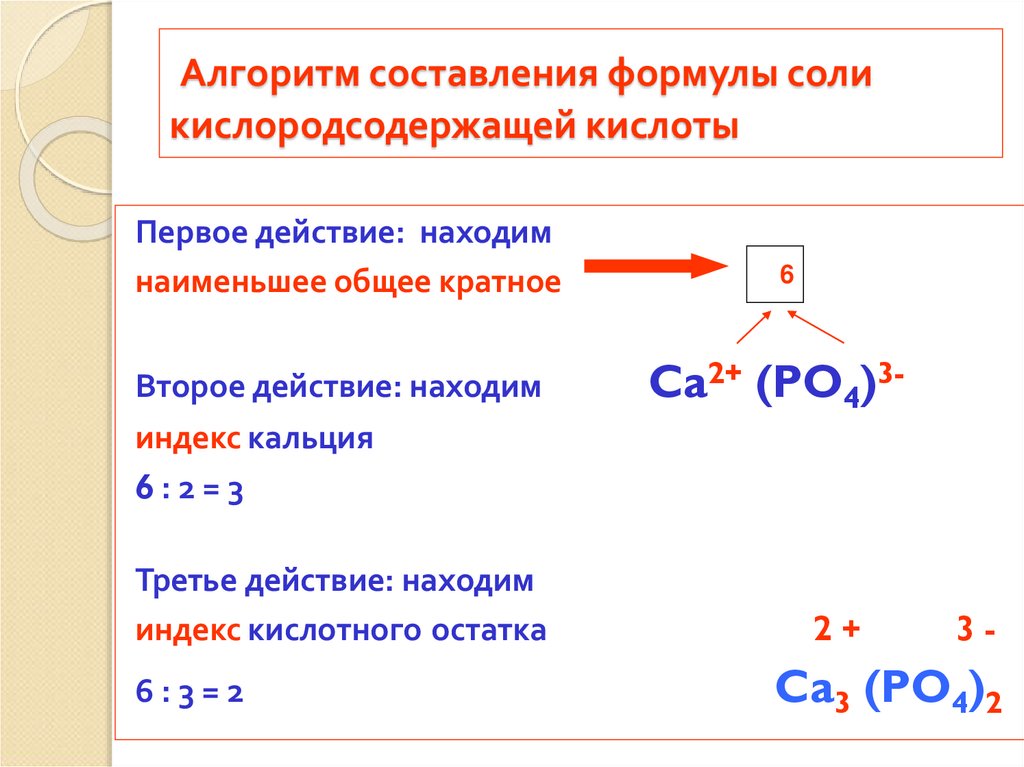
9. Алгоритм составления формулы соли кислородсодержащей кислоты
Первое действие: находимнаименьшее общее кратное
Второе действие: находим
6
Ca2+ (PO4)3-
индекс кальция
6:2=3
Третье действие: находим
индекс кислотного остатка
6:3=2
2+
3-
Ca3 (PO4)2
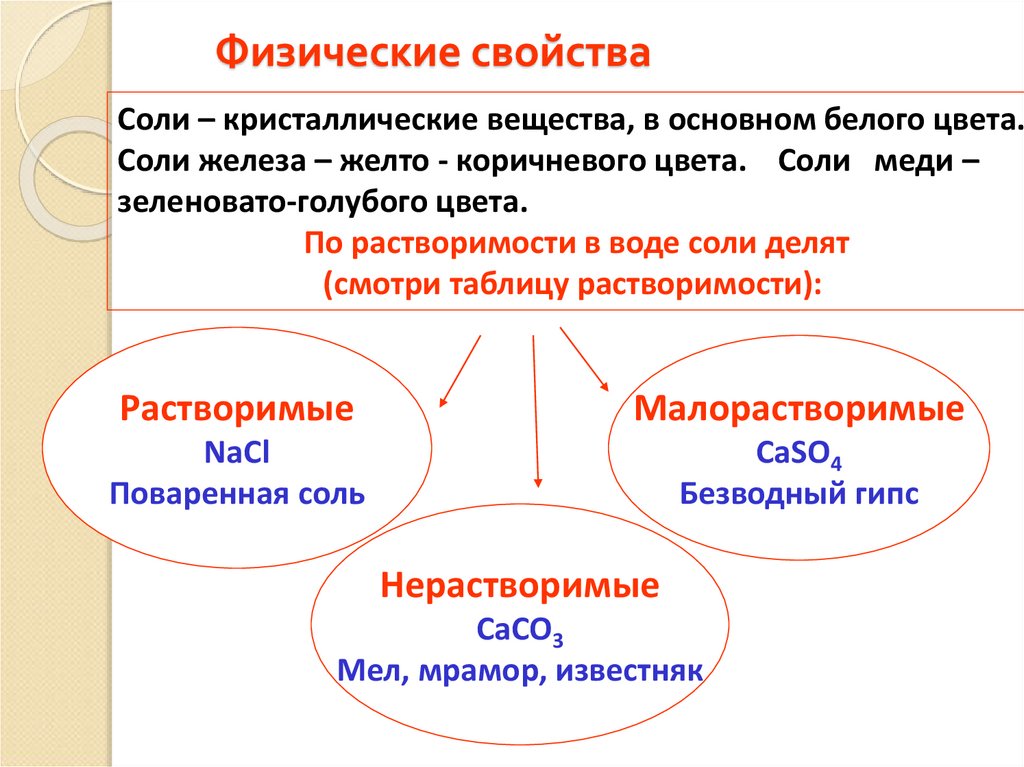
10. Физические свойства
Соли – кристаллические вещества, в основном белого цвета.Соли железа – желто - коричневого цвета. Соли меди –
зеленовато-голубого цвета.
По растворимости в воде соли делят
(смотри таблицу растворимости):
Растворимые
Малорастворимые
NaCl
Поваренная соль
CaSO4
Безводный гипс
Нерастворимые
CaCO3
Мел, мрамор, известняк
11. Типы солей
Нормальные (средние) -это соли, в которых все атомы водородасоответствующей кислоты замещены на атомы металла.
NaCl, Na2SO4, Na3PO4
Кислые - это соли, в которых атомы водорода замещены только
частично.
NaHSO4, Na2HPO4, NaH2PO4
Основные - это соли, в которых группы ОН соответствующего
основания частично замещены на кислотные остатки.
MgOHCl, Al(OH)2NO3
Двойные (смешанные) - это соли, в которых содержится два
разных катиона и один анион.
KAl(SO4)2, Fe(NH4)2(SO4)2
Комплексные - это соли, в состав которых входит комплексный
йон.
Na2[Zn(OH)4], K3[Fe(CN)6]
12. Химические свойства
Соли реагируют с металлами( исключенияактивные металлы: Li, Na, K, Ca, Ba - которые
при обычных условиях реагируют с водой):
Fe + CuSO4 = FeSO4 + Cu
Соли реагируют с кислотами:
Na2CO3 + 2HCl = 2NaCl + CO2 +
H2O
Карбонаты, сульфиты разлагаются при
нагревании:
СaCO3 = CaO + CO2
13. Химические свойства
Соли реагируют с некоторыми кислотнымиоксидами:
CaCO3 + SiO2 = CaSiO3 + CO2
Соли реагируют с другими солями с
образованием новых нерастворимых солей:
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
Соли реагируют с растворимыми основаниями
с образованием нерастворимого основания:
AlCl3 + 3KOH = Al(OH)3 + 3KCl
14. Получение солей
Взаимодействие металлов и неметаллов:2Fe + 3Cl2 = 2FeCl3
Взаимодействие кислотных оксидов с основными и
амфотерными оксидами:
CaO + CO2 = CaCO3
ZnO + SiO2 = ZnSiO3
Взаимодействие двух разных солей с образованием новой
нерастворимой соли:
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
Взаимодействие оснований и кислот:
NaOH + HCl = NaCl + H2O
Взаимодействие более активного металла с солями:
FeCl2 + Zn = ZnCl2 + Fe
Действие кислот на металлы, стоящие в ряду напряжений
металлов до H2 :
Zn + 2HCl = ZnCl2 + H2
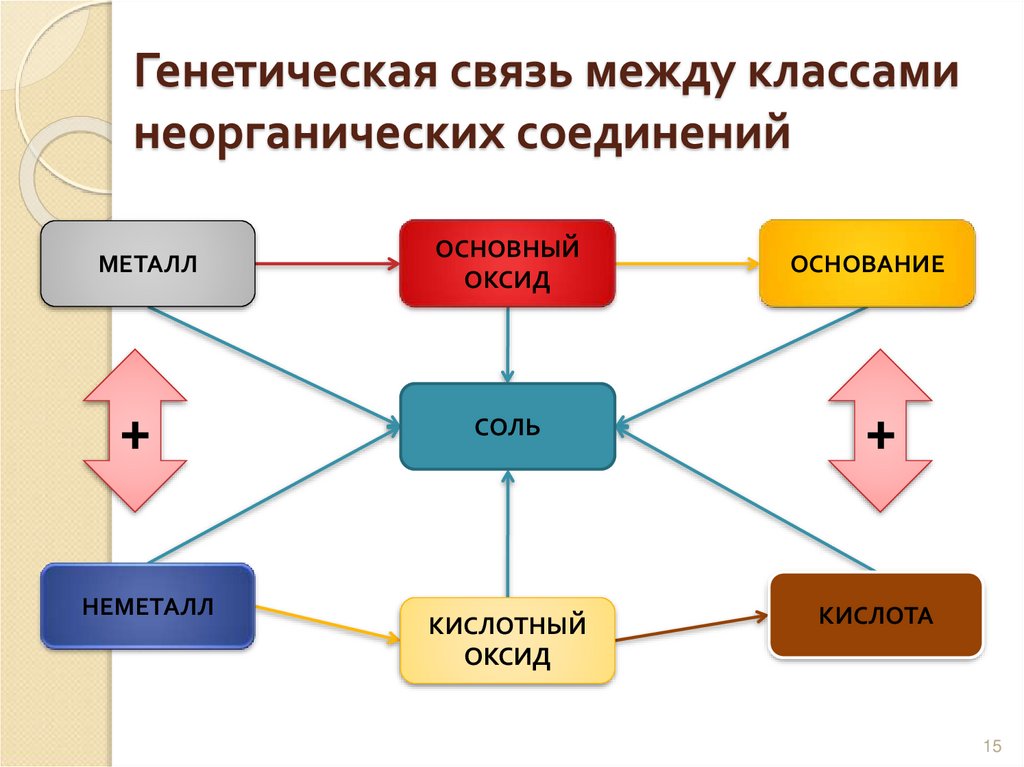
15. Генетическая связь между классами неорганических соединений
МЕТАЛЛ+
НЕМЕТАЛЛ
ОСНОВНЫЙ
ОКСИД
ОСНОВАНИЕ
СОЛЬ
+
КИСЛОТНЫЙ
ОКСИД
КИСЛОТА
15
16. КОНТРОЛЬНЫЕ ЗАДАНИЯ
1.Из предложенного перечня веществвыберите формулы солей, и дайте им
названия: Н2SO3, Ca3(PO4)2, H3PO4,
Mg(OH)2, NO2, HCl, Al(OH)3,CuO, HNO3,
ZnO, NaOH, NaBr , Be(OH) 2, Ca(OH) 2,
Fe(NО3)2, МgO, К2SO3, КOН, ZnСO3,
K2SiO3, Н2SiО3, МgCl2 , Ba(OH)2, ВеО,
Н2СO3, Mn2О7, Fe(OH)2 , BaF2, Fe(OH)3 ,
Fe2(SО4)3.
2. Напишите 3 уравнения реакций в
получения нитрата магния разными
способами в молекулярном виде.










 Химия
Химия








