Похожие презентации:
Химические свойства неорганических соединений
1. ХИМИЧЕСКИЕ СВОЙСТВА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
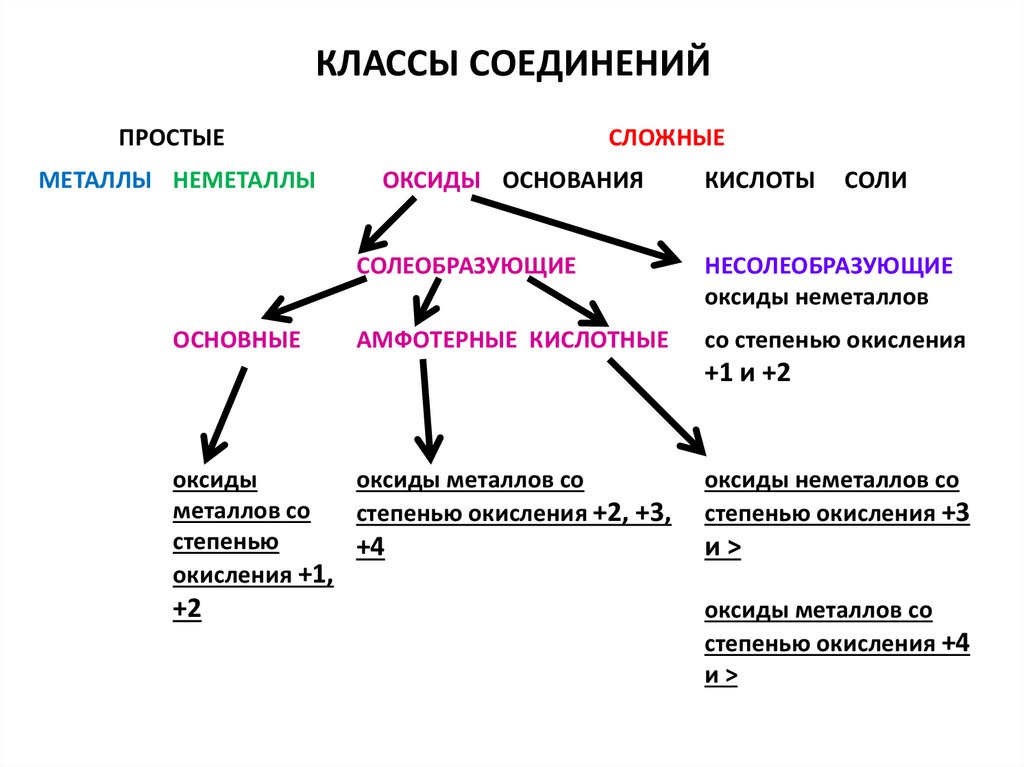
2. КЛАССЫ СОЕДИНЕНИЙ
ПРОСТЫЕМЕТАЛЛЫ НЕМЕТАЛЛЫ
ОСНОВНЫЕ
СЛОЖНЫЕ
ОКСИДЫ ОСНОВАНИЯ
КИСЛОТЫ
СОЛИ
СОЛЕОБРАЗУЮЩИЕ
НЕСОЛЕОБРАЗУЮЩИЕ
оксиды неметаллов
АМФОТЕРНЫЕ КИСЛОТНЫЕ
со степенью окисления
+1 и +2
оксиды
оксиды металлов со
металлов со
степенью окисления +2, +3,
степенью
+4
окисления +1,
оксиды неметаллов со
степенью окисления +3
+2
оксиды металлов со
степенью окисления +4
и>
и>
3.
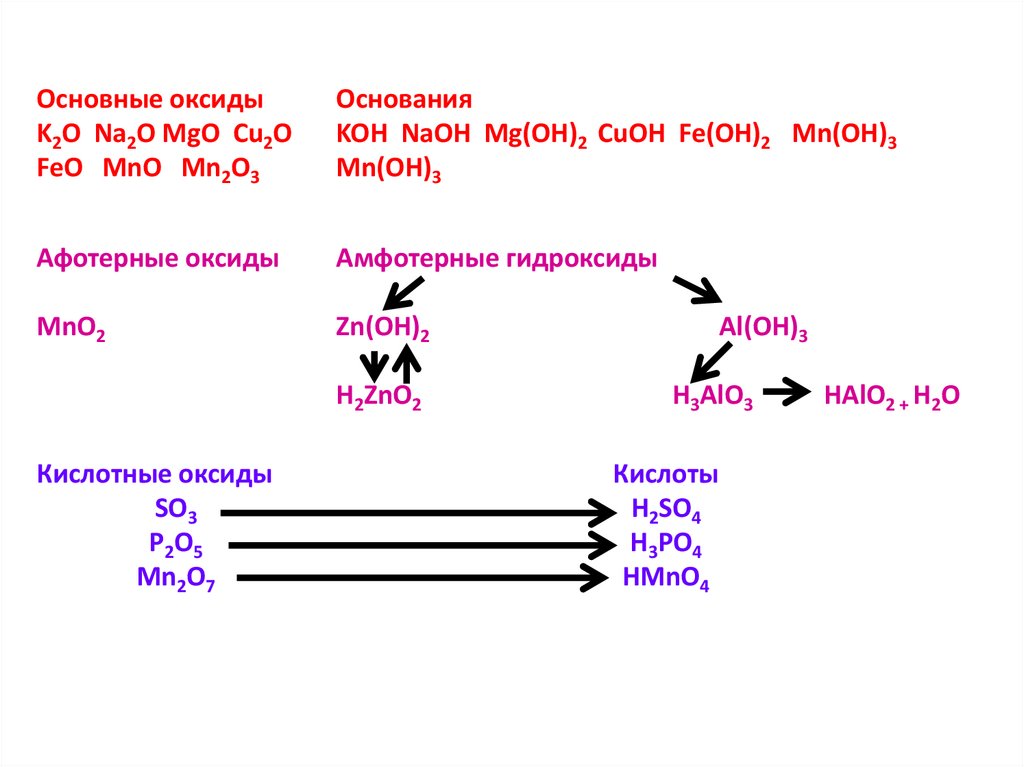
Основные оксидыK2O Na2O MgO Cu2O
FeO MnO Mn2O3
Основания
KOH NaOH Mg(OH)2 CuOH Fe(OH)2 Mn(OH)3
Mn(OH)3
Афотерные оксиды
Амфотерные гидроксиды
MnO2
Zn(OH)2
H2ZnO2
Кислотные оксиды
SO3
P2O5
Mn2O7
Al(OH)3
H3AlO3
Кислоты
H2SO4
H3PO4
HMnO4
HAlO2 + H2O
4.
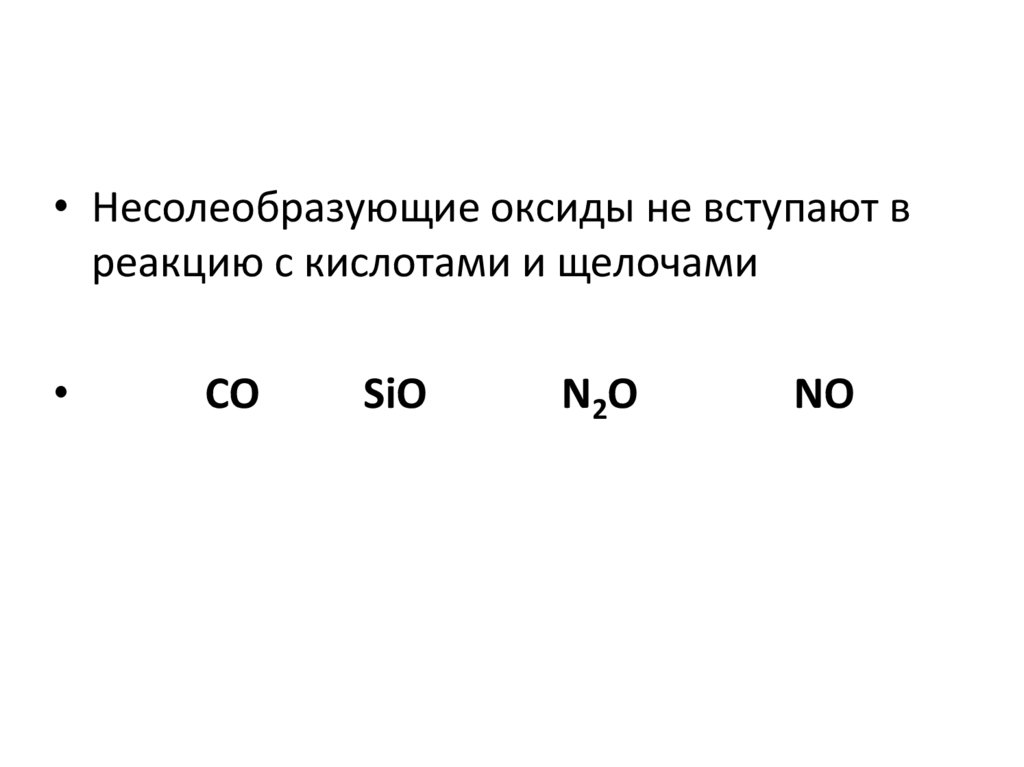
• Несолеобразующие оксиды не вступают вреакцию с кислотами и щелочами
CO
SiO
N2O
NO
5.
• Основные и кислотные оксиды растворяются вводе, если в результате реакции образуются
растворимые в воде основания и кислоты
FeO + H2O ≠
SiO2 + H2O ≠
• Основные и кислотные оксиды
взаимодействуют между собой (кислотный
оксид газообразный – реакция идет при
комнатной температуре; кислотный оксид не
растворим в воде – реагенты нагревают)
• Na2O + CO2 = Na2CO3 CaO+SO2 = CaSO3
Tн
• Na2O + SiO2→Na2SiO3 FeO+PbO2→FePbO3 +T


 Химия
Химия








