Похожие презентации:
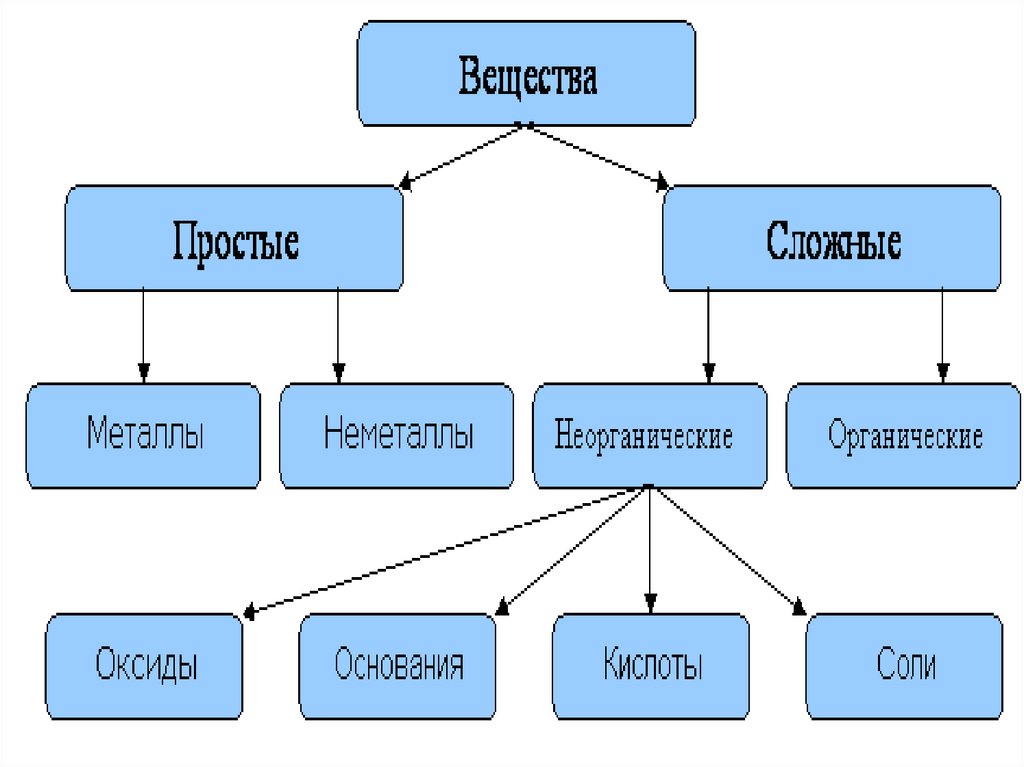
Основные классы неорганических веществ
1. Основные классы неорганических веществ
2.
3. Оксиды
• соединения, образованные атомами двухэлементов, одним из которых является
кислород в степени окисления (– 2)
• номенклатура: «оксид» + «какого элемента?»
(переменная степень окисления)
MgO - оксид магния
SO3 - оксид серы (VI)
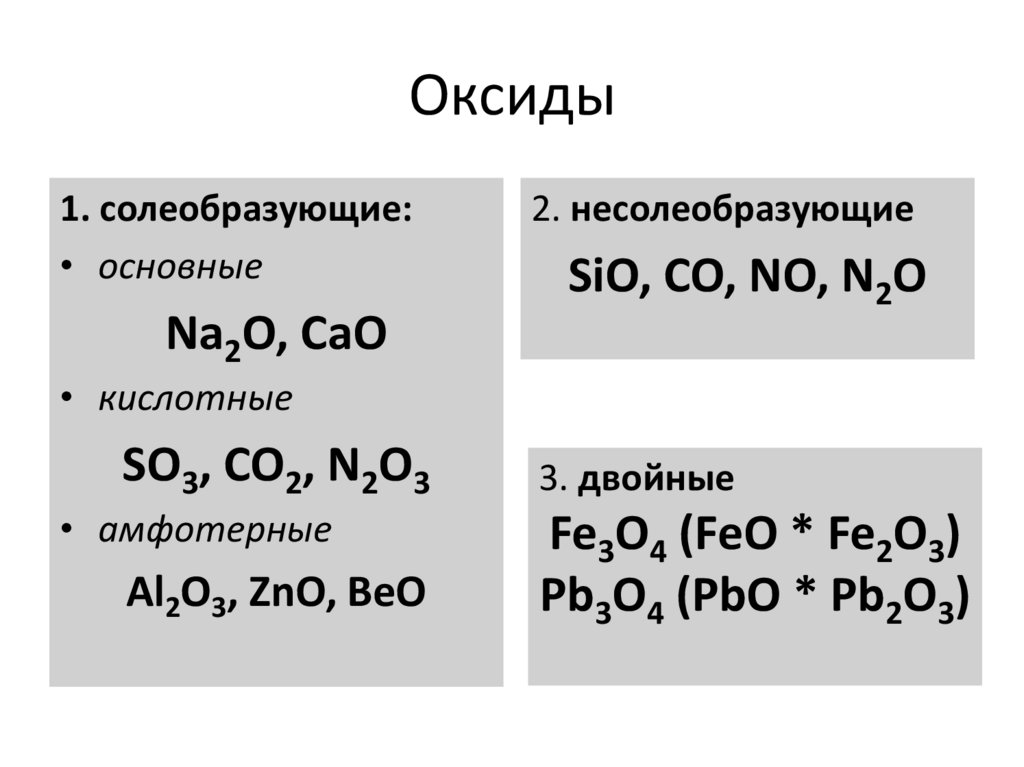
4. Оксиды
1. солеобразующие:• основные
Na2O, CaO
2. несолеобразующие
SiO, CO, NO, N2O
• кислотные
SO3, CO2, N2O3
• амфотерные
Al2O3, ZnO, BeO
3. двойные
Fe3O4 (FeO * Fe2O3)
Pb3O4 (PbO * Pb2O3)
5.
6. Основные оксиды
– оксиды всех металлов главной подгруппыпервой группы (щелочные металлы Li – Fr)
– главной подгруппы второй группы, начиная
с магния (Mg – Ra)
– оксиды переходных металлов в низших
степенях окисления (MnO, FeO)
7. Оксид железа (III)
8. Оксид алюминия
9. Оксид хрома (III)
10. Оксид кальция
11. Оксид железа (II)
12. Оксид ртути (II)
13. Оксид магния
14. Оксид свинца (II)
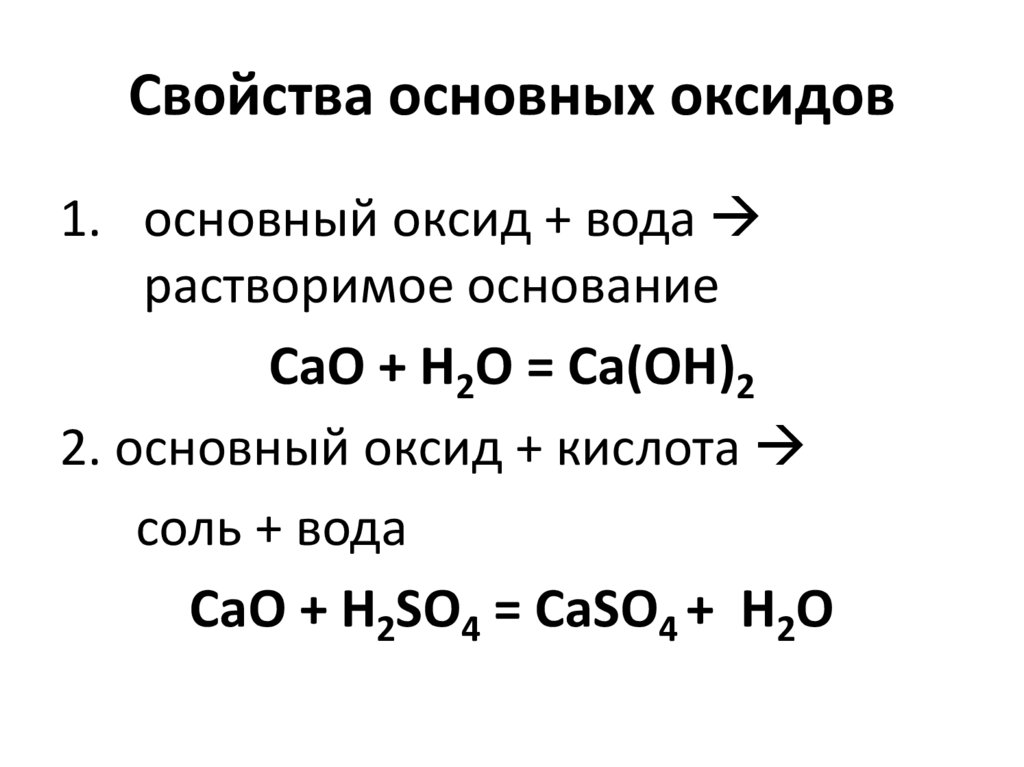
15. Свойства основных оксидов
1. основный оксид + водарастворимое основание
CaO + H2O = Ca(OH)2
2. основный оксид + кислота
соль + вода
CaO + H2SO4 = CaSO4 + H2O
16. Свойства основных оксидов
3. основный оксид + кислотныйоксид соль
CaO + CO2= CaCO3
4. основный оксид + Н2(С или СО)
металл + вода ( СО или СО2)
искл. оксиды раствор.
оснований
FeO + H2 = Fe + H2O
17. Кислотные оксиды
• оксиды металлов со степеньюокисления от +4 до +7
• оксиды неметаллов
(искл. несолеообразующие)
18. Свойства кислотных оксидов
1. кислотный оксид + водакислота
(искл. SiO2)
SO3 + H2O = H2SO4
2. кислотный оксид + основный
оксид соль
SO3 + CaO = CaSO4
19. Свойства кислотных оксидов
3. кислотный оксид +растворимое основание
соль + вода
SO3 + Ca(OH)2 = CaSO4 + H2O
20. Амфотерные оксиды
• оксиды, способные проявлять и кислотныеи основные свойства
• реагируя с сильной кислотой или
кислотным оксидом, проявляет свойства
основного оксида:
ZnO + SO3 = ZnSO4
• при взаимодействии с сильным
основанием или основным оксидом –
свойства
кислотного оксида:
ZnO + СаО = СаZnO2
21. Кислоты-
Кислоты• электролиты, при диссоциации которыхобразуется катион водорода и анион
кислотного остатка
Классификация:
1. неорганические HNO3
и
органические CH3COOH
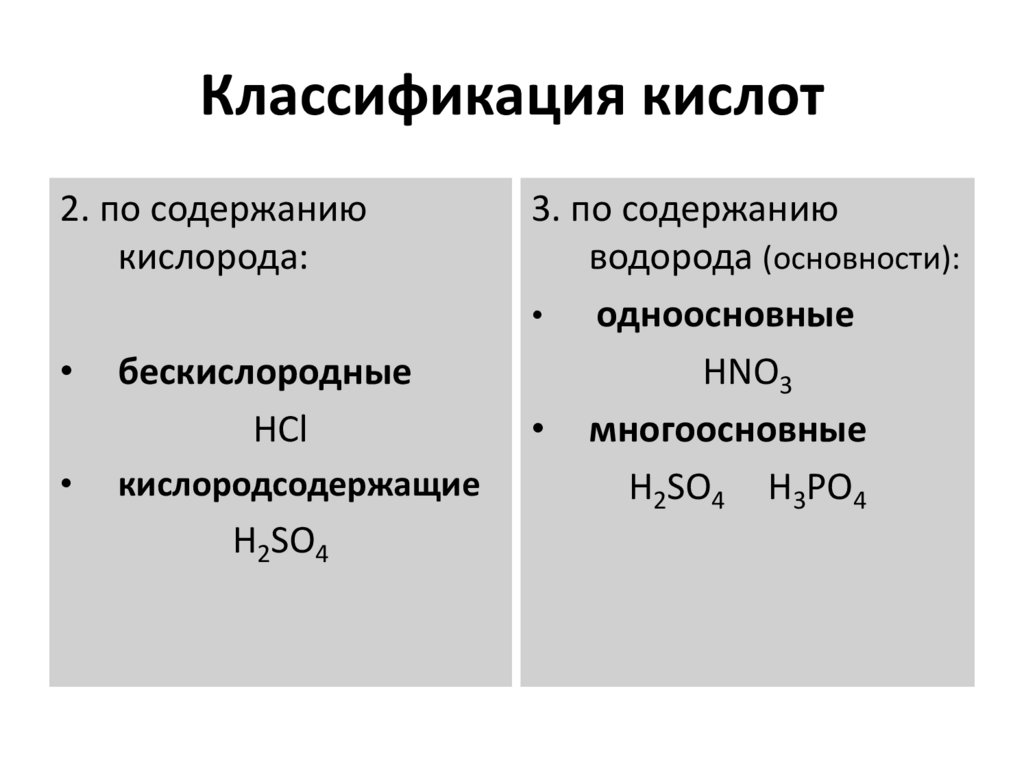
22. Классификация кислот
2. по содержаниюкислорода:
бескислородные
HCl
кислородсодержащие
H2SO4
3. по содержанию
водорода (основности):
одноосновные
HNO3
• многоосновные
H2SO4 H3PO4
23. Серная кислота
24. Хлороводородная кислота
25. Азотная кислота
26. Борная кислота
27. Ацетилсалициловая кислота
28. Уксусная кислота
29. Салициловая кислота
30. Муравьиная кислота
31. Яблочная кислота
32. Щавелевая кислота
33. Молочная кислота
34. Лимонная кислота
35. Витамин С
36. Пальмитиновая кислота
37. Винная кислота
38. Хлороводородная кислота
39. Хлороводородная кислота
40. Хлороводородная кислота
41. Хлороводородная кислота
42.
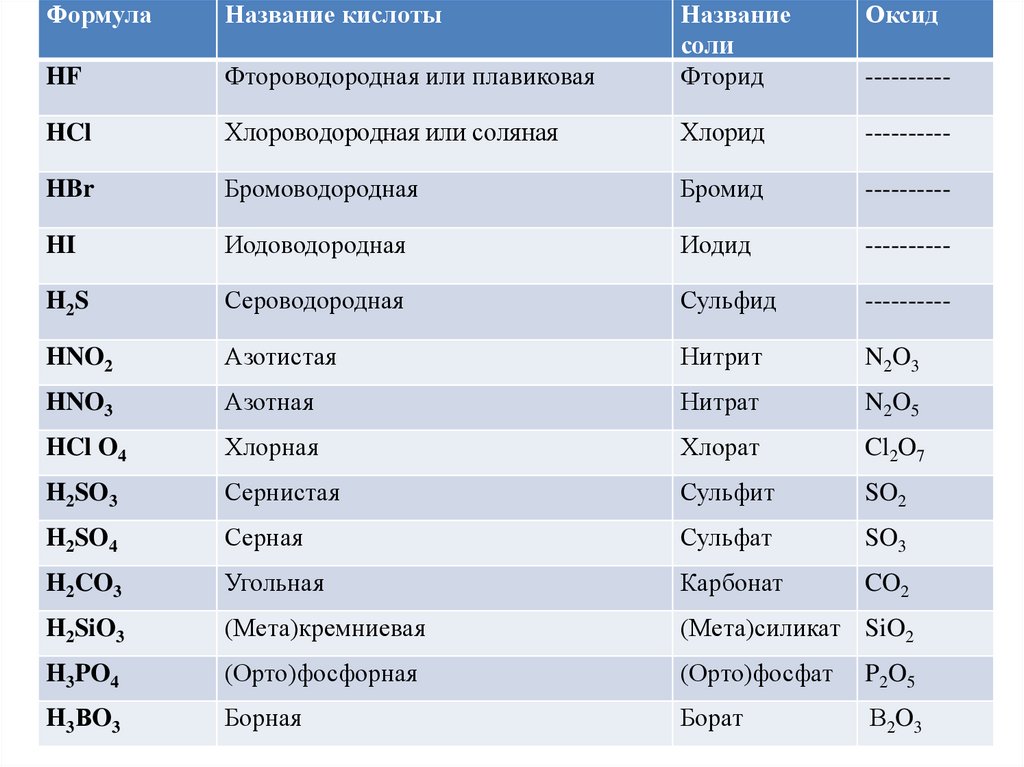
ФормулаНазвание кислоты
Оксид
Фтороводородная или плавиковая
Название
соли
Фторид
HF
HCl
Хлороводородная или соляная
Хлорид
----------
HBr
Бромоводородная
Бромид
----------
HI
Иодоводородная
Иодид
----------
H2S
Сероводородная
Сульфид
----------
HNO2
Азотистая
Нитрит
N2O3
HNO3
Азотная
Нитрат
N2O5
HCl O4
Хлорная
Хлорат
Cl2O7
H2SO3
Сернистая
Сульфит
SO2
H2SO4
Серная
Сульфат
SO3
H2CO3
Угольная
Карбонат
CO2
H2SiO3
(Мета)кремниевая
(Мета)силикат SiO2
H3PO4
(Орто)фосфорная
(Орто)фосфат
P2O5
H3ВO3
Борная
Борат
В2O3
----------
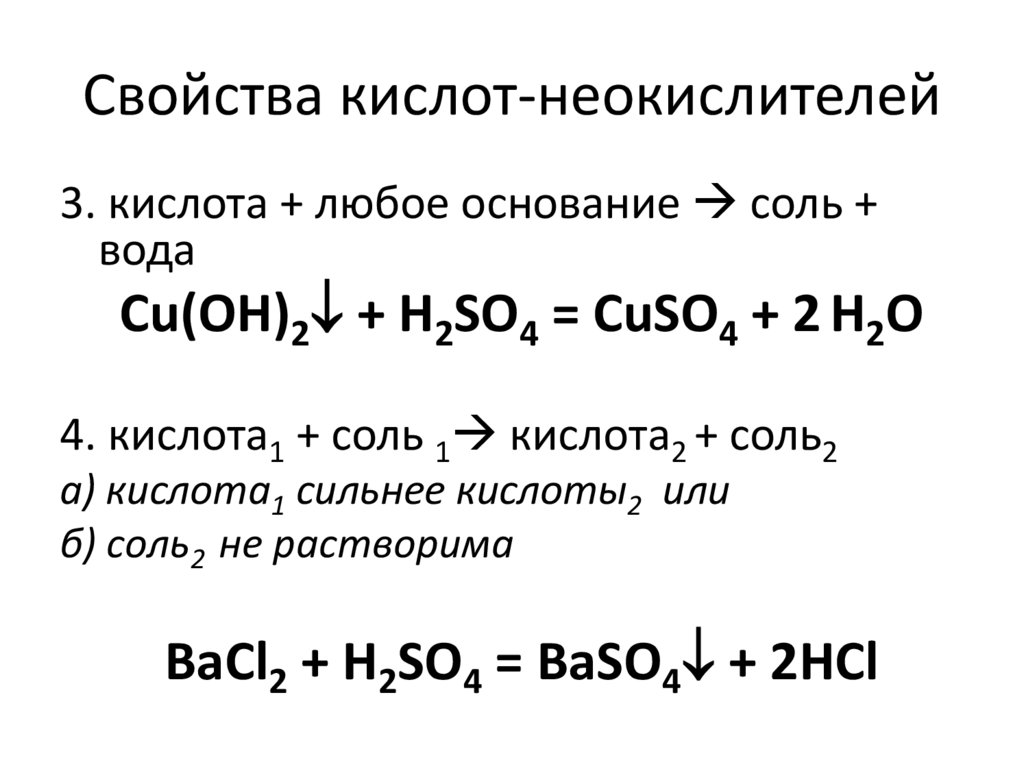
43. Свойства кислот-неокислителей
1. кислота + металл соль + Н2( искл. металл в ряду активности после водорода )
Mg + 2 HCl = MgCl2 + H2
2. кислота + основный оксид соль + вода
FeO + H2SO4 = FeSO4 + H2O
44. Свойства кислот-неокислителей
3. кислота + любое основание соль +вода
Cu(OH)2 + H2SO4 = CuSO4 + 2 H2O
4. кислота1 + соль 1 кислота2 + соль2
а) кислота1 сильнее кислоты2 или
б) соль2 не растворима
BaCl2 + H2SO4 = BaSO4 + 2HCl
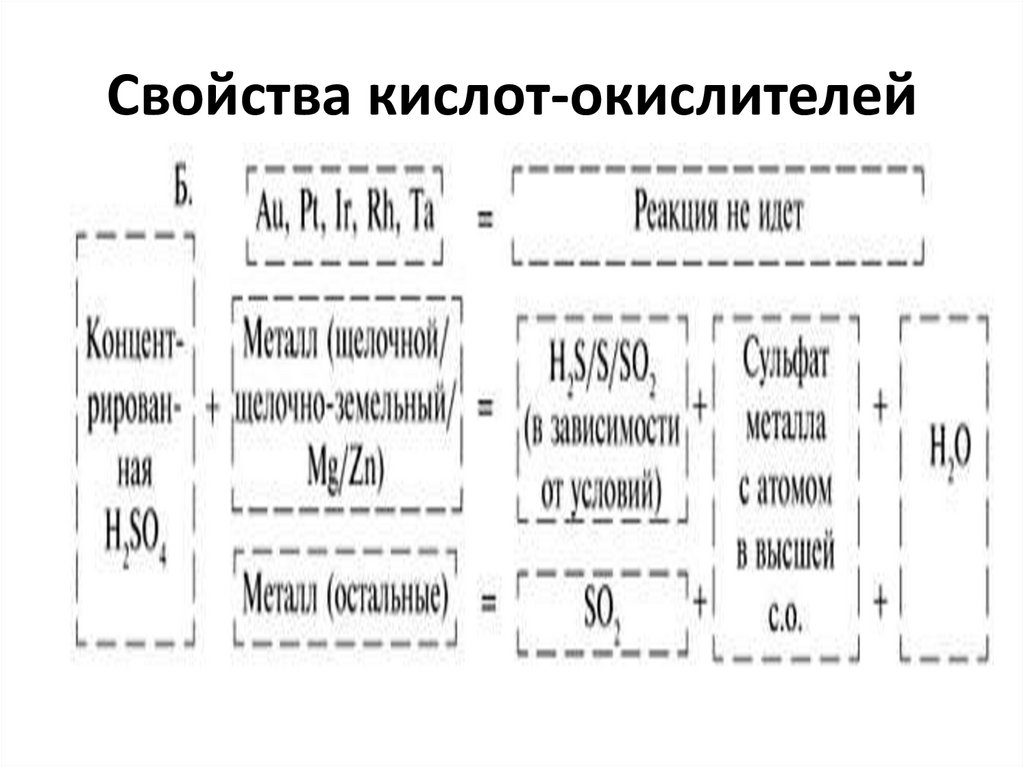
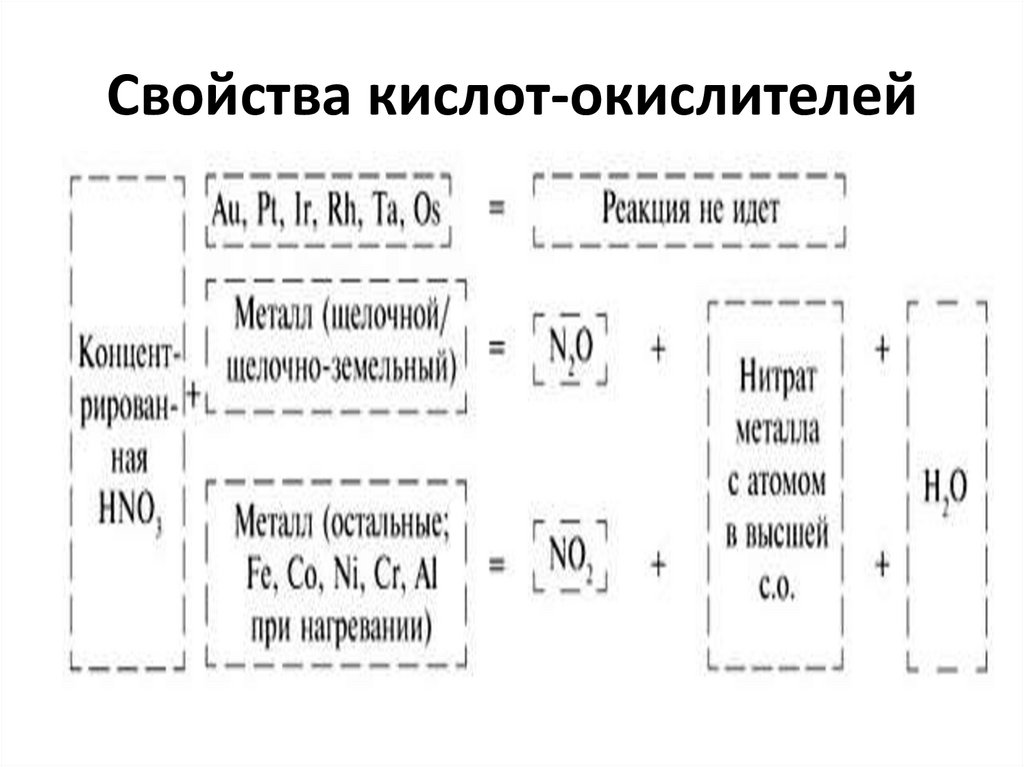
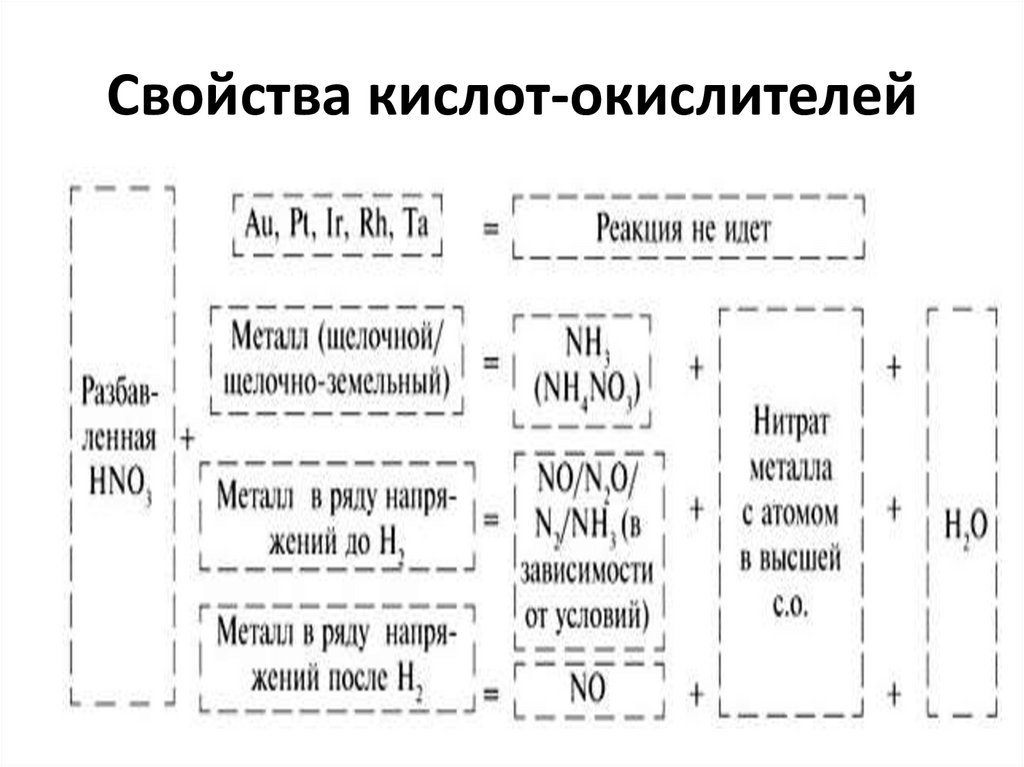
45. Свойства кислот-окислителей
46. Свойства кислот-окислителей
47. Свойства кислот-окислителей
48. Свойства кислот-окислителей
Cu + 4 HNO3 (к)= Cu(NO3)2 + 2 NO2 + 2 H2O3 Cu + 8 HNO3 (р)= 3 Сu(NO3)2 + 2 NO + 4 H2O
Cu + 2 H2SO4 (к) = CuSO4 + SO2 +2 H2O
S + 2 H2SO4 (к) = 3 SO2 + 2 H2O
3 P + 5 HNO3 (к) + 2 H2O = 3 H3PO4 + 5 NO
49. Серная кислота
50. Азотная кислота
51. Серная кислота
52. Серная кислота
53. Серная кислота
54. Основания
• электролиты, при диссоциации которыхобразуется катион металла и анион
гидроксогруппы
• номенклатура: «гидроксид» + какого
металла? + (переменная степень
окисления)
NaOH – гидроксид натрия
Fe(OH)2 - гидроксид железа (II)
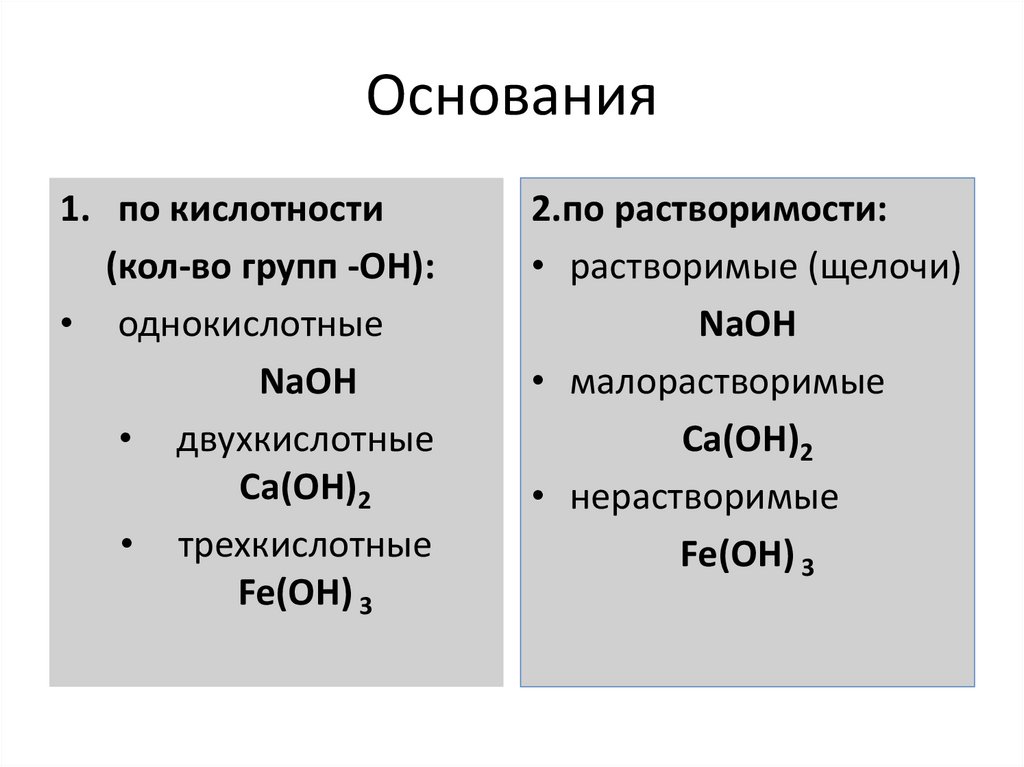
55. Основания
1. по кислотности(кол-во групп -ОН):
• однокислотные
NaOH
• двухкислотные
Ca(OH)2
• трехкислотные
Fe(OH) 3
2.по растворимости:
• растворимые (щелочи)
NaOH
• малорастворимые
Ca(OH)2
• нерастворимые
Fe(OH) 3
56. Гидроксид натрия
57. Гидроксид натрия на воздухе
58. Гидроксид калия
59. Гидроксид калия на воздухе
60. Гидроксид натрия
61. Гидроксид натрия
62. Гидроксид натрия
63. Гидроксид калия
64. Гидроксид калия
65. Гидроксид калия
66. Гидроксид железа (III)
67. Гидроксид меди (II)
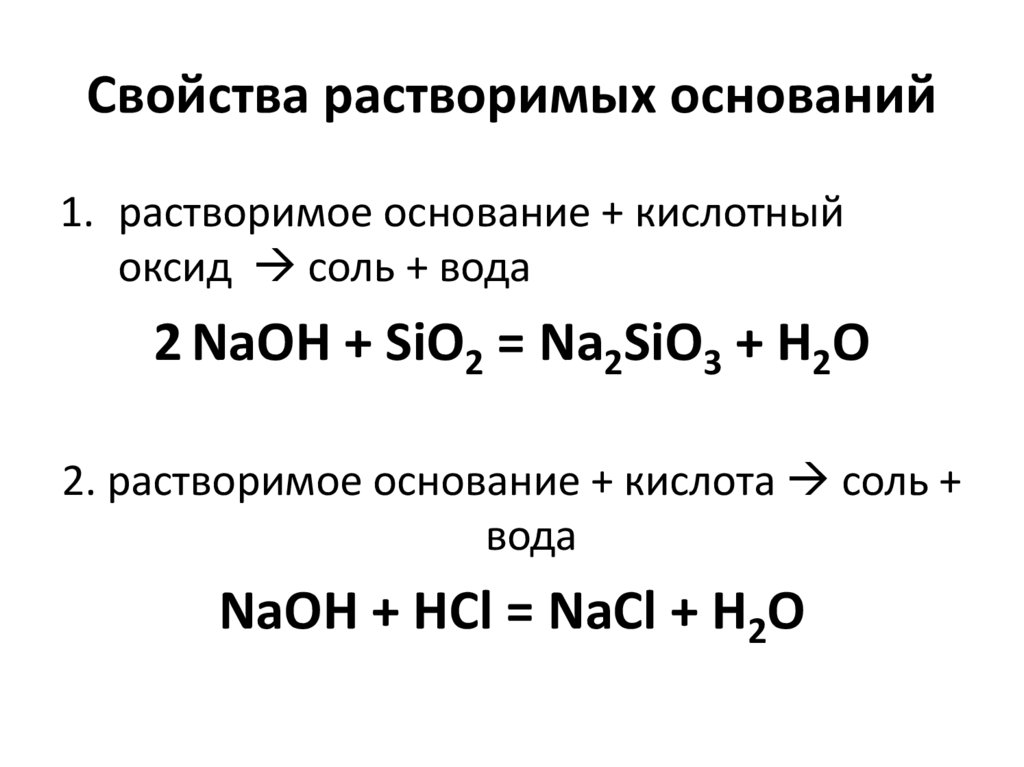
68. Свойства растворимых оснований
1. растворимое основание + кислотныйоксид соль + вода
2 NaOH + SiO2 = Na2SiO3 + H2O
2. растворимое основание + кислота соль +
вода
NaOH + HCl = NaCl + H2O
69. Свойства растворимых оснований
3. растворимое основание + соль1нерастворимое основание + соль2
а) соль1 растворима
2 NaOH + FeCl2 = Fe(OH)2 + 2 NaCl
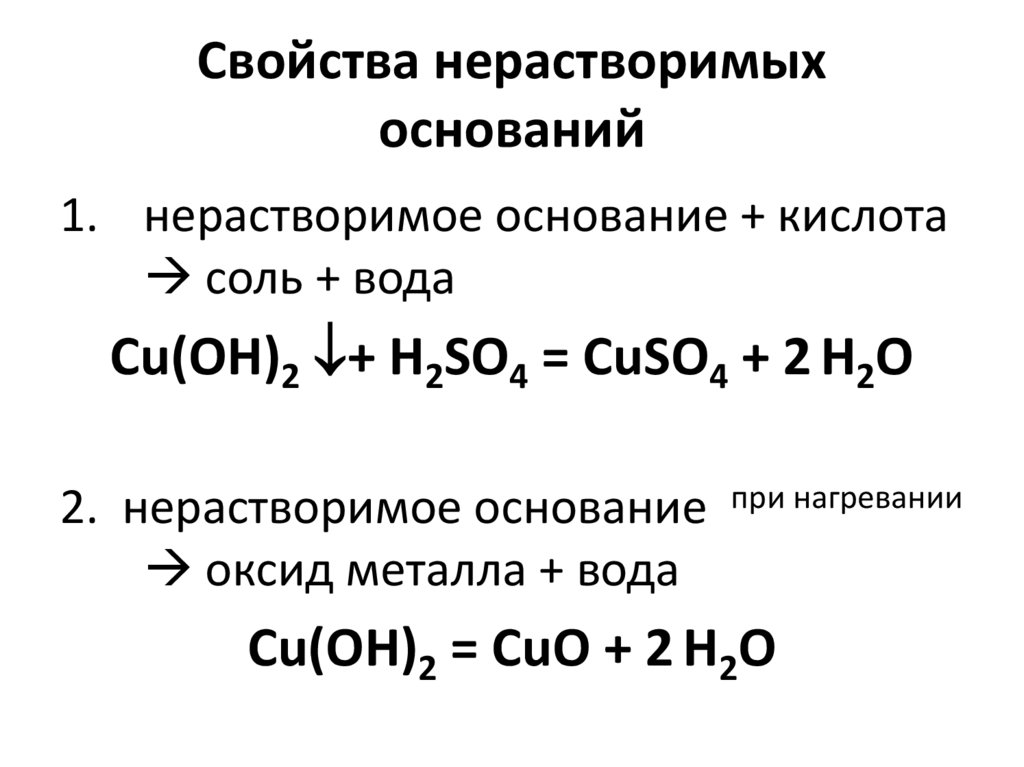
70. Свойства нерастворимых оснований
1. нерастворимое основание + кислотасоль + вода
Cu(OH)2 + H2SO4 = CuSO4 + 2 H2O
2. нерастворимое основание
оксид металла + вода
при нагревании
Cu(OH)2 = CuO + 2 H2O
71. Соли
• электролиты, которые в водных растворахдиссоциируют на катионы металлов и
анионы кислотного остатка
• номенклатура: «кислотный остаток» +
какого элемента? +(переменная степень
окисления)
Cu(NO3)2 - нитрат меди (II)
NaCl - хлорид натрия
72. Соли
1. средние Na2CO32. кислые NaHCO3
3. основные Al(OH)Cl2
4. двойные KAl(SO4)2
5. смешанные CaOCl2
6. комплексные K3[Fe(CN)6]
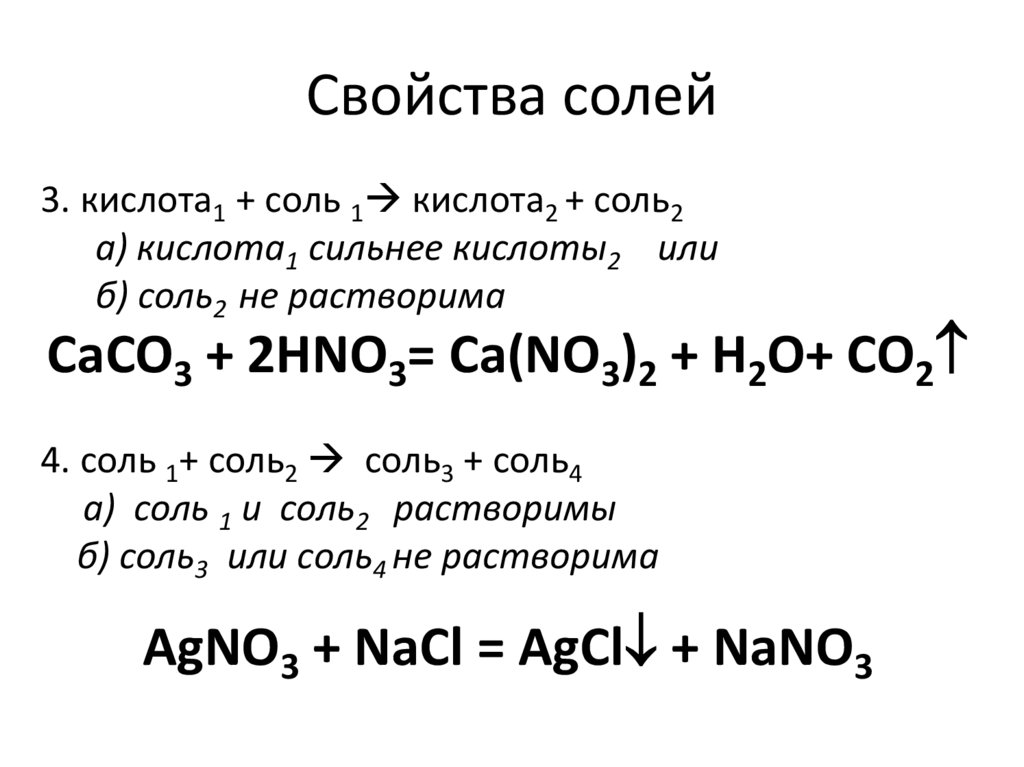
73. Свойства солей
1. металл1 + соль 1 металл2 + соль2а) соль 1 растворима
б) металл1 активнее металла2
2 AgNO3 + Cu = 2 Ag + Cu(NO3)2
2. растворимое основание + соль1 основание
+ соль2
а) соль1 растворима б) соль2 или основание не растворимы
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
74. Свойства солей
3. кислота1 + соль 1 кислота2 + соль2а) кислота1 сильнее кислоты2 или
б) соль2 не растворима
CaCO3 + 2НNO3= Ca(NO3)2 + H2O+ CO2
4. соль 1+ соль2 соль3 + соль4
а) соль 1 и соль2 растворимы
б) соль3 или соль4 не растворима
AgNO3 + NaCl = AgCl + NaNO3
75. Перманганат калия
76. Хлорид кальция
77. Хлорид меди(II)
78. Хлорид железа (III)
79. Хлорид меди(II)
80. Хлорид натрия (поваренная соль)
81. Хлорид калия
82. Хлорид никеля (II)
83. Хлорид магния
84. Хлорид кобальта (II)
85. Хлорид марганца (II)
86. Хлорид натрия
87. Хлорид натрия (поваренная соль)
88. Сульфат меди(II)
89. Сульфат никеля (II)
90. Сульфат меди(II)
91. Сульфат железа (II)
92. Сульфат меди(II)
93. Сульфат магния
94. Нитрат железа (III)
95. Нитрат калия
96. Нитрат кобальта (II)
97. Карбонат кальция
98. Карбонат кальция
99. Бихромат калия
100. Морская вода
101. Генетическая связь между основными классами неорганических соединений
основана на получении веществ одногокласса из веществ другого класса
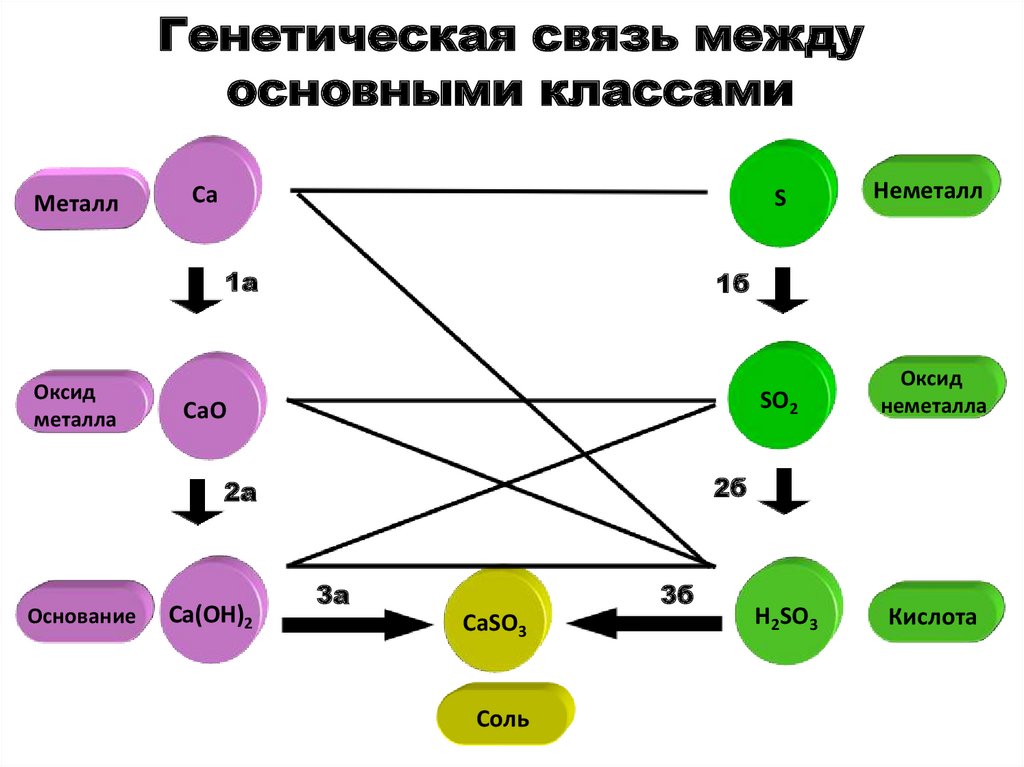
102. Генетическая связь между основными классами
МеталлCa
1a
Оксид
металла
CaO
Ca(OH)2
Неметалл
SO2
Оксид
неметалла
1б
2б
2a
Основание
S
3a
3б
CaSO3
Соль
H2SO3
Кислота
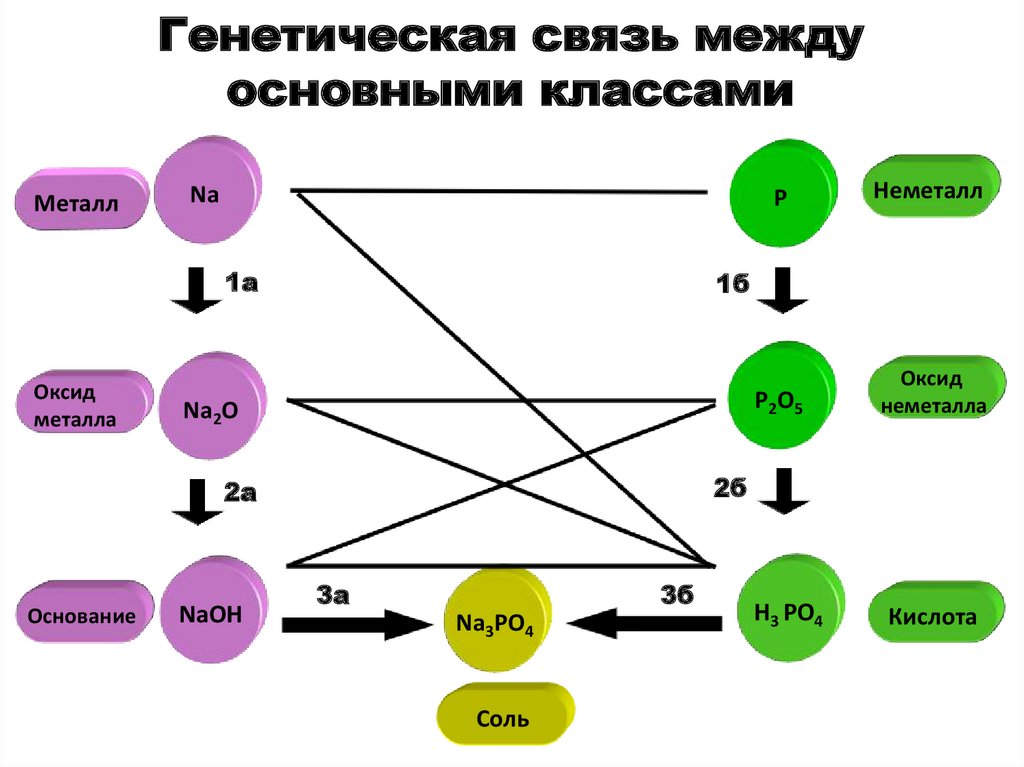
103. Генетическая связь между основными классами
МеталлNa
1a
Оксид
металла
Na2O
NaOH
Неметалл
P2O5
Оксид
неметалла
1б
2б
2a
Основание
P
3a
3б
Na3PO4
Соль
H3 PO4
Кислота
























































































 Химия
Химия








