Похожие презентации:
Молекулярная биология. Курс лекций
1. Презентация к курсу лекций по МОЛЕКУЛЯРНОЙ БИОЛОГИИ
LOGOПрезентация к курсу лекций по
МОЛЕКУЛЯРНОЙ
БИОЛОГИИ
кафедра биохимии и микробиологии
Составители:
к.б.н, доц. Сорокина И. А.
2. Содержание:
1. Основные этапы возникновения и развития молекулярной биологии.Методы молекулярной биологии.
2. Молекулярная организация генетического материала биологических
систем.
3. Мозаичная организация генома эукариот и вирусных систем.
Сплайсинг и его основные типы.
4. Нестабильность генома. Мобильные генетические элементы про- и
эукариот.
5. Репликация ДНК. Особенности биосинтеза вирусных нуклеиновых
кислот.
2
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
3. Содержание:
6. Репарация повреждений ДНК.7. Генетическая рекомбинация.
8. Экспрессионный аппарат клетки. Транскрипция.
9. Генетический код. Молекулярная организация тРНК т рибосом про- и
эукариот.
10. Трансляция: условия и энергетика. Рабочий цикл рибосомы.
Регуляция экспрессии гена.
Список использованных источников.
3
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
4. Лекция 1.
Основные этапы возникновения и развитиямолекулярной биологии.
Методы молекулярной биологии.
К
содержанию
4
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
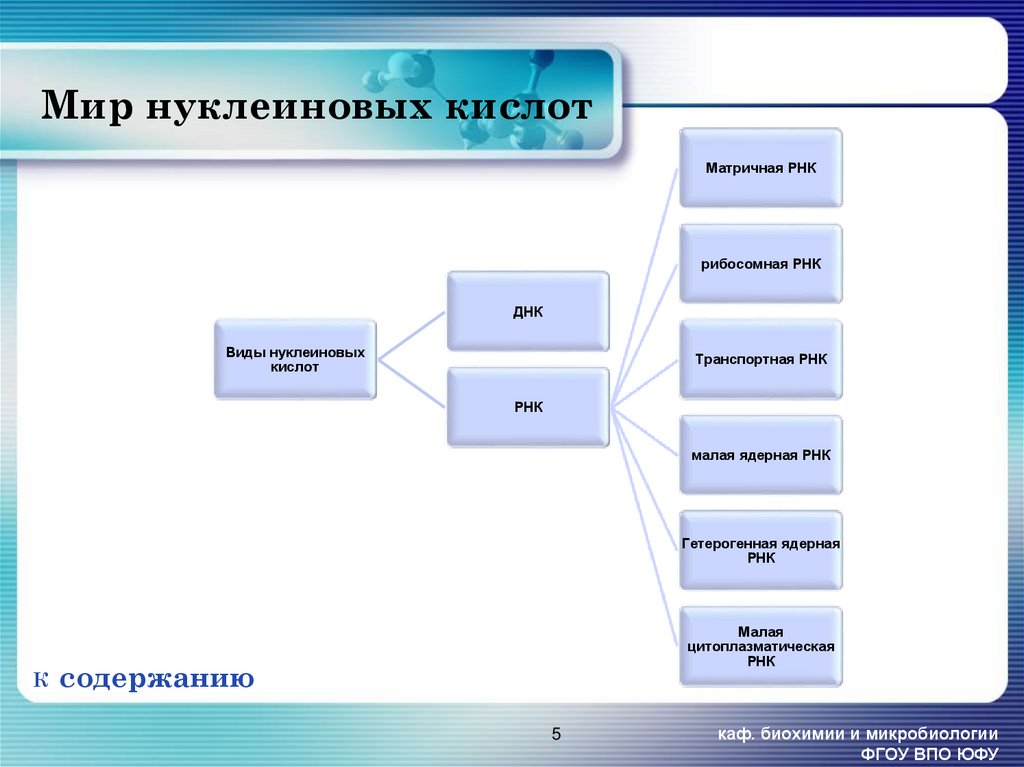
5. Мир нуклеиновых кислот
Матричная РНКрибосомная РНК
ДНК
Виды нуклеиновых
кислот
Транспортная РНК
РНК
малая ядерная РНК
Гетерогенная ядерная
РНК
К
Малая
цитоплазматическая
РНК
содержанию
5
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
6. Информационная связь между ДНК, РНК и белками
Ксодержанию
6
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
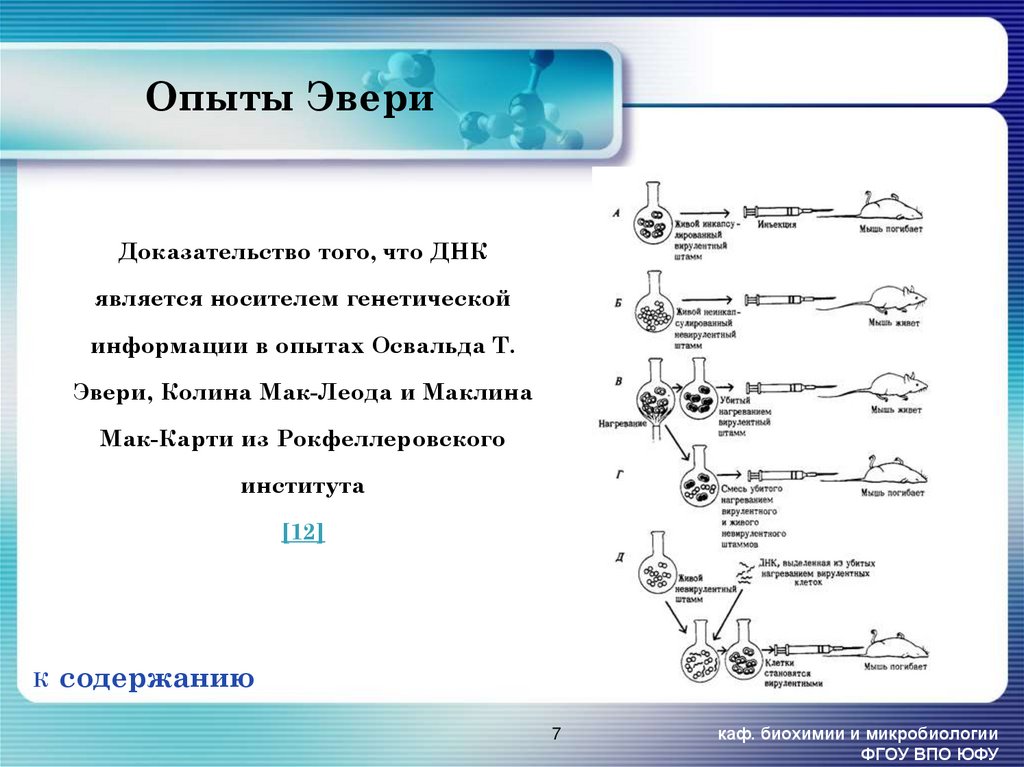
7. Опыты Эвери
Доказательство того, что ДНКявляется носителем генетической
информации в опытах Освальда Т.
Эвери, Колина Мак-Леода и Маклина
Мак-Карти из Рокфеллеровского
института
[12]
К
содержанию
7
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
8. Общая схема эксперимента Альфреда Д. Херши и Марты Чейз в опытах с применением радиоактивных меток (1952 г.). [12]
Эксперимент Альфреда Д.Херши и Марты Чейз
Нерадиоактивная белковая радиоактивная белковая
оболочка
оболочка
Радиоакти
вная ДНК
Фаг
Инъек
ция
Общая схема эксперимента
Альфреда Д. Херши и Марты
Чейз в опытах с применением
радиоактивных меток
(1952 г.). [12]
Гомогениз
ация
Нерадиоакти
вная
Раздел
ение
путём
центри
фугирования
Радиоактивн
ая
8
нерадиоакт
ивная ДНК
Радиоактивн
ая
Нерадиоакти
вная
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
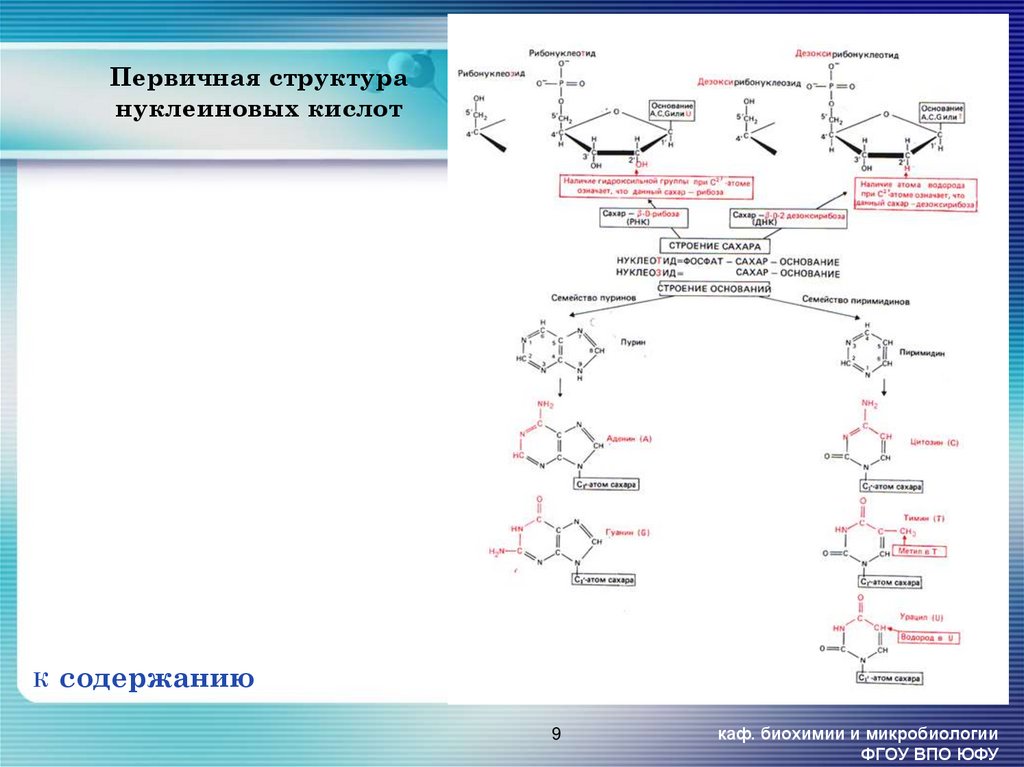
9. Первичная структура нуклеиновых кислот
Ксодержанию
9
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
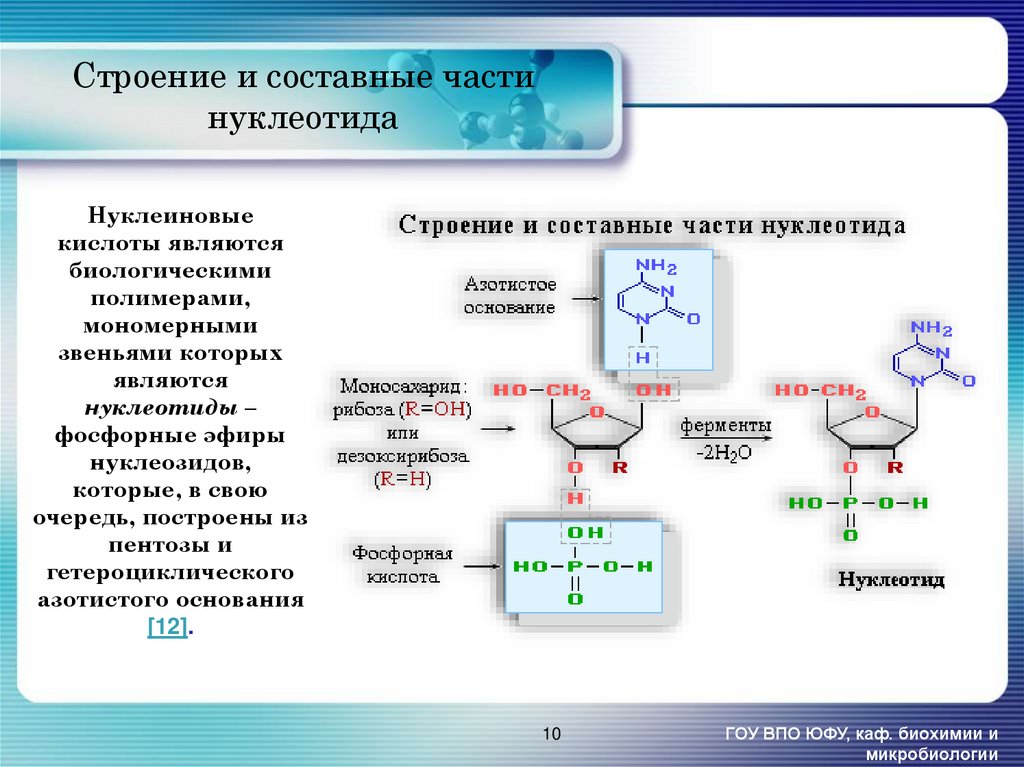
10. Нуклеиновые кислоты являются биологическими полимерами, мономерными звеньями которых являются нуклеотиды – фосфорные эфиры
Строение и составные частинуклеотида
Нуклеиновые
кислоты являются
биологическими
полимерами,
мономерными
звеньями которых
являются
нуклеотиды –
фосфорные эфиры
нуклеозидов,
которые, в свою
очередь, построены из
пентозы и
гетероциклического
азотистого основания
[12].
10
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
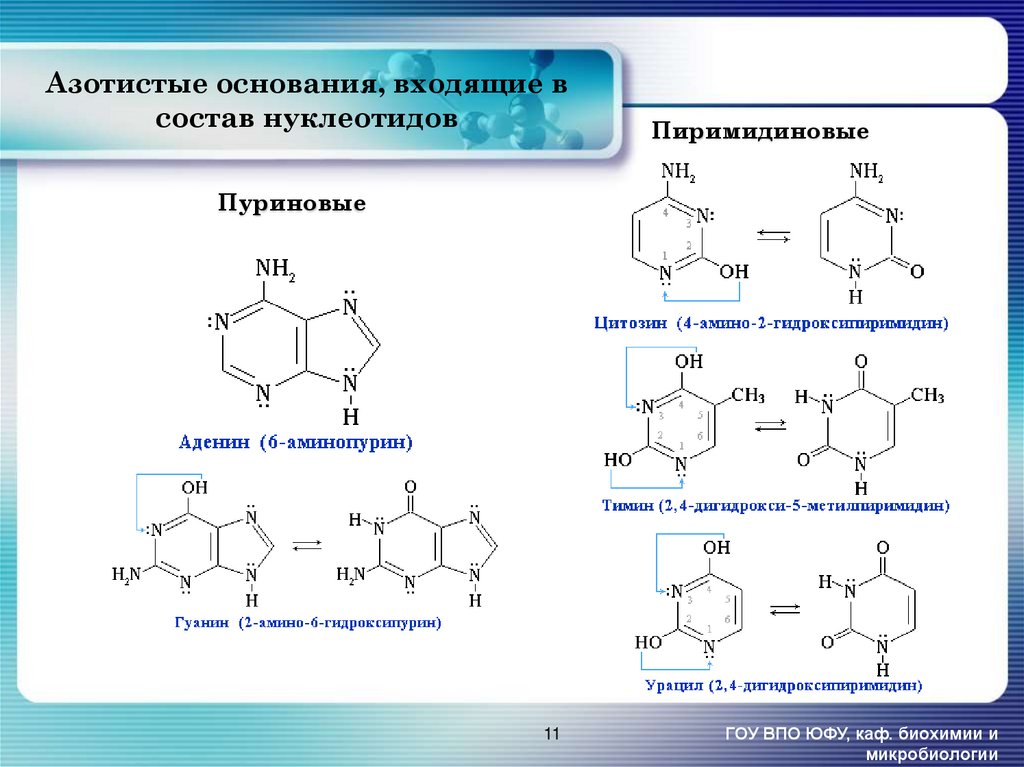
11. Азотистые основания, входящие в состав нуклеотидов
ПиримидиновыеПуриновые
11
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
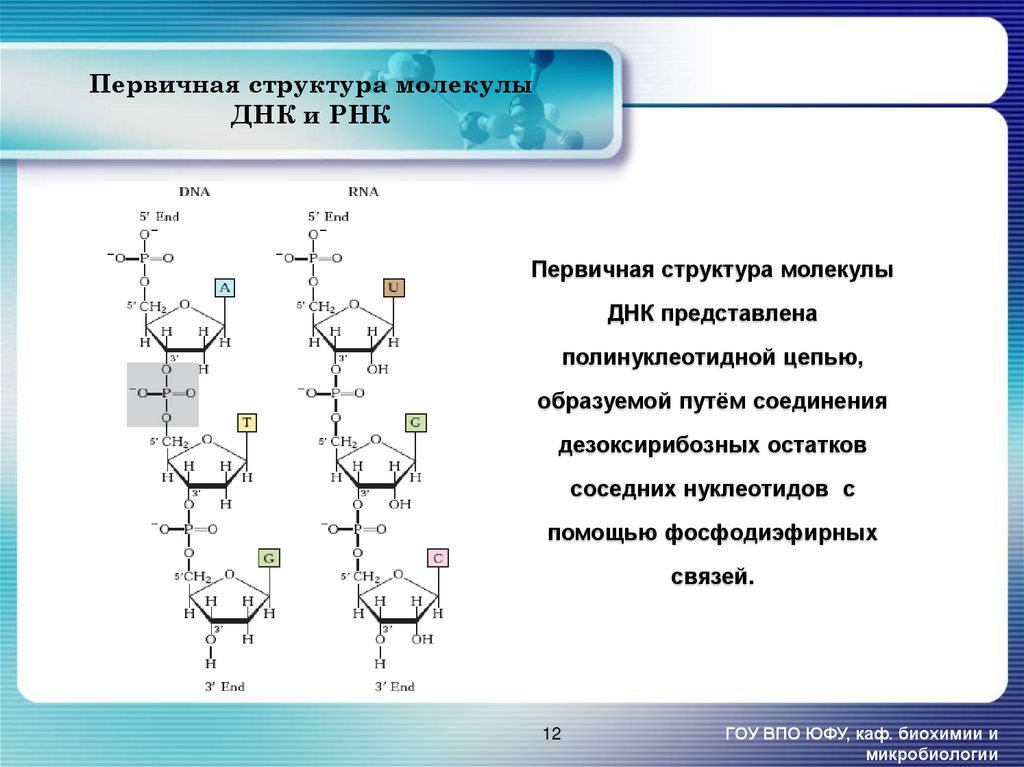
12. Первичная структура молекулы ДНК и РНК
Первичная структура молекулыДНК представлена
полинуклеотидной цепью,
образуемой путём соединения
дезоксирибозных остатков
соседних нуклеотидов с
помощью фосфодиэфирных
связей.
12
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
13. Взаимодействия между гетероциклическими основаниями в нуклеиновых кислотах [12].
Образованиекомплментарных
пар оснований
А-Т и G-C
13
Специфическая
макромолекулярная
структура ДНК
определяется двумя
типами взаимодействий
между
гетероциклическими
основаниями
нуклеотидных остатков:
1.) Взаимодействие между
парами оснований в
комплементарных цепях.
2.) Межплоскостные
взаимодействия
оснований
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
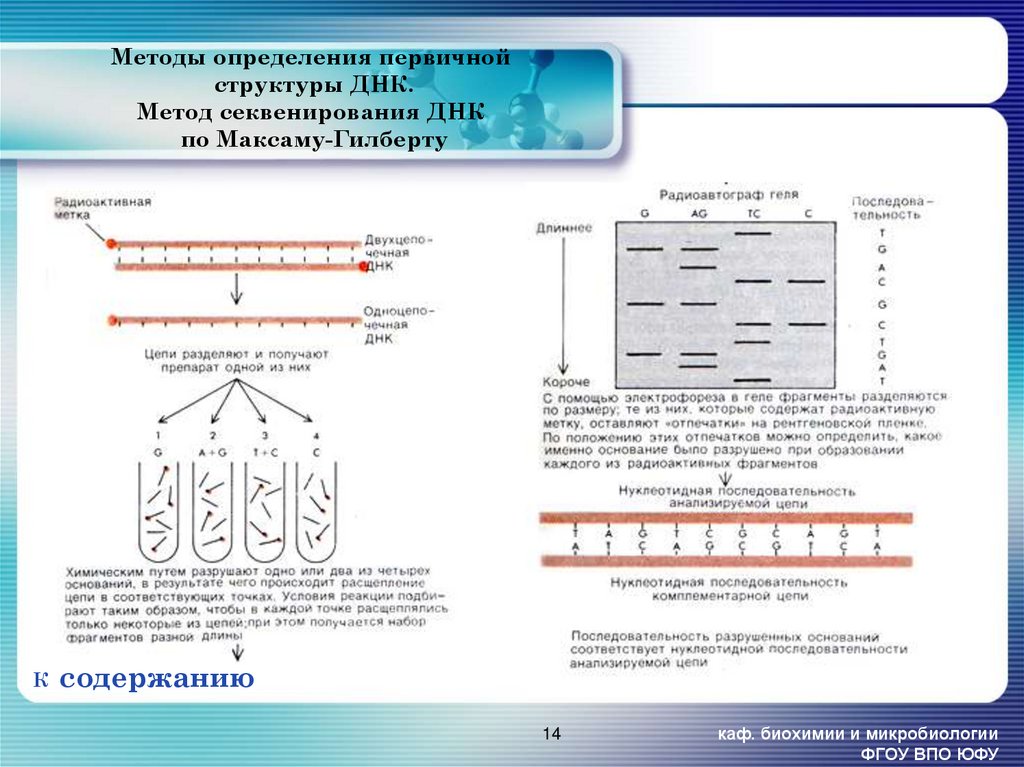
14. Методы определения первичной структуры ДНК. Метод секвенирования ДНК по Максаму-Гилберту
Ксодержанию
14
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
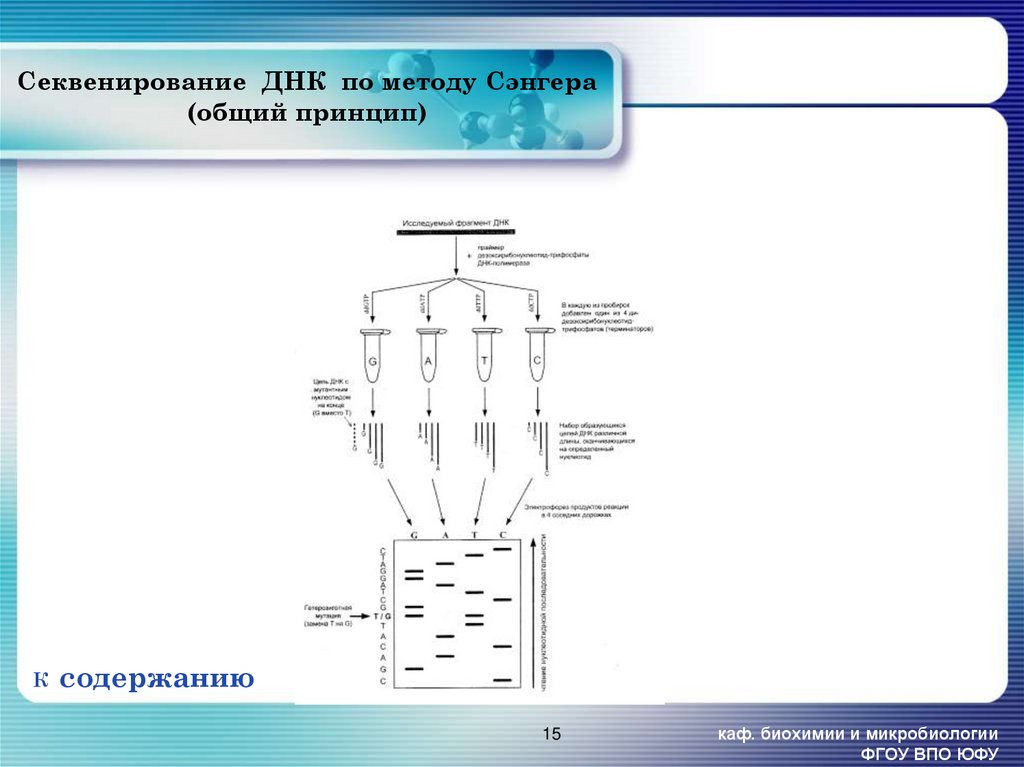
15. Секвенирование ДНК по методу Сэнгера (общий принцип)
Ксодержанию
15
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
16. Результаты секвенирования ДНК/РНК
Ксодержанию
16
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
17. Физико-химические свойства ДНК. Денатурация и ренатурация ДНК [2].
Кривые денатурацииДенатурация двухцепочечной ДНК
17
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
18. Лекция 2.
Молекулярная организация генетическогоматериала биологических систем.
К
содержанию
18
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
19. Постулирование модели двойной спирали ДНК американским генетиком Джеймсом Уотсоном и английским физиком Френсисом Криком [7].
19ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
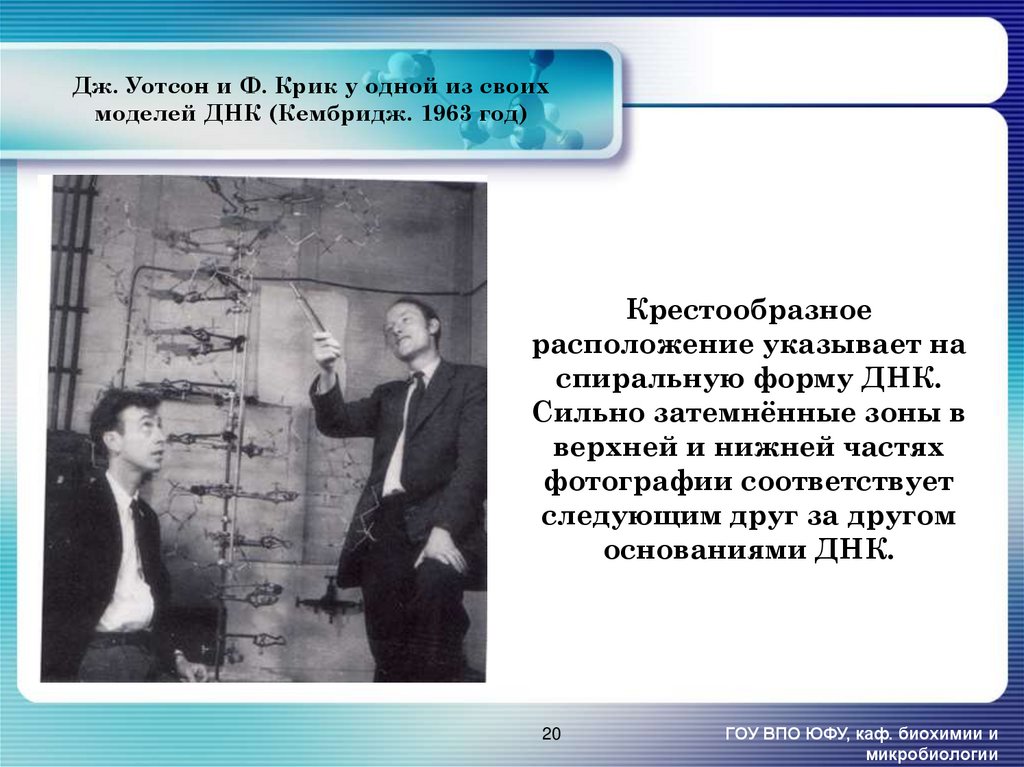
20. Дж. Уотсон и Ф. Крик у одной из своих моделей ДНК (Кембридж. 1963 год)
Крестообразноерасположение указывает на
спиральную форму ДНК.
Сильно затемнённые зоны в
верхней и нижней частях
фотографии соответствует
следующим друг за другом
основаниями ДНК.
20
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
21. Идеализированная картина дифракции ДНК. Результаты этих измерений привели к построению модели ДНК.
Рентгенограммы волокон ДНК,полученные Франклин и
Уилкинсом между 1950 и 1053 гг.
Идеализированная
дифракционная картина имеет
вид креста из рефлексов (пятен),
образующегося из-за
регулярностиструктуры ДНК.
21
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
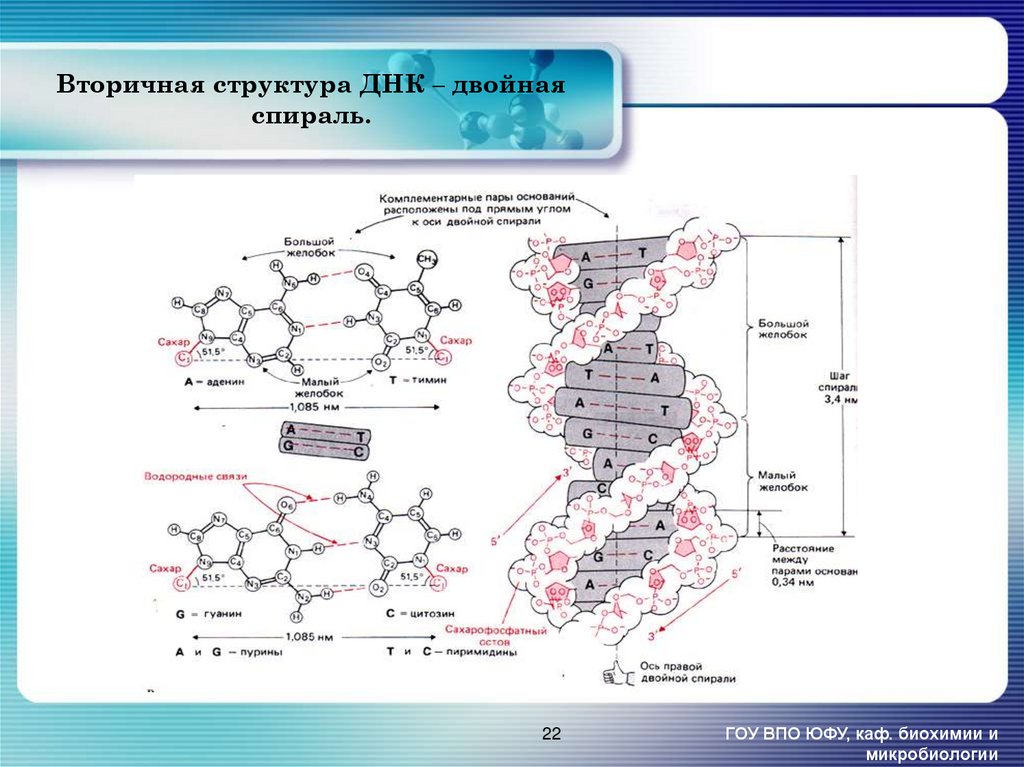
22. Вторичная структура ДНК – двойная спираль.
22ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
23. Спиральная структура молекулы ДНК [2].
Молекула ДНК обычно находится вформе двойной спирали, образуемой
двумя полинуклеотидными цепями,
обвивающимися одна вокруг другой.
Два дезоксирибозофосфатных остова,
расположенные по периферии
молекулы, имеют антипараллельную
ориентацию. Пуриновые и
пиримидиновые основания уложены
в стопки с интервалом 0,34 нм и
направлены внутрь спирали,
плоскости колец перпендикулярны
оптической оси спирали. [3]
23
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
24. Полиморфизм двойной спирали ДНК [1, 7].
А, В, С, D – формы молекулы ДНКА, В, Z – формы молекулы ДНК
24
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
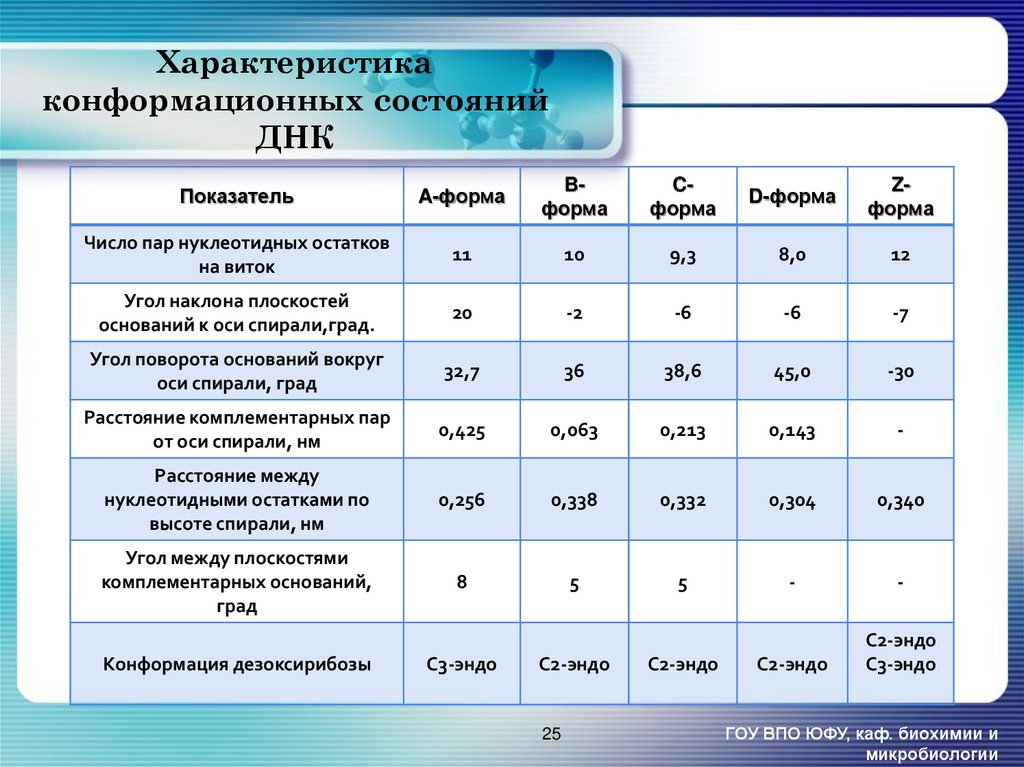
25. Характеристика конформационных состояний ДНК
ПоказательA-форма
Bформа
Cформа
D-форма
Zформа
Число пар нуклеотидных остатков
на виток
11
10
9,3
8,0
12
Угол наклона плоскостей
оснований к оси спирали,град.
20
-2
-6
-6
-7
Угол поворота оснований вокруг
оси спирали, град
32,7
36
38,6
45,0
-30
Расстояние комплементарных пар
от оси спирали, нм
0,425
0,063
0,213
0,143
-
Расстояние между
нуклеотидными остатками по
высоте спирали, нм
0,256
0,338
0,332
0,304
0,340
Угол между плоскостями
комплементарных оснований,
град
8
5
5
-
-
С2-эндо
С2-эндо
С3-эндо
Конформация дезоксирибозы
С3-эндо
С2-эндо
25
С2-эндо
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
26. Упаковка ДНК. Гистоны и нуклеосомы [7, 10].
26ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
27. Характеристика гистонов, входящих в состав гистонового октамера
ГистонХарактеристика
Н1
Слабо связаны с хроматином, легко
вымываются в солевом растворе. Связывается с
нуклеосомным кором на участке входа и
выхода ДНК, «склеивая» 2 оборота.
Сильноосновный.
Н2а
Умеренно богаты лизином.
Н2б
Умеренно богаты лизином.
Н3
Богаты аргинином.
Н4
Богаты аргинином.
27
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
28. Уровни компактизации молекулы ДНК [4].
Свободная ДНК скручивается вокруг гистонового октамера, образуянуклеосому, которая после связывания с гистоном Н1 образует
нуклеофиламент. Дальнейшая компактизация нуклеофиламентов
приводит к образованию соленоидной структуры, которая в дальнейшем
скручивается в спираль. Спираль образует суперскрученные петли,
которые непосредственно присоединяются к остову в центре хромосомы.
28
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
29. Разнообразие форм ДНК [2].
Линейная двухцепочечная ДНККольцевая двухцепочечная ДНК
29
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
30. ДНК кинетопласта из Leishmania tarentolae [2].
Электроннаямикрофотография ДНК
кинетопласта. Цепи
ДНК расправлены с
помощью формамидной
методики. Мини-кольца
и некоторые
удлинённые
компоненты
объединены в крупные
ассоциации; каждая из
них содержит около
10000 мини-колец. Мол.
Вес ДНК равен 1010.
30
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
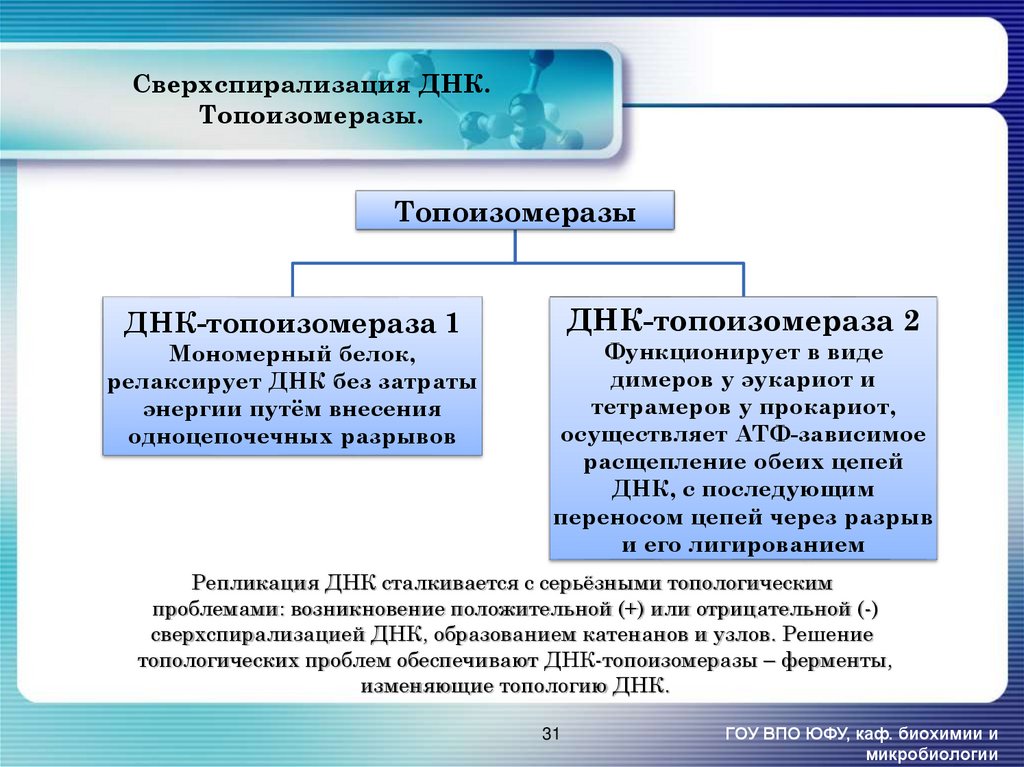
31. Сверхспирализация ДНК. Топоизомеразы.
ТопоизомеразыДНК-топоизомераза 1
Мономерный белок,
релаксирует ДНК без затраты
энергии путём внесения
одноцепочечных разрывов
ДНК-топоизомераза 2
Функционирует в виде
димеров у эукариот и
тетрамеров у прокариот,
осуществляет АТФ-зависимое
расщепление обеих цепей
ДНК, с последующим
переносом цепей через разрыв
и его лигированием
Репликация ДНК сталкивается с серьёзными топологическим
проблемами: возникновение положительной (+) или отрицательной (-)
сверхспирализацией ДНК, образованием катенанов и узлов. Решение
топологических проблем обеспечивают ДНК-топоизомеразы – ферменты,
изменяющие топологию ДНК.
31
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
32. Реакции, катализируемые топоизомеразами типа 1 [2].
32ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
33. Реакции, катализируемые топоизомеразами типа 2
Топоизомеразы типа 2катализируют
размыкание двух
кольцевых дуплексов.
[ B. Alberts et al., Molecular
Biology of the Cell (New York:
Garland, 1983), p.229]
33
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
34. Работа ДНК-гиразы
В бактериях обнаружена ДНКгираза. Показано образованиеотрицательных скерхвитков (-)
в релаксированном кольцевом
дуплексе ДНК.
[ A . Morrison, N. R. Cozzarelli,
Proc. Nati. Acad. Sci. USA, 78
(1981), 1416-1420.]
34
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
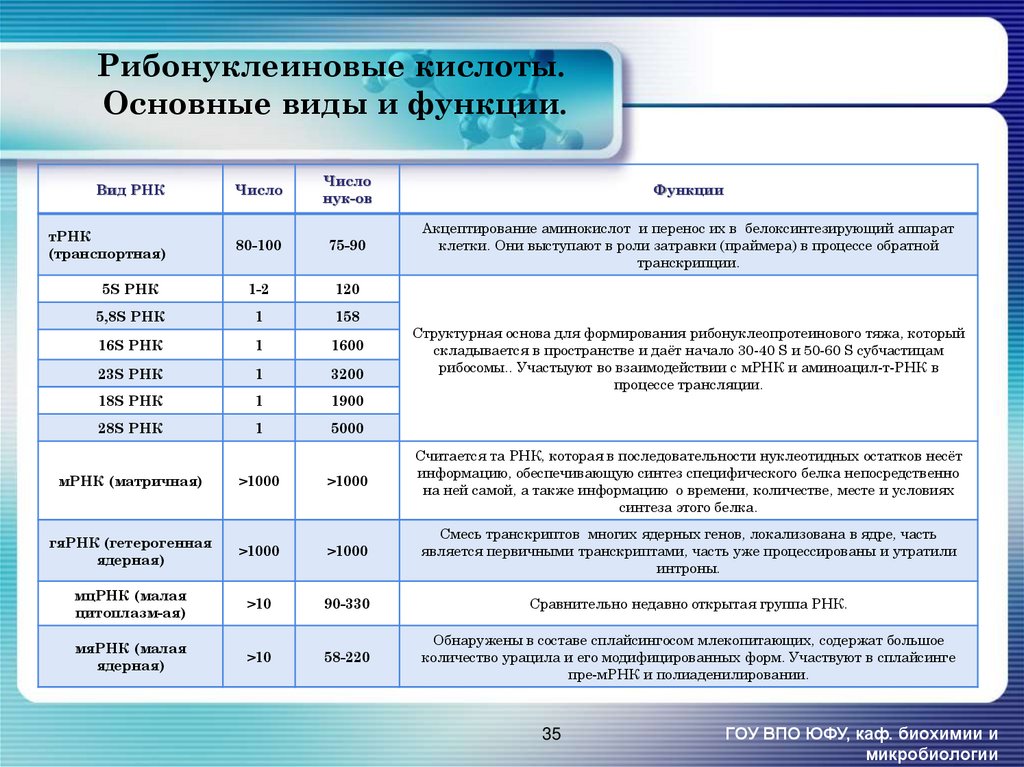
35. Рибонуклеиновые кислоты. Основные виды и функции.
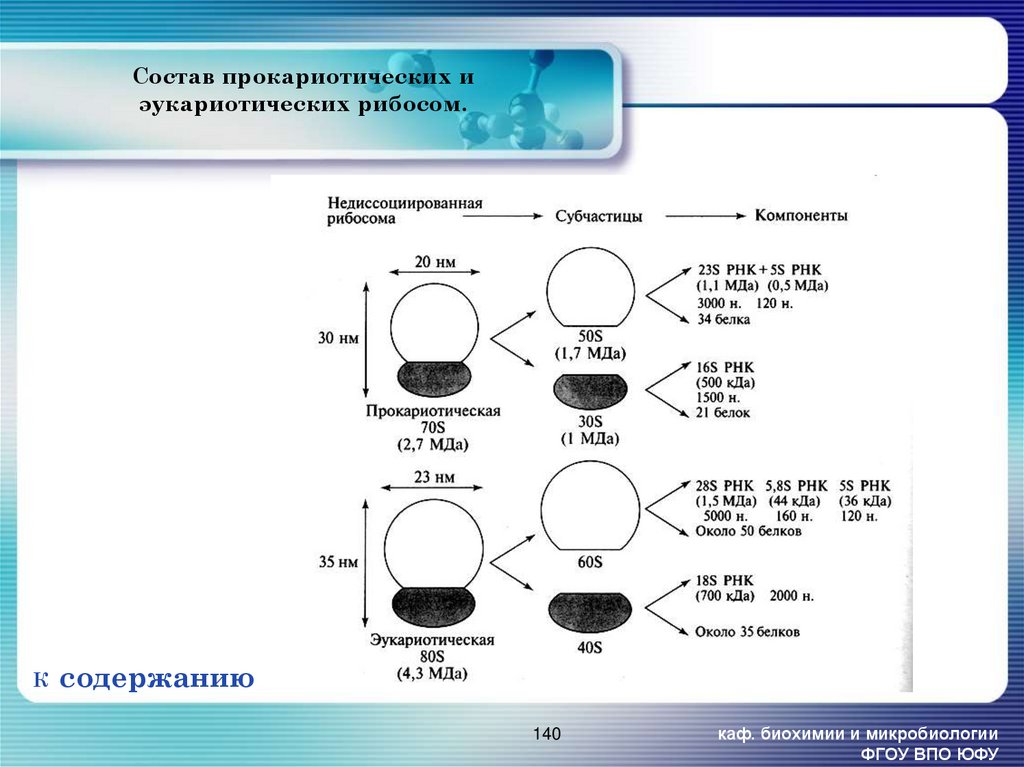
Вид РНКЧисло
Число
нук-ов
Функции
тРНК
(транспортная)
80-100
75-90
Акцептирование аминокислот и перенос их в белоксинтезирующий аппарат
клетки. Они выступают в роли затравки (праймера) в процессе обратной
транскрипции.
5S РНК
1-2
120
5,8S РНК
1
158
16S РНК
1
1600
23S РНК
1
3200
18S РНК
1
1900
28S РНК
1
5000
Структурная основа для формирования рибонуклеопротеинового тяжа, который
складывается в пространстве и даёт начало 30-40 S и 50-60 S субчастицам
рибосомы.. Участыуют во взаимодействии с мРНК и аминоацил-т-РНК в
процессе трансляции.
мРНК (матричная)
>1000
>1000
Считается та РНК, которая в последовательности нуклеотидных остатков несёт
информацию, обеспечивающую синтез специфического белка непосредственно
на ней самой, а также информацию о времени, количестве, месте и условиях
синтеза этого белка.
гяРНК (гетерогенная
ядерная)
>1000
>1000
Смесь транскриптов многих ядерных генов, локализована в ядре, часть
является первичными транскриптами, часть уже процессированы и утратили
интроны.
мцРНК (малая
цитоплазм-ая)
>10
90-330
Сравнительно недавно открытая группа РНК.
мяРНК (малая
ядерная)
>10
58-220
Обнаружены в составе сплайсингосом млекопитающих, содержат большое
количество урацила и его модифицированных форм. Участвуют в сплайсинге
пре-мРНК и полиаденилировании.
35
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
36. Сравнительная структура ДНК и РНК [5].
36ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
37. Вторичная и третичная структура однотяжевых РНК [2].
Макромолекулыбольшинства природных
РНК построены из одной
полирибонуклеотидной
цепи. Основной элемент их
вторичной структуры –
сравнительно короткие
двойные спирали,
образованные
комплементарными
участками одной и той же
цепи и перемежающиеся её
однотяжевыми сегментами.
Структурная схема одиночной
цепи РНК
37
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
38. Типы «третичных» внутримолекулярных взаимодействий. между отдельными элементами вторичной структуры молекулы РНК [1].
1. Образование дополнительных «не-уотсон –криковских» пар основаниймежду нулеотидными остатками удалённых друг от друга однотяжевых
участков и триплетов оснований между нулеотидными остатками
однотяжевых и двутяжевых элементов (Рис 1 (А, Б), Рис 2).
2. Образование «третичных» стэкинг-взаимодействий после
интеркаляции оснований одного участка между двумя соседними
основаниями другого однотяжевого участка (Рис 3).Образование
дополнительных водородных связей между 2Он-группами остатков
рибозы и основаниями, а также другими группами пентозофосфатного
остова.
Рис. 1.
Рис. 2
38
Рис. 3
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
39. Структура тРНК [12].
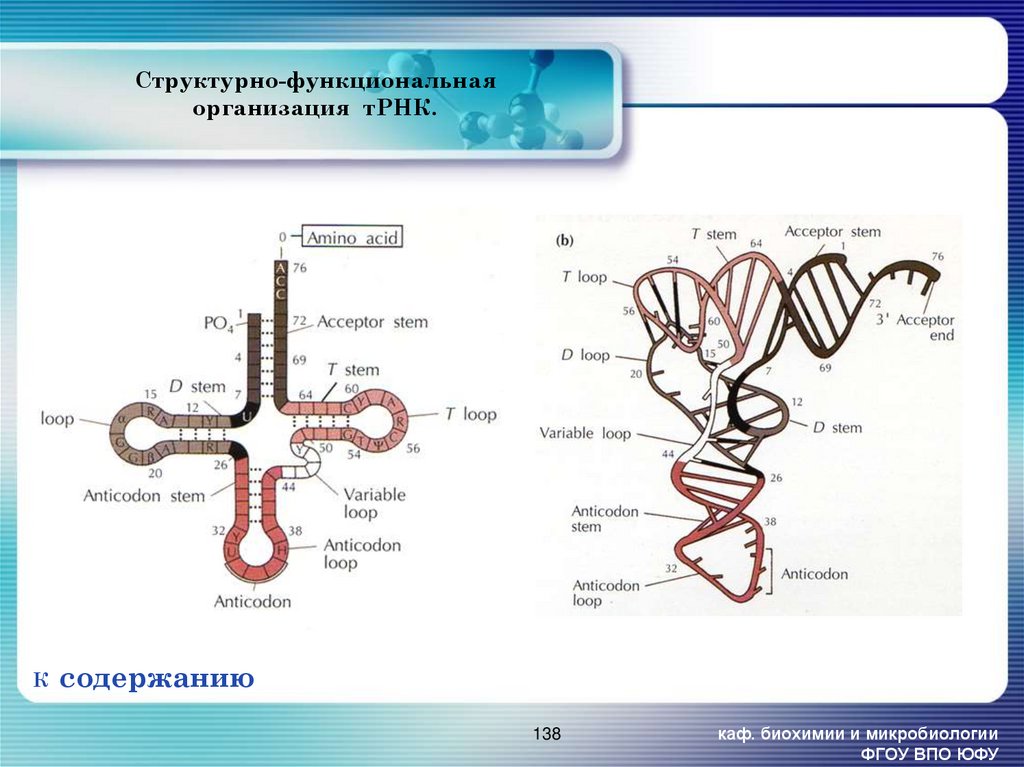
Последовательность тРНК включает 70-90 нуклеотидов и около 10% минорныхкомпонентов. Она образует вторичную структуру под названием «клеверного листа».
Эта структура состоит из 4-5 двуцепочечных спиральных стеблей и трёх петель.
Различают акцепторный, антикодоновый, дигидроуридиновый (D),
псевдоуридиловый (ТψС) и добавочный стебли.
39
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
40. Лекция 3.
Мозаичная организация генома эукариот ивирусных систем.
Сплайсинг и его основные типы.
К
содержанию
40
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
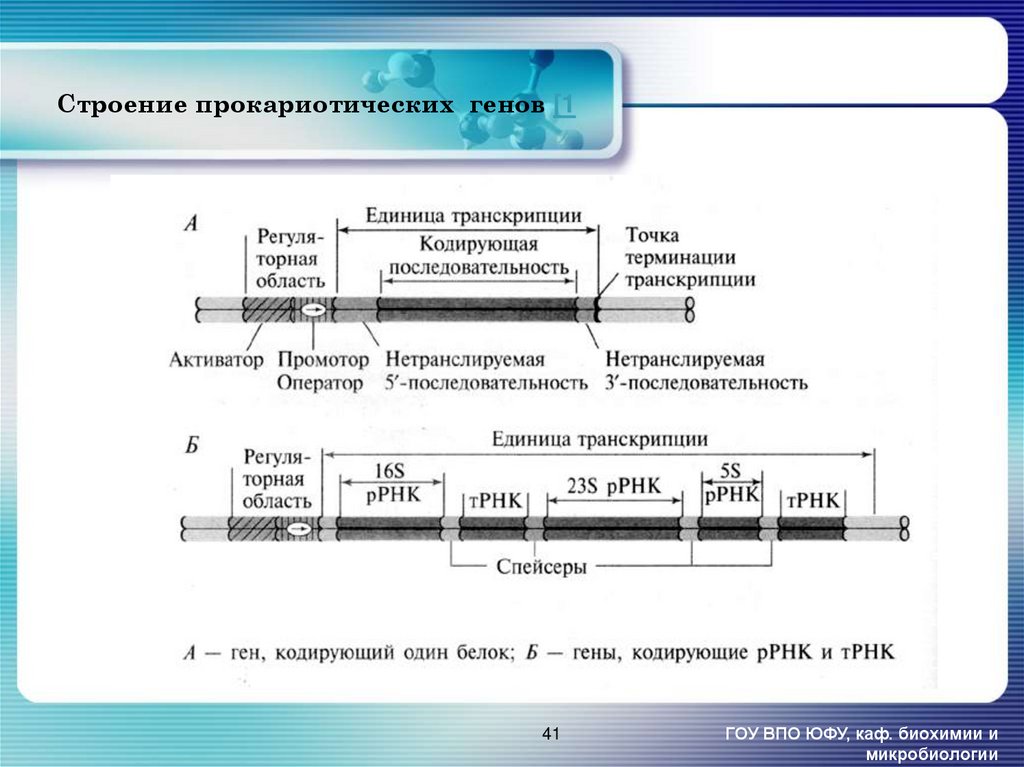
41. Строение прокариотических генов [1
41ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
42. Оперонная организация генов прокариот [1].
42ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
43. Гетеродуплексы ДНК - мРНК
Показаны петли,образующиеся в ходе
гибридизации из-за
присутствия интронов в
ДНК.
43
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
44. Организация прерывистого гена
Организация прерывистогогена ДНК, содержащую ген
овальбумина, гибридизовали с
овальбуминовой мРНК.
Восемь экзонов этого гена
гибридизовались с
комплементарными
участками РНК, а 7 интронов
образовывали петли,
выступающие из гибридного
дуплекса.
44
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
45. Структура β – глобинового гена и созревание его транскрипта
45ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
46. Строение эукариотического гена, кодирующего белок [1].
46ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
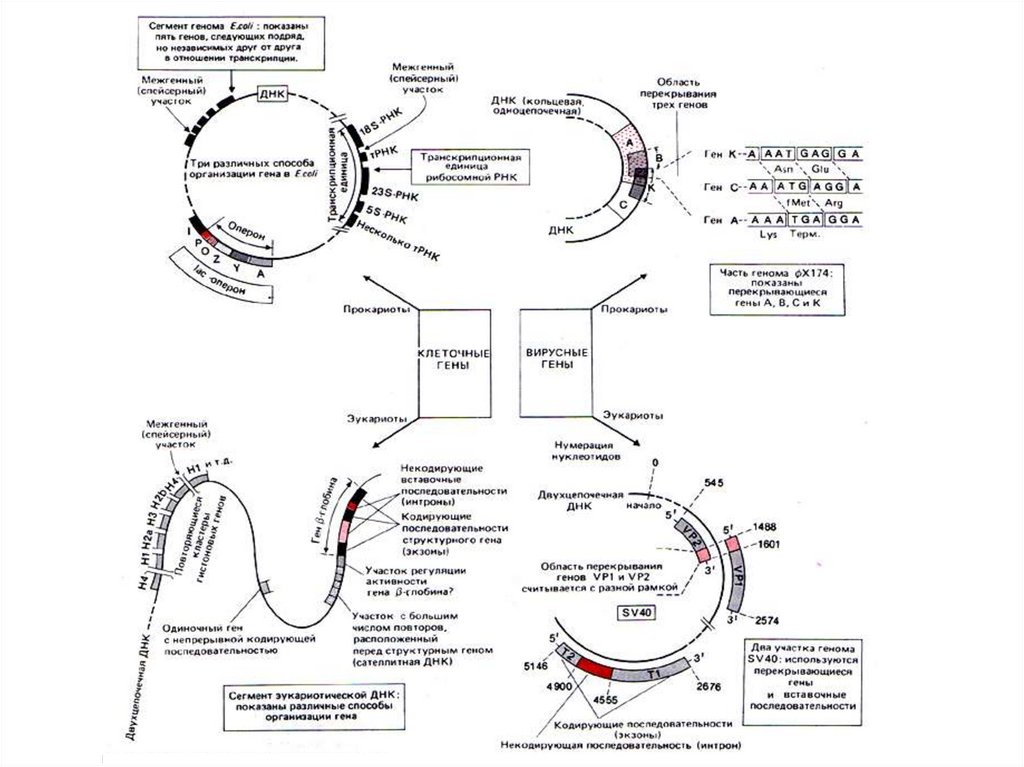
47. Организация генетического материала различных форм живой материи
47ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
48. Передача генетического материала в клетке
Процесс передачи генетическойинформации определяется так
называемой центральной догмой
биологии. Согласно современным
представлениям, путь от ДНК к
белку является весьма сложным и
распадается на ряд этапов.
48
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
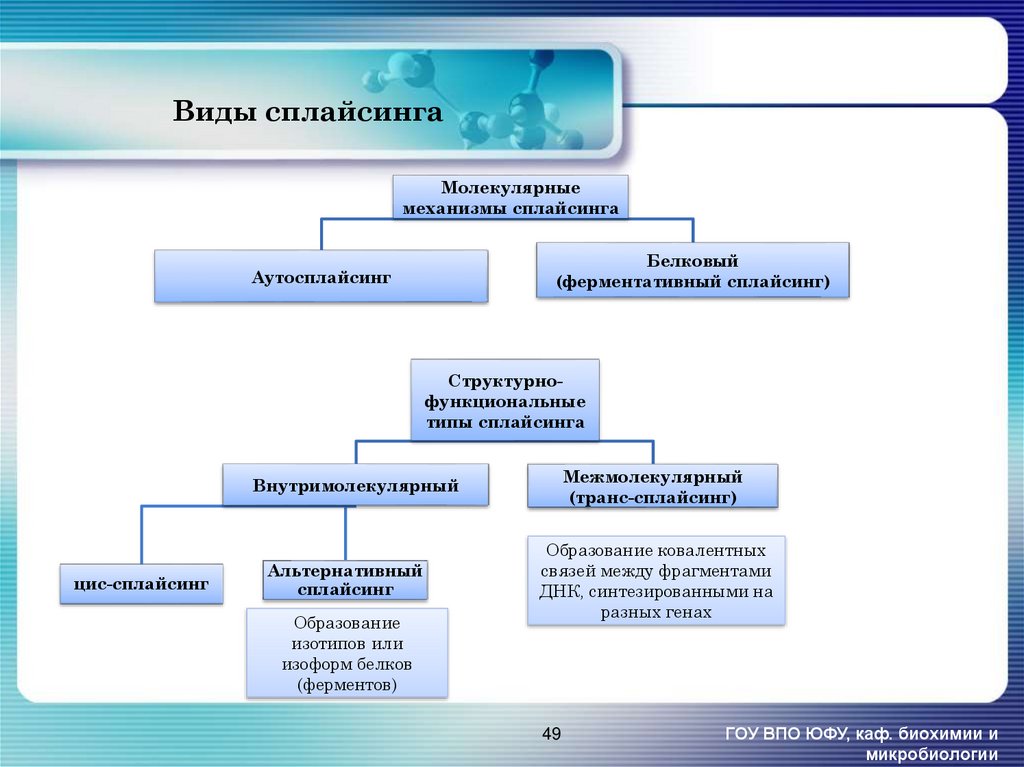
49. Виды сплайсинга
Молекулярныемеханизмы сплайсинга
Белковый
(ферментативный сплайсинг)
Аутосплайсинг
Структурнофункциональные
типы сплайсинга
Межмолекулярный
(транс-сплайсинг)
Внутримолекулярный
цис-сплайсинг
Альтернативный
сплайсинг
Образование
изотипов или
изоформ белков
(ферментов)
Образование ковалентных
связей между фрагментами
ДНК, синтезированными на
разных генах
49
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
50. Аутосплайсинг 26 S рРНК у тетрахимены в процессе образования рибозима [1].
Структура предшественникарРНК. В последовательности 26S
рРНК имеется вставка (интрон).
1. Гуанозин атакует 5`- конец интрона,
в результате чего происходит
разрыв межнуклеотидной связи и
высвобождение 5`- конца интрона;
2. Гидроксильная группа 3`-конца
экхона 1 атакует фосфодиэфирную
связь на 3`- конце интрона.
3. Замыкание фосфодиэфирной связи
между ОН-группой 3`-конца экзона
1 и 5`- фосфатной группой экзона 2
4. В результате двухэтапного
аутокаталитического расщепления
19 нуклеотидов из состава интрона
образуется рибозим, обладающий
каталитическими свойствами.
50
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
51. Сплайсинг предшественника мРНК с участием мяРНК через образование сплайсингосом [1].
51ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
52. Механизмы ферментативного сплайсинга ядерных генов животных.
52ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
53. Альтернативный сплайсинг при экспрессии гена кальцитонина крысы.
53ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
54. Типы альтернативного сплайсинга пре-мРНК [1].
54ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
55. Процессинг тРНК.
Процессинг тРНК измолекулыпредшественника
тРНК (Tyr) E. coli.
Удаление интрона из
предшественника.
55
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
56. Процессинг рРНК у прокариот.
Б. Спейсерныепоследовательности,
расположенные в
предшественнике
рРНК, образуют
черешки (стебли),
которые
расщепляются РНКазой 3.
В. РНК-аза М5
отщепляет от
первичного
транскрипта 5S РНК.
56
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
57. Лекция 4.
Нестабильность генома.Мобильные генетические элементы
про- и эукариот.
К
содержанию
57
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
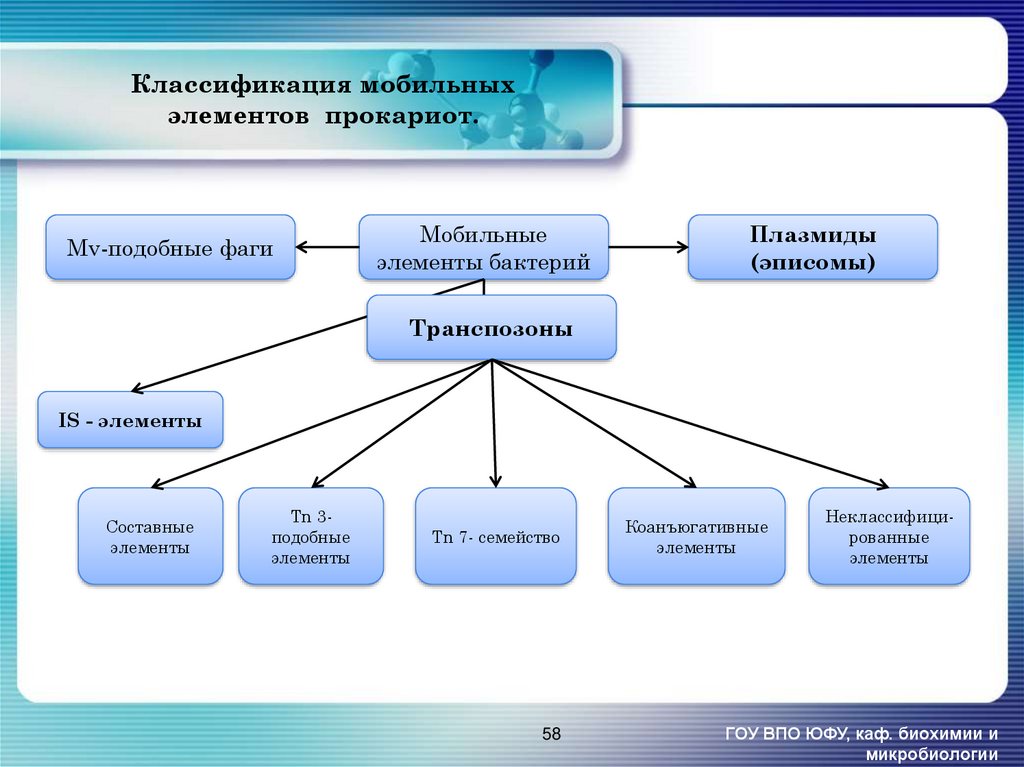
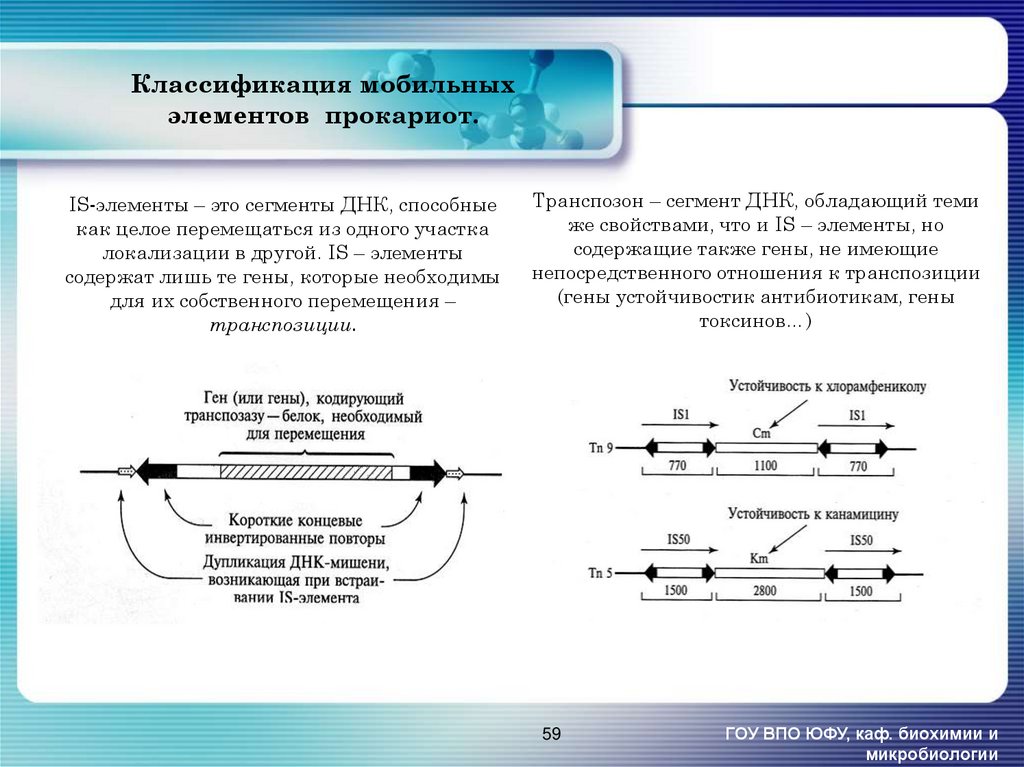
58. Классификация мобильных элементов прокариот.
Mv-подобные фагиМобильные
элементы бактерий
Плазмиды
(эписомы)
Транспозоны
IS - элементы
Составные
элементы
Tn 3подобные
элементы
Tn 7- семейство
58
Коанъюгативные
элементы
Неклассифицированные
элементы
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
59. Классификация мобильных элементов прокариот.
IS-элементы – это сегменты ДНК, способныекак целое перемещаться из одного участка
локализации в другой. IS – элементы
содержат лишь те гены, которые необходимы
для их собственного перемещения –
транспозиции.
Транспозон – сегмент ДНК, обладающий теми
же свойствами, что и IS – элементы, но
содержащие также гены, не имеющие
непосредственного отношения к транспозиции
(гены устойчивостик антибиотикам, гены
токсинов…)
59
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
60. Типичные IS-элементы E. coli [1]
ISIS1
Cуммарная
длина,
н.п.
768
Длина концевых
инвертированных
повторов, н.п.
Длина
дуплицированной
мишени, н.п.
Обычное местонахождение
9
Хромосома E. coli, 19 копий;
плазмида R6, две копии;
Shigella dysenteria, >40
копий.
23
IS2
1327
41
5
Хромосома E. Coli,
0-12 копий; R6, одна копия; Fплазмида, одна копия.
IS4
1426
18
11
Хромосома E. Coli,
1-2 копии
IS10
1329
23
9
R-плазмиды
60
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
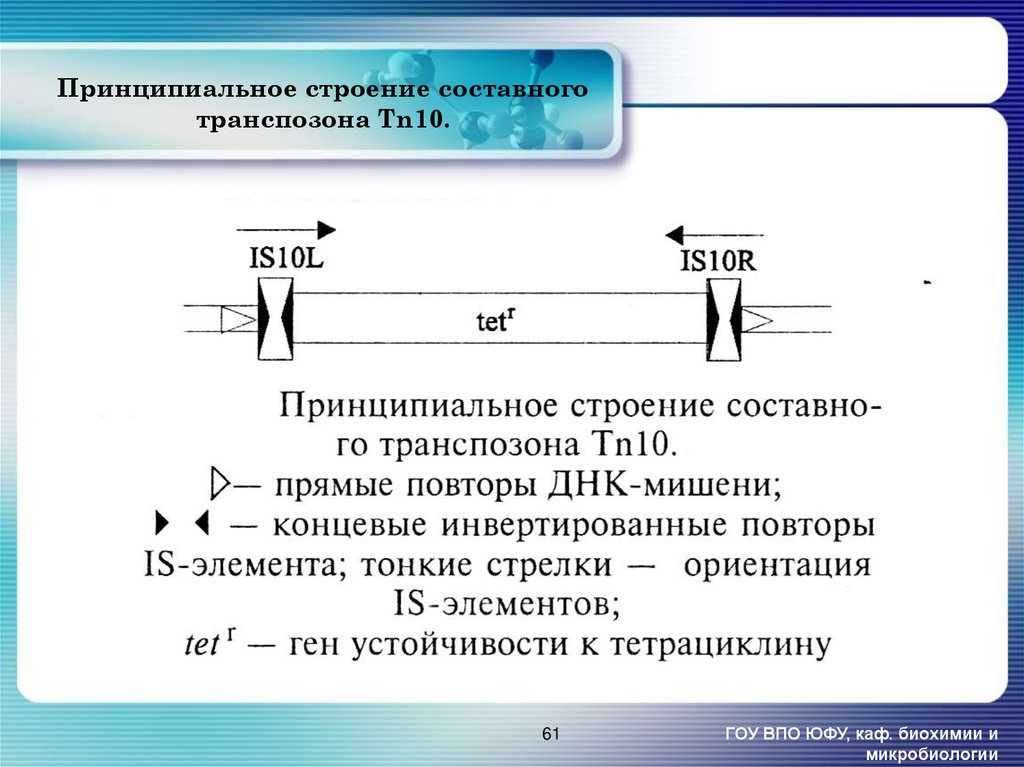
61. Принципиальное строение составного транспозона Tn10.
61ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
62. R-плазмида со всеми инсерционными последовательностями (IS) и транспозонами (Tn) [2]
62ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
63.
Механизмы перемещениямобильных элементов бактерий [1]
64.
Механизм транспозиции Tn65. Дупликация сайта-мишени после встраивания мобильного элемента [2].
Расщепление обеихцепей эндонуклеазой.
Места расщеплений
отстоят друг от друга
на несколько пар
оснований, в
результате чего
образуются
ступенчатые разрывы.
Образовавшиеся
бреши застраиваются,
в результате чего
появляются две копии
сайта-мишени – по
одной с каждой
стороны вставки.
66.
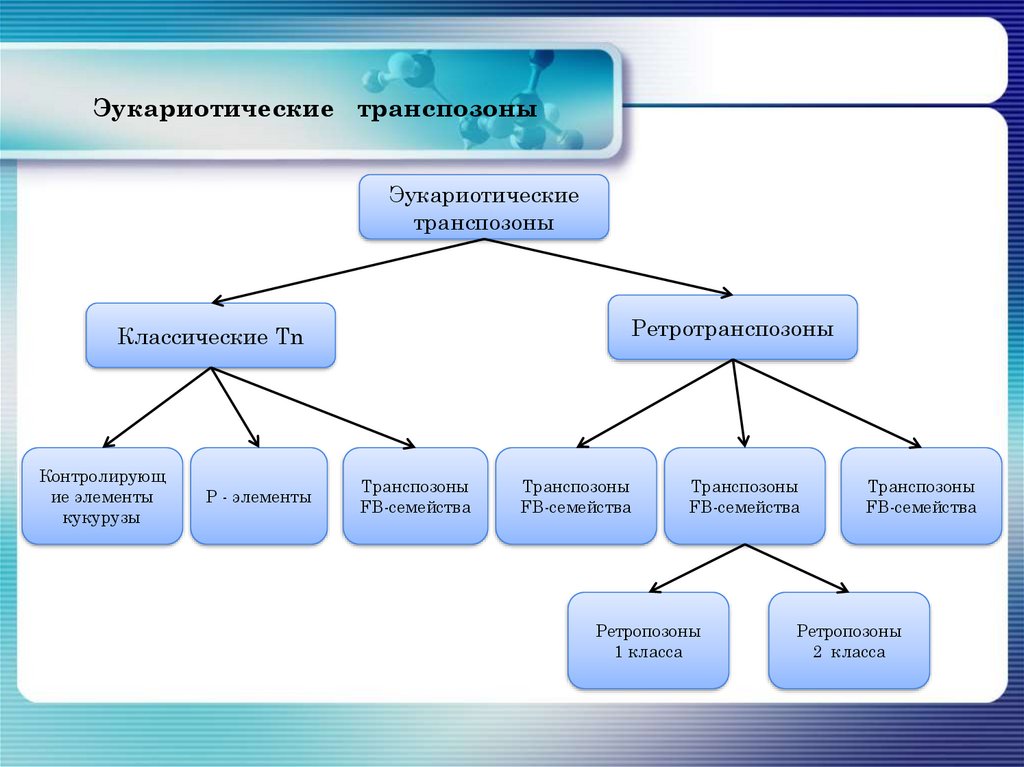
Эукариотические транспозоныЭукариотические
транспозоны
Ретротранспозоны
Классические Tn
Контролирующ
ие элементы
кукурузы
Р - элементы
Транспозоны
FB-семейства
Транспозоны
FB-семейства
Транспозоны
FB-семейства
Ретропозоны
1 класса
Транспозоны
FB-семейства
Ретропозоны
2 класса
67. Ретротранспозон класса 1 и его транскрипт [2]
68. Модель транспозиции ретрогенов при участии РНК-посредника [2]
В результате транскрипциии процессинга,
включающего сплайсинг
интронов,образуется
функциональная мРНК, на
которой с помощью
обратной транскриптазы
синтезируется одна цепь
кДНК; РНК-матрица затем
расщепляется РНК-зой Н.
Одноцепочечная ДНК затем
пришивается через 3гидроксильный конец к 5концу геномной ДНК и в
месте несимметричного
разреза с помощью ДНК-pol
синтезируется вторая цепь.
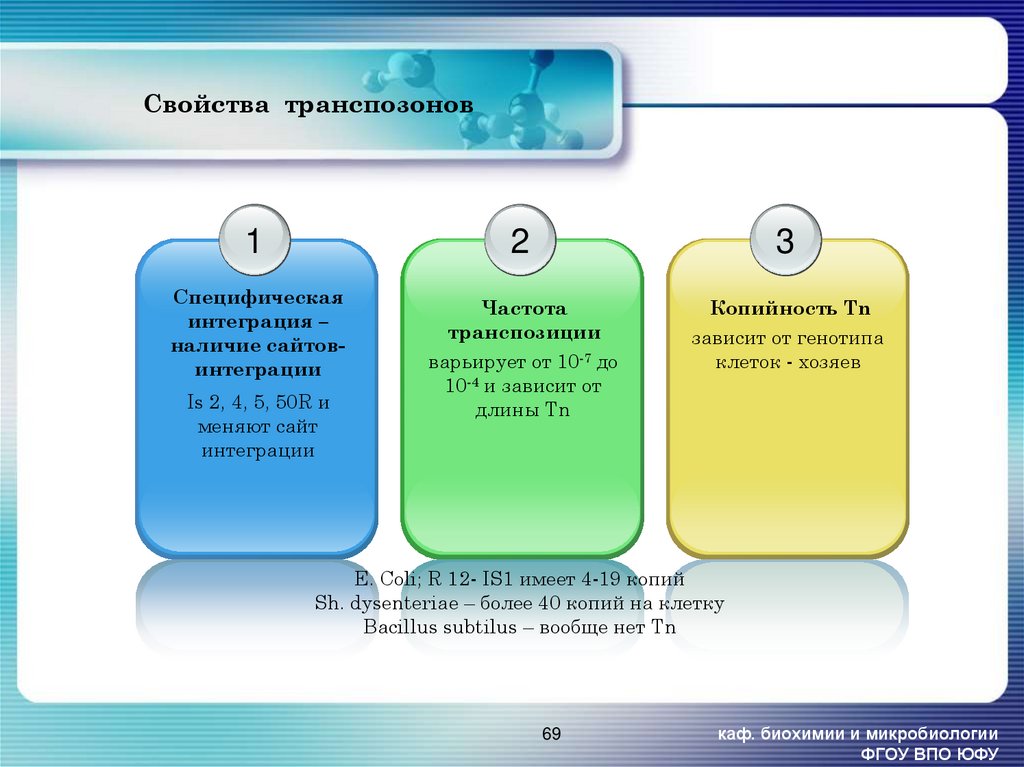
69. Свойства транспозонов
1Специфическая
интеграция –
наличие сайтовинтеграции
Is 2, 4, 5, 50R и
меняют сайт
интеграции
2
3
Частота
транспозиции
варьирует от 10-7 до
10-4 и зависит от
длины Tn
Копийность Tn
зависит от генотипа
клеток - хозяев
E. Coli; R 12- IS1 имеет 4-19 копий
Sh. dysenteriae – более 40 копий на клетку
Bacillus subtilus – вообще нет Tn
69
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
70. Биологическая роль транспозонов
№Биологическая роль
1
Геномные перестройки (внутри и межхромосомные)
2
Мутации
3
Перенос генов
4
Взаимоинтеграция мобильных элементов
5
Реакция на стресс
6
Значение в эволюции живых систем
71. Лекция 5.
Репликация ДНК.Особенности биосинтеза вирусных
нуклеиновых кислот.
К
содержанию
71
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
72. Предполагаемые модели репликации дуплексной ДНК [2].
консервативныйполуконсервативный дисперсионный
72
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
73. Экспериментальные подтверждения модели Уотсона-Крика в работах Мэтью Мезельсона и Франклина Сталя [12].
Разделение молекулДНК с различной
плотностью
посредством
центрифугирования в
градиенте плотности
хлористого цезия.
Схематически
изображены
последовательные
этапы эксперимента
Мезелсона и Сталя,
показавшего
полуконсервативный
механизм репликации
ДНК Е. coli.
73
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
74. Экспериментальные подтверждения модели Уотсона-Крика в работах Мэтью Мезельсона и Франклина Сталя [12].
А. Распределение плотностимолекул ДНК, наблюдавшееся
Мезелсоном и Сталем после
перенесения растущих клеток Е. coli
из тяжелой среды в легкую. Б.
Схематическая интерпретация
результатов, представленных на А.
ДНК, меченная 15N, и вновь
синтезируемая ДНК, имеющая 14N,
изображены разным цветом. В.
Нагревание ДНК промежуточной
плотности превращает ее в
одноцепочечную ДНК, содержащую
две фракции, плотность одной из
которых совпадает с плотностью
нагретой ДНК, меченной 15N, а
другой -меченной 14N.
74
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
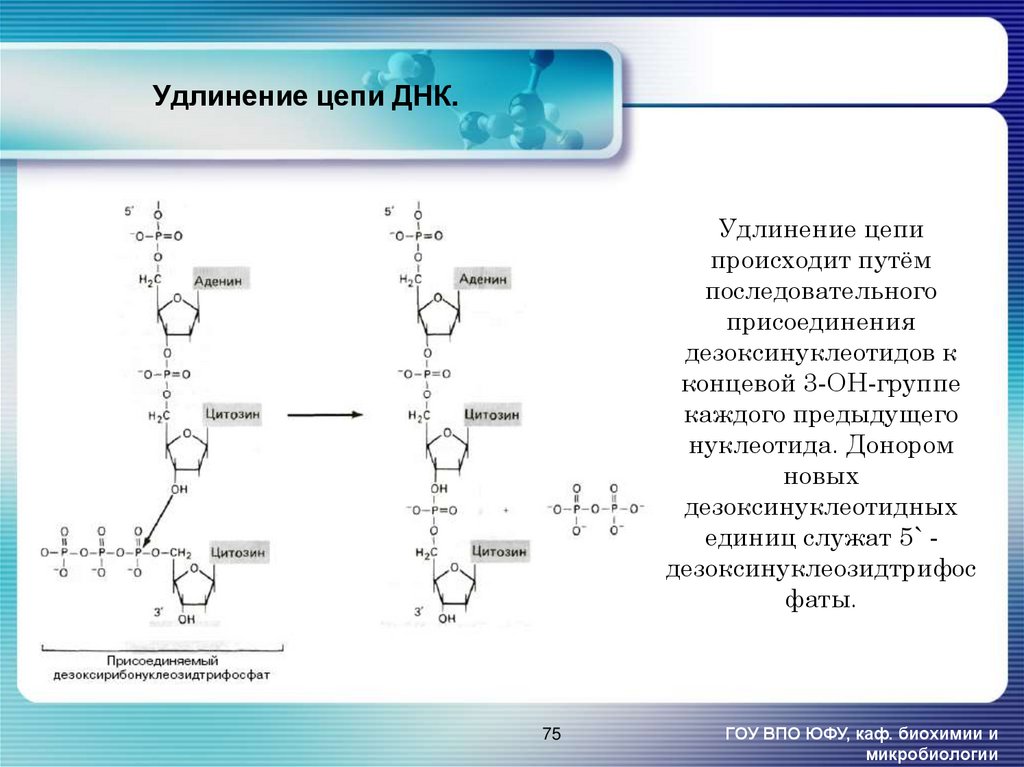
75. Удлинение цепи ДНК.
Удлинение цепипроисходит путём
последовательного
присоединения
дезоксинуклеотидов к
концевой 3-ОН-группе
каждого предыдущего
нуклеотида. Донором
новых
дезоксинуклеотидных
единиц служат 5` дезоксинуклеозидтрифос
фаты.
75
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
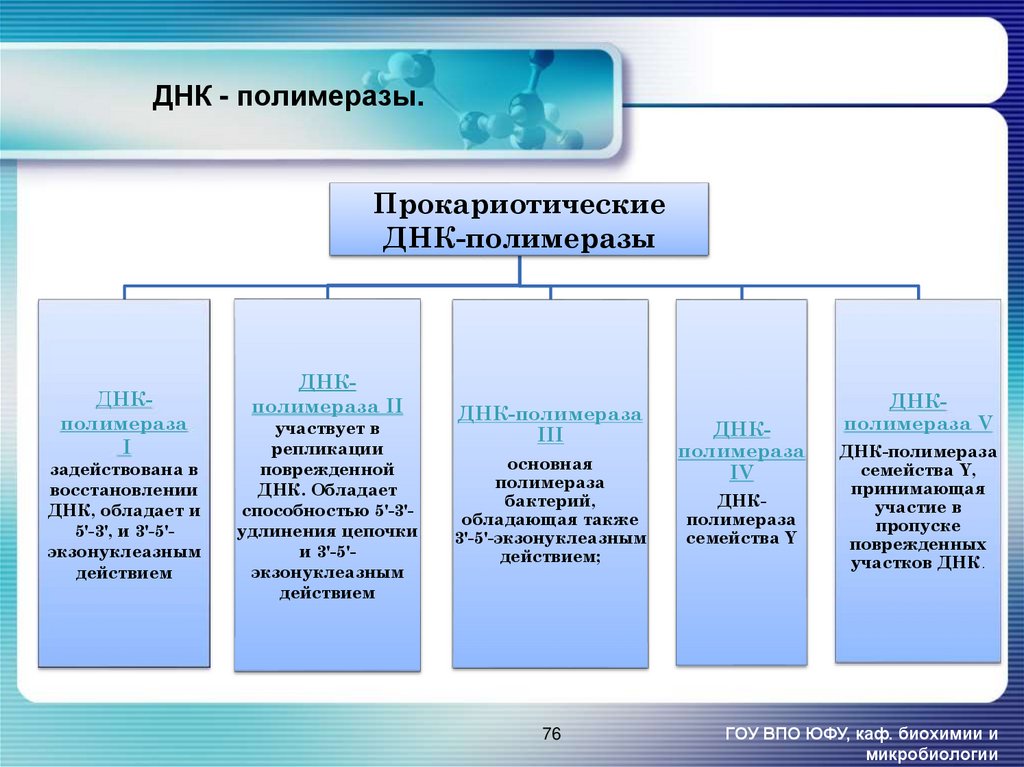
76. ДНК - полимеразы.
ПрокариотическиеДНК-полимеразы
ДНКполимераза
I
задействована в
восстановлении
ДНК, обладает и
5'-3', и 3'-5'экзонуклеазным
действием
ДНКполимераза II
участвует в
репликации
поврежденной
ДНК. Обладает
способностью 5'-3'удлинения цепочки
и 3'-5'экзонуклеазным
действием
ДНК-полимераза
III
основная
полимераза
бактерий,
обладающая также
3'-5'-экзонуклеазным
действием;
76
ДНКполимераза
IV
ДНКполимераза
семейства Y
ДНКполимераза V
ДНК-полимераза
семейства Y,
принимающая
участие в
пропуске
поврежденных
участков ДНК.
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
77. ДНК-полимеразы
ДНК-полимераза — фермент, участвующий врепликации ДНк. Ферменты этого класса
катализируют полимеризацию
дезоксирибонуклеопротеидов вдоль цепочки
нуклеотидов ДНК, которую фермент «читает» и
использует в качестве шаблона. Тип нового нуклеотида
определяется по принципу комплементарности с
шаблоном, с которого ведётся считывание. Собираемая
молекула комплементарна шаблонной моноспирали и
идентична второму компоненту двойной спирали.
Выделяют ДНК-зависимую ДНК-полимеразу (КФ
2.7.7.7.), использующую в качестве матрицы одну из
цепей ДНК, и РНК-зависимую ДНК-полимеразу (другое
название обратная транскриптаза, КФ 2.7.7.49),
способную также к считыванию информации с РНК.
77
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
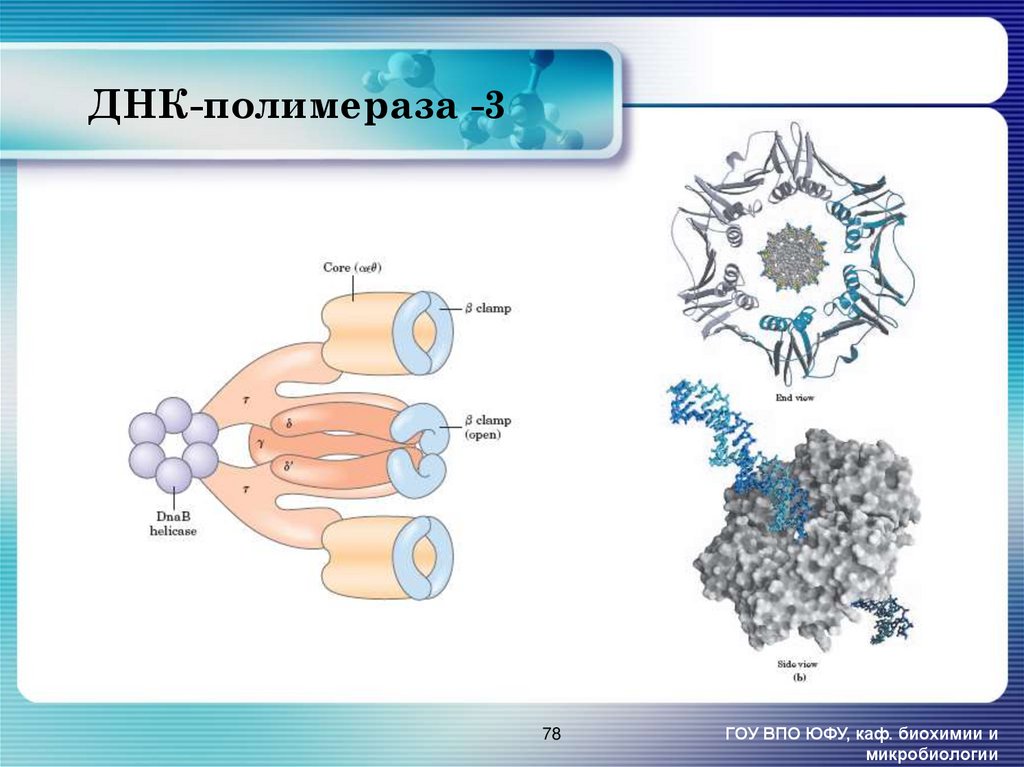
78. ДНК-полимераза -3
78ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
79. Белки, входящие в состав репликативного комплекса ].
БелкиЭнзиматическая
активность
Узнавание области начала репликации и привлечение к месту сборки остальных
белковых компонентов реплисомы
DNA A
DNA B
ДНК-хеликаза
DNA G
SSB
Праймаза
DNA-pol1
ДНК-полимераза
3~ --- 5~ экзонуклеаза
5~ --- 3~ экзонуклеаза
DNA-pol3
(αθε)корфермент
β-белок
ДНК-полимераза
τ-Белок
Лигаза
Раскручивание двойной спирали ДНК в репликативной вилке
Обеспечение взаимодействия хеликазы и праймазы с ДНК, находящейся в комплексе с
SSB-белком.
DNA C
γ-Комплекс
Биологические функции
ДНК-зависимая
АТФ-аза
Лигаза
Синтез РНК-затравок. Взаимодействие с одноцепочечной ДНК, активация ДНКполимеразы и стабилизация расплетённого комплекса.
Созревание реплицирующейся ДНК (застраивание брешей)
Коррекция ошибок
Удаление РНК-затравки (праймера)
Синтез лидирующей и отстающей цепей ДНК. Активация ДНК-полимеразы и ДНК
зависимой АТФ-зы, осуществление функции «скользящего зажима», оеспечивающего
процессивност репликации.
Связывание затравки с матрицей, активация ДНК-полимеразы
Сборка и димеризация холофермента ДНК-полимеразы
Лигирование фрагментов ДНК
Топоизомера
за 1
Топоизомераза
Релаксирование отрицательной суперспирализации.
(ДНКгираза)
Топоизомераза
Индуцирование образования отрицательных сверхвитков, разделение катенанов
79
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
80. Инициация репликации ДНК [2].
80ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
81. Полуконсервативный механизм репликации ДНК E. coli [9].
81ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
82. Репликация ДНК [ 7].
1.2.
3.
4.
5.
6.
7.
Отстающая цепь
Лидирующая цепь
ДНК-полимераза-1
ДНК-лигаза
РНК-праймер
ДНК-праймаза
Фрагмень Оказаки
8.
9.
10.
11.
ДНК-полимераза-3
Хеликаза
SSB- белки (Single Strand Binding proteins)
Топоизомераза
82
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
83. ДНК-лигаза. Механизм лигазной реакции [12].
83ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
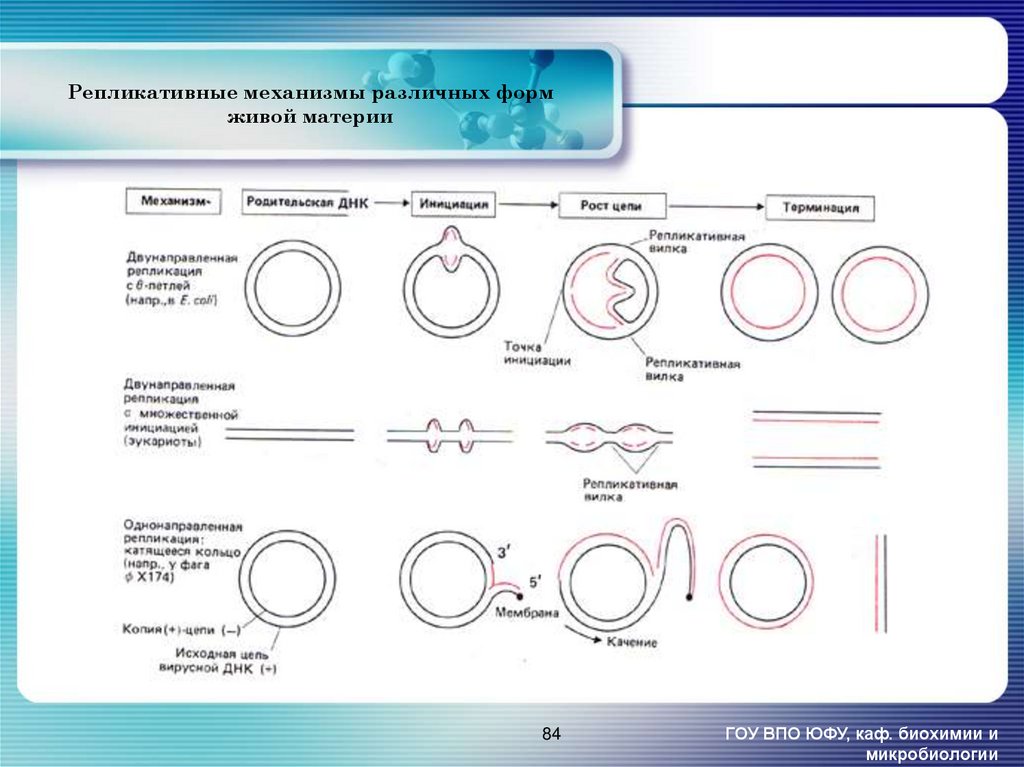
84. Репликативные механизмы различных форм живой материи
84ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
85. Репликация хромосомной ДНК эукариот [2].
Репликация идёт вдвух направлениях из
разных точек начала
репликации (ori) с
образованием
пузырьков.По мере
движения
репликативных вилок
пузырьки
увеличиваются в
размере и в концеконцов сливаются.
85
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
86. Начало репликации [2].
Репликацияинициируется
в
специфическо
м участае ДНК,
точке
начала
репликации
(ori).
Репликативная
вилка
перемещается
либо в
двух, либо в
одном
направлении.
86
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
87. Репликация по типу катящегося кольца [2].
87ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
88. Поочерёдная репликация цепей ДНК аденовируса [2].
88ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
89. Репликация теломерных участков эукариотических хромосом [1].
А- возникновение недореплицирования 5`-конца линейной хромосомы и синтез на этом концевом участкетеломерной ДНК с помощью теломеразы. Б- основные этапы синтеза теломерного повтора теломеразой.
89
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
90. Общий принцип полимеразной цепной реакции.
1.2.
3.
4.
Денатурация двойной спирали ДНК-матрицы
при t = 90-95 0С, образование одноцепочечной
молекулы.
Гибридизация (отжиг) одноцепочечной ДНКматрицы и праймеров при t = 40-60 0С в
процессе которой праймеры «распознают»
комплиментарные им участки ДНК-матрицы.
Полимеризация, т.е. отжиг дочерних ДНК,
при t = 65-72 0С при помощи Taq-ДНКполимеразы (фрагмент Клёнова, ДНКполимеразы 1 из Thermus aquaticus). Синтез
комплиментарной цепи на ДНК-матрице
начинается от места гибридизации праймера
в направлении 5` - 3`.
Повторная амплификация.
90
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
91. Сравнительная структура ДНК и РНК [5].
91ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
92. Лекция 6.
Репарация повреждений ДНК.К
содержанию
92
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
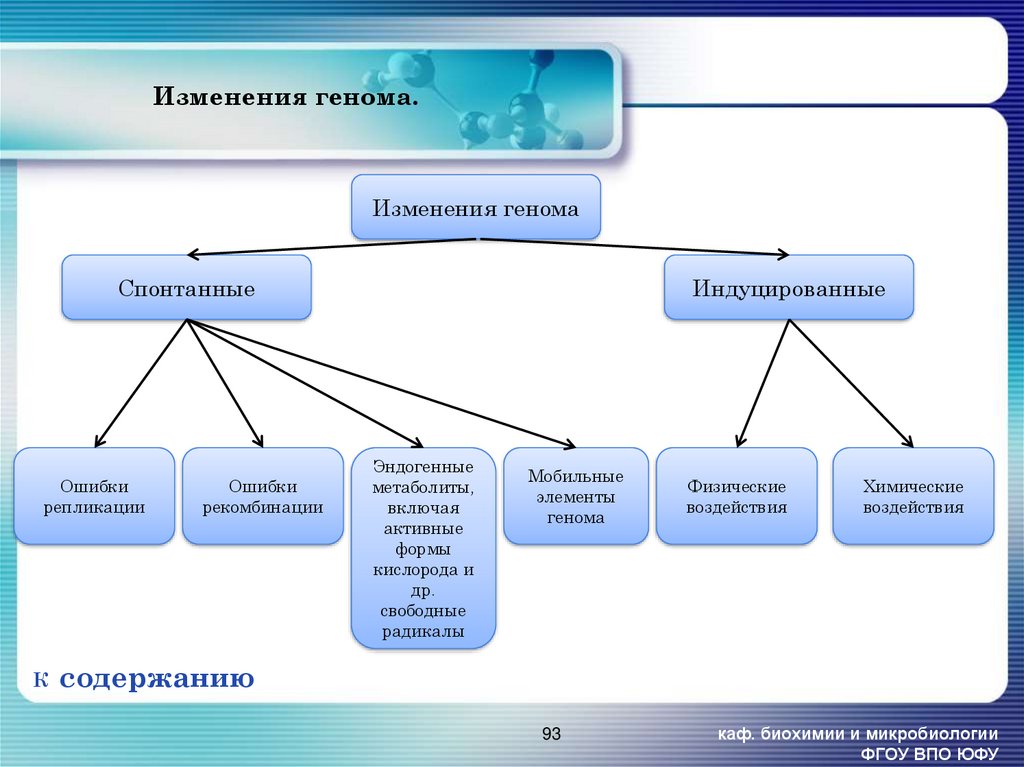
93. Изменения генома.
Изменения геномаСпонтанные
Ошибки
репликации
К
Ошибки
рекомбинации
Индуцированные
Эндогенные
метаболиты,
включая
активные
формы
кислорода и
др.
свободные
радикалы
Мобильные
элементы
генома
Физические
воздействия
Химические
воздействия
содержанию
93
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
94. Мутагенные агенты и типы повреждений молекулы ДНК [4].
1. Повреждение одиночных нуклеотидов2 Повреждение пары нуклеотидов
3. Разрыв цепи ДНК
4. Образование поперечных сшивок между основаниями одной цепи или разных цепей ДНК
94
ФГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
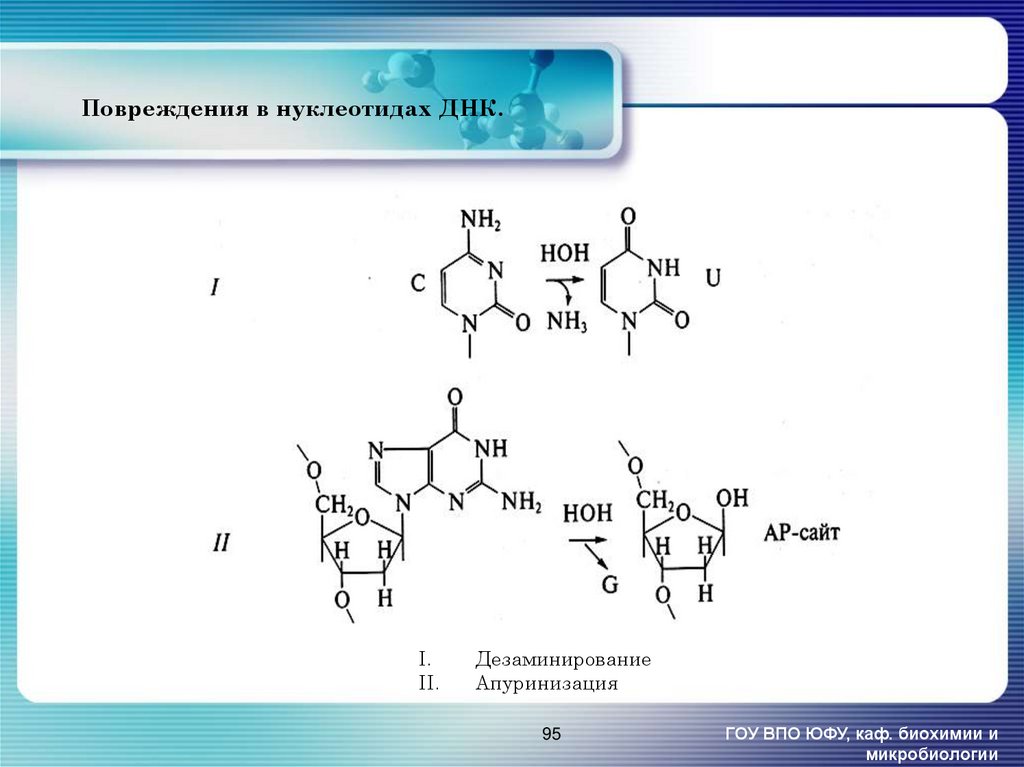
95. Повреждения в нуклеотидах ДНК.
I.II.
Дезаминирование
Апуринизация
95
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
96. Повреждения в нуклеотидах ДНК [1].
III.IV.
V.
VI.
Метилирование
Размыкание кольца
Окисление
Образование тиминовых димеров
96
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
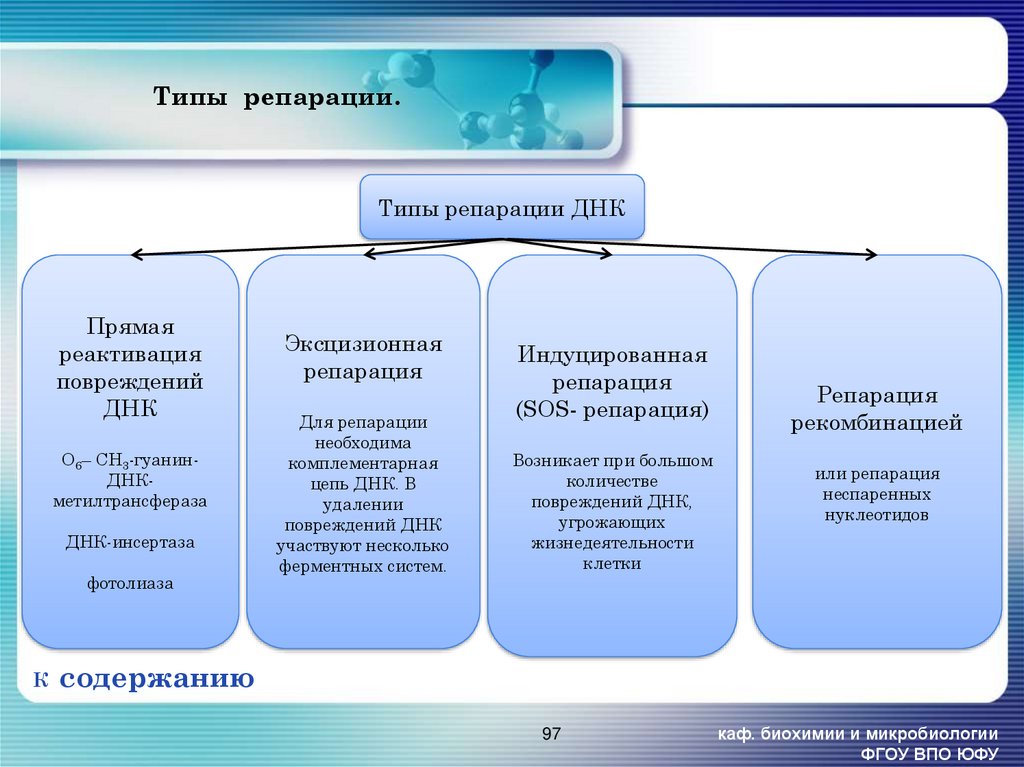
97. Типы репарации.
Типы репарации ДНКПрямая
реактивация
повреждений
ДНК
О6– СН3-гуанинДНКметилтрансфераза
ДНК-инсертаза
фотолиаза
К
Эксцизионная
репарация
Для репарации
необходима
комплементарная
цепь ДНК. В
удалении
повреждений ДНК
участвуют несколько
ферментных систем.
Индуцированная
репарация
(SOS- репарация)
Возникает при большом
количестве
повреждений ДНК,
угрожающих
жизнедеятельности
клетки
Репарация
рекомбинацией
или репарация
неспаренных
нуклеотидов
содержанию
97
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
98. Прямая репарация [1]
ДезалкилированиеО6-метилгуаниновых
остатков катализируется специфической
О6-метилгуанозиналкилтрансферазой
Фермент катализирует перенос
алкильных групп на
сульфгидрильные группы
цистеиновых остатков фермента,
при этом акцепторный белок
инактивируется.
98
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
99. Схема эксцизионной репарации [1].
1.2.
3.
99
ДНК-N-гликозилаза удаляет
повреждённое основание, АРэндонуклеаза вносит разрыв в
цепь ДНК.
Экзонуклеаза удаляет ряд
нуклеотидов
ДНК-полимераза заполняет
освободившийся участок
комплементарными
нуклеотидами, ДНК-лигаза
сшивает репарированную цепь
ДНК.
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
100. Схема нуклеотидной эксцизионной репарации у E. coli с участием эксинуклеазы [1].
Схема эксцизионнойрепарации [1].
Схема нуклеотидной
эксцизионной репарации у
E. coli с участием
эксинуклеазы [1].
100
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
101. Ферментативная репарация циклобутановых тиминовых димеров [2].
Ферментативный комплекс uvrABC E. Coli инициирует репарацию, гидролизуя цкпьна расстоянии восьми фосфодиэфирных связей от димера с 5` - стороны и четырёхпяти связнй с 3`- стороны.
101
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
102. Репарация с помощью N- гликозилаз. [2]
102ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
103. Делеции и амплификации, возникающие при репликации или репарации [1].
103ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
104. Некоторые гены SOS-системы и результат их индукции.
Индуцируемый генФизиологическое действие
uvr A, B, C, D
Репарация повреждений, нарушающих вторичную
структуру ДНК, реактивация Уэйгла
Rec A
Пострепликативная репарация, репарация
двухцепочечных разрывов, мутагенез, индукция SOS системы
Rec N
Репарация двухцепочечных разрывов
ruv
То же
ssb
Участвует в репарации и рекомбинации
umu DC
Мутагенез, реактивация Уэйгла
sul A
Подавление клеточного деления
lex A
К
Выключение SOS- ответа
содержанию
104
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
105. Лекция 7.
Генетическая рекомбинация.К
содержанию
105
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
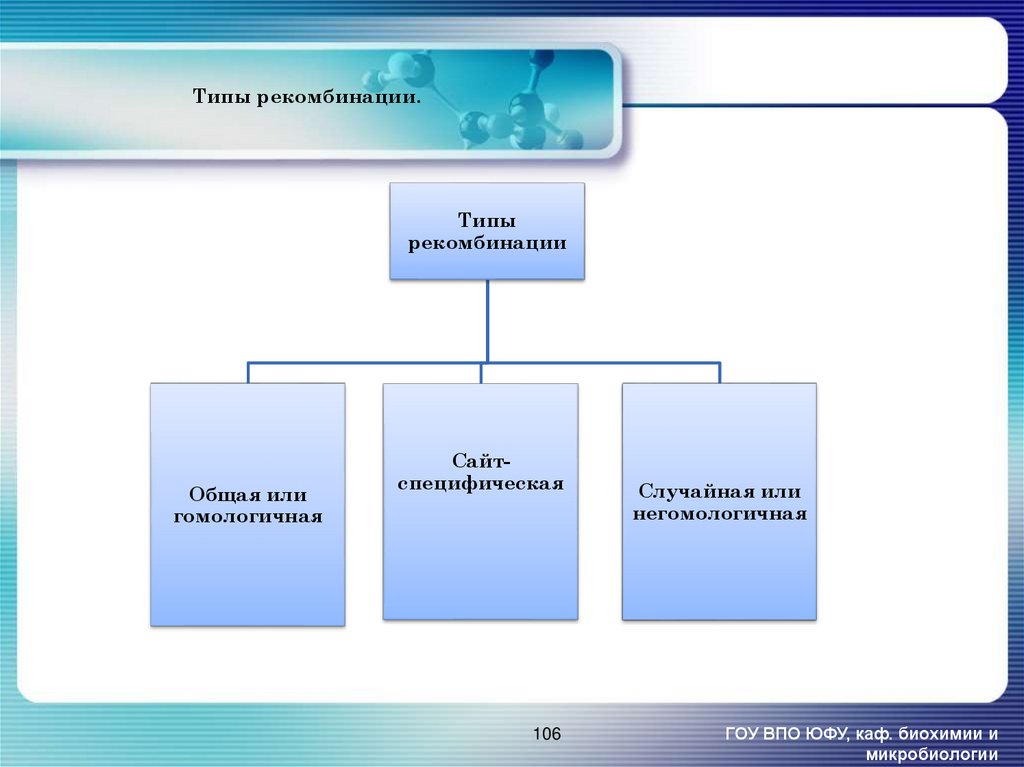
106. Типы рекомбинации.
Типырекомбинации
Общая или
гомологичная
Сайтспецифическая
106
Случайная или
негомологичная
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
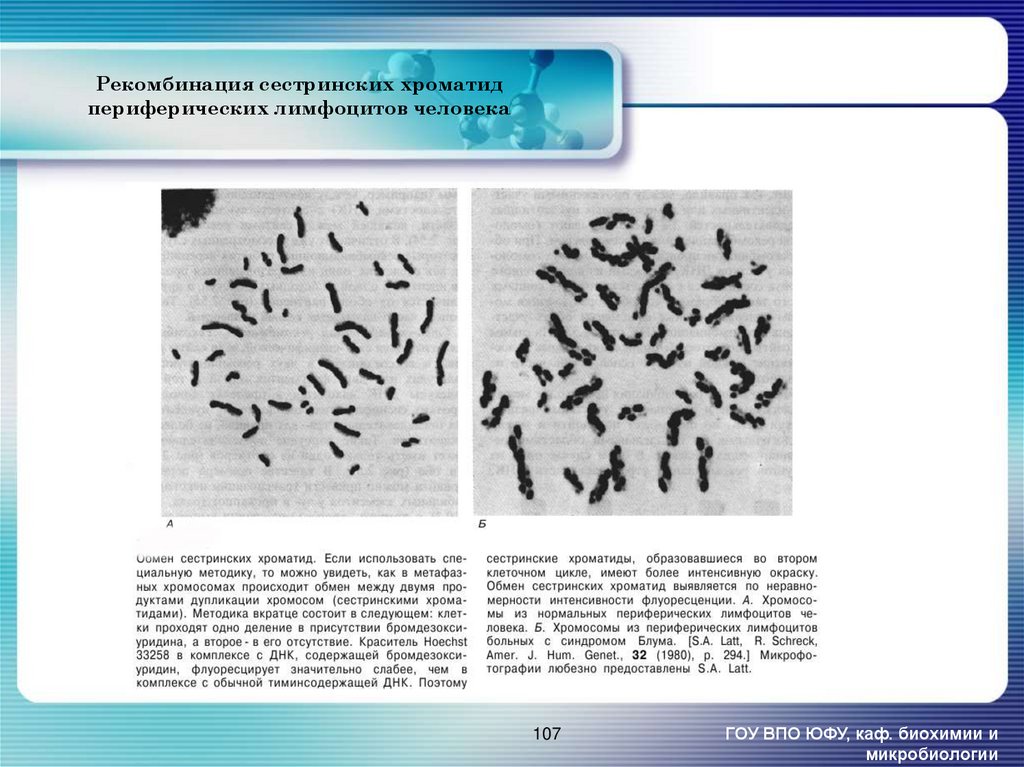
107. Рекомбинация сестринских хроматид периферических лимфоцитов человека
107ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
108. Гомологичная рекомбинация
Комплементарноеспаривание цепей,
принадлежащих разным
дуплексам обеспечивает
взаимное узнавание
гомологичных молекул.
108
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
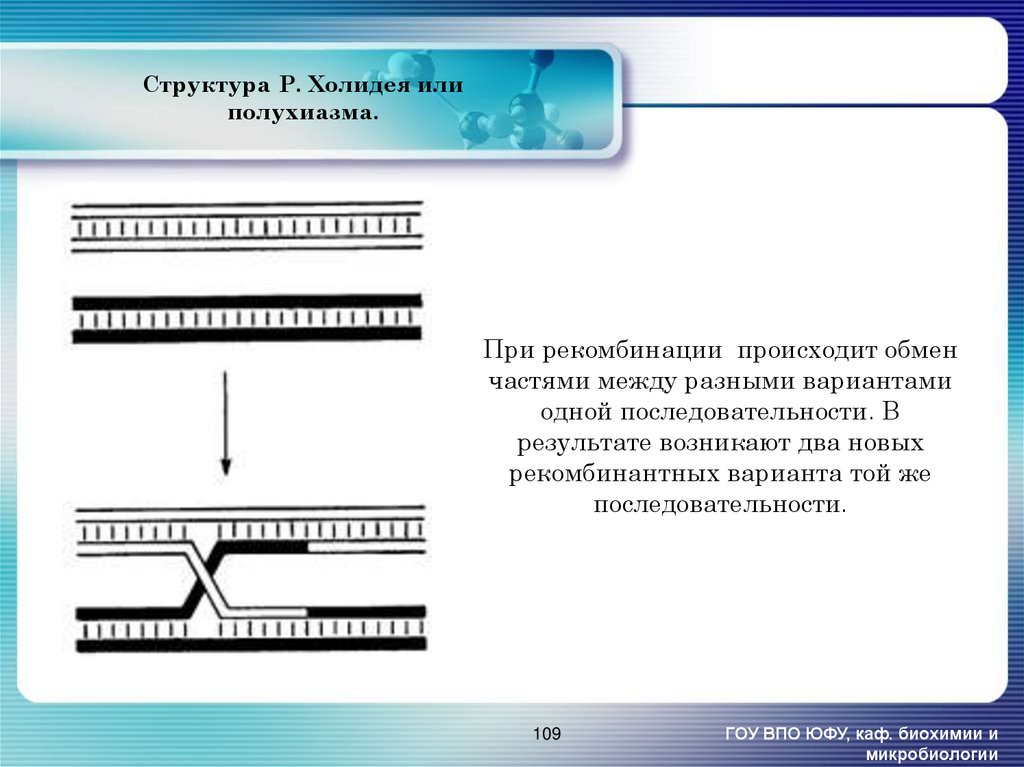
109. Структура Р. Холидея или полухиазма.
При рекомбинации происходит обменчастями между разными вариантами
одной последовательности. В
результате возникают два новых
рекомбинантных варианта той же
последовательности.
109
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
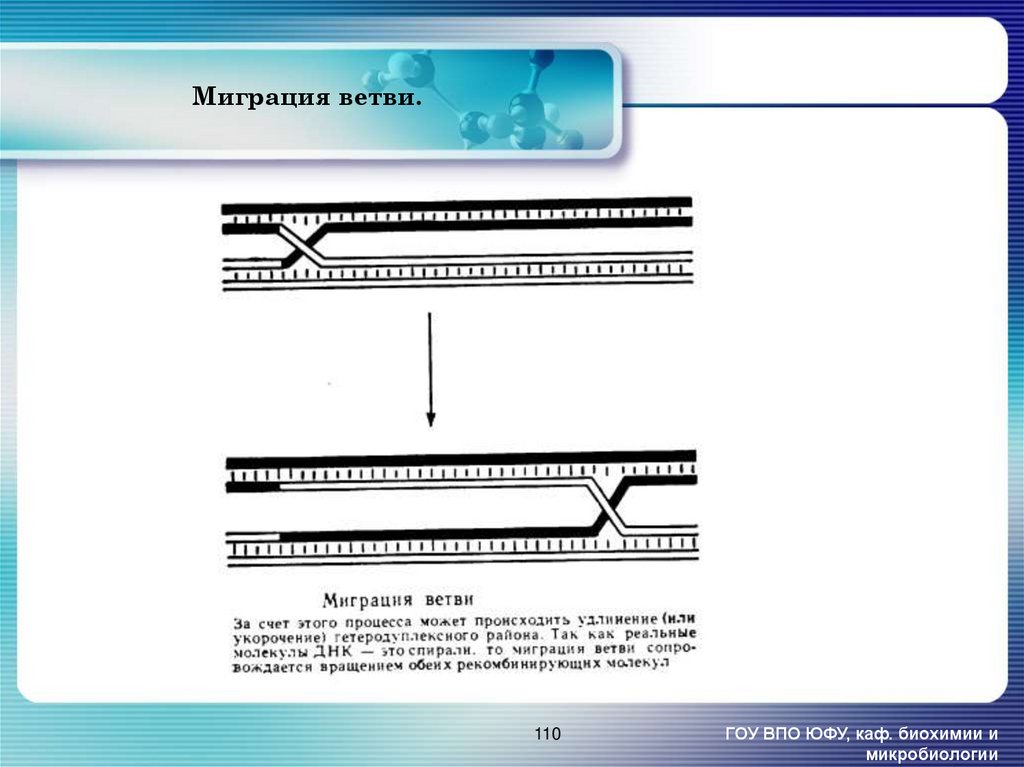
110. Миграция ветви.
110ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
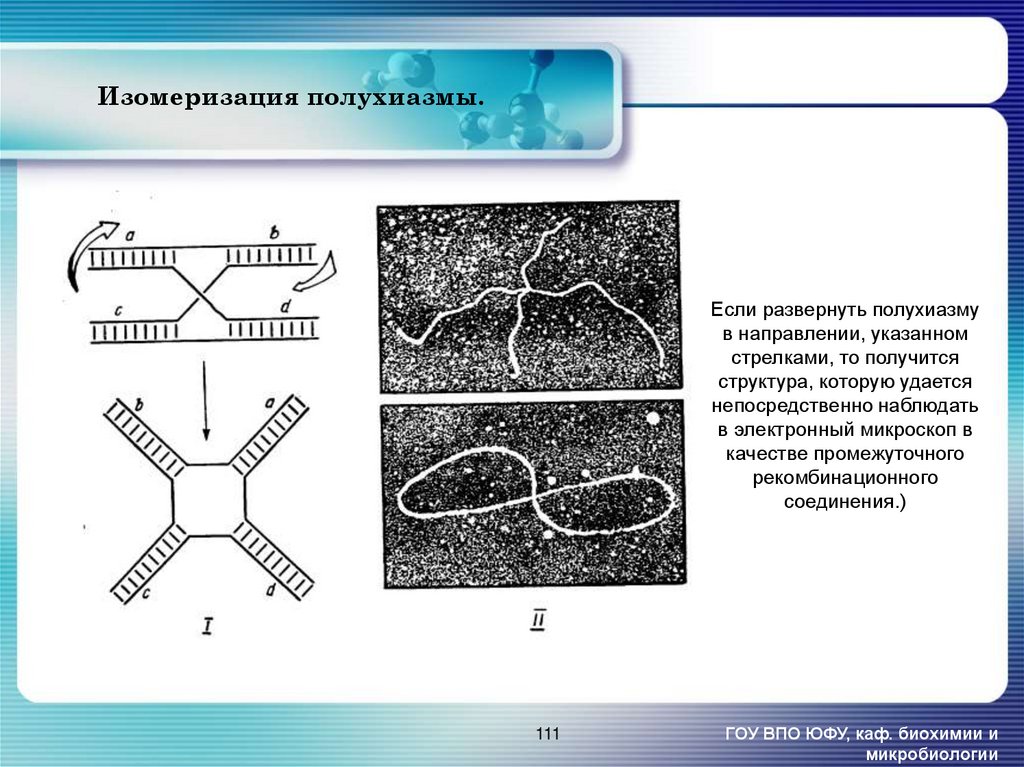
111. Изомеризация полухиазмы.
Если развернуть полухиазмув направлении, указанном
стрелками, то получится
структура, которую удается
непосредственно наблюдать
в электронный микроскоп в
качестве промежуточного
рекомбинационного
соединения.)
111
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
112. Способы разрезания полухиазмы.
112ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
113. Общая рекомбинация с образованием двухцепочечного разрыва [2].
113ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
114. Сайт-специфическая рекомбинация [2].
Интеграция ДНК фага лямбда схромосомной ДНК E. coli
Специфические
последовательности
имеются в обеих
участвующих в
рекомбинации ДНК.
Интеграция ДНК фага
лямбда с хромосомной
ДНК E. coli
114
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
115. Нереципрокная гомологичная рекомбинация как один из этапов репарации ДНК в месте образования пиримидиновых димеров [2].
115ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
116. RecA-зависимая общая рекомбинация ДНК E/ coli [2].
116ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
117. Лекция 8.
Экспрессионный аппарат клетки.Транскрипция.
К
содержанию
117
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
118. Пространственная модель комплекса РНК-полимеразы E. coli с фрагментом ДНК-матрицы [9].
Цифрами обозначеныместоположения
нуклеотидных звеньев
вдоль промотора в
молекуле ДНК. (отсчёт
от стартовой точки)
118
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
119. Схема синтеза РНК с помощью РНК-полимеразы [9].
РНК – полимераза бактерийсодержит четыре
субъединицы: ααββ – так
называемый кор-фермент,
после присоединения σ –
субъединицы образуется так
называемый холофермент,
способный осуществлять
транскрипцию. Полный
фермент способен «узнавать»
промотор и связываться с
ним.
119
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
120. Функциональные участки ДНК-зависимой РНК-полимеразы [8]
РНК-полимераза экранирует при взаимодействии участок ДНК,включающий примерно 60 пар нуклеотидов. Активные центры фермента
приведены на рисунке.
120
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
121. Типичный промотор E. coli [2].
Транскрипция инициируется при образовании стабильногокомплекса между холоферментом и специфической
последовательностью, называемой промотором и
располагающейся в начале всех транскрипционных единицю
121
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
122. Взаимное расположение блока Прибнова и блока -35 [11].
Точки контакта для РНК-полимеразы находятся на одной поверхностиДНК. (комплементарной цепи), образующей промотор.
122
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
123. Очерёдность процессов транскрипции, трансляции и деградации иРНК у бактерий [8] .
A. Связывание РНК-полимеразыи начало транскрипции в
направлении 5-3.
B. Включение нуклеотидов в
РНК со скоростью 40
нукл\сек, одновременно к
иРНК прикрепляются
рибосомы.
C. Группы рибосом следуют за
полимеразой. С 5`-конца
начинается деградация ДНК.
D. По мере движения рибосом
иРНК деградирует, но с
меньшей скоростью, чем идёт
процесс трансляции.
E. После окончания
транскрипции иРНК
освобождается, но процессы
деградации и трансляции
продолжаются.
А
B
C
D
Е
123
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
124. Схема транскрипции, катализируемой РНК-полимеразой [1].
1. Поиск промотора2. Образование закрытого
промоторного комплекса
3. Образование открытого
комплекса
4. Отсоединение σ –
фактора и присоединение
фактора элонгации
5. Терминация синтеза.
РНК- полимераза
достигает зоны
терминатора
6. Высвобождение
готовойго
РНУ0транскрипьа в виде
копии матричной ДНК.
124
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
125. Терминация транскрипции. Примеры шпилек в ρ-независимых и ρ-зависимых терминаторах [2].
Обнаружено два типа сигналов терминации. Они содержат инвертированныеповторы, благодаря чему 3`- концы РНК-транскриптов складываются с образованием
шпилек разной длины.
125
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
126. Влияние ρ-белка на остановку РНК-полимеразы в терминаторе, сопровождающуюся терминацией транскрипции с отделением фермента и
ρ-белок и терминациятранскрипции [2].
Влияние ρ-белка на
остановку РНКполимеразы в
терминаторе,
сопровождающуюся
терминацией
транскрипции с
отделением фермента и
синтезированной к тому
моменту цепи.
126
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
127. Эукариотическая иРНК [11].
Эукариотическая иРНК имеет «заблокированный№ 5`- конец, за которымрасположен нетранслируемый лидер, содержащий промоторную последовательность.
Кодирующая область связана также с нетранслируемым трейлером, имеющим на 3`конце poly(A)- хвост
127
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
128. Структура «кэпов», расположенных на 5`- конце эукариотических иРНК [11].
Все кэпы содержат 7-метил гуанилат, присоединённыйпирофосфатной связью к 5`- концу.
128
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
129. Обратная транскрипция [2].
Схематическое изображениеобратной транскрипции
ретровирусной РНК, при
которой образуется
линейная двухцепочечная
ДНК, ограниченная LTRпослеловатеьностями
J. Darnell, H. Lodish, D. Baltimore,
Molecular Cell Biology (New York:
Scientific American Books< 1986), p.
1052.
129
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
130. Лекция 9.
Генетический код.Молекулярная организация тРНК и рибосом
про- и эукариот.
К
содержанию
130
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
131. Свойства генетического кода:
Генетический код является непрерывным и неперекрывающимся.код белка
является
триплетным.
ВГенетический
процессе синтеза
последовательность
мРНК считывается последовательно
группами по три нуклеотида.
Генетический код является вырожденным.
Многие аминокислоты кодируются двумя и более кодонами. Только Met и Trp кодируются
единичными кодонами. Для каждой аминокислоты существует более одной тРНК, и одна
тРНК может взаимодействовать более чем с одним кодоном МРНК.
Генетический код является квазидуплетным.
В генетическом коде преобладающую роль играют первые две буквы кодонов. Эта
особенность кода позволяет использовать меньшее число тРНК: для
взаимодействия с 61 кодоном достаточно 31 тРНК в цитоплазме и 22 тРНК в
белоксинтезирующей системе митохондрий животных.
Генетический код является универсальным.
Генетический код един для всез живущих на земле организмов – от бактерий, до человека.
Исключение составляет генетический код митохондрий и хлоропластов.
131
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
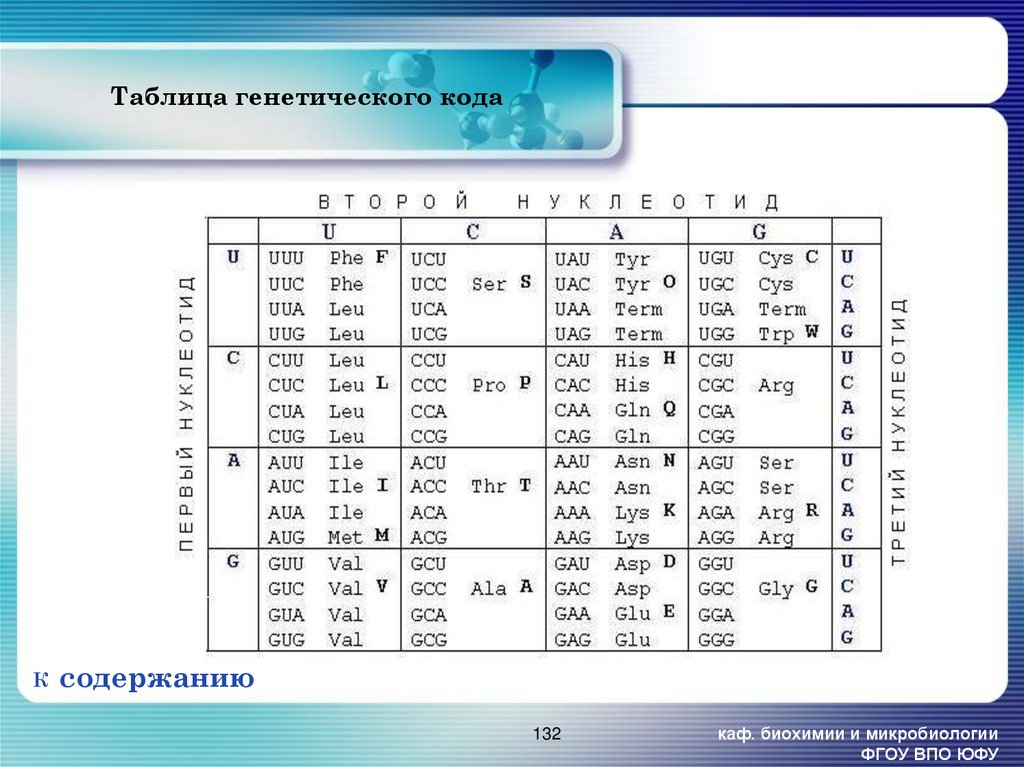
132. Таблица генетического кода
Ксодержанию
132
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
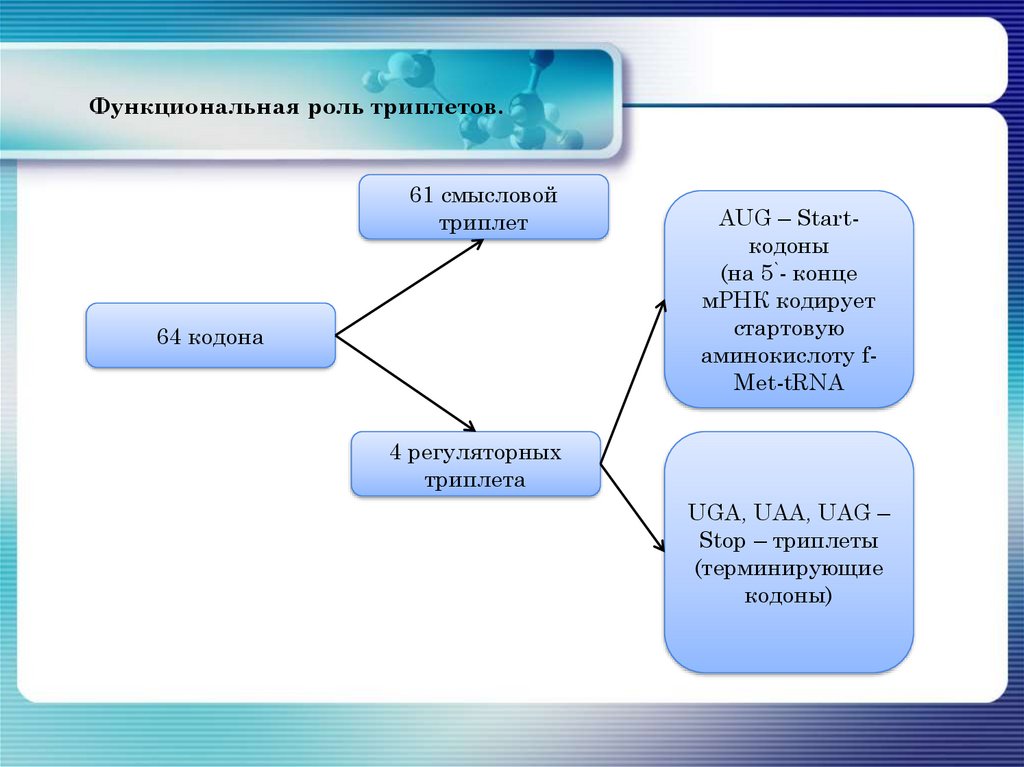
133. Функциональная роль триплетов.
61 смысловойтриплет
64 кодона
AUG – Startкодоны
(на 5`- конце
мРНК кодирует
стартовую
аминокислоту fMet-tRNA
4 регуляторных
триплета
UGA, UAA, UAG –
Stop – триплеты
(терминирующие
кодоны)
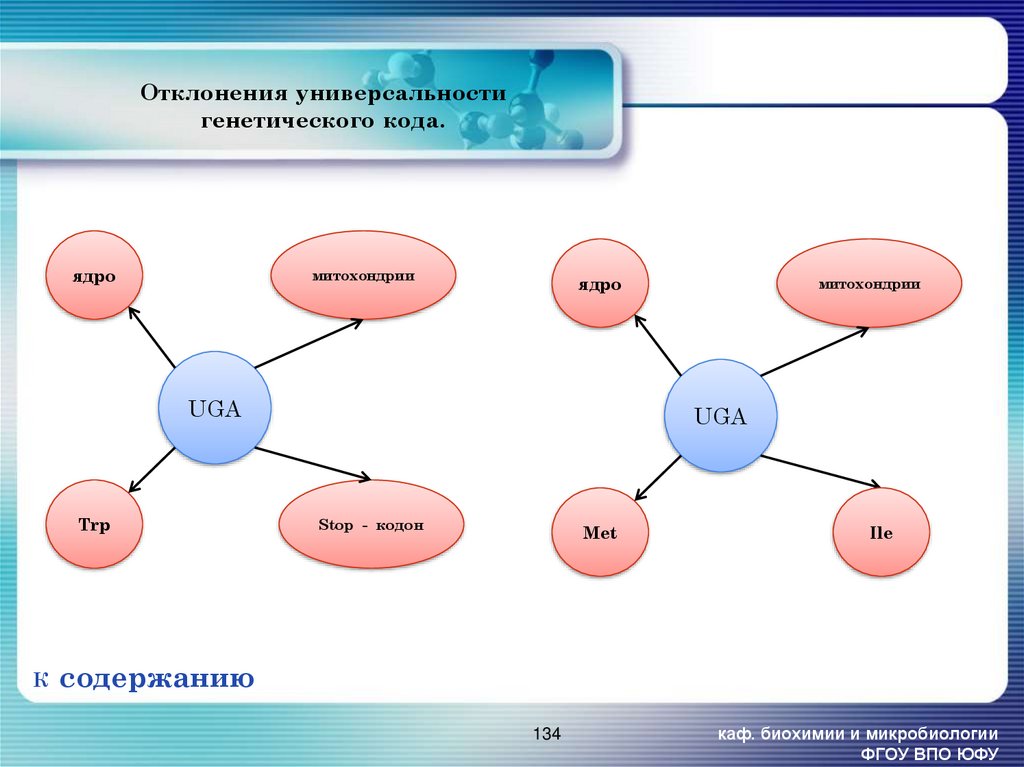
134. Отклонения универсальности генетического кода.
ядромитохондрии
ядро
UGA
Trp
К
митохондрии
UGA
Stop - кодон
Met
Ile
содержанию
134
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
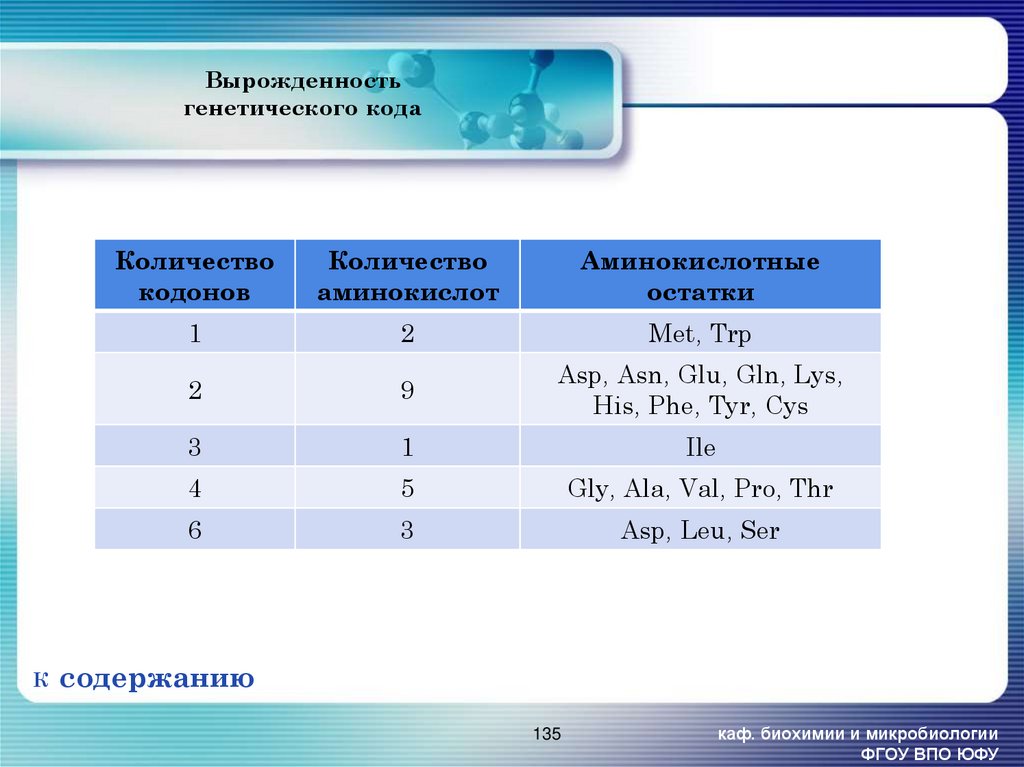
135. Вырожденность генетического кода
ККоличество
кодонов
Количество
аминокислот
Аминокислотные
остатки
1
2
Met, Trp
2
9
Asp, Asn, Glu, Gln, Lys,
His, Phe, Tyr, Cys
3
1
Ile
4
5
Gly, Ala, Val, Pro, Thr
6
3
Asp, Leu, Ser
содержанию
135
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
136. Гипотеза неоднозначного соответствия Ф. Крика (1956) (гипотеза «качения»
Для объяснения вырожденности кода по 3-му положению основания в кодоне Ф.Крик постулировал гипотезу «качения». Согласно которой соответствие 3-го
основания кодона первому основанию антикодона тРНК является нестрогим.
Ala GCU GCC GCA GCG
Часто 1-е положение в антикодоне тРНК бывает занято необычным основанием
инозином (I), которое может образовывать Н+-связи с U,C или А, находящимися в
3-м положении.
U
I (инозин)
C
U
Ψ -урацил
A
G
A
Неоднозначность спаривания нуклеотидов в 3-м положении антикодона.
XYAG
или
XY UC
К
содержанию
136
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
137. Рамка считывания.
Поскольку каждый кодон содержит три нуклеотида, один и тот жегенетический текст можно прочитать тремя разными способами
(начиная с первого, второго и третьего нуклеотидов), то есть в трех
разных рамках считывания. За некоторыми интересными
исключениями, значимой является информация закодированная только
в одной рамке считывания. По этой причине крайне важным для
синтеза белка рибосомой является ее правильное позиционирование на
стартовом AUG-кодоне — инициация трансляции.
137
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
138. Структурно-функциональная организация тРНК.
Ксодержанию
138
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
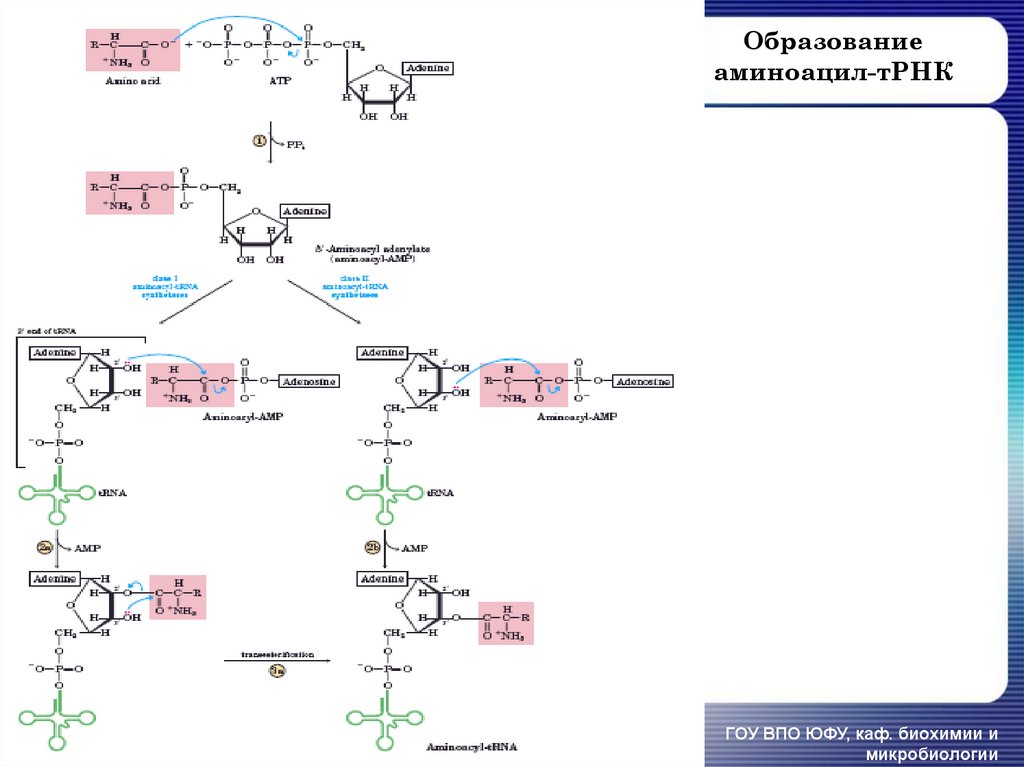
139. Образование аминоацил-тРНК
139ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
140. Состав прокариотических и эукариотических рибосом.
Ксодержанию
140
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
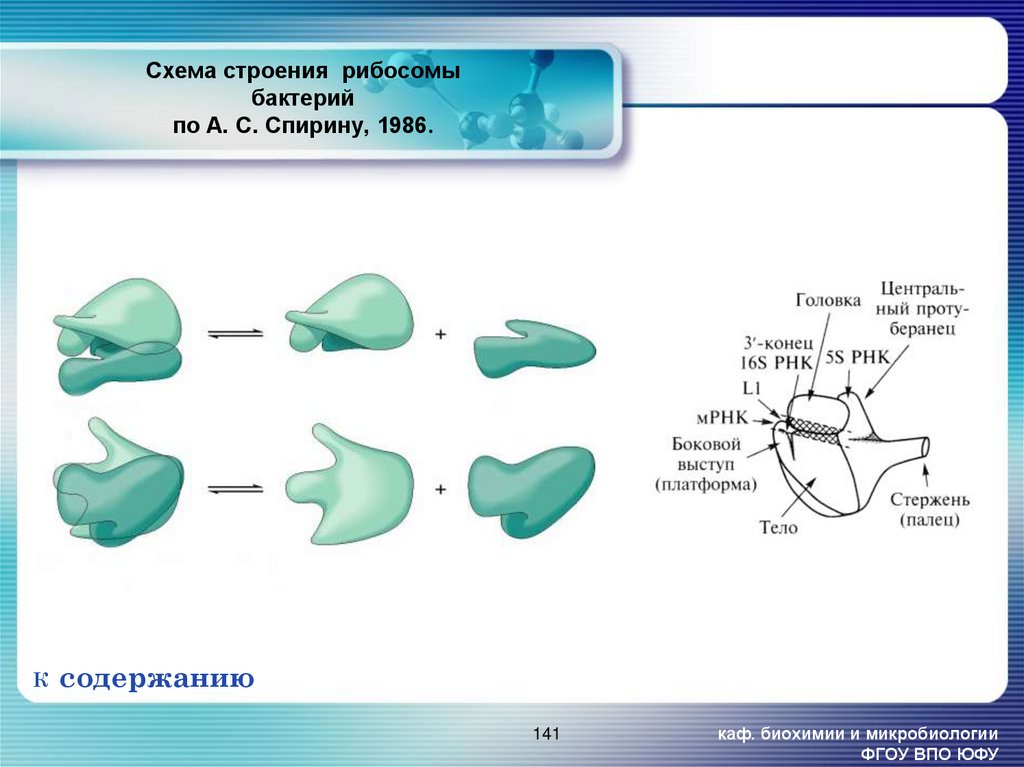
141. Схема строения рибосомы бактерий по А. С. Спирину, 1986.
Ксодержанию
141
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
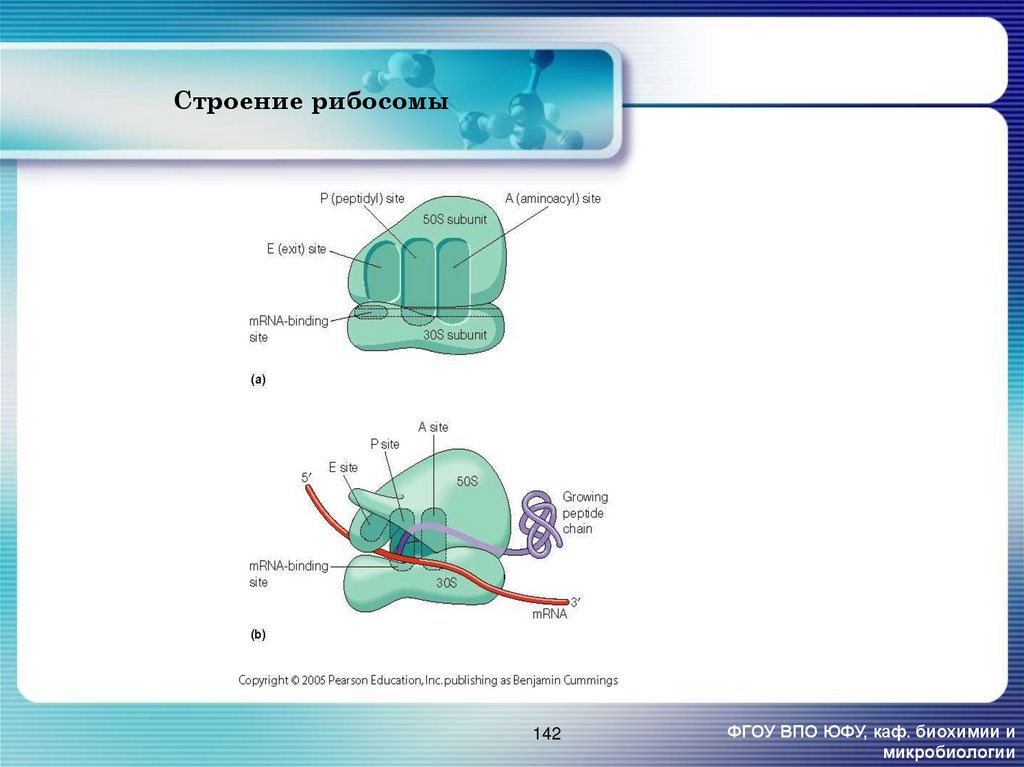
142. Строение рибосомы
142ФГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
143. Лекция 10.
Трансляция: условия и энергетика.Рабочий цикл рибосомы.
Регуляция экспрессии гена.
К
содержанию
143
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
144. Основные участники этапов трансляции.
Активация аминокислот (рекогниция)20 аминокислот + 20 аминоацил-тРНК синтетаз + 20 тРНК + АТФ + Mg2+
Инициация
тРНК-fMet + мРНК + 30S субъединица рибосомы + IF1 + IF2 + IF3
Элонгация
Инициирующий комплекс (70 S-рибосома) + 20 аминоацил-тРНК +
Mg2+ +GTP + факторы элонгации TU, Ts, G
Терминация
Терминирующий кодон + ATP+ R1 + R2 + R3
Процессинг белка
144
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
145. Ферменты (факторы) трансляции про- и эукариот.
Ферменты (факторы) трансляции прои эукариот.Прокариоты
Эукариоты
Факторы инициации
IF1, IF2 (a, b), IF3
UF1, IF2 (a, b), IF3, IF4 (a, d, c, d, f), IF5
Факторы элонгации
EF Tu, EF Ts, EF G
EF1 (α,β,γ), EF2, EF3
Факторы терминации
Rf1, Rf2, Rf3
К
Rf
содержанию
145
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
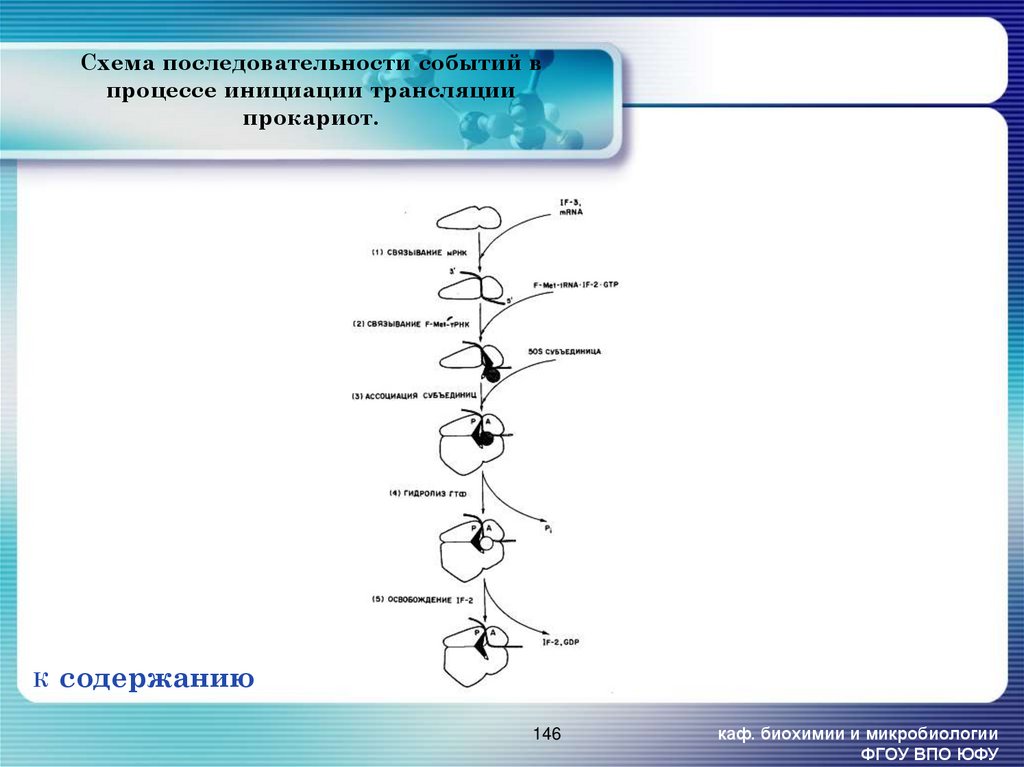
146. Схема последовательности событий в процессе инициации трансляции прокариот.
Ксодержанию
146
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
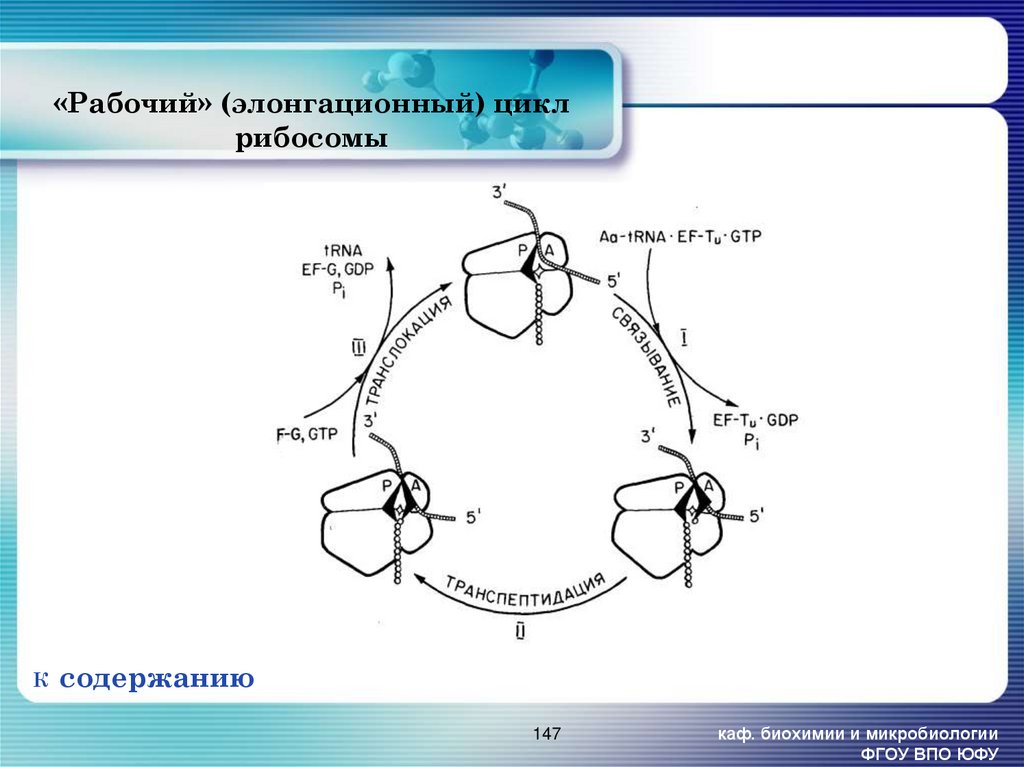
147. «Рабочий» (элонгационный) цикл рибосомы
Ксодержанию
147
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
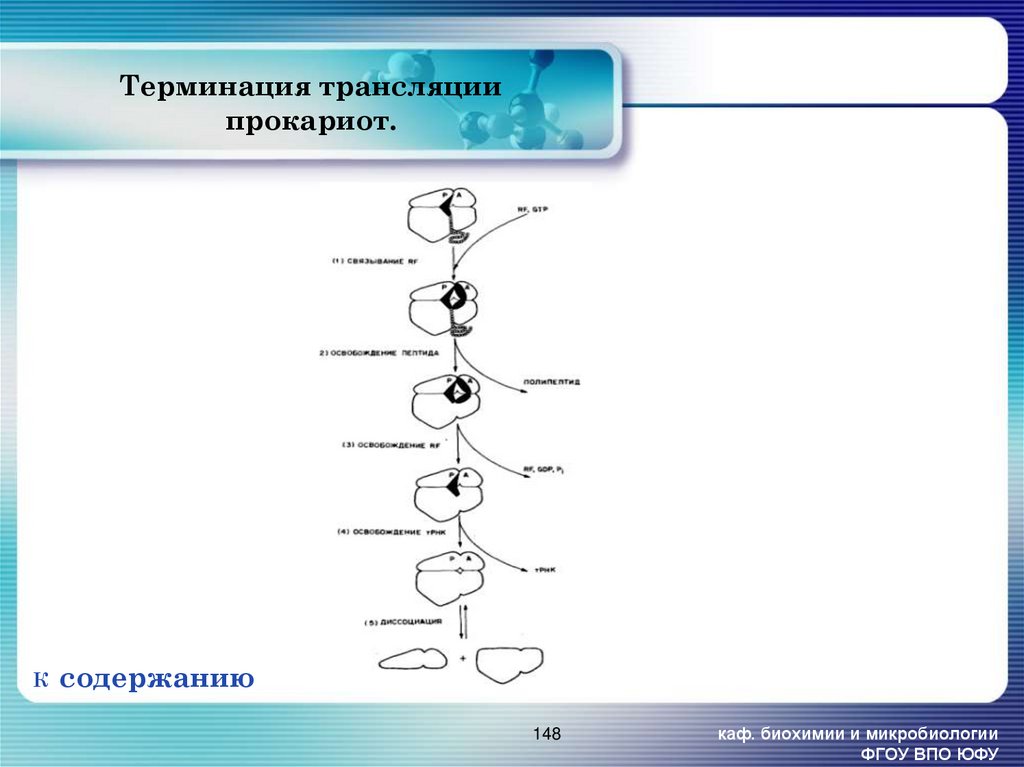
148. Терминация трансляции прокариот.
Ксодержанию
148
каф. биохимии и микробиологии
ФГОУ ВПО ЮФУ
149. Лактозный оперон E. coli и ген lac-репрессора [2].
Лактозный оперон E. coli и ген lacрепрессора [2].149
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
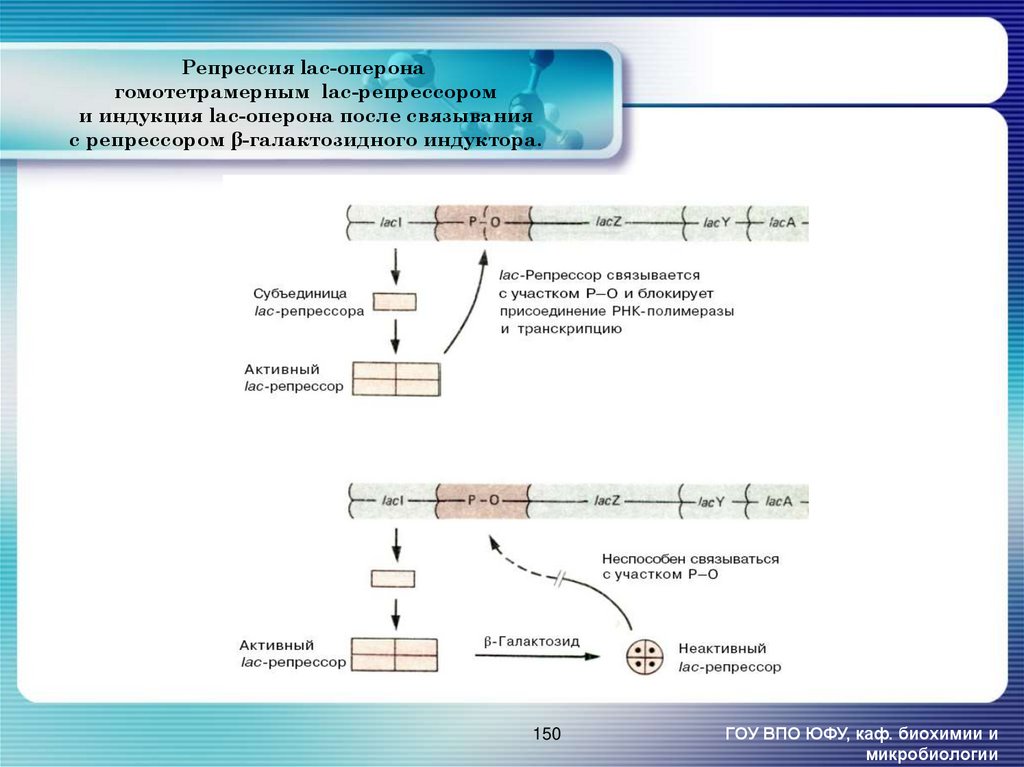
150. Репрессия lac-оперона гомотетрамерным lac-репрессором и индукция lac-оперона после связывания с репрессором β-галактозидного
индуктора.150
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
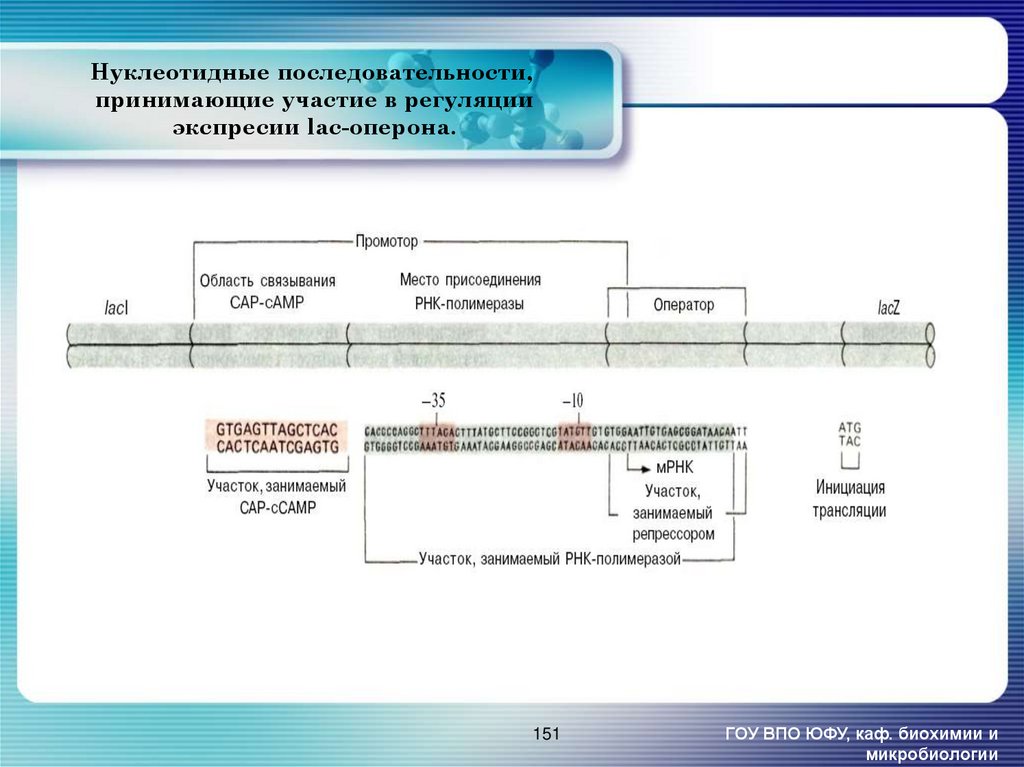
151. Нуклеотидные последовательности, принимающие участие в регуляции экспресии lac-оперона.
151ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
152. «Цинковые пальцы» - элементы сверхвторичной структуры в ДНК-связывающих белках, участвующих в регуляции транскрипции [1].
А – упрощённая схемастроения ДНКсвязывающего домена,
содержащего остатки Cys
и His, образующих связи с
атомами цинка.
Б – схема взаимодействия
четырёх «цинковых
пальцев2 с большими
желобами молекулы
ДНКю Каждый «палец»
узнаёт определённую
последовательность из
пяти нулеотидных пар.
152
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
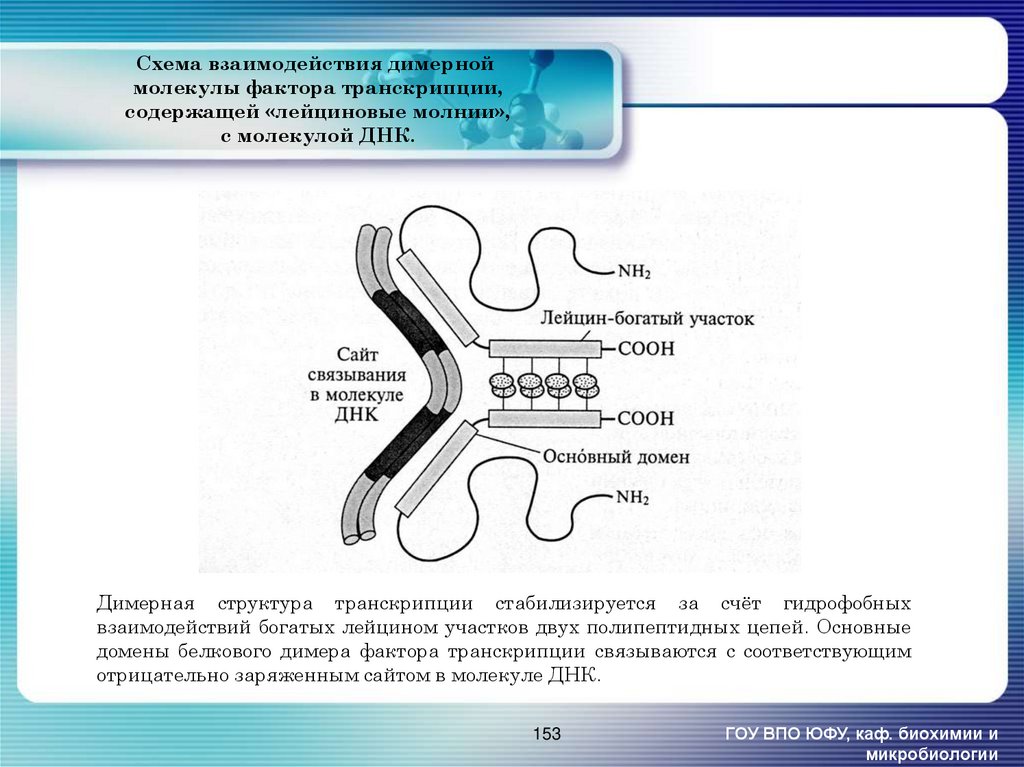
153. Схема взаимодействия димерной молекулы фактора транскрипции, содержащей «лейциновые молнии», с молекулой ДНК.
Димерная структура транскрипции стабилизируется за счёт гидрофобныхвзаимодействий богатых лейцином участков двух полипептидных цепей. Основные
домены белкового димера фактора транскрипции связываются с соответствующим
отрицательно заряженным сайтом в молекуле ДНК.
153
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
154. Комплексы белков, участвующих в регуляции транскрипции у эукариот.
R- белки-регуляторы, передающие сигнал от энхансера; A, B, D, E, F, H – факторытранскрипции (TF); Srb, Gal 11, Med – субмедиаторного комплекса; SWI/SNF –
комплекс белков, модифицирующий структуру хроматина; TBP – TATAсвязывающий белок; CTD - С-концевой домен РНК-полимеразы 2, с
присоединёнными к нему фосфорными остатками.
154
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
155. Терминация транскрипции. Примеры шпилек в ρ-независимых и ρ-зависимых терминаторах.
Обнаружено два типа сигналов терминации. Они содержатинвертированные повторы, благодаря чему 3`- концы РНК-транскриптов
складываются с образованием шпилек разной длины.
155
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
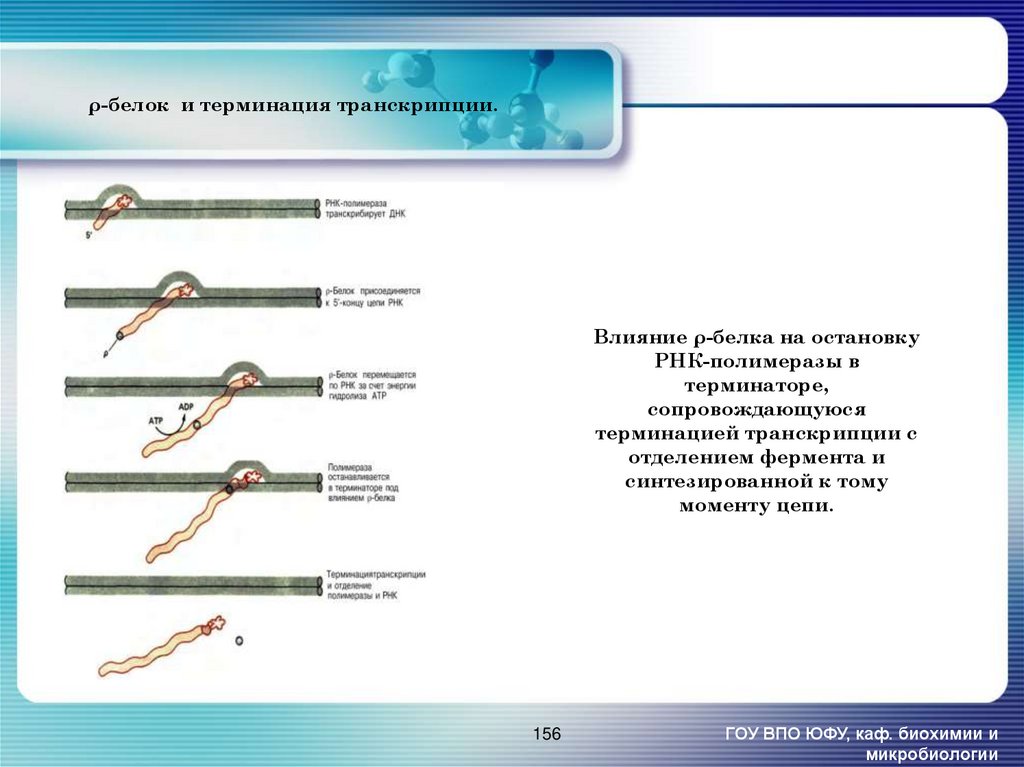
156. Влияние ρ-белка на остановку РНК-полимеразы в терминаторе, сопровождающуюся терминацией транскрипции с отделением фермента и
ρ-белок и терминация транскрипции.Влияние ρ-белка на остановку
РНК-полимеразы в
терминаторе,
сопровождающуюся
терминацией транскрипции с
отделением фермента и
синтезированной к тому
моменту цепи.
156
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии
157. Список литературных источников.
1.2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
Коничев А. С., Севастьянова Г. А. Молекулярная биология. М.: Издательский центр
«Академия», 2003.
Сингер М., Берг П. Гены и геномы. М.: Мир, 1998
Марри Р., Греннер Р., Мейес П., Родуэлл В. Биохимия человека: в 2-х томах. Т.2 Пер. с
англ.: - М.: Мир, 1993.
Кольман Я., Рём К. –Г. Наглядная биохимия: Пер. с нем. - М.: Мир.: Мир, 2000.
Григорович С. В начале была РНК? В поисках молекулы первожизни. // Наука и жизнь.
№2., 2004.
Каменский А. А., Соколова Н. А. Ответы на вопросы по биологии. 16/2000
Интернет источник: Википедия
Льюин Б. Гены. М.: Мир, 1987.
Овчинников Ю. А. Биоорганическая химия. М.: Просвещение, 1987.
Строев Е. А. Биологическая химия. М.: Высш. Шк., 1986.
Бокуть С. Б., Герасимович Н. В., Милютин А. А. Молекулярная биология: молекулярные
механизмы хранения, воспроизведения и реализации генетической информации: учебное
пособие. Мн.: Высш. Шк., 2005.
Ленинджер. Принципы биохимии, 2004
Бил Дж., Ноулз. Внеядерная наследственность: Пер. с англ.-М.: Мир, 1981.
Джеймс Д. Уотсон. Двойная спираль: Пер. с англ.-М.: Мир, 1969.
Э. Рис., М. Стернберг. От клеток к атомам : Пер. с англ.-М.: Мир, 1988.
Рыбчин В. Н., Основы генетической инженерии. 2-е изд., перераб. и доп.: Учебник для
вузов. СПб.: Изд-во СПбГТУ, 2002. 522 с.Дж. Уотсон., Дж. Туз., Д. Курц. Рекомбинантные
ДНК. Пер. с англ.-М.: Мир, 1986.
Иллариошкин С. Н. ДНК-диагностика и медико-генетическое консультирование.-М:
Медицинское информационное агентство, 2004.- 2007
157
ГОУ ВПО ЮФУ, каф. биохимии и
микробиологии





![Общая схема эксперимента Альфреда Д. Херши и Марты Чейз в опытах с применением радиоактивных меток (1952 г.). [12] Общая схема эксперимента Альфреда Д. Херши и Марты Чейз в опытах с применением радиоактивных меток (1952 г.). [12]](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-7.jpg)
![Взаимодействия между гетероциклическими основаниями в нуклеиновых кислотах [12]. Взаимодействия между гетероциклическими основаниями в нуклеиновых кислотах [12].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-12.jpg)
![Физико-химические свойства ДНК. Денатурация и ренатурация ДНК [2]. Физико-химические свойства ДНК. Денатурация и ренатурация ДНК [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-16.jpg)

![Постулирование модели двойной спирали ДНК американским генетиком Джеймсом Уотсоном и английским физиком Френсисом Криком [7]. Постулирование модели двойной спирали ДНК американским генетиком Джеймсом Уотсоном и английским физиком Френсисом Криком [7].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-18.jpg)

![Спиральная структура молекулы ДНК [2]. Спиральная структура молекулы ДНК [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-22.jpg)
![Полиморфизм двойной спирали ДНК [1, 7]. Полиморфизм двойной спирали ДНК [1, 7].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-23.jpg)
![Упаковка ДНК. Гистоны и нуклеосомы [7, 10]. Упаковка ДНК. Гистоны и нуклеосомы [7, 10].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-25.jpg)

![Уровни компактизации молекулы ДНК [4]. Уровни компактизации молекулы ДНК [4].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-27.jpg)
![Разнообразие форм ДНК [2]. Разнообразие форм ДНК [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-28.jpg)
![ДНК кинетопласта из Leishmania tarentolae [2]. ДНК кинетопласта из Leishmania tarentolae [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-29.jpg)
![Реакции, катализируемые топоизомеразами типа 1 [2]. Реакции, катализируемые топоизомеразами типа 1 [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-31.jpg)


![Сравнительная структура ДНК и РНК [5]. Сравнительная структура ДНК и РНК [5].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-35.jpg)
![Вторичная и третичная структура однотяжевых РНК [2]. Вторичная и третичная структура однотяжевых РНК [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-36.jpg)
![Типы «третичных» внутримолекулярных взаимодействий. между отдельными элементами вторичной структуры молекулы РНК [1]. Типы «третичных» внутримолекулярных взаимодействий. между отдельными элементами вторичной структуры молекулы РНК [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-37.jpg)
![Структура тРНК [12]. Структура тРНК [12].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-38.jpg)

![Оперонная организация генов прокариот [1]. Оперонная организация генов прокариот [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-41.jpg)



![Строение эукариотического гена, кодирующего белок [1]. Строение эукариотического гена, кодирующего белок [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-45.jpg)

![Аутосплайсинг 26 S рРНК у тетрахимены в процессе образования рибозима [1]. Аутосплайсинг 26 S рРНК у тетрахимены в процессе образования рибозима [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-49.jpg)
![Сплайсинг предшественника мРНК с участием мяРНК через образование сплайсингосом [1]. Сплайсинг предшественника мРНК с участием мяРНК через образование сплайсингосом [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-50.jpg)


![Типы альтернативного сплайсинга пре-мРНК [1]. Типы альтернативного сплайсинга пре-мРНК [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-53.jpg)



![Типичные IS-элементы E. coli [1] Типичные IS-элементы E. coli [1]](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-59.jpg)
![R-плазмида со всеми инсерционными последовательностями (IS) и транспозонами (Tn) [2] R-плазмида со всеми инсерционными последовательностями (IS) и транспозонами (Tn) [2]](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-61.jpg)


![Дупликация сайта-мишени после встраивания мобильного элемента [2]. Дупликация сайта-мишени после встраивания мобильного элемента [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-64.jpg)
![Ретротранспозон класса 1 и его транскрипт [2] Ретротранспозон класса 1 и его транскрипт [2]](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-66.jpg)
![Модель транспозиции ретрогенов при участии РНК-посредника [2] Модель транспозиции ретрогенов при участии РНК-посредника [2]](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-67.jpg)


![Предполагаемые модели репликации дуплексной ДНК [2]. Предполагаемые модели репликации дуплексной ДНК [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-71.jpg)
![Экспериментальные подтверждения модели Уотсона-Крика в работах Мэтью Мезельсона и Франклина Сталя [12]. Экспериментальные подтверждения модели Уотсона-Крика в работах Мэтью Мезельсона и Франклина Сталя [12].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-72.jpg)
![Экспериментальные подтверждения модели Уотсона-Крика в работах Мэтью Мезельсона и Франклина Сталя [12]. Экспериментальные подтверждения модели Уотсона-Крика в работах Мэтью Мезельсона и Франклина Сталя [12].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-73.jpg)

![Белки, входящие в состав репликативного комплекса ]. Белки, входящие в состав репликативного комплекса ].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-78.jpg)
![Инициация репликации ДНК [2]. Инициация репликации ДНК [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-79.jpg)
![Полуконсервативный механизм репликации ДНК E. coli [9]. Полуконсервативный механизм репликации ДНК E. coli [9].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-80.jpg)
![Репликация ДНК [ 7]. Репликация ДНК [ 7].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-81.jpg)
![ДНК-лигаза. Механизм лигазной реакции [12]. ДНК-лигаза. Механизм лигазной реакции [12].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-82.jpg)
![Репликация хромосомной ДНК эукариот [2]. Репликация хромосомной ДНК эукариот [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-84.jpg)
![Начало репликации [2]. Начало репликации [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-85.jpg)
![Репликация по типу катящегося кольца [2]. Репликация по типу катящегося кольца [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-86.jpg)
![Поочерёдная репликация цепей ДНК аденовируса [2]. Поочерёдная репликация цепей ДНК аденовируса [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-87.jpg)
![Репликация теломерных участков эукариотических хромосом [1]. Репликация теломерных участков эукариотических хромосом [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-88.jpg)

![Сравнительная структура ДНК и РНК [5]. Сравнительная структура ДНК и РНК [5].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-90.jpg)

![Мутагенные агенты и типы повреждений молекулы ДНК [4]. Мутагенные агенты и типы повреждений молекулы ДНК [4].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-93.jpg)
![Повреждения в нуклеотидах ДНК [1]. Повреждения в нуклеотидах ДНК [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-95.jpg)
![Прямая репарация [1] Прямая репарация [1]](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-97.jpg)
![Схема эксцизионной репарации [1]. Схема эксцизионной репарации [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-98.jpg)
![Схема нуклеотидной эксцизионной репарации у E. coli с участием эксинуклеазы [1]. Схема нуклеотидной эксцизионной репарации у E. coli с участием эксинуклеазы [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-99.jpg)
![Ферментативная репарация циклобутановых тиминовых димеров [2]. Ферментативная репарация циклобутановых тиминовых димеров [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-100.jpg)
![Репарация с помощью N- гликозилаз. [2] Репарация с помощью N- гликозилаз. [2]](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-101.jpg)
![Делеции и амплификации, возникающие при репликации или репарации [1]. Делеции и амплификации, возникающие при репликации или репарации [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-102.jpg)




![Общая рекомбинация с образованием двухцепочечного разрыва [2]. Общая рекомбинация с образованием двухцепочечного разрыва [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-112.jpg)
![Сайт-специфическая рекомбинация [2]. Сайт-специфическая рекомбинация [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-113.jpg)
![Нереципрокная гомологичная рекомбинация как один из этапов репарации ДНК в месте образования пиримидиновых димеров [2]. Нереципрокная гомологичная рекомбинация как один из этапов репарации ДНК в месте образования пиримидиновых димеров [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-114.jpg)
![RecA-зависимая общая рекомбинация ДНК E/ coli [2]. RecA-зависимая общая рекомбинация ДНК E/ coli [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-115.jpg)

![Пространственная модель комплекса РНК-полимеразы E. coli с фрагментом ДНК-матрицы [9]. Пространственная модель комплекса РНК-полимеразы E. coli с фрагментом ДНК-матрицы [9].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-117.jpg)
![Схема синтеза РНК с помощью РНК-полимеразы [9]. Схема синтеза РНК с помощью РНК-полимеразы [9].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-118.jpg)
![Функциональные участки ДНК-зависимой РНК-полимеразы [8] Функциональные участки ДНК-зависимой РНК-полимеразы [8]](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-119.jpg)
![Типичный промотор E. coli [2]. Типичный промотор E. coli [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-120.jpg)
![Взаимное расположение блока Прибнова и блока -35 [11]. Взаимное расположение блока Прибнова и блока -35 [11].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-121.jpg)
![Очерёдность процессов транскрипции, трансляции и деградации иРНК у бактерий [8] . Очерёдность процессов транскрипции, трансляции и деградации иРНК у бактерий [8] .](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-122.jpg)
![Схема транскрипции, катализируемой РНК-полимеразой [1]. Схема транскрипции, катализируемой РНК-полимеразой [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-123.jpg)
![Терминация транскрипции. Примеры шпилек в ρ-независимых и ρ-зависимых терминаторах [2]. Терминация транскрипции. Примеры шпилек в ρ-независимых и ρ-зависимых терминаторах [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-124.jpg)

![Эукариотическая иРНК [11]. Эукариотическая иРНК [11].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-126.jpg)
![Структура «кэпов», расположенных на 5`- конце эукариотических иРНК [11]. Структура «кэпов», расположенных на 5`- конце эукариотических иРНК [11].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-127.jpg)
![Обратная транскрипция [2]. Обратная транскрипция [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-128.jpg)







![Лактозный оперон E. coli и ген lac-репрессора [2]. Лактозный оперон E. coli и ген lac-репрессора [2].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-148.jpg)
![«Цинковые пальцы» - элементы сверхвторичной структуры в ДНК-связывающих белках, участвующих в регуляции транскрипции [1]. «Цинковые пальцы» - элементы сверхвторичной структуры в ДНК-связывающих белках, участвующих в регуляции транскрипции [1].](https://cf3.ppt-online.org/files3/slide/o/olM6T2tR7A4XxEFq8JyGif0IasezmnhNHpVSw5/slide-151.jpg)




 Биология
Биология