Похожие презентации:
Химический состав клетки. Тема: «Строение белков»
1. Тема: «Строение белков»
Глава I.Химический состав клетки
Тема: «Строение белков»
Задачи:
Изучить особенности строения
белков, их свойства и функции
2.
«Жизнь есть способ существования белковых тел,существенным моментом которого является
постоянный обмен веществ с окружающей их
внешней природой, причем с прекращением этого
обмена веществ прекращается и жизнь, что
приводит к разложению белка».
Ф. Энгельс
«Живые тела, существующие на Земле, представляют собой открытые,
саморегулирующиеся и самовоспроизводящиеся системы,
построенными из биополимеров – белков и нуклеиновых кислот».
М. В. Волькенштейн
3.
Общая характеристика белковИз органических веществ клетки по количеству и значению на
первом месте стоят белки (10-20% от массы клетки).
В состав белков входят: С, Н, О, N, S. Часть белков образует
комплексы с другими молекулами, содержащими фосфор, железо,
цинк и медь.
Белки обладают огромной молекулярной массой: молекулярная
масса альбумина (одного из белков яйца) — 36000, гемоглобина —
152000, миозина (одного из белков мышц) — 500000. Для
сравнения: молекулярная масса спирта — 46, уксусной кислоты —
60, бензола — 78.
Белки являются непериодическими полимерами, мономерами
которых являются 20 видов α-аминокислот.
4.
Общая характеристика белковВ зависимости от того, могут ли аминокислоты синтезироваться в
организме, различают: заменимые аминокислоты — десять
аминокислот, синтезируемых в организме; незаменимые
аминокислоты, которые в организме не синтезируются.
Незаменимые аминокислоты должны поступать в организм вместе с
пищей.
В зависимости от аминокислотного состава, белки бывают:
полноценными, если содержат весь набор незаменимых аминокислот;
неполноценными, если в их составе отсутствует хотя бы одна
незаменимая аминокислота.
Различают простые белки — белки, состоящие только из аминокислот
(фибрин, трипсин) и сложные — белки, содержащие помимо
аминокислот еще и небелковую — простетическую группу.
Она может быть представлена ионами металлов (металлопротеины
— гемоглобин), углеводами (гликопротеины), липидами
(липопротеины), нуклеиновыми кислотами (нуклеопротеины).
5.
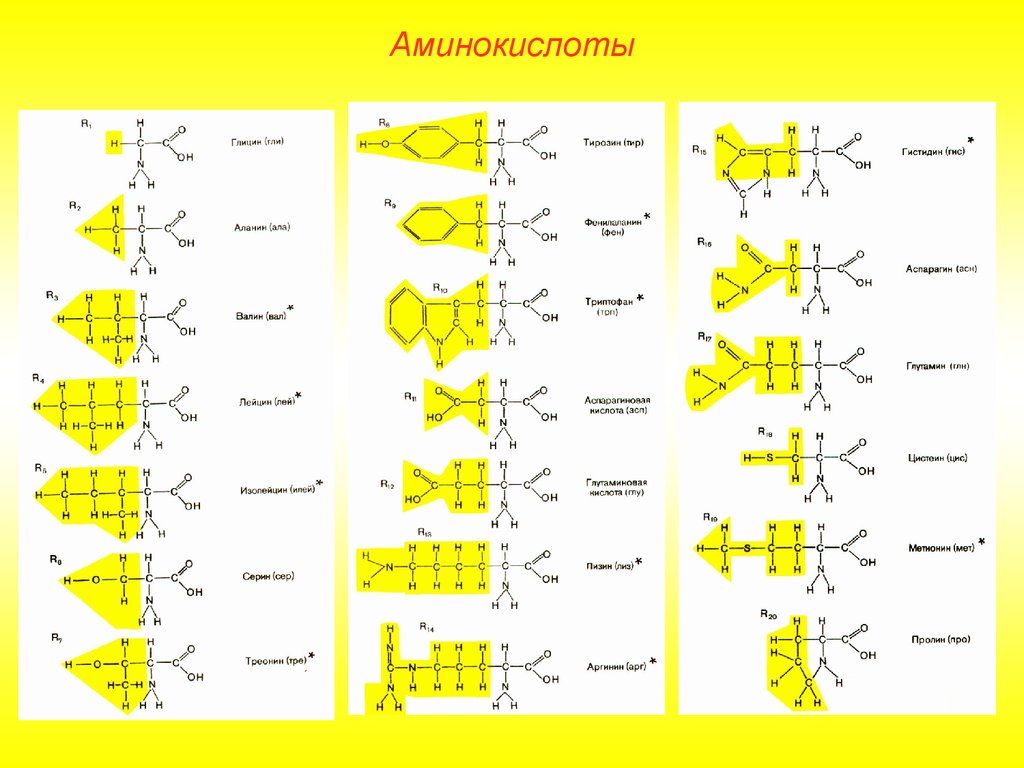
АминокислотыВсе аминокислоты содержат хотя бы одну
карбоксильную группу
(-СООН) и одну
аминогруппу
(-NH2). Остальная часть
молекулы представлена R-группой.
В зависимости от количества аминогрупп и
карбоксильных групп, входящих в состав
аминокислот, различают: нейтральные
аминокислоты, имеющие одну
карбоксильную группу и одну аминогруппу;
основные аминокислоты, имеющие более
одной аминогруппы; кислые аминокислоты,
имеющие более одной карбоксильной
группы.
6.
Аминокислоты7.
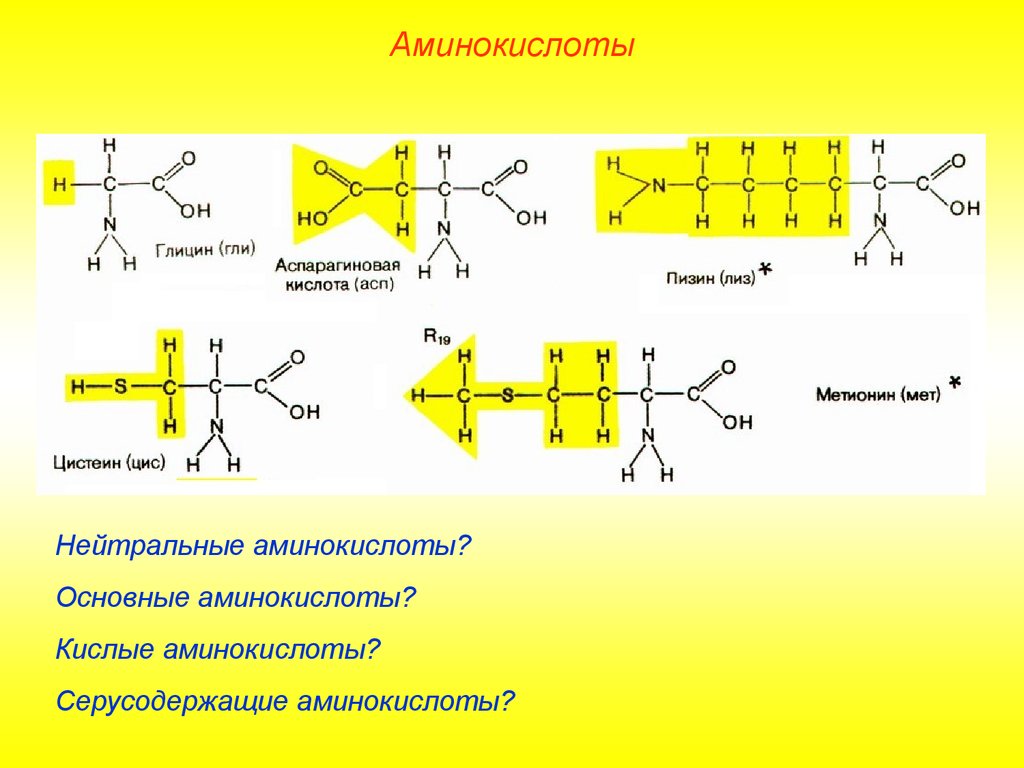
АминокислотыНейтральные аминокислоты?
Основные аминокислоты?
Кислые аминокислоты?
Серусодержащие аминокислоты?
8.
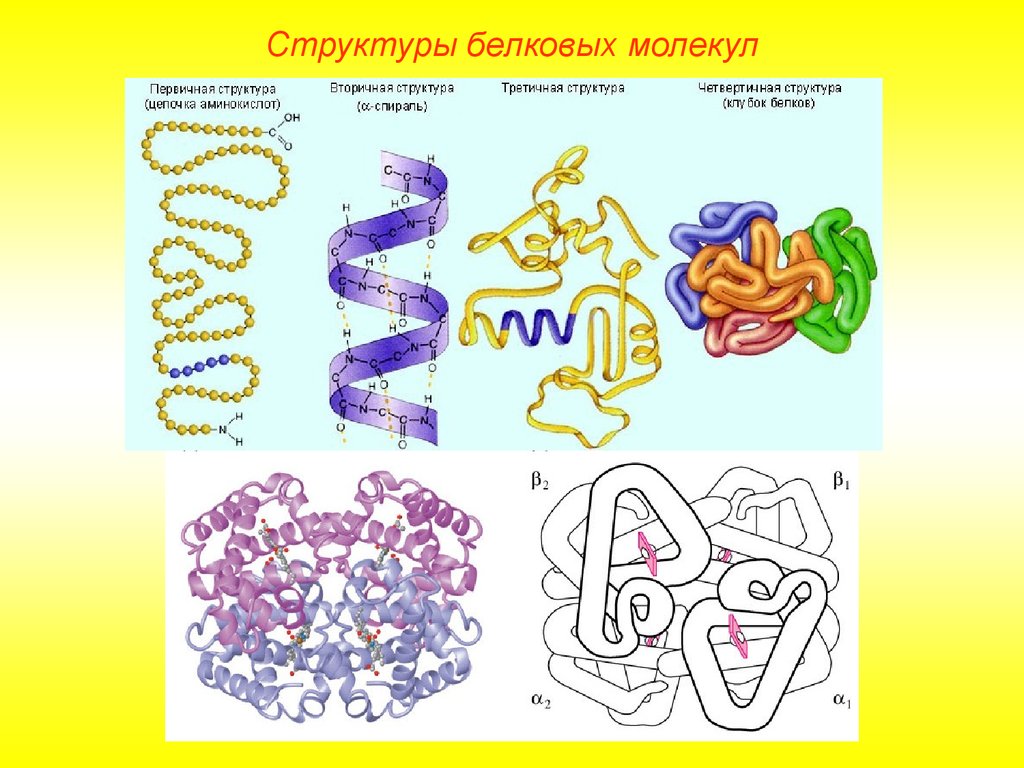
Структуры белковых молекул9.
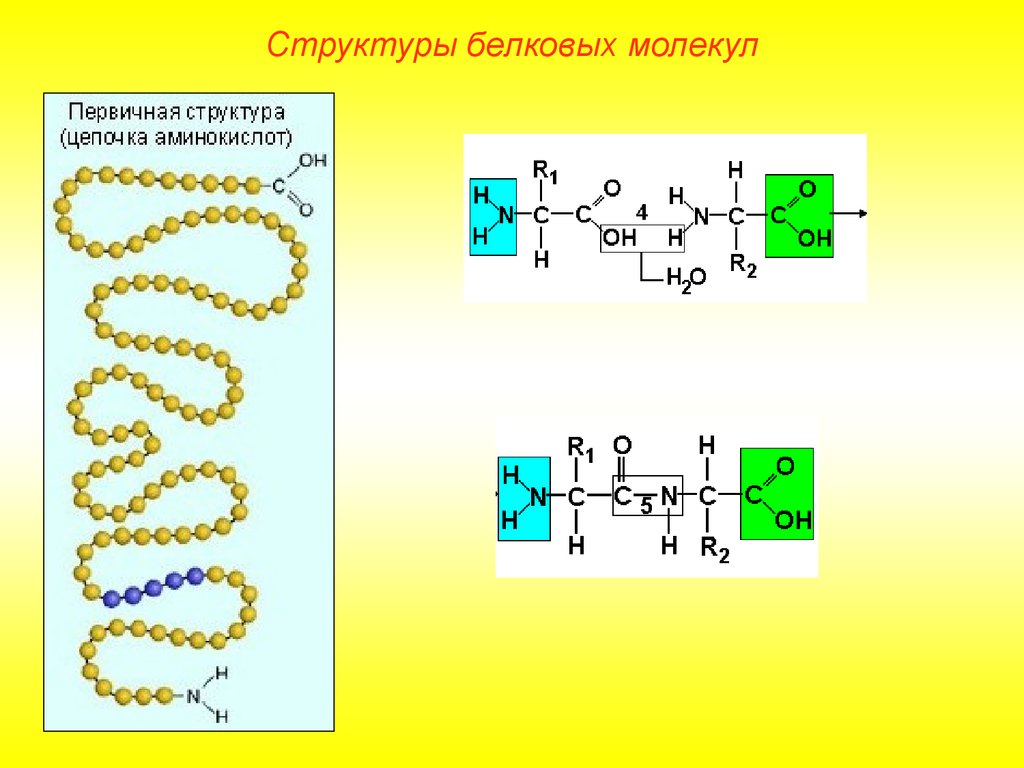
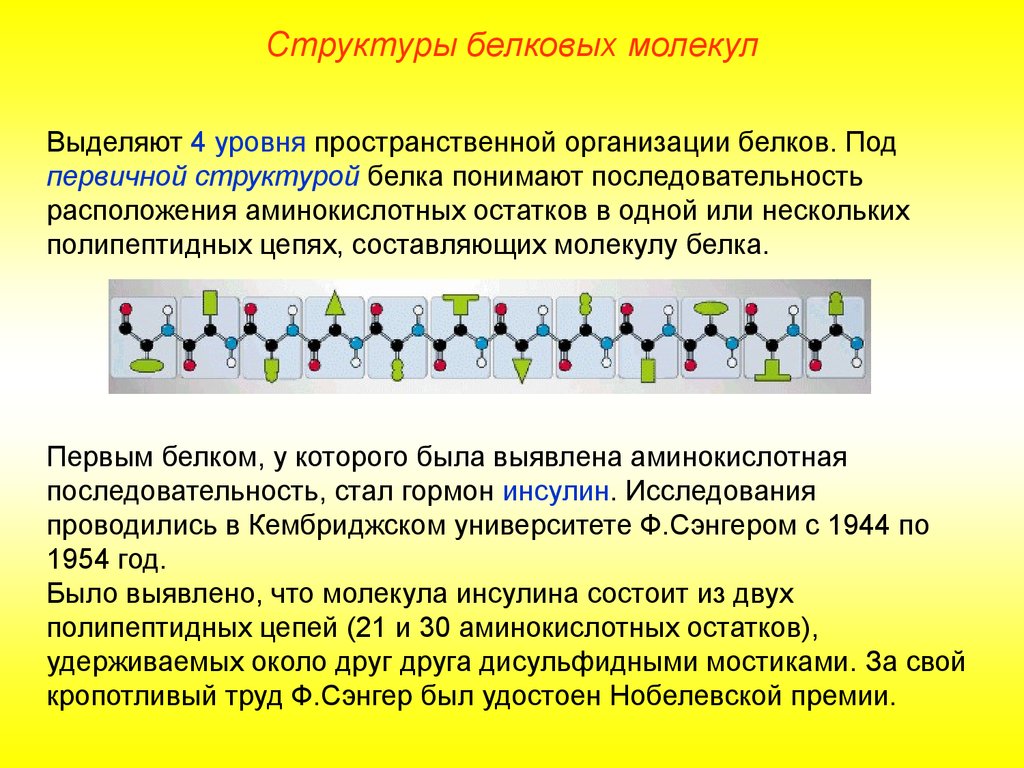
Структуры белковых молекулВыделяют 4 уровня пространственной организации белков. Под
первичной структурой белка понимают последовательность
расположения аминокислотных остатков в одной или нескольких
полипептидных цепях, составляющих молекулу белка.
Первым белком, у которого была выявлена аминокислотная
последовательность, стал гормон инсулин. Исследования
проводились в Кембриджском университете Ф.Сэнгером с 1944 по
1954 год.
Было выявлено, что молекула инсулина состоит из двух
полипептидных цепей (21 и 30 аминокислотных остатков),
удерживаемых около друг друга дисульфидными мостиками. За свой
кропотливый труд Ф.Сэнгер был удостоен Нобелевской премии.
10.
Структуры белковых молекулВ организме человека обнаружено порядка 10 тыс. различных белков.
Имея всего лишь 20 аминокислот, можно составить из них огромное
количество самых разнообразных комбинаций. Так, если молекула
белка состоит всего из 10 аминокислотных остатков, то число
теоретически возможных вариантов белковых молекул, отличающихся
порядком чередования аминокислот, — 2010. Белки же, выделенные из
живых организмов, образованы сотнями, а иногда и тысячами
аминокислотных остатков.
Первичная структура белковой молекулы определяет свойства
молекул белка и ее пространственную конфигурацию. Замена всего
лишь одной аминокислоты на другую в полипептидной цепочке может
привести к изменению свойств и функций белка.
Лишь незначительное количество белков имеет строго линейную
структуру. Основная масса белков подвергается дальнейшей укладке,
что приводит к образованию вторичной структуры белковой
молекулы.
11.
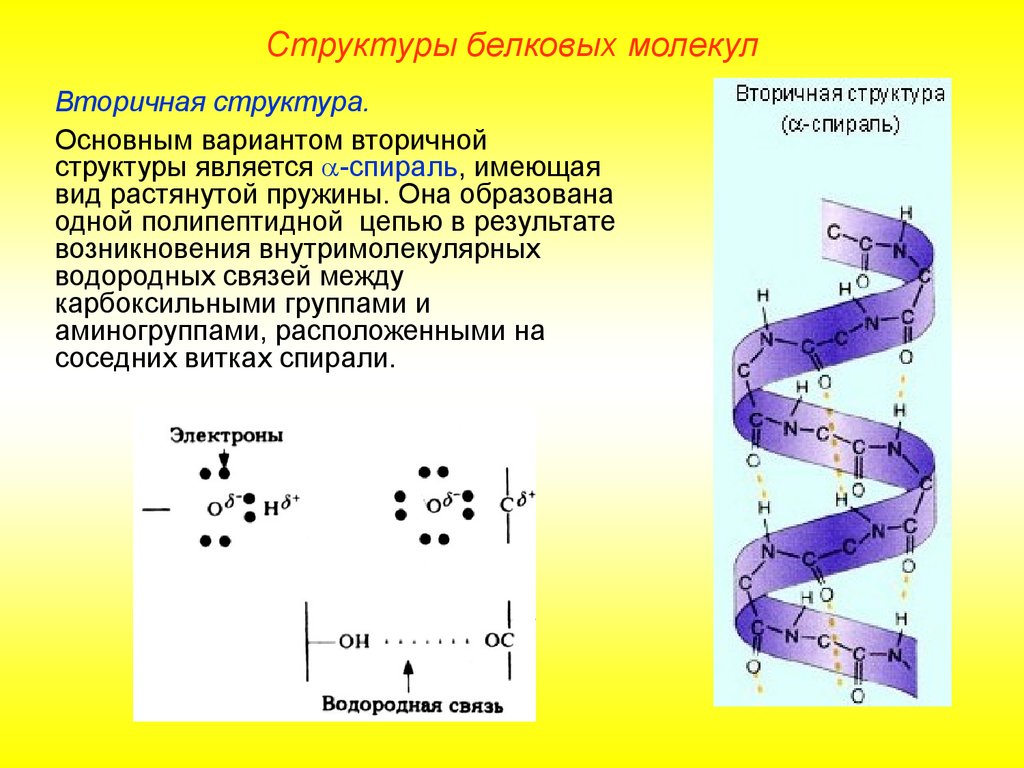
Структуры белковых молекулВторичная структура.
Основным вариантом вторичной
структуры является -спираль, имеющая
вид растянутой пружины. Она образована
одной полипептидной цепью в результате
возникновения внутримолекулярных
водородных связей между
карбоксильными группами и
аминогруппами, расположенными на
соседних витках спирали.
12.
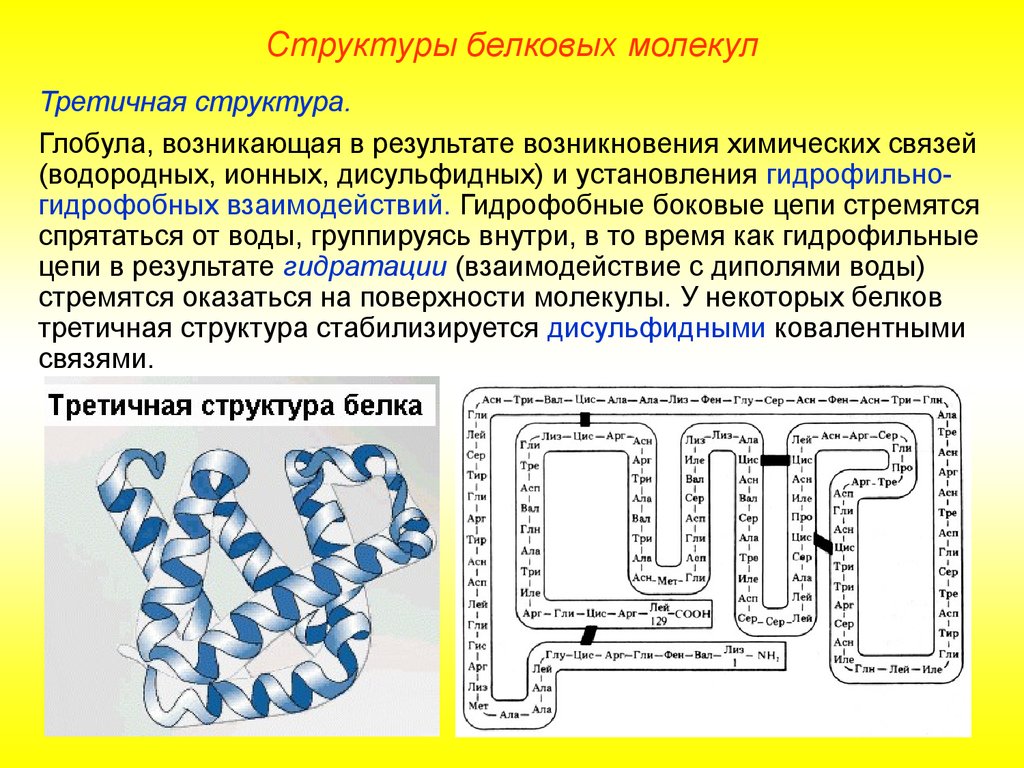
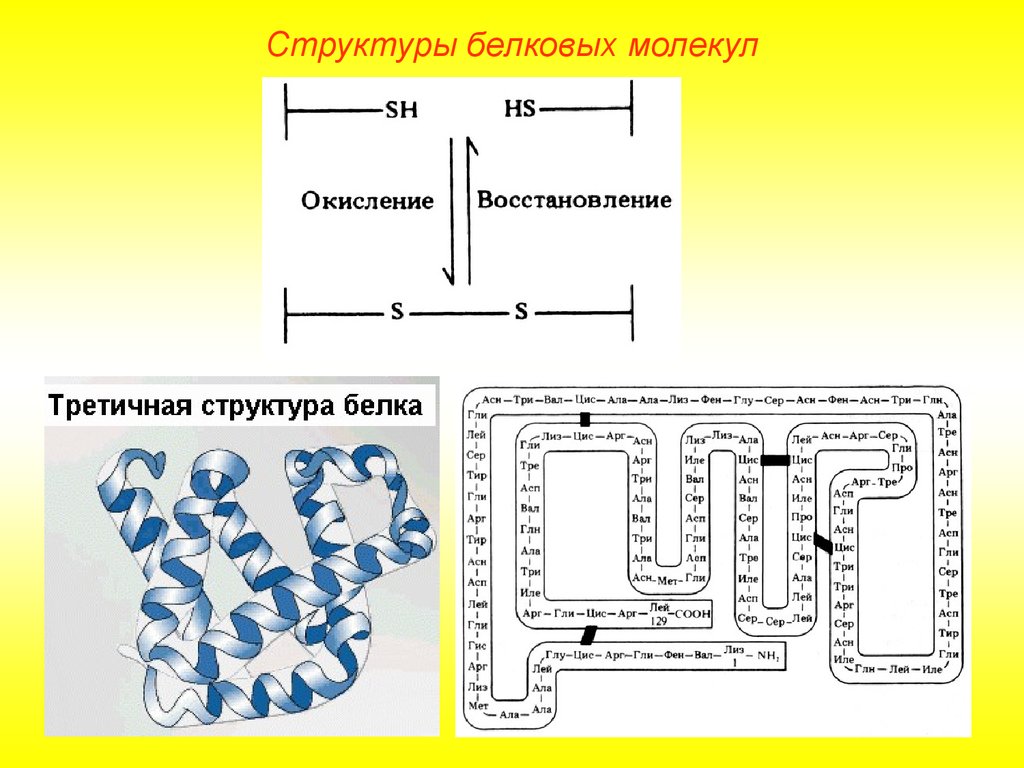
Структуры белковых молекулТретичная структура.
Глобула, возникающая в результате возникновения химических связей
(водородных, ионных, дисульфидных) и установления гидрофильногидрофобных взаимодействий. Гидрофобные боковые цепи стремятся
спрятаться от воды, группируясь внутри, в то время как гидрофильные
цепи в результате гидратации (взаимодействие с диполями воды)
стремятся оказаться на поверхности молекулы. У некоторых белков
третичная структура стабилизируется дисульфидными ковалентными
связями.
13.
Структуры белковых молекул14.
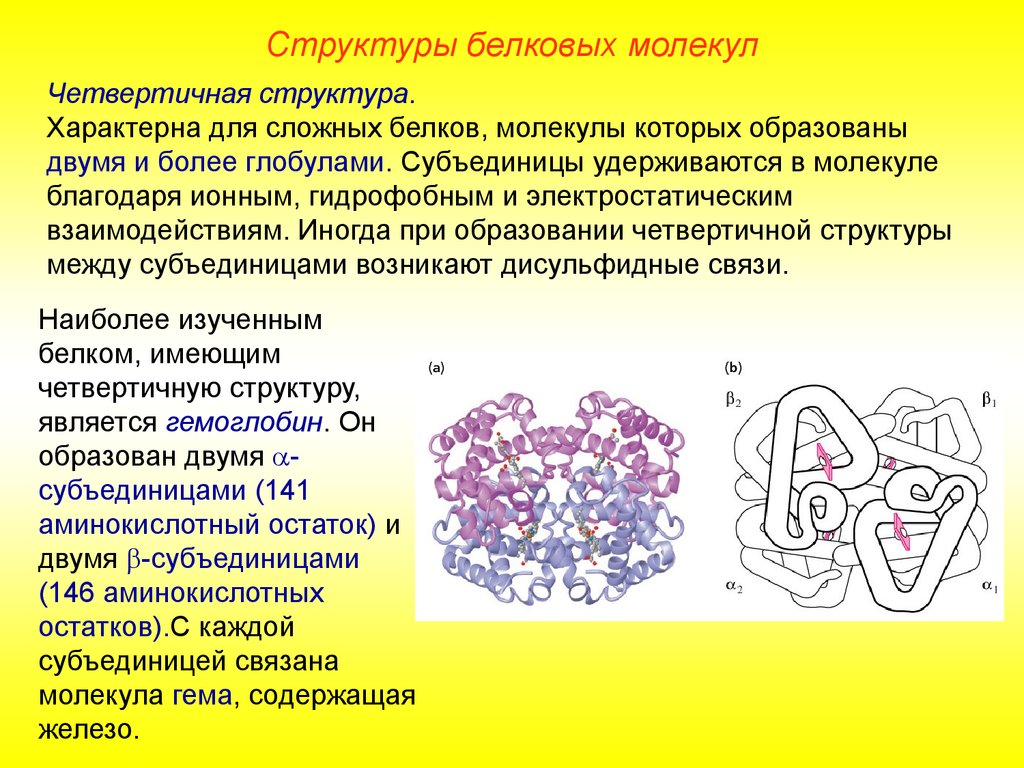
Структуры белковых молекулЧетвертичная структура.
Характерна для сложных белков, молекулы которых образованы
двумя и более глобулами. Субъединицы удерживаются в молекуле
благодаря ионным, гидрофобным и электростатическим
взаимодействиям. Иногда при образовании четвертичной структуры
между субъединицами возникают дисульфидные связи.
Наиболее изученным
белком, имеющим
четвертичную структуру,
является гемоглобин. Он
образован двумя субъединицами (141
аминокислотный остаток) и
двумя -субъединицами
(146 аминокислотных
остатков).С каждой
субъединицей связана
молекула гема, содержащая
железо.
15.
Структуры белковых молекул16.
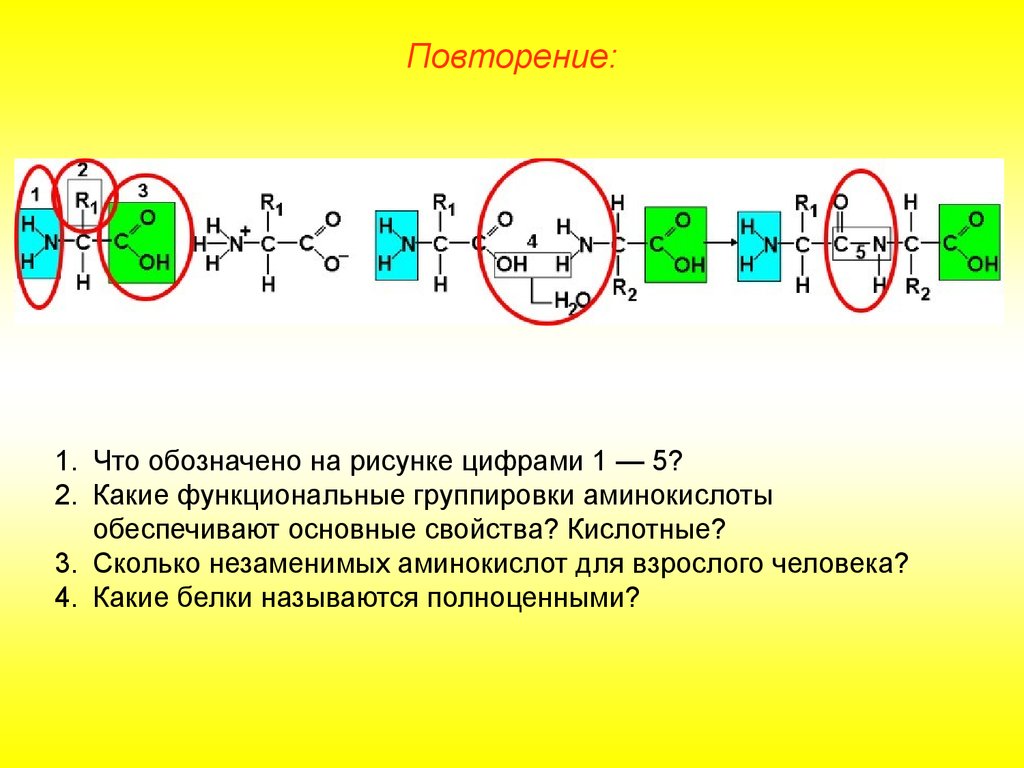
Повторение:1. Что обозначено на рисунке цифрами 1 — 5?
2. Какие функциональные группировки аминокислоты
обеспечивают основные свойства? Кислотные?
3. Сколько незаменимых аминокислот для взрослого человека?
4. Какие белки называются полноценными?
17.
Повторение:Тест 1. На первом месте по массе из органических веществ в
клетке находятся:
1. Углеводы.
2. Белки.
3. Липиды.
4. Нуклеиновые кислоты.
**Тест 2. В состав простых белков входят следующие элементы:
1. Углерод.
5. Фосфор.
2. Водород.
6. Азот.
3. Кислород.
7. Железо.
4. Сера.
8. Хлор.
Тест 3. Количество различных стандартных аминокислот,
встречающихся в белках:
1. 170.
2. 26.
3. 20.
4. 10.
18.
Повторение:**Тест 4. Количество незаменимых для человека аминокислот:
1. Таких аминокислот нет.
2. 20.
3. 10.
4. 7.
**Тест 5. Неполноценные белки — белки:
1. В которых отсутствуют некоторые аминокислоты.
2. В которых отсутствуют некоторые незаменимые аминокислоты.
3. В которых отсутствуют некоторые заменимые аминокислоты.
4. Все известные белки являются полноценными.
Тест 6. Придают аминокислотам свойства:
1. Кислые — радикал, щелочные — аминогруппа.
2. Кислые — аминогруппа, щелочные — радикал.
3. Кислые — карбоксильная группа, — щелочные — радикал.
4. Кислые — карбоксильная группа, щелочные — аминогруппа.
19.
Повторение:Тест 7. Пептидная связь образуется в результате:
1. Реакции гидролиза.
2. Реакции гидратации.
3. Реакции конденсации.
4. Все выше перечисленные реакции могут привести к образованию
пептидной связи.
Тест 8. Пептидная связь образуется:
1. Между карбоксильными группами соседних аминокислот.
2. Между аминогруппами соседних аминокислот.
3. Между аминогруппой одной аминокислоты и радикалом другой.
4. Между аминогруппой одной аминокислоты и карбоксильной группой
другой.
**Тест 9. Вторичную структуру белков стабилизируют:
1. Ковалентные.
2. Водородные.
3. Ионные.
4. Такие связи отсутствуют.
20.
Повторение:**Тест 10. Третичную структуру белков стабилизируют:
1. Ковалентные.
2. Водородные.
3. Ионные.
4. Гидрофильно-гидрофобное взаимодействие.
5. Все выше перечисленные виды связей.










 Биология
Биология








