Похожие презентации:
Неорганические и органические кислоты
1. ОБЩАЯ ХИМИЯ 11 КЛАСС
РАЗДЕЛ«ВЕЩЕСТВА И ИХ СВОЙСТВА»
2. СЛОЖНЫЕ ВЕЩЕСТВА:
ОКСИДЫОСНОВАНИЯ
КИСЛОТЫ
АМФОТЕРНЫЕ ГИДРОКСИДЫ
СОЛИ
3.
4. Карбоновые кислоты
Химическаяформула
Систематическое
название
Тривиальное
название
НСООН
метановая
СН3СООН
НООС-СООН
этановая
этандиовая
муравьина
я
уксусная
щавелевая
5. ЗНАЧЕНИЕ КИСЛОТ В ЖИЗНИ ЧЕЛОВЕКА
Пищевкусовые добавкиКонсервирование
Производство
лекарственных средств,
красителей, полимеров,
взрывчатых веществ, удобрений,
пищевых продуктов.
6. ТЕМА УРОКА: КИСЛОТЫ
ЦЕЛЬ:СИСТЕМАТИЗИРОВАТЬ И ОБОБЩИТЬ ЗНАНИЯ О
НЕОРГАНИЧЕСКИХ И ОРГАНИЧЕСКИХ КИСЛОТАХ
ЗАДАЧИ:
УГЛУБИТЬ ЗНАНИЯ О НОМЕНКЛАТУРЕ И
ПРИНЦИПАХ КЛАССИФИКАЦИИ КИСЛОТ
РАССМОТРЕТЬ ЗАВИСИМОСТЬ ИЗМЕНЕНИЯ
СВОЙСТВ КИСЛОТ ОТ СОСТАВА ИХ МОЛЕКУЛ
ОБОБЩИТЬ ЗНАНИЯ ОБ ОБЩИХ ХИМИЧЕСКИХ
СВОЙСТВАХ КИСЛОТ
РАЗВИВАТЬ УМЕНИЯ НАПИСАНИЯ УРАВНЕНИЙ
ХИМИЧЕСКИХ РЕАКЦИЙ С УЧАСТИЕМ КИСЛОТ
РАССМОТРЕТЬ НАХОЖДЕНИЕ КИСЛОТ В ПРИРОДЕ
ИХ РОЛЬ В ЖИЗНИ ЧЕЛОВЕКА
7.
Кислоты – это соединения,состоящие из кислотных остатков
и атомов водорода,
способных замещаться атомами
металлов
с образованием солей.
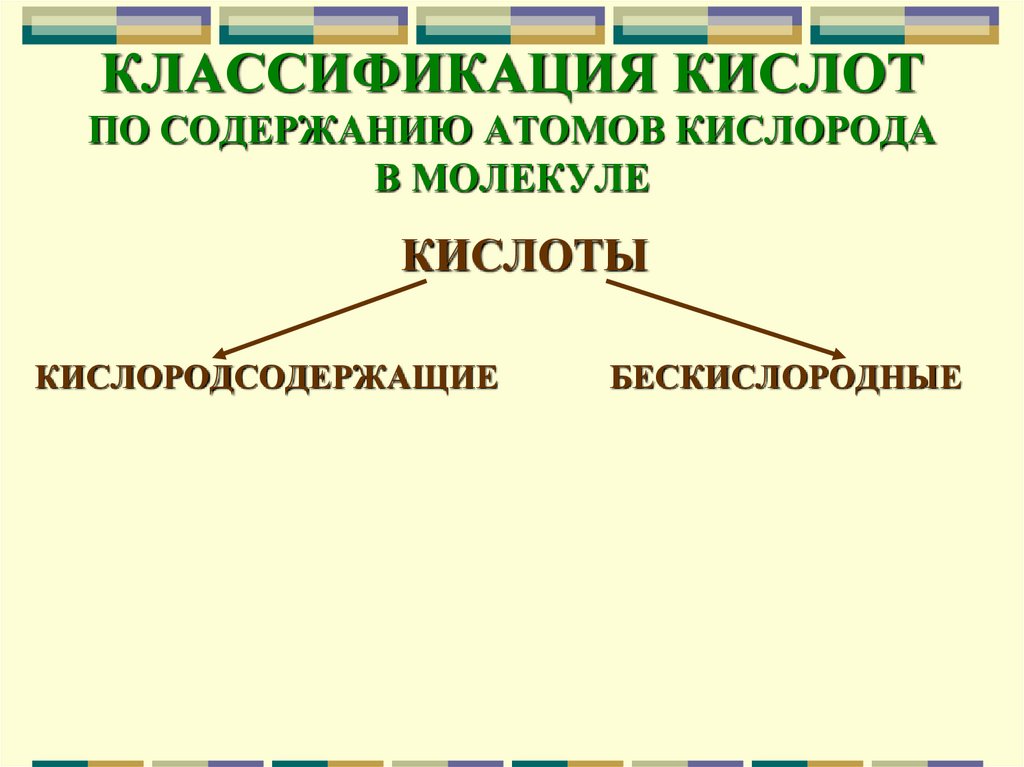
8. КЛАССИФИКАЦИЯ КИСЛОТ ПО СОДЕРЖАНИЮ АТОМОВ КИСЛОРОДА В МОЛЕКУЛЕ
КИСЛОТЫКИСЛОРОДСОДЕРЖАЩИЕ
БЕСКИСЛОРОДНЫЕ
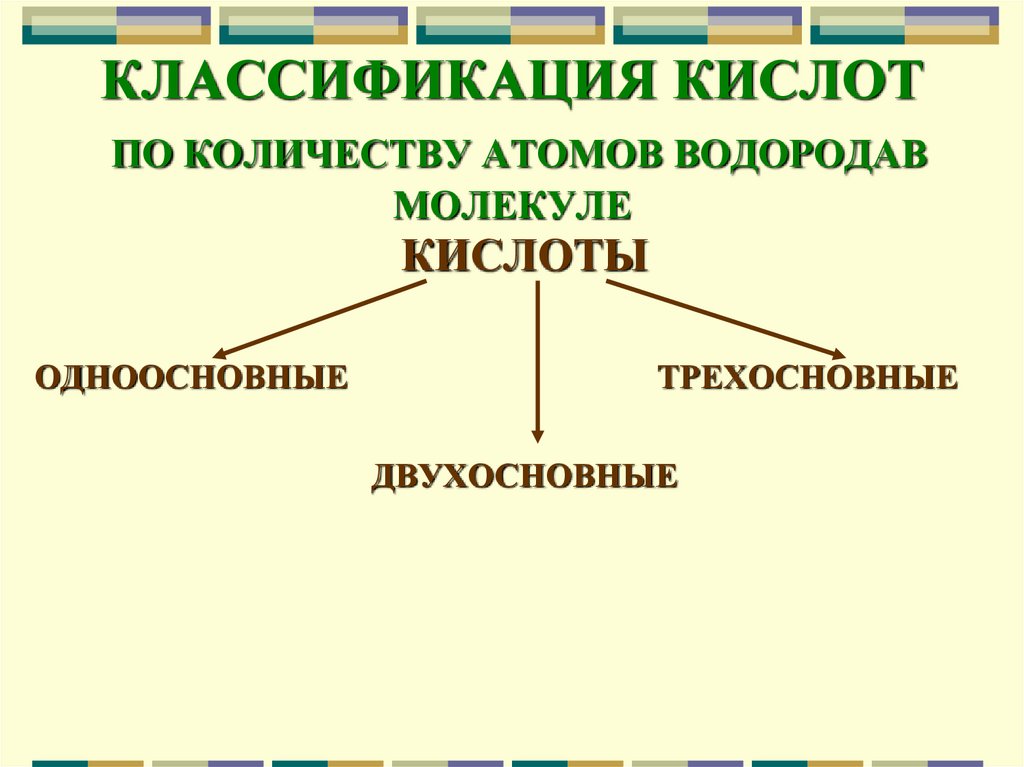
9. КЛАССИФИКАЦИЯ КИСЛОТ ПО КОЛИЧЕСТВУ АТОМОВ ВОДОРОДАВ МОЛЕКУЛЕ
КИСЛОТЫОДНООСНОВНЫЕ
ТРЕХОСНОВНЫЕ
ДВУХОСНОВНЫЕ
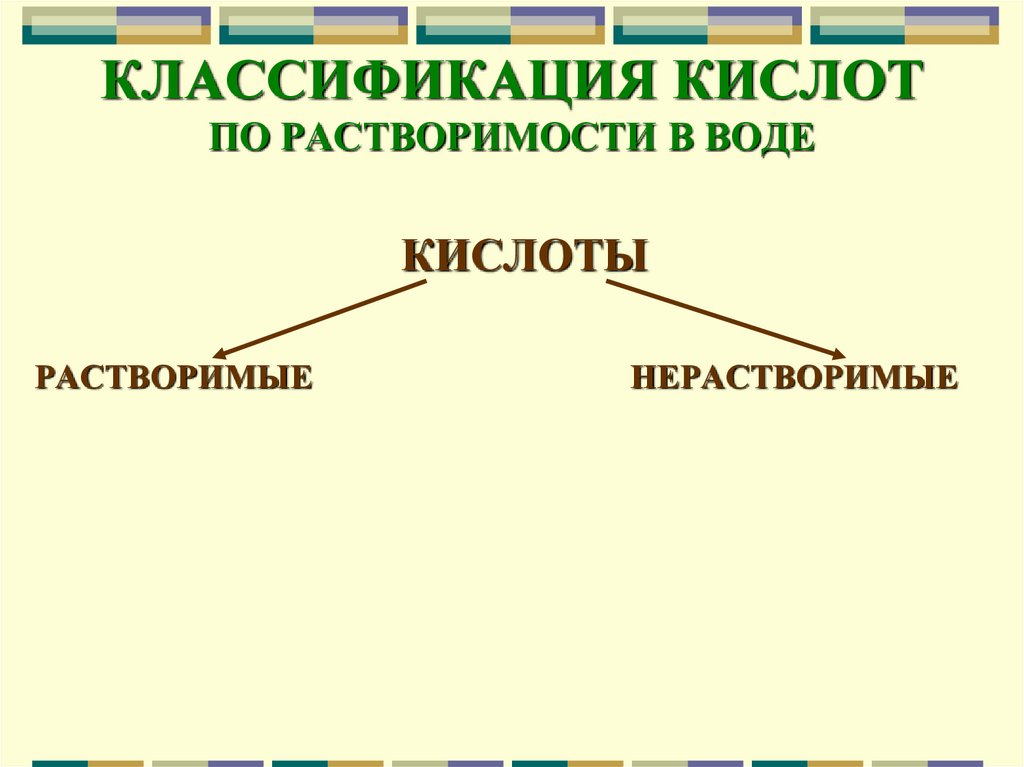
10. КЛАССИФИКАЦИЯ КИСЛОТ ПО РАСТВОРИМОСТИ В ВОДЕ
КИСЛОТЫРАСТВОРИМЫЕ
НЕРАСТВОРИМЫЕ
11. КЛАССИФИКАЦИЯ КИСЛОТ ПО ЛЕТУЧЕСТИ
КИСЛОТЫЛЕТУЧИЕ
НЕЛЕТУЧИЕ
12. КЛАССИФИКАЦИЯ КИСЛОТ ПО СТЕПЕНИ ДИССОЦИАЦИИ
КИСЛОТЫСИЛЬНЫЕ
СЛАБЫЕ
13. КЛАССИФИКАЦИЯ КИСЛОТ ПО СТАБИЛЬНОСТИ (УСТОЙЧИВОСТИ)
КИСЛОТЫСТАБИЛЬНЫЕ
НЕСТАБИЛЬНЫЕ
14. НОМЕНКЛАТУРА КИСЛОТ
Бескислородные кислоты:К названию кислотообразующего элемента
добавляют гласную «о» и слова «водородная
кислота»
H2S – сероводородная кислота
Кислородсодержащие кислоты:
К русскому названию кислотообразующего
элемента добавляют суффикс.
+5
Если элемент проявляет высшую СО – «-ная»: HNO3
+3
Если СО элемента ниже высшей – «-истая»: HNO2
15. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
ДИССОЦИАЦИЯ КИСЛОТКакие кислоты диссоциируют ступенчато?
Какова окраска лакмуса в растворах
кислот?
Наличием каких ионов обусловлена
окраска лакмуса?
Когда в повседневной жизни мы
встречаемся с процессом диссоциации
кислот?
16. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИИ ОСНОВНЫМИ ОКСИДАМИ
ВСЕ ЛИ МЕТАЛЛЫ РЕАГИРУЮТ С
КИСЛОТАМИ?
ПОЧЕМУ ХИМИЧЕСКАЯ РЕАКЦИЯ
АЛЮМИНИЯ С КИСЛОТОЙ НАЧИНАЕТСЯ
ТОЛЬКО ПОСЛЕ НАГРЕВАНИЯ?
МОЖНО ЛИ В АЛЮМИНИЕВОЙ ПОСУДЕ
ГОТОВИТЬ КИСЛЫЕ ЩИ?
МОЖНО ЛИ В ОЦИНКОВАННОМ ВЕДРЕ
ХРАНИТЬ ЯГОДУ, КВАСИТЬ КАПУСТУ?
17. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
ВЗАИМОДЕЙСТВИЕ КИСЛОТС ОСНОВАНИЯМИ
В ЧЕМ СУТЬ ВЗАИМОДЕЙСТВИЯ КИСЛОТ С
ОСНОВАНИЯМИ?
КАК НАЗЫВАЮТСЯ ДАННЫЕ РЕАКЦИИ?
ПОЧЕМУ?
КАК В ПОВСЕДНЕВНОЙ ЖИЗНИ МЫ
МОЖЕМ ИСПОЛЬЗОВАТЬ ДАННОЕ
СВОЙСТВО КИСЛОТ?
18. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
ВЗАИМОДЕЙСТВИЕ КИСЛОТС СОЛЯМИ
В ЧЕМ ОПАСНОСТЬ КИСЛОТНЫХ ДОЖДЕЙ
ДЛЯ АРХИТЕКТУРНЫХ ПАМЯТНИКОВ?
КОГДА В ПОВСЕДНЕВНОЙ ЖИЗНИ МЫ
ВСТРЕЧАЕМСЯ С РЕАКЦИЕЙ
ВЗАИМОДЕЙСТВИЯ ГИДРОКАРБОНАТА
НАТРИЯ С УКСУСНОЙ КИСЛОТОЙ?
ВСЕ ЛИ СОЛИ И КИСЛОТЫ БУДУТ
ВЗАИМОДЕЙСТВОВАТЬ МЕЖДУ СОБОЙ?
19. Кислотные свойства кислот, образованных элементами одного периода:
H3BO3 -H2CO3 - H2SO4
20. Кислотные свойства кислот, образованных элементами одной подгруппы:
H2SO4H2SeO3
H6TeO6
21. Кислотные свойства кислот, образованных элементом в различных СО:
+5+6
HNO3
H2SO4
+3
+4
HNO2
H2SO3
22. ОБЩИЕ СВОЙСТВА КИСЛОТ
Кислый вкусДействие на индикаторы
Электрическая проводимость
Химическое взаимодействие с
металлами, основными и
амфотерными оксидами,
основаниями, солями, спиртами
Диссоциация при растворении в воде.















 Химия
Химия








