Похожие презентации:
Основания
1.
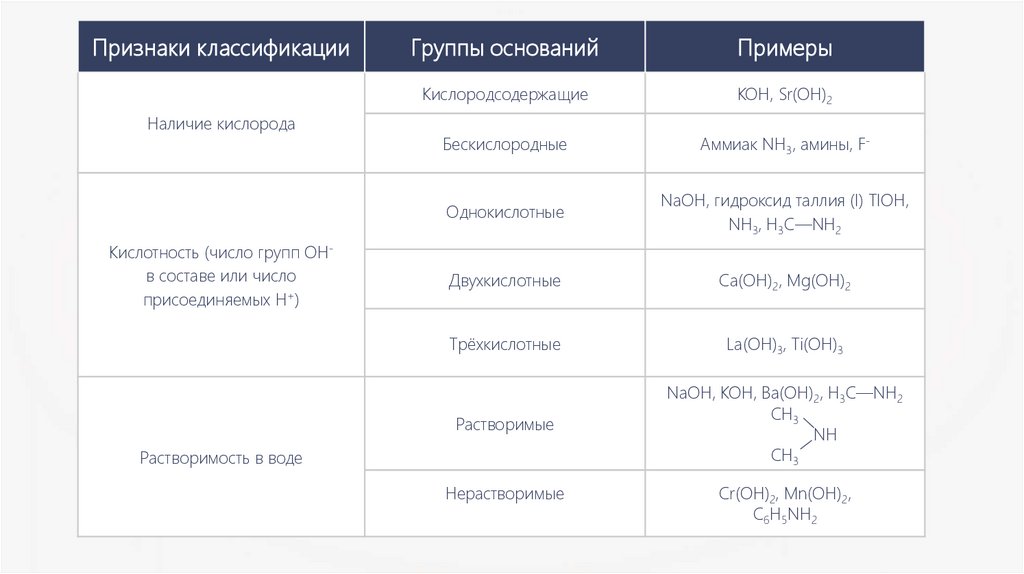
Признаки классификацииНаличие кислорода
Кислотность (число групп OHв составе или число
присоединяемых H+)
Группы оснований
Примеры
Кислородсодержащие
KOH, Sr(OH)2
Бескислородные
Аммиак NH3, амины, F-
Однокислотные
NaOH, гидроксид таллия (I) TIOH,
NH3, H3C—NH2
Двухкислотные
Ca(OH)2, Mg(OH)2
Трёхкислотные
La(OH)3, Ti(OH)3
Растворимые
NaOH, KOH, Ba(OH)2, H3C—NH2
CH3
NH
CH3
Растворимость в воде
Нерастворимые
Cr(OH)2, Mn(OH)2,
C6H5NH2
2.
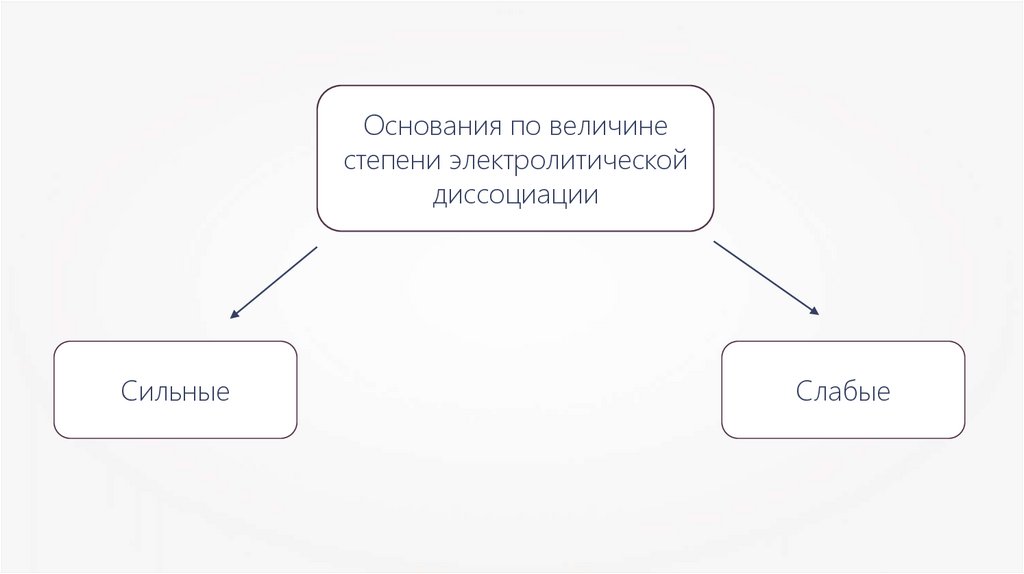
Основания по величинестепени электролитической
диссоциации
Сильные
Слабые
3.
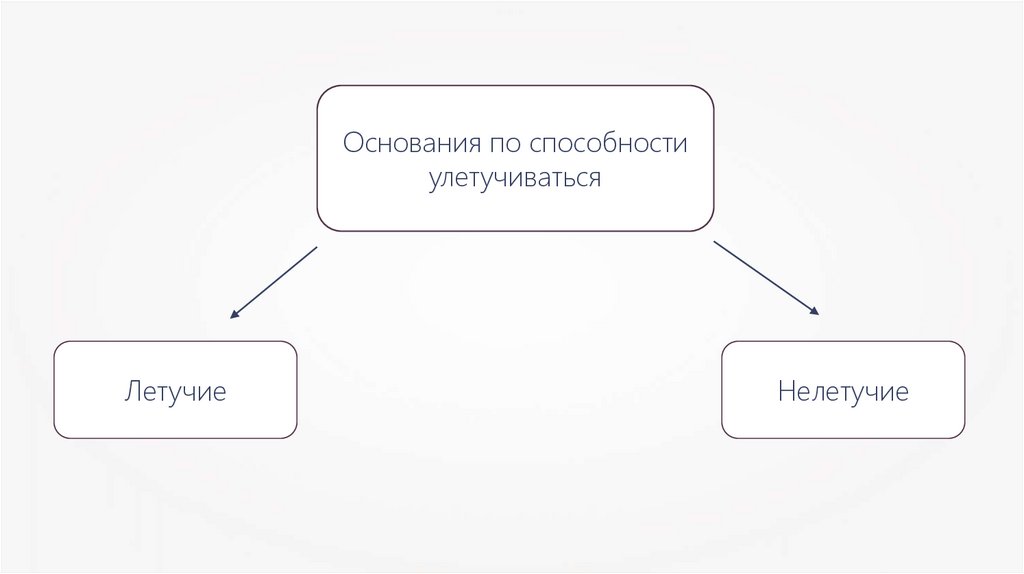
Основания по способностиулетучиваться
Летучие
Нелетучие
4.
Основания по стабильностиСтабильные
Нестабильные
5.
Работа со щелочами требуетсоблюдения мер безопасности
6.
Взаимодействие оснований с кислотамиПри взаимодействии гидроксида натрия с серной кислотой
образуются сульфат натрия и вода:
2NaOH + H2SO4 = Na2SO4 + 2H2O
При взаимодействии гидроксида кальция с уксусной кислотой
образуются ацетат кальция и вода:
CaCO3 + 2CH3COOH = (CH3COO)2Ca + H2O + CO2↑
7.
Взаимодействие оснований с кислотамиПри взаимодействии бескислородных оснований с кислотами
образуется только соль, например, при взаимодействии
аммиака с соляной кислотой образуется только хлорид
аммония:
NH3 + HCl = NH4Cl
При взаимодействии метиламина с соляной кислотой образуется
хлорид метиламмония:
C2H5NH2 + HCl → [CH3NH3]+Cl-
8.
Взаимодействие щелочей с кислотными оксидамиВзаимодействовать с кислотными оксидами могут только
растворимые основания, т.е. щёлочи. При взаимодействии
гидроксида натрия с оксидом серы (VI) образуются сульфат
натрия и вода:
2NaOH + SO3 = Na2SO4 + H2O
При взаимодействии гидроксида бария с оксидом углерода (IV)
образуются карбонат бария и вода:
Ba(OH)2 + CO2 = BaCO3 + H2O
9.
К взаимодействию с солямисклонны только щёлочи.
Причём в данном случае реакция
пойдёт, если в результате
образуется осадок, газ или
малодиссоциирующее вещество.
10.
Взаимодействие щелочей с солямиОбычно в результате взаимодействия между щёлочью и солью
образуются нерастворимое основание и соль, например, в
реакции между гидроксидом натрия и хлоридом меди образуются
нерастворимое основание гидроксид меди и соль хлорид натрия:
2NaOH + СuCl2 = 2NaCl + Cu(OH)2
В реакции между солью хлоридом аммония и щёлочью
гидроксидом калия образуются хлорид калия, вода и выделяется
аммиак:
NH4Cl + KOH = KCl + H2O + NH3↑
11.
Термическое разложение нерастворимых основанийНерастворимые основания подвергаются термическому
разложению, в результате которого образуются основный оксид и
вода. При нагревании гидроксида меди (II) происходит реакция
разложения в результате которой образуется оксид меди (II) и
вода.
Сu(OH)2 = CuO + H2O






 Химия
Химия