Похожие презентации:
Алканы. Свойства. Строение и применение
1.
Алканы. Свойства.Строение и применение
2.
Алканы – предельные или насыщенные углеводороды,в их молекулах все атомы углерода соединены
одинарной связью.
2·1 +2=4
1 атом углерода
СН4
2 · 2 + 2 = 6 2 атома углерода
С 2Н 6
2 · 3 + 2 = 8 3 атома углерода
С3Н8
CnH2n+2
n – число атомов
углерода
3.
Гомологический ряд – ряд веществ, расположенных впорядке возрастания относительных молекулярных
масс, сходных по строению
и свойствам,
Гомологический
ряд но
отличающихся друг от друга на одну или несколько групп
СН
СН2.2– гомологическая разность
Вещества такого ряда называют
гомологами.
4.
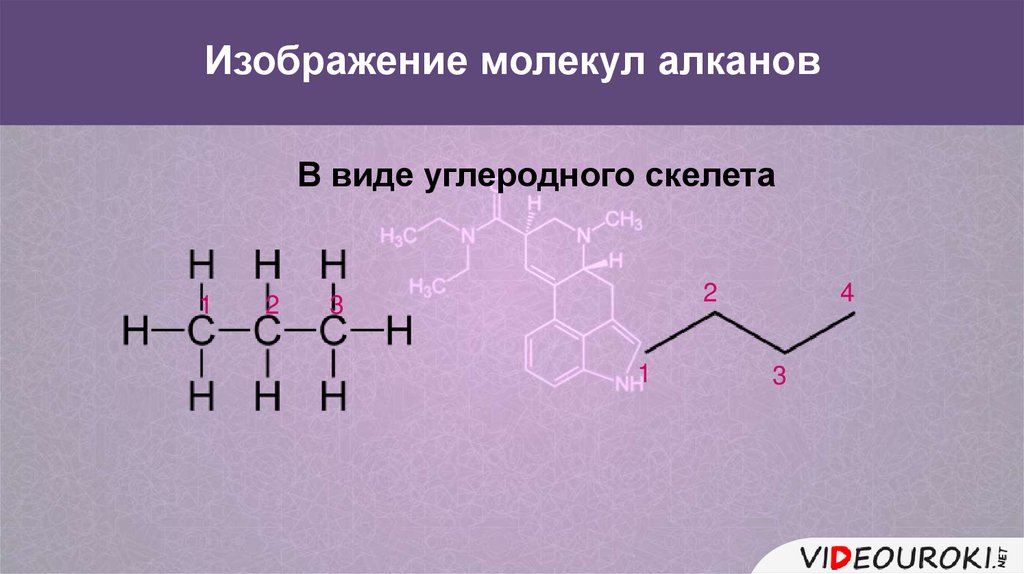
Изображение молекул алкановВ виде углеродного скелета
1
2
2
3
1
4
3
5.
Вращение атомов углерода6.
Строение молекулы метана109°
7.
Гомологический ряд алкановСН4– метан
С6Н14– гексан
С2Н6– этан
С7Н16– гептан
С3Н8– пропан
С8Н18– октан
С4Н10– бутан
С9Н20– нонан
С5Н12– пентан
С10Н22– декан
8.
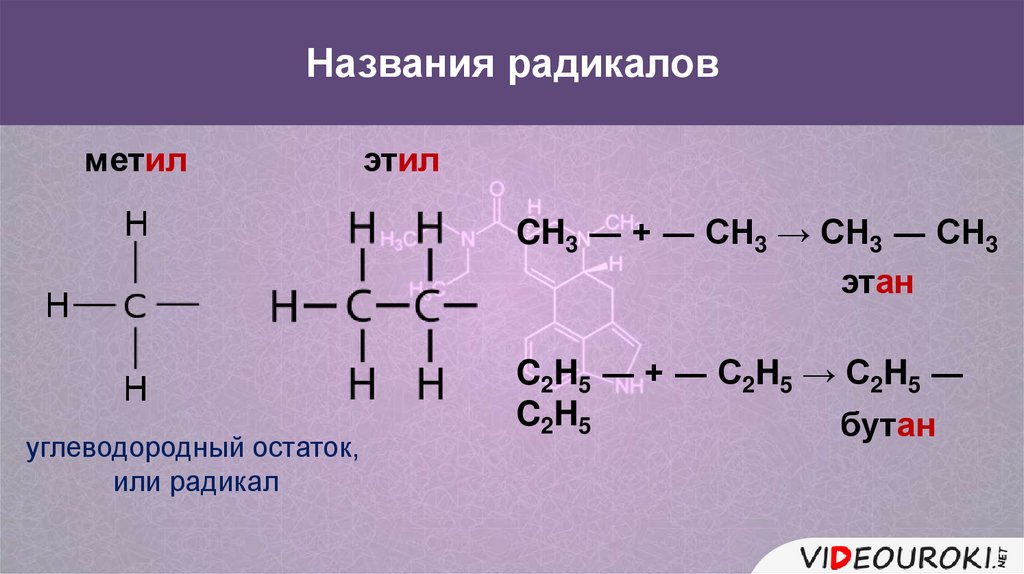
Названия радикаловметил
этил
CH3 ― + ― CH3 → CH3 ― CH3
этан
углеводородный остаток,
или радикал
C2H5 ― + ― C2H5 → C2H5 ―
C2H5
бутан
9.
Понятие об изомерахС4Н10 – бутан
Изомеры
10.
Понятие об изомерахИзомеры – вещества, которые имеют один и тот же
количественный и качественный состав, но разное
строение и свойства.
Явление существования изомеров называется изомерией.
Т кип. -0,5 0С
Т кип. -11,7 0С
11.
Физические свойства алкановНазвание
Температура Температура
плавления, 0С кипения, 0С
Формула
Свойства
СН4
газ
метан
-182
-162
С2Н6
газ
этан
-183
-89
С3Н8
газ
пропан
-42
С4Н10
газ
С5Н12
жидкость
бутан
пентан
-187
-138
С6Н14
жидкость
С7Н16
жидкость
гексан
гептан
-0,5
-130
-95
+36
-91
+98
+69
12.
Физические свойства алкановС1 ― С4 – газы; С5 ― С15 – жидкости; С16 и более –
твёрдые вещества.
Алканы не имеют цвета, жидкие алканы обладают
характерным запахом, твёрдые не имеют запаха.
Алканы малорастворимы в воде.
Метан, при обычных условиях – газ, не имеющий
запаха и цвета, он практически не растворяется в воде.
13.
Нахождение алкановнефть
СН4
Метан – болотный газ.
Метан – рудничный
газ.
СН4
природный газ
парафин
14.
Доказательство наличия углерода и водорода впарафине
2Н2 +
t
О2
= 2Н2О
15.
Доказательство наличия углерода и водорода впарафине
СО2 + Са(ОН)2 = СаСО3↓ + Н2О
16.
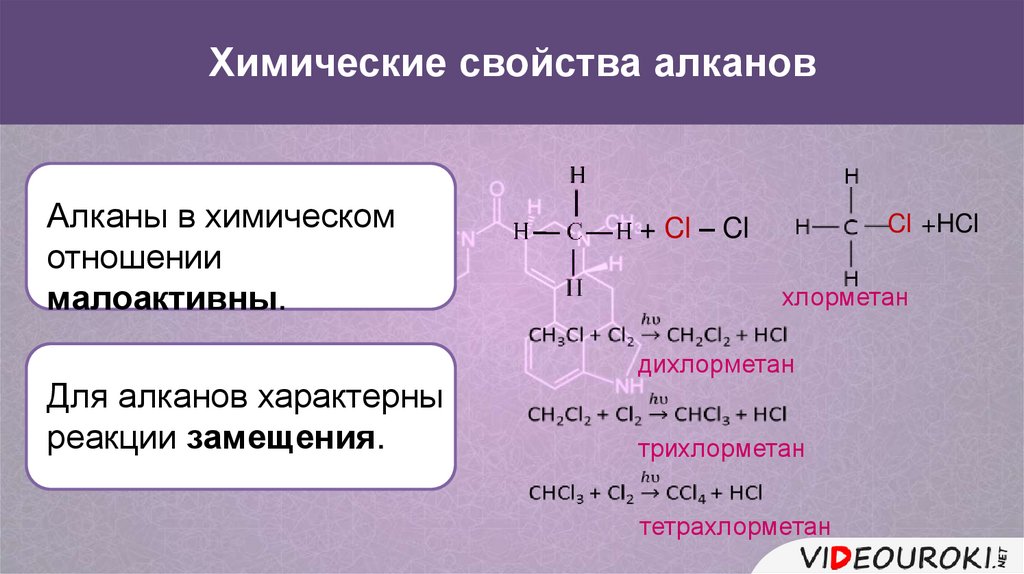
Химические свойства алкановАлканы в химическом
отношении
малоактивны.
Для алканов характерны
реакции замещения.
+ Cl – Cl
Cl +HCl
хлорметан
дихлорметан
трихлорметан
тетрахлорметан
17.
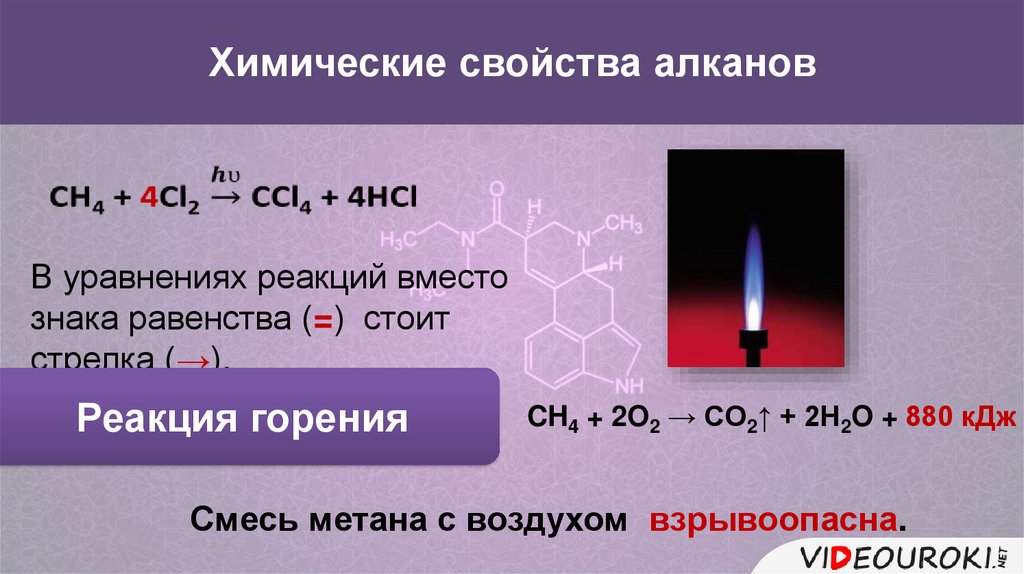
Химические свойства алкановВ уравнениях реакций вместо
знака равенства (=) стоит
стрелка (→).
Реакция горения
CH4 + 2O2 → CO2↑ + 2H2O + 880 кДж
Смесь метана с воздухом взрывоопасна.
18.
Химические свойства алкановРеакция расщепления
Реакция дегидрирования
Реакции дегидрирования – это реакции, в результате
которых от молекул органических соединений отщепляются
молекулы водорода.
19.
Применение алкановТекст
20.
ВыводыАлканы
– это углеводороды,
в составе
Ряд углеводородов,
соседниесодержащие
члены которого
молекул
только
одинарные
- С связи.
отличаются
на группу
СН -С, называют
2
гомологическим рядом, а члены ряда – гомологами.
Общая формула алканов CnH2n+2.
Гомологи имеют сходные химические свойства и
Молекула метана
имеет тетраэдрическое
закономерно
изменяющиеся
физические свойства.
строение.
Для метана характерны реакции замещения и
окисления.
















 Химия
Химия