Похожие презентации:
Классы неорганических веществ
1.
ХИМИЯЛекция 2.
Основные классы неорганических веществ.
2.
Классификация неорганических веществМеталлы: Na –натрий, K
– калий, Al – алюминий,
Cu – медь, Fe – железо,
Ag – серебро, Au – золото
Простые
Неметаллы: Н2 –водород,
В - бор, С - углерод, Si кремний, N2 - азот, Р4 фосфор, As – мышьяк
Вещества
Сложные
Многоатомные
соединения разных
элементов: H2O – вода,
H2SO4 – серная кислота,
СО2 – углекислый газ
3.
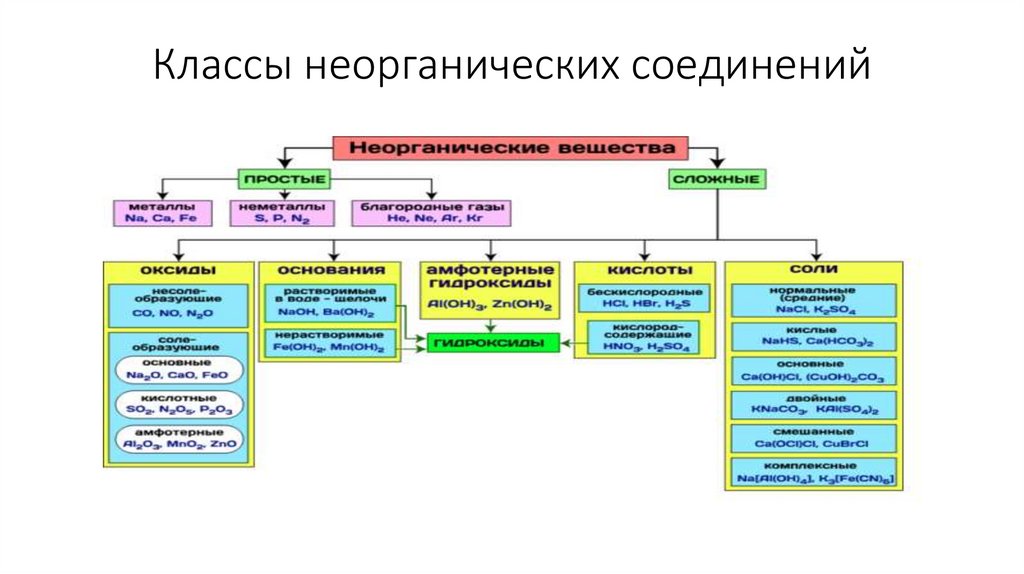
Классы неорганических соединений4.
ОксидыОксиды – сложные вещества, молекулы которых состоят из
атомов двух элементов, один из которых кислород.
Валентность кислорода в оксиде равна двум.
Название оксидов строится следующим образом: к слову
оксид добавляется название элемента с указанием его степени
окисления, если она не постоянна.
Например, СаО – оксид кальция, Fе2О3 – оксид железа (III),
FеО – оксид железа (II), NО2 – оксид азота (IV), NО – оксид азота (II).
5.
ОксидыОсновные оксиды: оксиды металлов +1, +2 (СuO, Ag2O, Fe2O3)
СаО + Н2О → Са(ОН)2 – образование основание
Кислотные оксиды: оксиды неметаллов,оксиды металлов > +5 (CO2,
SO3, NO2)
SО2 + Н2О → Н2SО3 – образование кислоты
Амфотерные оксиды:оксиды металлов +2, +3, +4 (BeO, ZnO, Cr2O3)
ZnО + 2НСl → ZnСl2 + Н2О – реагируют с кислотами
ZnО + 2NаОН → Nа2ZnО2 + Н2О - реагируют с основаниями
6.
СВЯЗЬ ХАРАКТЕРА ОКСИДА С ПОЛОЖЕНИЕМ ЭЛЕМЕНТА В ПЕРИОДИЧЕСКОЙТАБЛИЦЕ МЕНДЕЛЕЕВА
7.
ДРУГИЕ КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ• ПЕРОКСИДЫ – О22-, например К2О2, Н2О2, СаО2, ВаО2
Пероксиды сильные окислители, но могут быть и восстановителями
3%-ный раствор Н2О2 – перекись водорода
30%-ный раствор Н2О2 - пергидроль
• НАДПЕРОКСИДЫ (СУПЕРОКСИДЫ) – О21-, например КО2, NaO2, CsO2
• ОЗОНИДЫ – О31- , например КО3, RbO3, CsO3
Надпероксиды и озониды сильные окислители
8.
ОснованияОснования – сложные вещества, при диссоциации которых в
качестве анионов образуются гидроксид-ионы ОН-. Названия оснований
составляют из слова гидроксид и названия соответствующего катиона с
указанием его степени окисления, если она переменна. Например, NН4ОН
– гидроксид аммония, Fе(ОН)2 – гидроксид железа (II), Fе(ОН)3 – гидроксид
железа (III).
9.
Классификация основанийОснования (гидроксиды)
KtOH Kt+ + OH-
По количеству ОНгрупп (по кислотности)
Однокислотные
NaOH, KOH, CsOH, LiOH,
NH4OH
Многокислотные
Mg(OH)2, Al(OH)3, Fe(OH)3,
Pb(OH)2
По растворимости в воде
Растворимые щелочи NaOH,
CsOH, KOH,
Ba(OH)2, Sr(OH)2
Нерастворимые в
воде основания
Cu(OH)2, Be(OH)2,
Al(OH)3
10.
Разделение оснований по количеству гидроксогруппПо кислотности (количеству гидроксогрупп) основания
бывают:
однокислотные (NаОН и др.);
поликислотные (двухкислотное Мg(ОН)2, трехкислотное Аl(ОН)3 и
т.д.).
11.
Разделение оснований по растворимостиПо растворимости различают:
• растворимые в воде основания или щелочи, образуемые
щелочными и щелочно-земельными металлами (NаОН, КОН,
RbОН, СsОН, Sr(ОН)2 и Ва(ОН)2),
• нерастворимые в воде основания (Сu(ОН)2, Ве(ОН)2 и др.).
12.
ЩелочиКристаллы щелочей при растворении в воде полностью
диссоциируют, то есть распадаются на положительно заряженные ионы
металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются
положительно заряженные ионы натрия и отрицательно заряженные
гидроксид-ионы:
NaOH→Na+ + OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим
уравнением:
Ca(OH)2→Ca2+ + 2OH−.
13.
Щелочи- изменение окраски индикатора в растворах щелочейФактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся
в растворе любой щёлочи. При этом протекает химическая реакция с
образованием нового продукта, признаком протекания которой является
изменение окраски вещества.
Индикатор
Изменение окраски индикатора
Фиолетовый лакмус становится синим
Лакмус
Беcцветный фенолфталеин становится
малиновым
Фенолфталеин
Универсальный
индикатор
Универсальный индикатор становится
синим
14.
Свойства основанийВсе основания взаимодействуют с растворами кислот,
образуя соли:
• Fе(ОН)2 + 2НСl → FеСl2 + 2Н2О
Амфотерные основания взаимодействуют с растворами как
кислот, так и щелочей:
• Ве(ОН)2 + 2НСl → ВеСl2 + 2Н2О
• Ве(ОН)2 + 2КОН → К2ВеО2 + 2Н2О
15.
КислотыКислоты - сложные вещества, при диссоциации которых в
качестве катионов образуются ионы водорода Н+.
Например, при диссоциации серной кислоты образуется 2
иона водорода и отрицательно заряженный кислотный остаток
сульфат-ион: Н2SО4 → 2Н+ + SО42Диссоциация азотной кислоты идет по схеме: НNО3 → Н+ + NО3Диссоциация соляной кислоты по схеме: НCl → Н+ + Cl-
16.
Классификация кислотОдноосновные
НСl, HNO2, HClO4
По количеству
протонов H+
Многоосновные
H2SO4, H3PO4, H2S
Кислоты
HAn H+ + An-
Бескислородные
HBr, HI, HCN
По содержанию
кислорода
Кислородсодержащие
HNO3, HClO, H2CO3
17.
Разделение кислот по количеству ионов водородаПо основности (количеству ионов водорода) кислоты
различают на:
- одноосновные (НВr, HCl, HF, HNO3 );
- полиосновные (двухосновная Н2S, Н2SO4, H2CO3; трехосновная
Н3РО4 и т.д.).
18.
КислотыПо содержанию кислорода кислоты бывают:
- бескислородные (НСl, НСN, HF, H2S и др.);
- кислородсодержащие (НNО2, Н2SО3 H3PO4 и др.).
19.
20.
Кислотность средыИндикатор
Интервал рН
Цвет индикатора
перехода
Кислая, рН 7 Нейтральная, Щелочная,
окраски
рН=7
рН 7
Лакмус
5-8
красный
фиолетовый синий
Метиловый
оранжевый
3,1 – 4,4
розовый
оранжевый
Фенолфталеин 8,3 – 10,0
желтый
бесцветный бесцветный малиновый
21.
СолиСоли – сложные вещества, при диссоциации которых
образуются катионы металлов (или аммония NН4+) и анионы
кислотных остатков.
22.
Классификация солей23.
Средние солиСредние соли – продукты полного замещения ионов водорода в
кислоте ионами металлов (или аммония) или продукты полного
замещения гидроксогрупп основания кислотными остатками:
• Fе(ОН)2 + Н2SО4 → FеSО4 + 2Н2О
Названия средних солей составляют из названия аниона в
именительном падеже и названия катиона в родительном падеже
с указанием валентности, если она переменна. Например, КNО3 –
нитрат калия, FеSО4 – сульфат железа (II).
Диссоциация средних солей описывается уравнением:
• FеSО4 ↔ Fе2+ + SО42-;
24.
Кислые солиКислые соли – продукты неполного замещения ионов водорода
полиосновных кислот ионами металлов (или аммония):
• 2КОН + Н3РО4 → К2НРО4 + 2Н2О
Названия кислых солей составляют из названия аниона в
именительном падеже с добавлением приставки гидро- и, при
необходимости, соответствующего числительного, а также
названия катиона в родительном падеже с указанием валентности,
если она переменна. Например, К2НРО4 – гидроортофосфат калия,
КН2РО4 – дигидроортофосфат калия.
Уравнение диссоциации кислых солей:
• К2НРО4 ↔ 2К+ + НРО4-;
25.
Основные солиОсновные соли – продукты неполного замещения
гидроксогрупп поликислотных оснований кислотными остатками:
• Fе(ОН)3 + НNО3 → Fе(ОН)2NО3 + Н2О
Названия основных солей составляют из названия аниона в
именительном падеже и названия катиона в родительном падеже
с указанием валентности, если она переменна, с добавлением
приставки гидроксо- и, при необходимости, соответствующего
числительного. Например, Fе(ОН)2NО3 – нитрат дигидроксожелеза
(III), МgОНСl – хлорид гидроксомагния. Уравнение диссоциации
основных солей:
• Fе(ОН)2NО3 ↔ (Fе(ОН)2)+ + NО3-;
26.
Смешанные солиСмешанные соли – образованы двумя металлами и одним
кислотным остатком.
Например, KA1(SO4)2 – сульфат алюминия-калия.
27.
Двойные солиДвойные соли – образованы одним металлом и двумя
кислотными остатками.
Например, CaClOCl – хлоридгипохлорит кальция.
28.
29.
КристаллогидратыСреди солей существует очень много кристаллогидратов. Это
кристаллические соединения, содержащие воду. У этих
соединений определенный состав, вода входит в кристаллическую
структуру соли. Она легко отделяется от молекулы соли при
нагревании или растворении соли в воде.
Пример кристаллогидратов:
Na2CO3. 10 H2O – кристаллогидрат карбоната натрия – сода;
Na2B4O7. 10 H2O – кристаллогидрат тетрабората натрия – бура;
CuSO4 .5 H2O – кристаллогидрат сульфата меди -медный купорос.
30.
Примерные вопросы тестов1. Из предложенного ряда оксидов выбрать кислотные.
2. Из предложенных веществ выбрать то, которое при
растворении образует кислоту.
3. Из предложенного ряда выбрать кислую соль.
4. Из предложенного ряда выбрать амфотерный оксид.
5. Дана формула соли- назвать соль по международной
номенклатуре.
6. Из предложенных оксидов выбрать основной.
7. Общий признак кислот.
31.
ГЕНЕТИЧЕСКАЯ СВЯЗЬ ОСНОВНЫХ КЛАССОВ СОЕДИНЕНИЙОксиды
Кислотные
Кислотные
Основные
Основные
Амфотерные
Амфотерные
Основания
Трехкислотные
Двухкислотные
Однокислотные
Соли
Основные
Одноосновные
Средние
Двухосновные
Кислые
Трехосновные
Кислоты
32.
33.
Некоторые свойства неорганических веществНеметалл
Кислотный оксид
Кислота
Металл
Основный оксид
Основание
Соль
Zn + Сl2 →
CuO + H2 →
2КОН + Сl2 →
2КВr + Сl2 →
ZnСl2
Cu + H2O
КСl + КСlО + Н2О
2КСl + Вr2
---
СаО + SiО2 → СаSiО3 Ва(ОН)2 + СО2 → ВаСО3 СаСО3 + SiO2 → CaSiO3
Zn + 2НСl → ZnСl2 + Н2 СаО + 2НСl → СаСl2 +
Н2О
Соль
Zn + СuСl2 → ZnСl2 +
Сu
---
+ Н2О
+ CO2
КОН + НСl →
АgNО3 + НСl → АgСl +
КСl + Н2О
НNО3
ZnСl2 + КОН → Zn(ОН)2 СаСl2 + Н2SО4 → СаSО4
+ 2КСl
+ 2НСl
34.
Пример задач на практическом занятииНапишите уравнения реакций, характеризующие следующие
превращения:
(1)
( 2)
Ca
Ca(OH)2
Ca
CaCl2
( 3)
( 4)
Ca CaCO3
Ca CaO
(1)
Al
AlCl3
( 3)
Al Al2O3
( 2)
Al
Al(OH)3
( 4)
Al Al2(SO4)3
(1)
NaOH
NaAlO2
( 3)
NaOH Na2SO4
( 2)
NaOH
Na2CO3
( 4)
NaOH NaH2PO4
(1)
Zn(OH)2
Zn(NO3)2
( 3)
Zn(OH)2 ZnSO4
( 2)
Zn(OH)2
ZnO
( 4)
Zn(OH)2 K2ZnO2
(1)
FeCl2
Fe(OH)2
( 3)
FeSO4 Fe
( 2)
Fe(OH)2
FeSO4
( 4)
FeCl2.
Fe
35.
36.
Взаимодействие кислот с металламиКислоты взаимодействуют с металлами, стоящими в ряду активности
металлов левее водорода. В результате реакции образуется соль и выделяется
водород.
Например, при взаимодействии магния с соляной кислотой образуется хлорид
магния и выделяется водород:
Mg+2HCl→MgCl2+H2↑.
Эта реакция относится к реакциям замещения.
Необходимо отметить, что азотная кислота и концентрированная
серная кислота с металлами взаимодействуют иначе (соль образуется, но
водород при этом не выделяется).
37.
Окисление химических элементовОкисление щелочных металлов
4Li + О2 = 2Li2O оксид лития
2Na + О2 = Na2О2 пероксид натрия
К + О2 = КО2 супероксид калия
Окисление всех металлов, кроме Au, Pt
Me + О2 = МеxOy оксиды
Окисление неметаллов, кроме галогенов и благородных газов
N2 +О2 = 2NO - Q
S + О2 = SО2;
C + О2 = CО2;
4Р + 5О2 = 2Р2О5
Si + О2 = SiО2
38.
39.
Взаимодействие основных оксидов с водой40.
Взаимодействие кислотных оксидов с водой41.
Взаимодействие кислот с основными оксидами42.
Некоторые свойства оксидов43.
Способы получения солей44.
Химический эквивалентХимический эквивалент Э, моль – это количество вещества,
которое может замещать, присоединять, высвобождать или быть
эквивалентно одному молю одновалентных ионов в кислотно-
основных, ионообменных реакциях или одному электрону в
окислительно-восстановительных реакциях.
45.
Химический эквивалент веществаЧисло эквивалентов
Реакция
A+B
NaOH + НСl = NaCl + H2O
MnO4- + 8H++ 5̅̄e=Mn2++4H2O
СuCl2 +Na2S=CuS+2NaCl
S + H2=H2S
nэкв= m/MЭ Фактор эквивалентности f = 1/а
Химический
эквивалент вещества
A, моль
Фактор эквивалентности, f
МЭ, г/моль
= М


























































 Химия
Химия








