Похожие презентации:
Язык естествознания. Химия
1.
Язык естествознания: химия2.
• Тривиальные названия веществ (купоросноемасло — серная кислота,
негашеная известь- оксид кальция)
• Рациональная номенклатура для
неорганический веществ
СО2 — оксид углерода (IV), тривиальное
название «углекислый газ»;
• Международная номенклатура
Построение названий органических веществ в
соответствии с номенклатурой IUPAC
3.
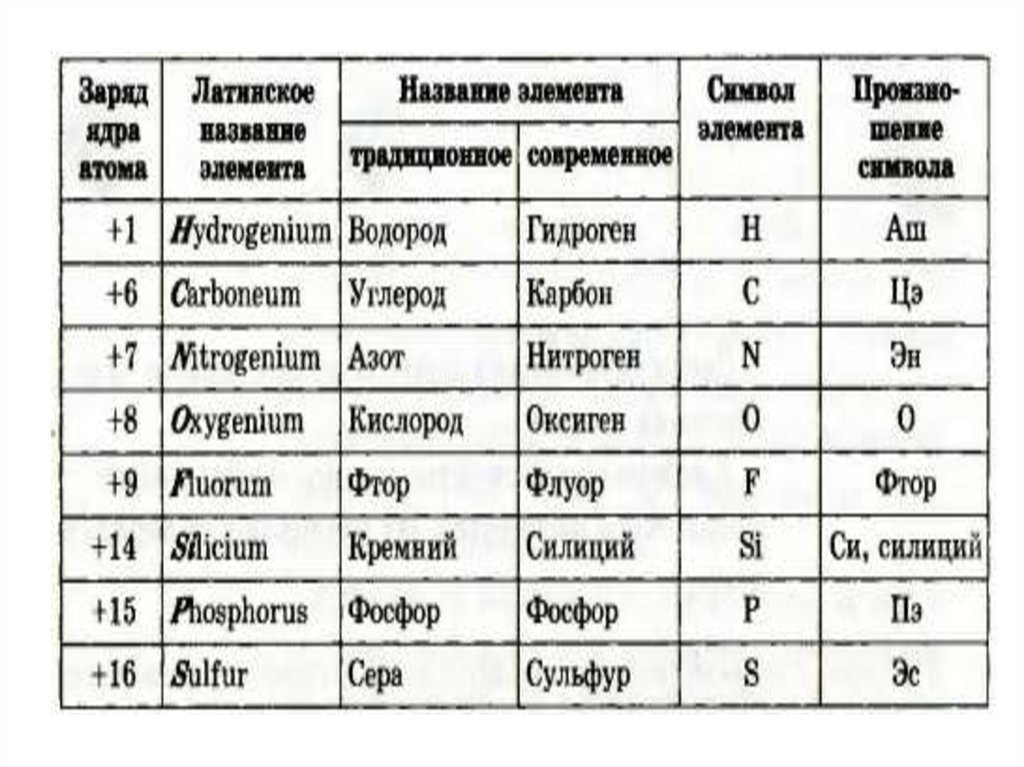
Основоположникомхимической
«письменности» считают
шведского ученого
Й. Я. Берцелиус, который
предложил в качестве
символов
(«букв»)
химических
элементов
использовать начальные
буквы
их
латинских
названий, а если с этой
буквы
начинаются
названия
нескольких
элементов, то добавлять к
начальной букве еще одну
из последующих букв
названия
4.
5.
1.2.
3.
4.
5.
Этимология названий химических
элементов
Свойства простых веществ, образованных
химическими элементами (водород —
«рождающий воду», кислород — «рождающий
кислоты»).
Мифы древних греков. Например, тантал и
прометий.
Географические начала — названия: государств
(галлий, германий, полоний, рутений); частей
света (америций, европий); городов (гафний — в
честь Копенгагена, лютеций — в честь Парижа).
Астрономические начала: селен — в честь Луны
(Селены), уран, нептуний, плутоний.
Имена великих ученых: кюрий, эйнштейний ,
менделевий.
6.
Классификация неорганических веществи принципы образования их названий
7.
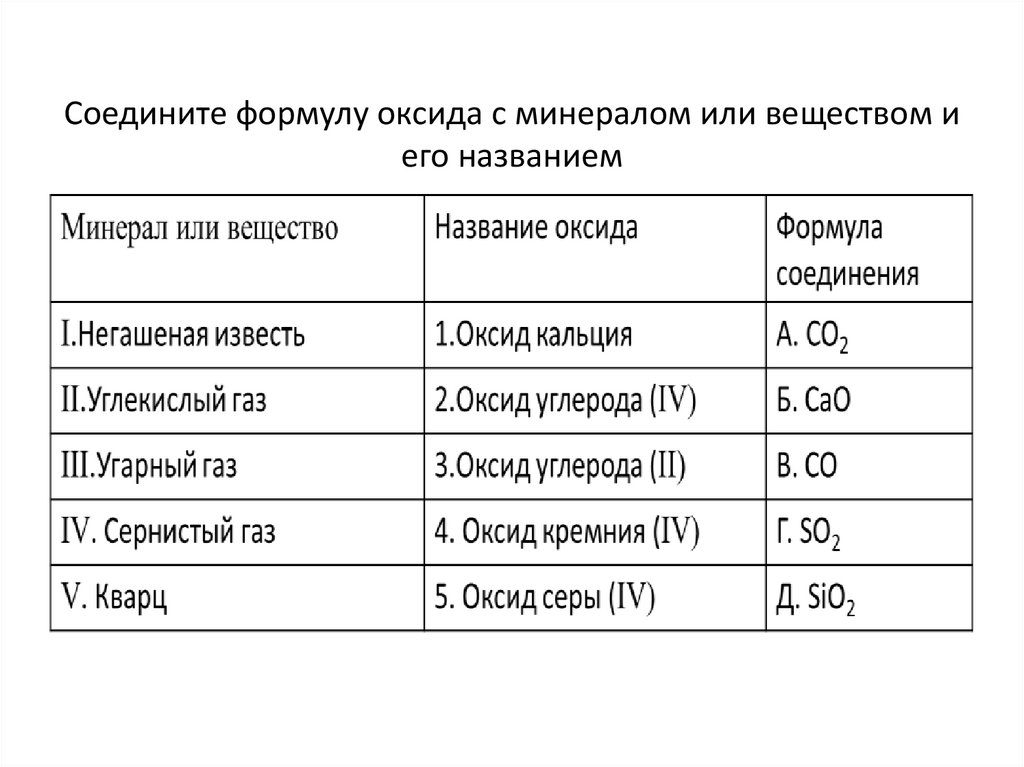
Соедините формулу оксида с минералом или веществом иего названием
8.
9.
ОСНОВАНИЯ.общая формула оснований: Mn+(OH)n,
где n — заряд иона = с. о. металла (М).
Ca(OH)2
10.
Классификация оснований1. По растворимости:
• Растворимые
• Нерастворимые
• 2. По числу (ОН)- групп
• Однокислотные MOH
NaOH
• Двухкислотные M(OH)2 Ca(OH)2
11.
12.
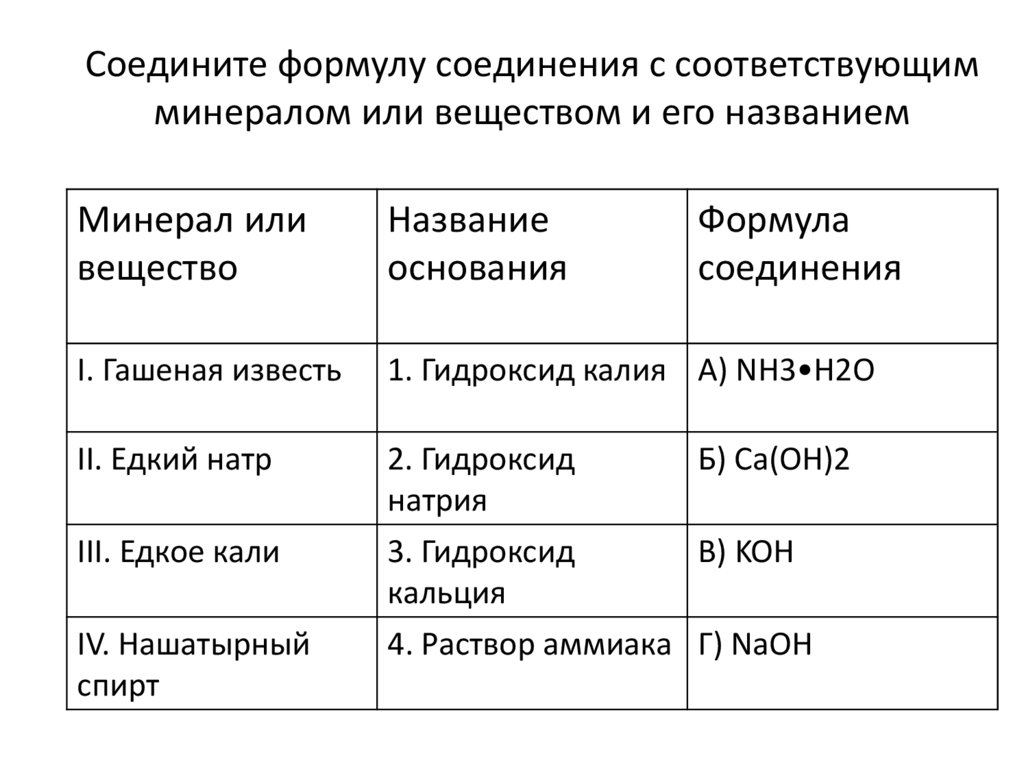
Соедините формулу соединения с соответствующимминералом или веществом и его названием
Минерал или
вещество
Название
основания
Формула
соединения
I. Гашеная известь
1. Гидроксид калия А) NH3•H2O
II. Едкий натр
2. Гидроксид
натрия
Б) Ca(OH)2
III. Едкое кали
3. Гидроксид
кальция
В) KOH
IV. Нашатырный
спирт
4. Раствор аммиака Г) NaOH
13.
Кислоты• Кислоты – это сложные
вещества, состоящие из атомов
водорода и кислотного остатка.
• В растворе образуют простые ионы
водорода Н+ и сложные или
простые ионы кислотного остатка
• Общая формула кислот НnAcdn- , где
n- заряд кислотного остатка
14.
Классификация кислот• По содержанию атомов кислорода
бескислородные (H2S);
кислородсодержащие (HNO3, H2SO4).
• По количеству кислых атомов водорода:
одноосновные (HNO3);
двухосновные (H2SO4);
трёхосновные (H3PO4)
• По растворимости в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3);
• По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
15.
Соли• Сложные вещества;
• Состоят из положительных ионов металла и
отрицательных ионов кислотного остатка
• Способ образование названий солей
Название иона кислотного остатка +
название металла (М) + (с. о. M, если она
переменная)
16.
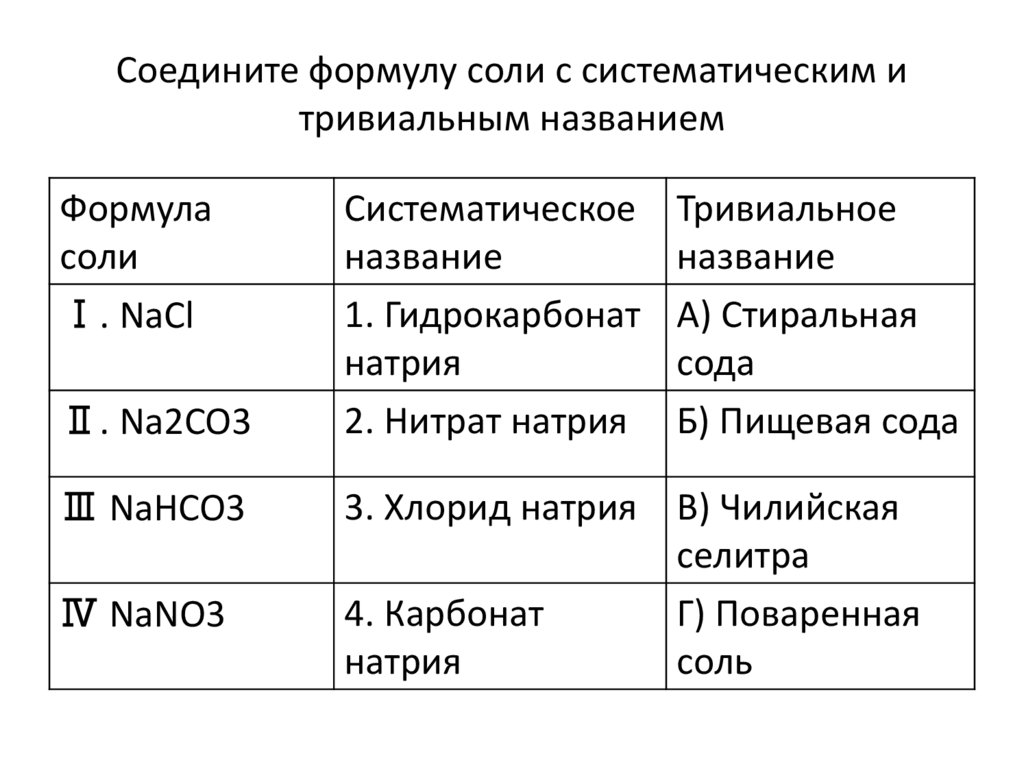
Соедините формулу соли с систематическим итривиальным названием
Формула
соли
Ⅰ. NaCl
Ⅱ. Na2CO3
Ⅲ NaHCO3
Ⅳ NaNO3
Систематическое
название
1. Гидрокарбонат
натрия
2. Нитрат натрия
Тривиальное
название
А) Стиральная
сода
Б) Пищевая сода
3. Хлорид натрия В) Чилийская
селитра
4. Карбонат
Г) Поваренная
натрия
соль












 Химия
Химия








