Похожие презентации:
Влияние условий на скорость химической реакции
1. Влияние условий на скорость химической реакции.
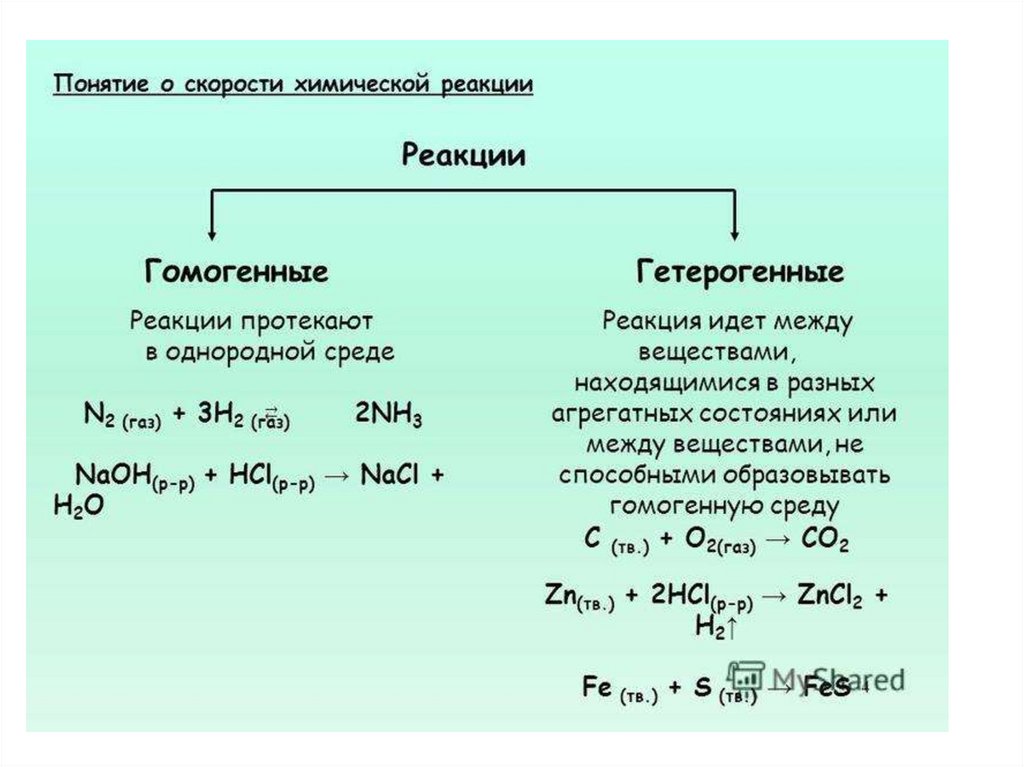
2. По фазовому составу
• Гомогенный процесс• Гетерогенный процесс
3.
4.
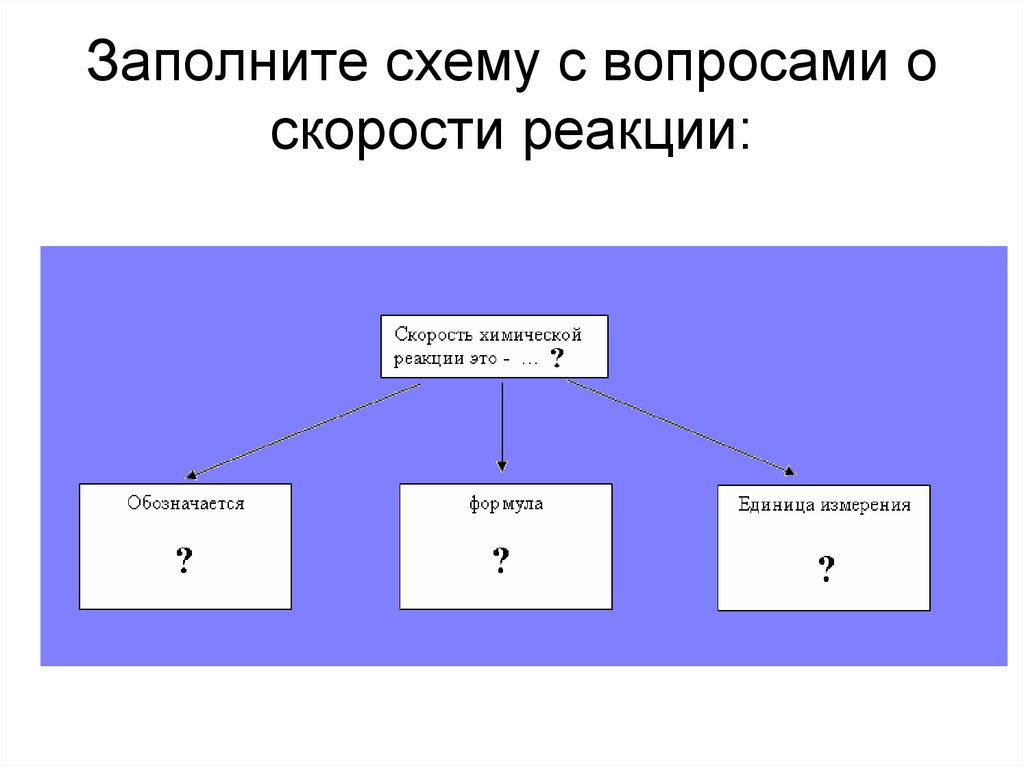
5. Заполните схему с вопросами о скорости реакции:
6. v
7.
8.
9. Изменение концентрации реагирующих веществ в единицу времени.
10. Перечислите факторы, влияющие на скорость химической реакции.
11.
Изучаемыйфактор
Используемые
вывод
вещества
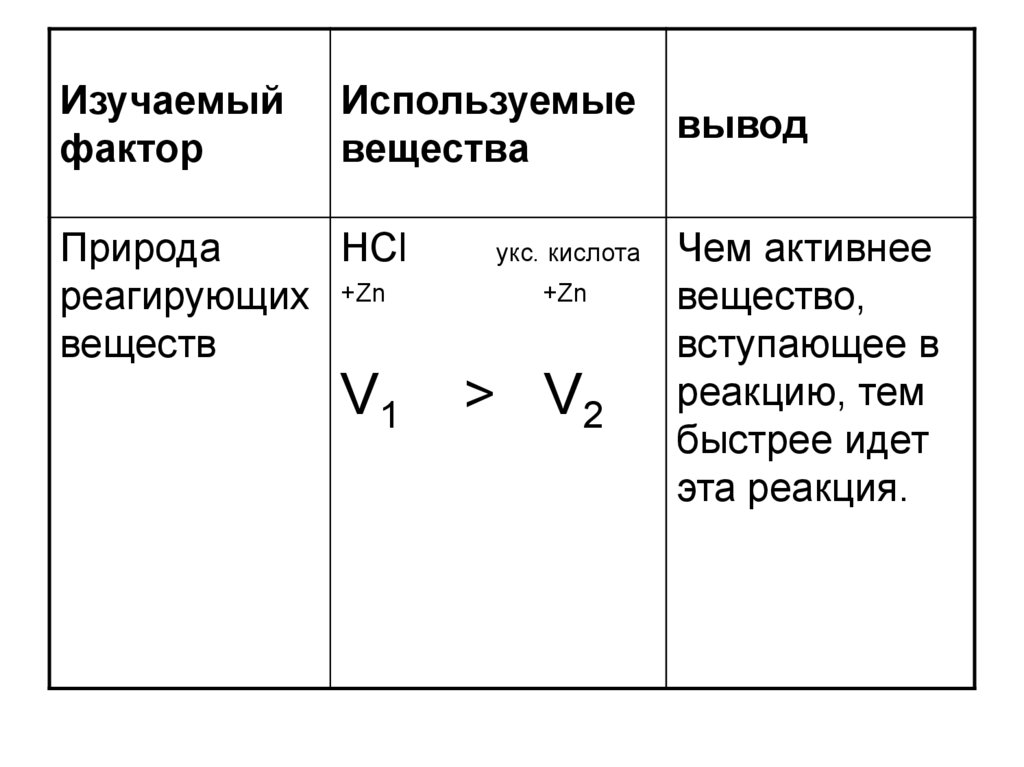
Природа
HCl
реагирующих +Zn
веществ
V1
укс. кислота
+Zn
> V2
Чем активнее
вещество,
вступающее в
реакцию, тем
быстрее идет
эта реакция.
12.
Изучаемыйфактор
Используемые
вывод
вещества
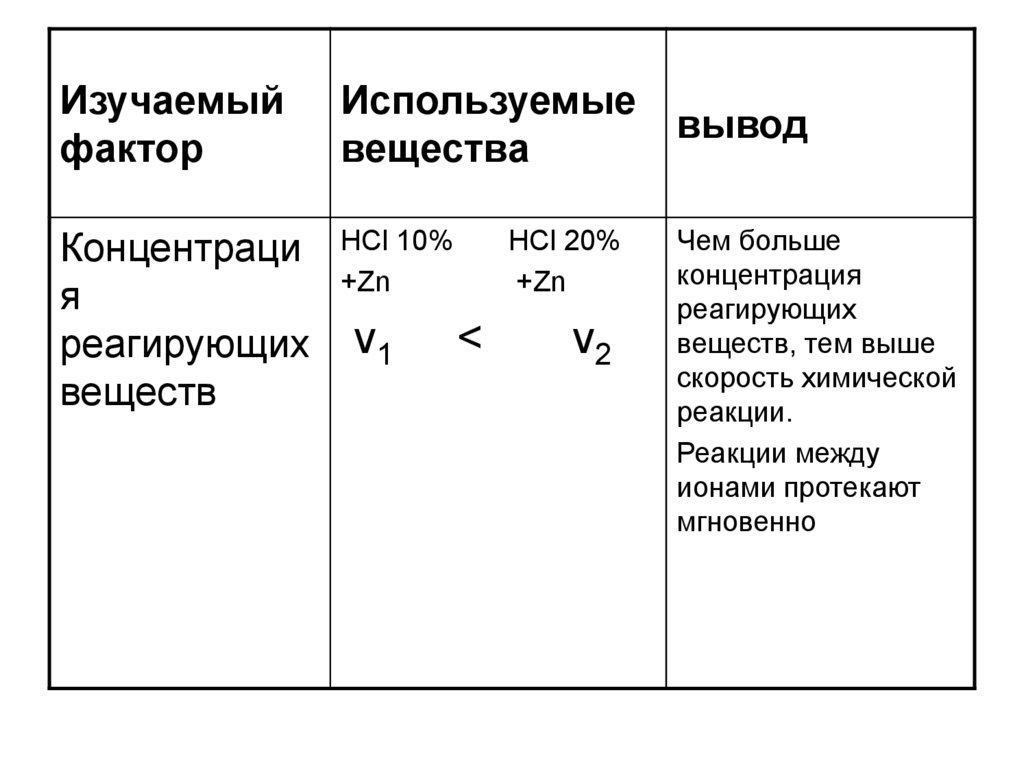
Концентраци
я
реагирующих
веществ
НCl 10%
+Zn
v1
HCl 20%
+Zn
<
v2
Чем больше
концентрация
реагирующих
веществ, тем выше
скорость химической
реакции.
Реакции между
ионами протекают
мгновенно
13.
14.
Запишите кинетическое уравнение для следующих уравнений
реакций:
А) S(тв) + O2 (г) = SO2 (г)
Б) 2SO2 (г) + O2 (г) = 2SO3 (ж)
15.
• Решение:• Согласно закону действующих масс,
который действует для газов и
жидкостей (твёрдые вещества не
учитываются):
• υ = к1 C (O2)
• υ = к2 C2 (SO2)·C (O2)
16.
Изучаемыйфактор
Используемые
вещества
Площадь
Fe (порошок) Fe (кнопка)
+ НCl
соприкоснове НCl
ния
V
>
V
1
2
реагирующих
веществ.
вывод
Чем больше
площадь
соприкосновения
реагирующих
веществ, тем
выше скорость
химической
реакции.
17.
Изучаемыйфактор
Используемые
вывод
вещества
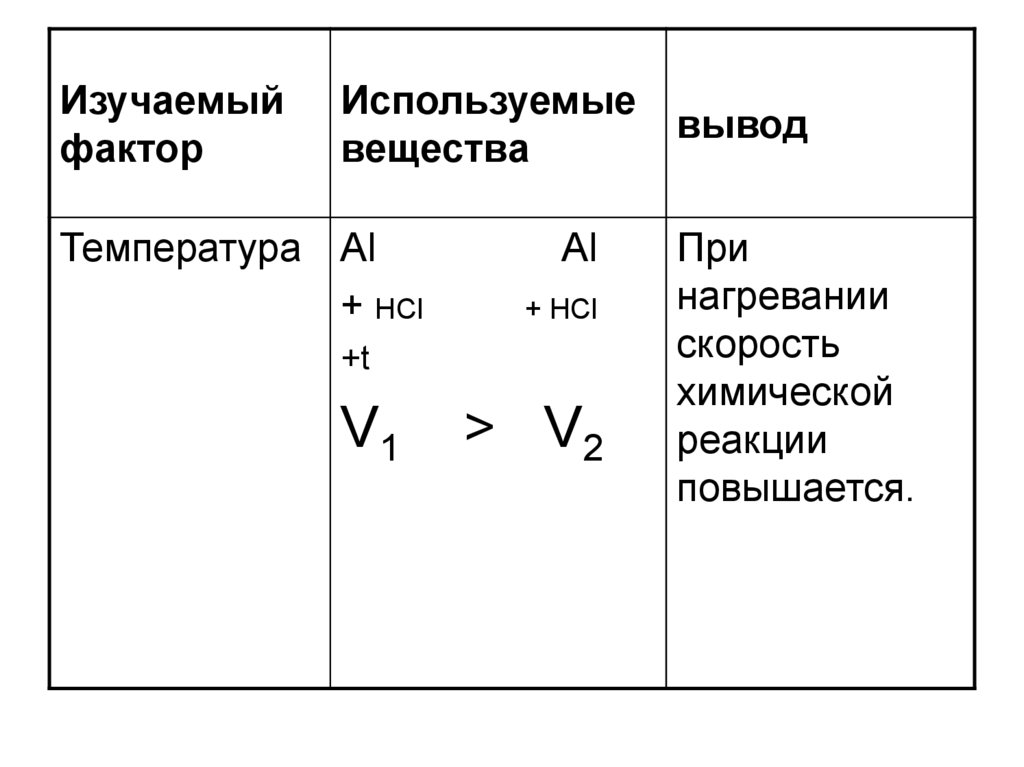
Температура Al
+ НCl
Al
+ НCl
+t
V1
> V2
При
нагревании
скорость
химической
реакции
повышается.
18.
Изучаемыйфактор
Используемые
вещества
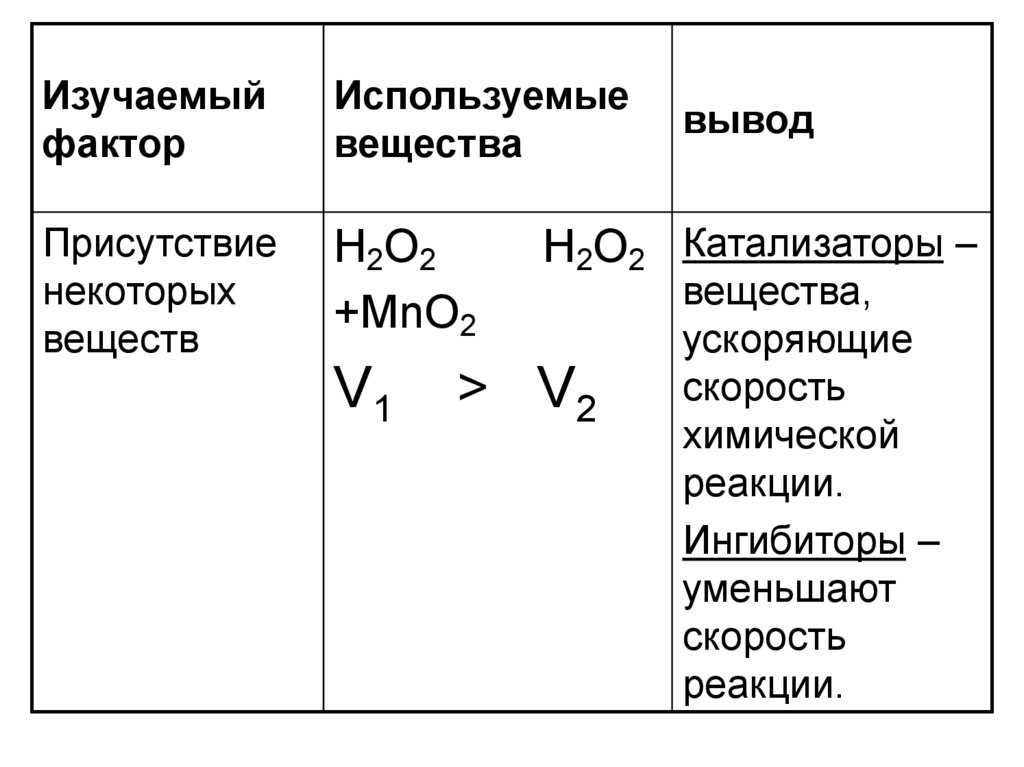
Присутствие
некоторых
веществ
H2O2
+MnO2
V1
вывод
H2O2 Катализаторы –
> V2
вещества,
ускоряющие
скорость
химической
реакции.
Ингибиторы –
уменьшают
скорость
реакции.
19.
20. Использование знаний о скорости реакции в быту
Почему продуктыхранят в
холодильнике?
21. Использование знаний о скорости реакции в быту
• Дляконсервирования
продуктов
используют
вещества
консерванты. Какое
другое название
можно дать этим
веществам?
22. Задачи
1.Задача. Вычислите среднюю
скорость реакции, схема
которой А + B —>C, если
начальная концентрация
вещества А равна 0,220 моль/л ,
а через 10 сек – 0,215 моль/л.
• 2.Задача. Как изменится
скорость химической реакции
при охлаждении системы от
100° С до 50° С, если
температурный коэффициент
скорости химической реакции
равен 2?
Вычислите, во сколько раз
увеличится скорость реакции
при повышении температуры от
30 до 70 ∘ С, если
температурный коэффициент
скорости равен 2.
23. 1. С наибольшей скоростью при комнатной температуре реагируют:
CuSO4(ТВ)CuSO4(ТВ)
CuSO4(р-р)
CuSO4(р-р)
и
и
и
и
Fe (порошок)
Fe (гвоздь)
Fe (порошок)
Fe (гвоздь)
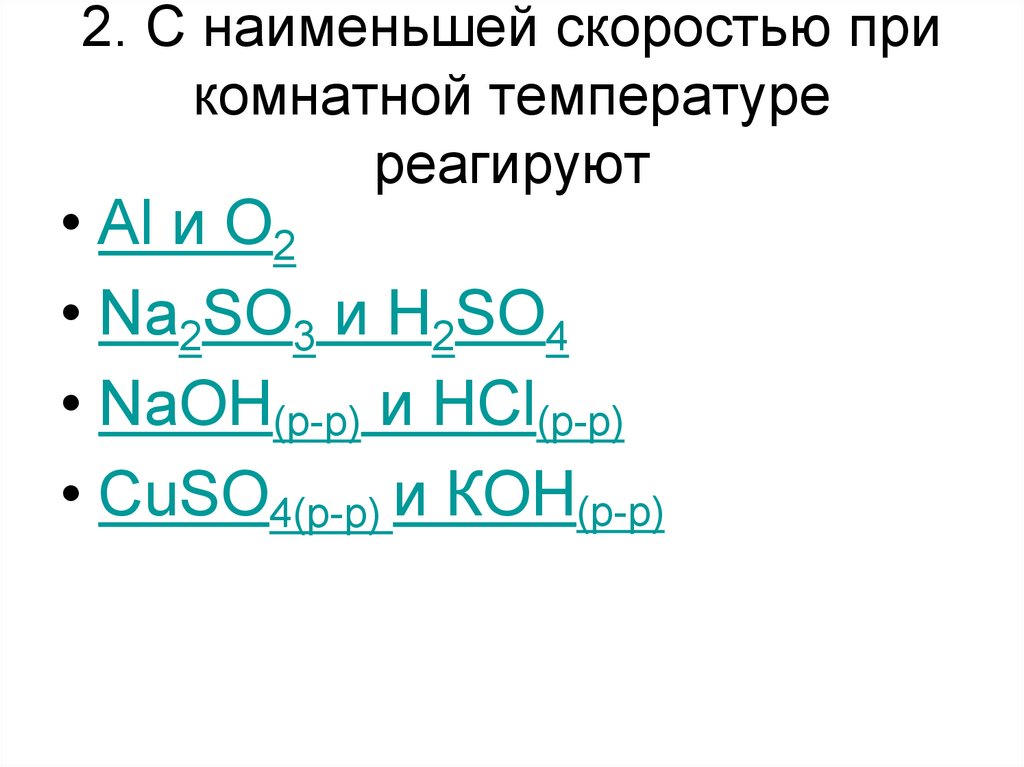
24. 2. С наименьшей скоростью при комнатной температуре реагируют
• Al и О2• Na2SO3 и H2SO4
• NaOH(р-р) и HCl(р-р)
• CuSO4(р-р) и КОН(р-р)
25. 3. Скорость реакции: S(т) + О2 → SO2 увеличивается при…
• уменьшении концентрациикислорода;
• увеличении концентрации
кислорода;
• повышении температуры;
• понижении давления.
26.
4. На скорость химической реакциимежду раствором серной
кислоты и железом не оказывает
влияния
• 1) концентрация кислоты
• 2) измельчение железа
• 3) температура реакции
• 4) увеличение давления
27.
5. Для увеличения скорости
взаимодействия железа с
хлороводородной кислотой
следует
1) добавить ингибитор
2) понизить температуру
3) повысить давление
4) увеличить концентрацию
соляной кислоты HCl
28.
6. С наибольшей скоростью приобычных условиях
взаимодействуют
• 1) цинк и соляная кислота
• 2) натрий и вода
• 3) магний и вода
• 4) свинец и соляная кислота
29.
7. При повышении давленияувеличивается скорость реакции
• 1) кислорода с сернистым газом
• 2) цинка с серной кислотой
• 3) серы с железом
• 4) гидроксида натрия с хлоридом
меди (II)
30.
8. Скорость реакции
Zn + H2SO4 = ZnSO4 + H2 + Q
понизится при
1) повышении температуры
2) понижении давления
3) повышении давления
4) разбавлении раствора кислоты
31.
9. Для увеличения скорости
реакции водорода с азотом
1) охлаждают азотоводородную
смесь
2) снижают давление в системе
3) используют катализатор
4) используют циркуляцию
азотоводородной смеси
32.
10. При комнатной температуре снаибольшей скоростью протекает
реакция между
• 1) Zn и HCl (1 % р-р)
• 2) Zn и HCl (30 % р-р)
• 3) Zn и HCl (10 % р-р)
• 4) ZnCl2 (р-р) и AgNO3 (р-р)
























 Химия
Химия








