Похожие презентации:
Задачи на растворы
1.
Решение задачРастворы
2.
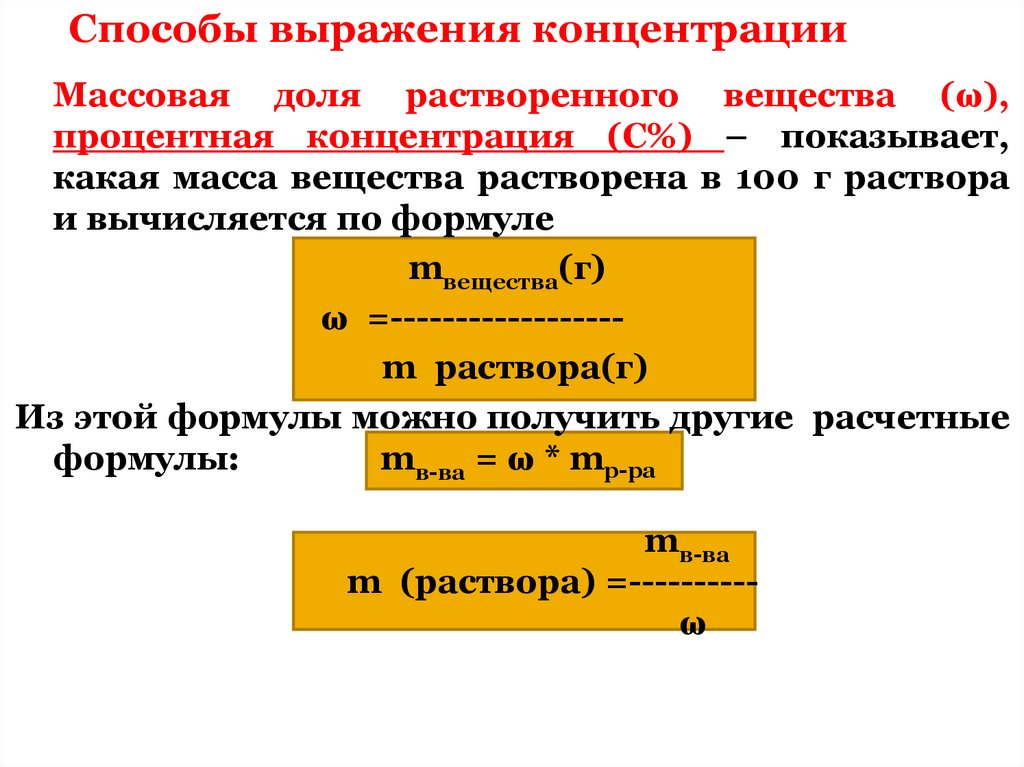
Способы выражения концентрацииМассовая доля растворенного вещества (ω),
процентная концентрация (С%) – показывает,
какая масса вещества растворена в 100 г раствора
и вычисляется по формуле
mвещества(г)
ω =-----------------m раствора(г)
Из этой формулы можно получить другие расчетные
формулы:
mв-ва = ω * mр-ра
mв-ва
m (раствора) =---------ω
3.
Массу раствора можно выразить и через объёмраствора и его плотность
mв-ва = V * ρ * ω
V – объем раствора (мл, л, м3 )
ρ - плотность раствора (г/мл)
4.
Вычислить массу серной кислотысодержащейся в 230мл серной кислоты, если
массовая доля H2S04 в этом растворе 12%.
Плотность раствора 1,08 г/мл.
( Запишите число с точностью до десятых)
5.
1)Вычислите массу(г) хлорида калия, который содержится в 750мл. 10% -ногораствора с плотностью 1,063 г/мл.
( Запишите число с точностью до десятых)
2) Вычислите массу (кг) 25% -го раствора хлорида калия, который необходимо
прибавить к 1 кг 50%- го раствора, чтобы получить 35%-й раствор.
( Запишите число с точностью до десятых).
1) (79,7г)
2) (1,5 кг)
6.
КристаллогидратыКристаллогидраты – это тоже растворы, где можно
рассчитать массовую долю растворенного
вещества.
ZnSО4* 7Н2О – кристаллогидрат,
его М(ZnSО4* 7Н2О) = 65 + 32+ 16*4 + 7(1*2 +16) =
161 + 126 = 287г\моль
161
ω (ZnSО4 в кристгидр. ZnSО4* 7Н2О)= ---- = 0,56 или56%
287
СuSО4* 5Н2О – медный купорос, кристаллогидрат:
Задание: Вычислите ω(СuSО4)в кристаллогидрате
0,64 или 64%
Задачи на кристаллогидраты то же можно решать,
используя «метод стаканчиков».
7.
Решение задач на кристаллогидратыЗадача.В какой массе воды нужно растворить 125 г
медного купороса СuSО4* 5Н2О, чтобы получить 8%
раствор сульфата меди (ll)?
Решение: М (СuSО4* 5Н2О) = 160 + 90 = 250 г\моль
160
ω (СuSО4 в кристаллогидр.СuSО4* 5Н2О) =----- = 0,64
250
Составляем схему приготовления раствора.
0,64
0
0.08
+
=
125
х
125+х
Составляем уравнение и решаем его относительно х;
125 * 0,64 +0*х = (125 + х) 0,08
х = 875 – это масса воды
Ответ: m (воды)=875г
8.
1) Какую массу железного купороса (FeSO4•7H2O) надо взять,чтобы приготовить 1,25 л раствора сульфата железа с массовой
долей 9%, если плотность этого раствора 1,086 г/мл?
2) Вычислите объём воды и массу кристаллогидрата
Na2SO4·10H2O (глауберовой соли), которые требуются для
приготовления 500 г раствора с массовой долей Na2SO4 15%.
1) 223,45 г
2) m(Na2SO4·10H2O) = 170,45 г;
V(H2O) = 329,55 мл.







 Химия
Химия