Похожие презентации:
Соединения алюминия
1. Соединения алюминий
2. Соединения алюминия В природе алюминий встречается только в виде соединений и по распространенности в земной коре занимает
первое место средиметаллов и третье – среди всех элементов (после кислорода и кремния).
.
Общее содержание алюминия в земной коре составляет 8,8 % по массе
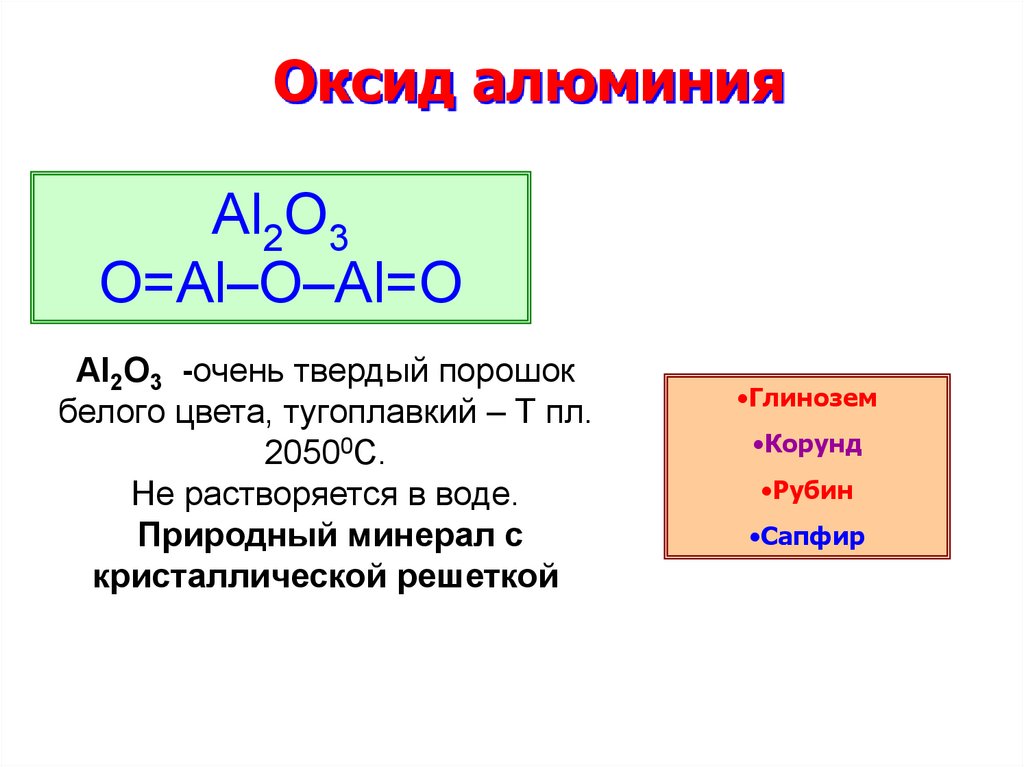
3. Оксид алюминия
Al2O3O=Al–O–Al=O
Al2O3 -очень твердый порошок
белого цвета, тугоплавкий – Т пл.
20500С.
Не растворяется в воде.
Природный минерал с
кристаллической решеткой
•Глинозем
•Корунд
•Рубин
•Сапфир
4. Получение оксида алюминия
Образуется:а) при окислении или горении алюминия на
воздухе
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термическом разложении гидроксида
алюминия
2Al (OH)3 = Al2O3 + 3H2O
5. Получение оксида алюминия
Алюминий окисляется на воздухе:4Al + 3O2 = 2Al2O3
восстановитель Al0 - 3ē → Al+3
4- окисление
окислитель O20 + 4ē → 2O-2 12 3-восстановление
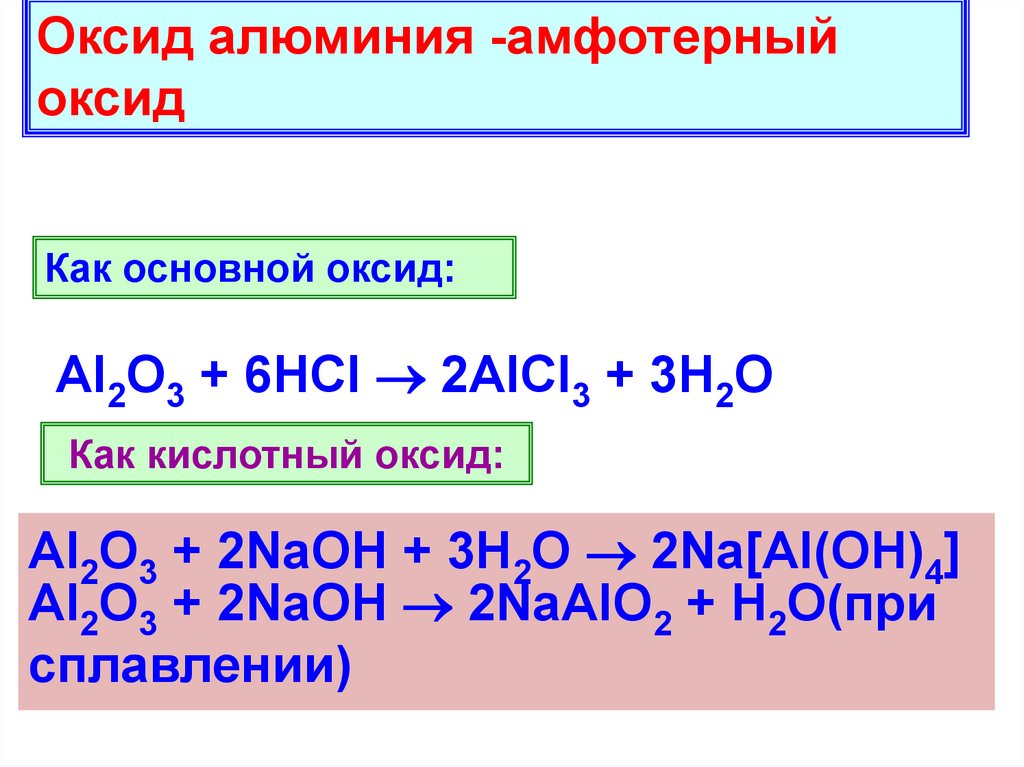
6.
Оксид алюминия -амфотерныйоксид
Как основной оксид:
Al2O3 + 6HCl 2AlCl3 + 3H2O
Как кислотный оксид:
Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
Al2O3 + 2NaOH 2NaAlO2 + H2O(при
сплавлении)
7. Химические свойства оксида алюминия
Al2O3 по характеру амфотерный оксид.Взаимодействует:
а) с кислотами:
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Al2O3 + 6H+ + 3SO42- = 2Al3+ + 3SO42- + 3H2O
Al2O3 + 6H+ = 2Al3+ + 3H2O
б) со щелочами:
Al2O3 + 2NaOH = 2NaAlO2+ H2O
Al2O3 + 2Na+ + 2OH- = 2Na+ + 2AlO2- + H2O
Al2O3 + 2OH- = 2AlO2- + H2O
8. Гидроксид алюминия
Al(OH)3Гидроксид алюминия Al(OН)3 – белое, кристаллическое вещество, не
растворимое в воде амфотерное основание, которое получается при
взаимодействии соли алюминия и щелочи.
AlCl3 + 3NaOH Al(OH)3 + 3NaCl
9.
Амфотерный гидроксид взаимодействует:с кислотами и со щелочами
Как основание:
Al(OH)3 + 3HCl AlCl3 + 3H2O
Как кислота
Al(OH)3 + NaOH Na[Al(OH)4]
Как нерастворимый гидроксид
2Al(OH)3 –t° Al2O3 + 3H2O
10. Гидроксид алюминия
• Белый нерастворимый в воде порошок• Проявляет амфотерные свойства.
• Взаимодействует:
а) с кислотами:
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
Al(OH)3 + 3H+ + 3NO3- = Al3+ + 3NO3- + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
б) со щелочами:
Al(OH)3 + KOH = К[Al(OН)4 ]
Al(OH)3 + K+ + OH- = K+ + [Al(OН)4 ]Al(OH)3 + OH- = [Al(OН)4 ]-
11.
Соли алюминияРастворимы в воде
Нерастворимые в воде:
Соли неустойчивых
алюминиевых кислот
называют алюминатами
Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O
фосфаты
Разлагаются водой:
сульфиты, сульфиды
Природные алюминаты:
благородная шпинель и
драгоценный хризоберилл
12.
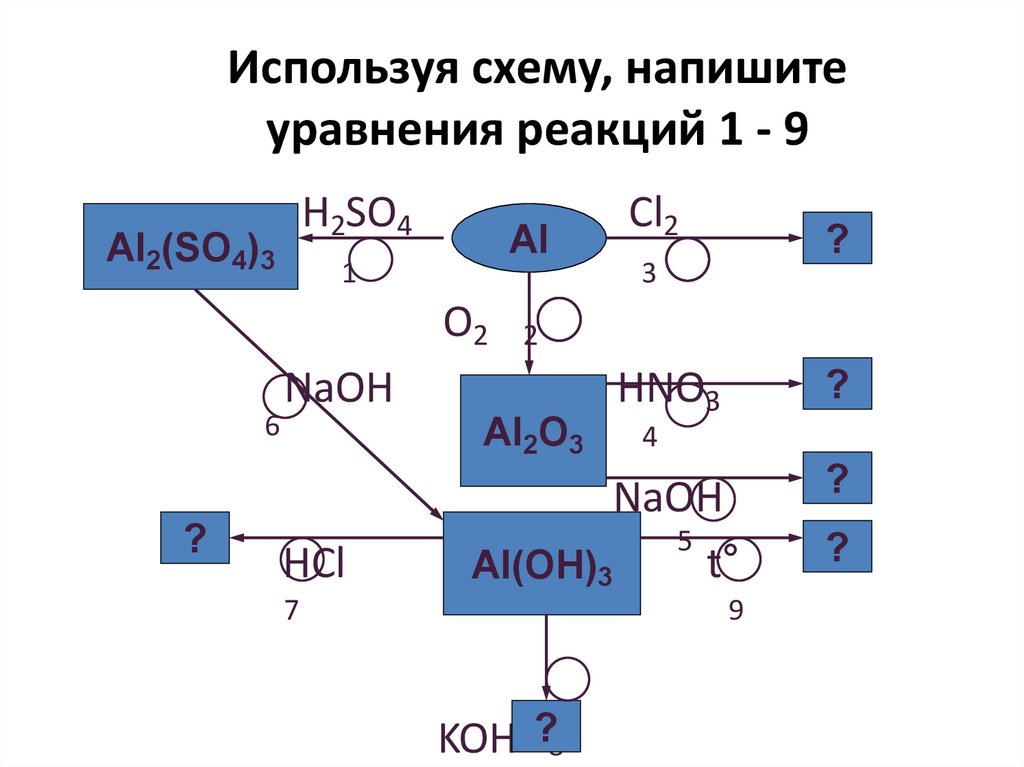
Применение сапфиров и рубинов13. Используя схему, напишите уравнения реакций 1 - 9
H2SO4Al2(SO4)3
Al
1
O2
6
?
?
3
2
NaOH
Al2O3
HCl
Cl2
HNO3
?
4
NaOH
5
t°
Al(OH)3
7
9
KOH ?8
?
?
14. Домашнее задание:
§ 16, в 5уравнения
реакций в ионном
виде










 Химия
Химия








