Похожие презентации:
Генетика клеточного цикла. Периоды клеточного цикла. Выборка к зачету
1. Генетика клеточного цикла Электронно-лекционный курс Выборка к зачету 2016
2.
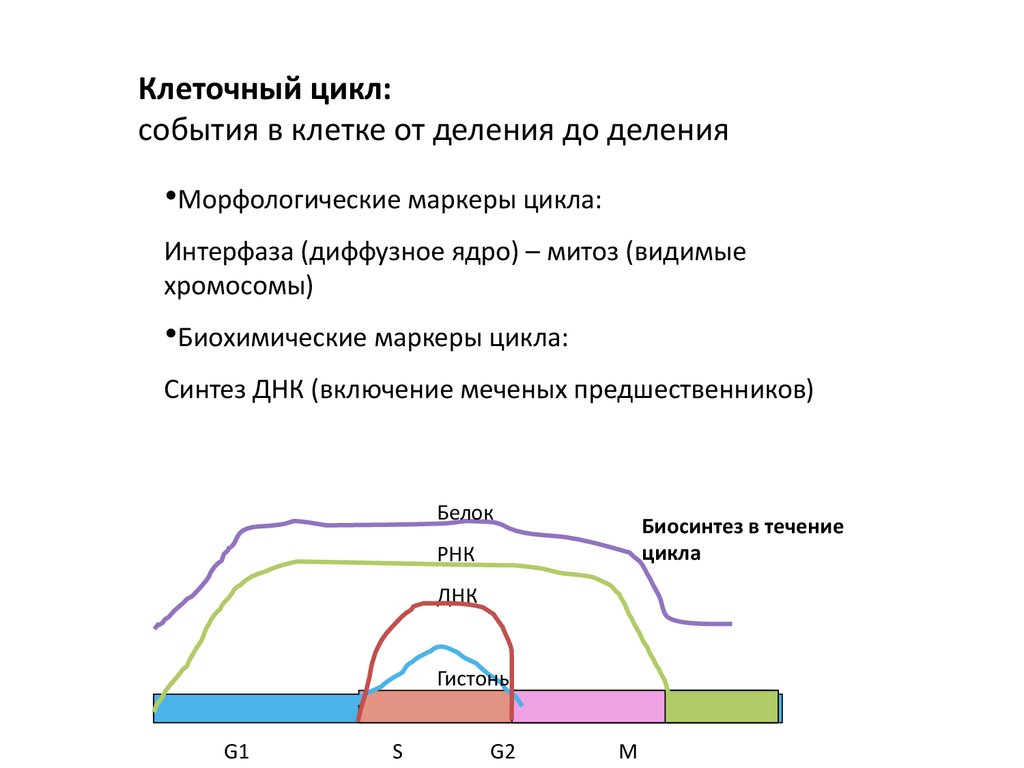
Клеточный цикл:события в клетке от деления до деления
•Морфологические маркеры цикла:
Интерфаза (диффузное ядро) – митоз (видимые
хромосомы)
•Биохимические маркеры цикла:
Синтез ДНК (включение меченых предшественников)
Белок
Биосинтез в течение
цикла
РНК
ДНК
Гистоны
G1
S
G2
M
3.
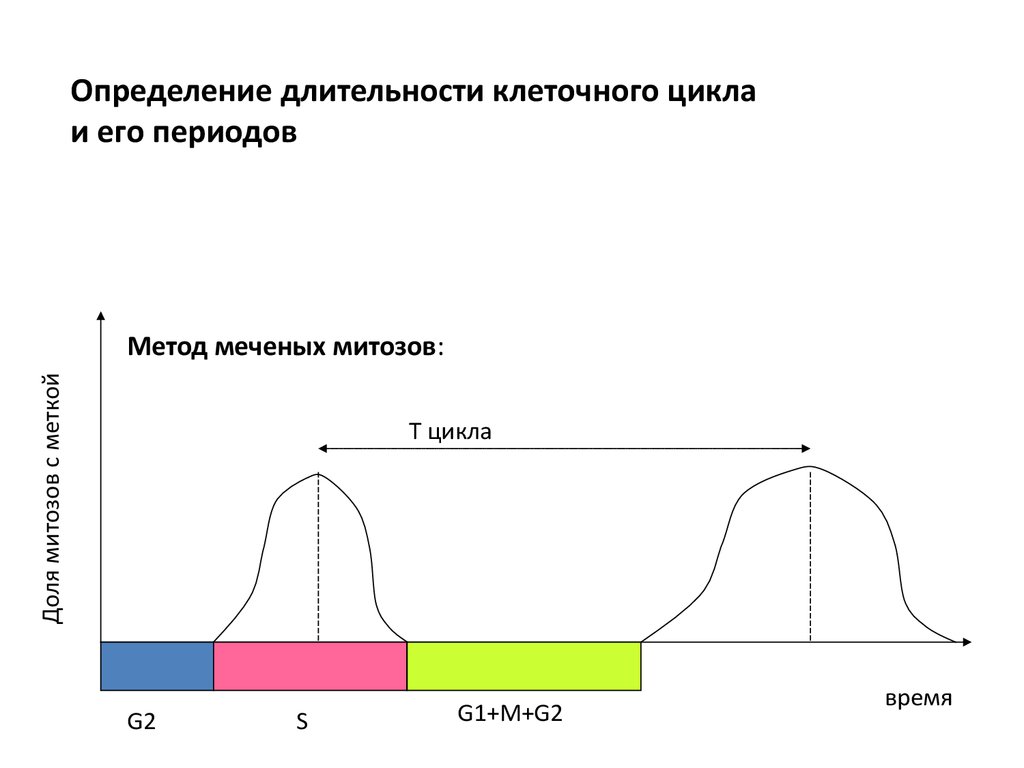
Определение длительности клеточного циклаи его периодов
Доля митозов с меткой
Метод меченых митозов:
Т цикла
G2
S
G1+M+G2
время
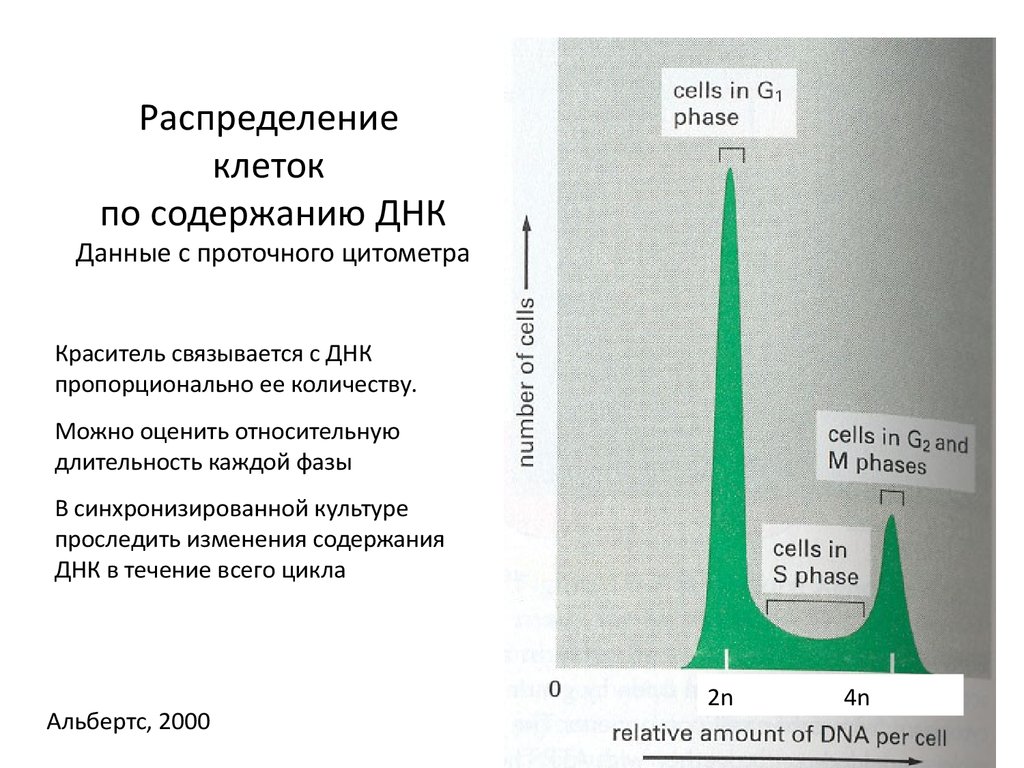
4. Распределение клеток по содержанию ДНК Данные с проточного цитометра
Краситель связывается с ДНКпропорционально ее количеству.
Можно оценить относительную
длительность каждой фазы
В синхронизированной культуре
проследить изменения содержания
ДНК в течение всего цикла
Альбертс, 2000
2n
4n
5.
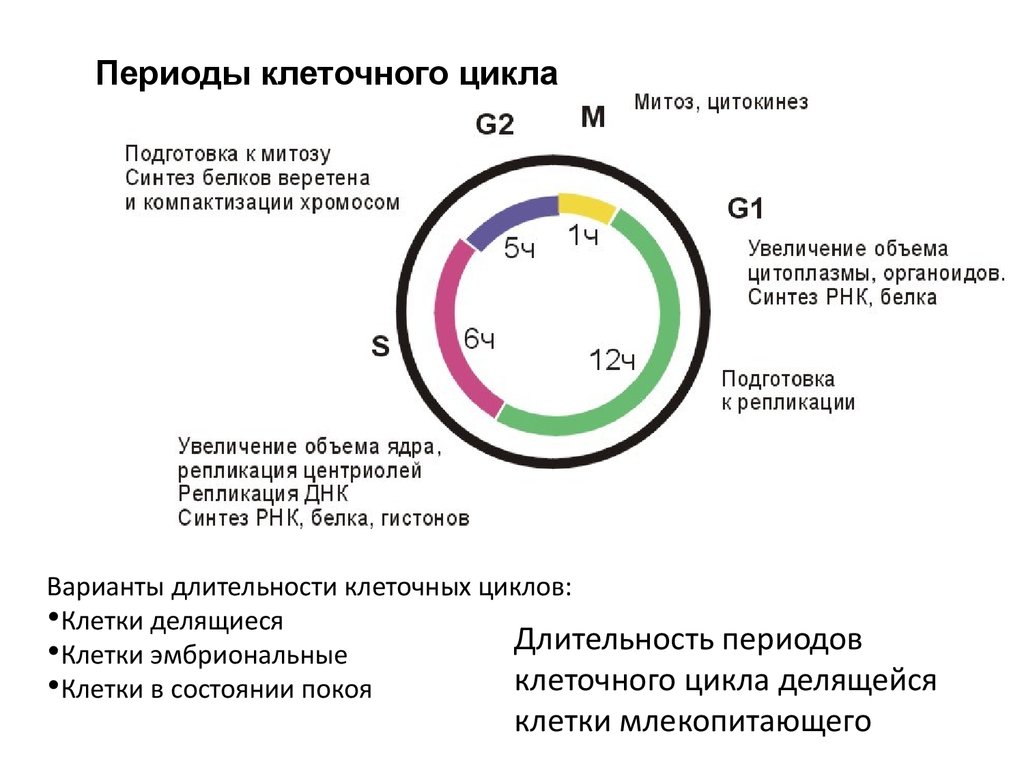
Периоды клеточного циклаВарианты длительности клеточных циклов:
•Клетки делящиеся
Длительность периодов
•Клетки эмбриональные
клеточного цикла делящейся
•Клетки в состоянии покоя
клетки млекопитающего
6.
Разработаны методы культивирования клетокКак синхронизировать циклы клеток?
Синхронизация индукционная: обработка агентом, блокирующим
(обратимо или нет) специфический этап в клетке
G1
- гидроксимочевина блокируют репликацию -остановка в
- колхицин, винбластин, колцемид – блокируют веретено
деления - остановка в метафазе
Синхронизация селекционная: отбирают субпопуляцию клеток по
их принадлежности к какой-либо фазе цикла.
и G2
-центрифугирование по массе – разделяют популяции G1
-смывают плохо прикрепленные митотические клетки –
получают популяцию в начале G1
Синхронизация естественная: деления дробления у амфибий и
некоторых беспозвоночных
7.
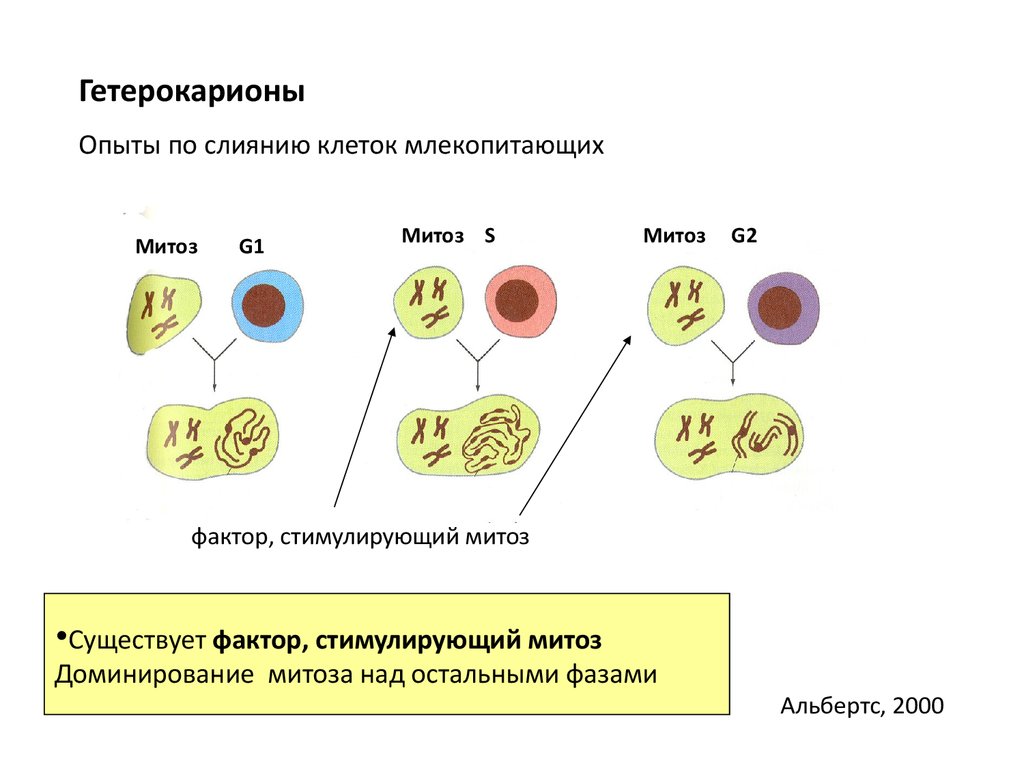
ГетерокарионыОпыты по слиянию клеток млекопитающих
Митоз
G1
Митоз S
Митоз
G2
фактор, стимулирующий митоз
•Существует фактор, стимулирующий митоз
Доминирование митоза над остальными фазами
Альбертс, 2000
8.
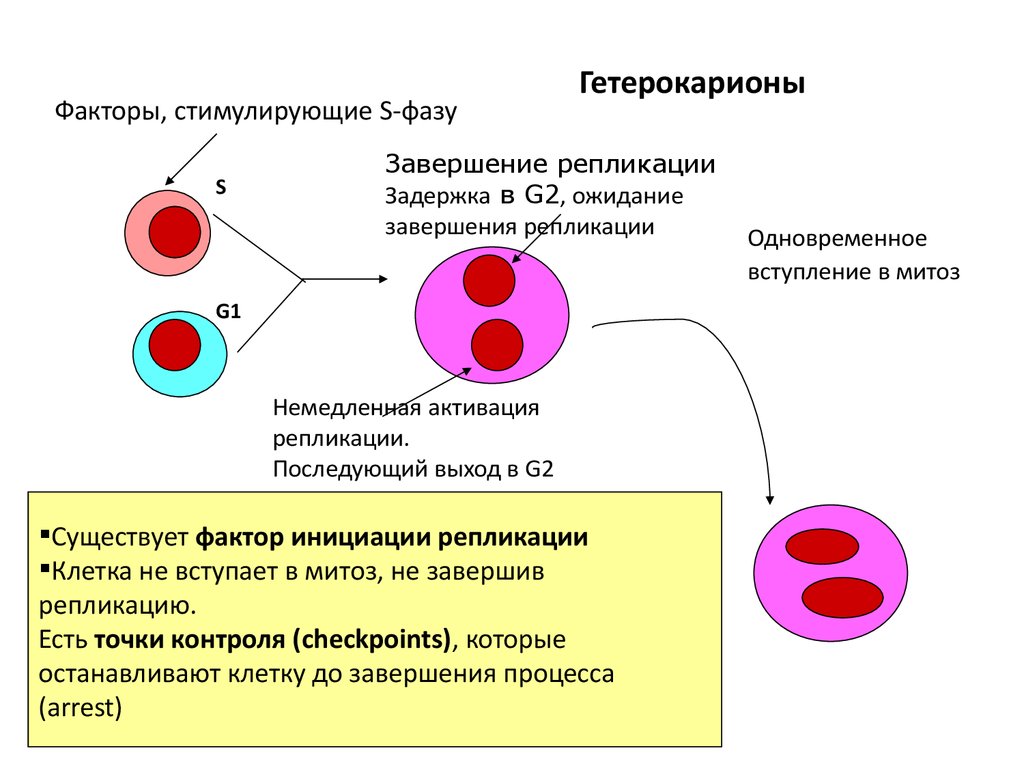
Факторы, стимулирующие S-фазуS
Гетерокарионы
Завершение репликации
Задержка в G2, ожидание
завершения репликации
G1
Немедленная активация
репликации.
Последующий выход в G2
Существует фактор инициации репликации
Клетка не вступает в митоз, не завершив
репликацию.
Есть точки контроля (checkpoints), которые
останавливают клетку до завершения процесса
(arrest)
Одновременное
вступление в митоз
9.
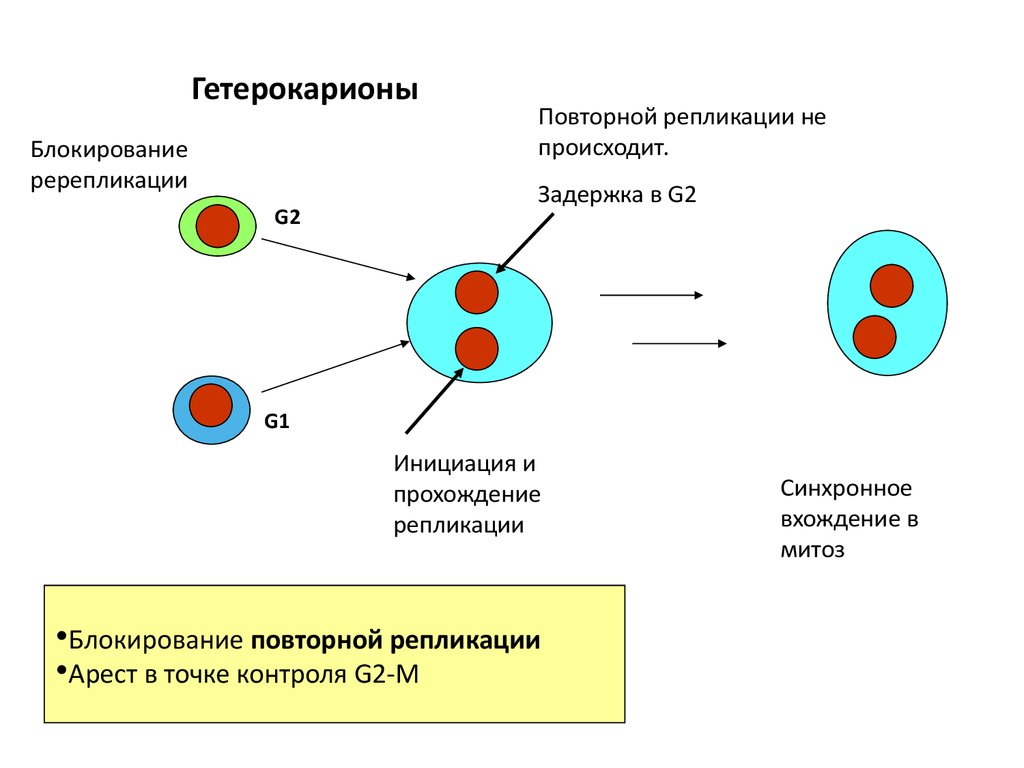
ГетерокарионыБлокирование
ререпликации
G2
Повторной репликации не
происходит.
Задержка в G2
G1
Инициация и
прохождение
репликации
•Блокирование повторной репликации
•Арест в точке контроля G2-M
Синхронное
вхождение в
митоз
10.
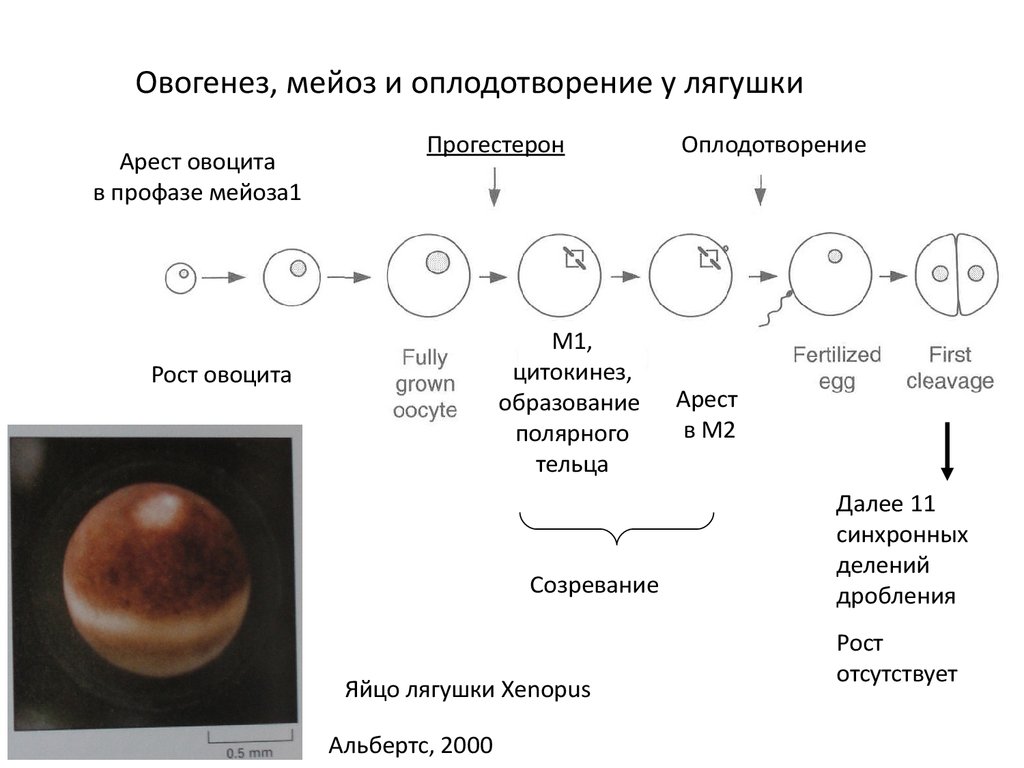
Овогенез, мейоз и оплодотворение у лягушкиАрест овоцита
в профазе мейоза1
Прогестерон
M1,
цитокинез,
образование
полярного
тельца
Рост овоцита
Созревание
Яйцо лягушки Xenopus
Альбертс, 2000
Оплодотворение
Арест
в М2
Далее 11
синхронных
делений
дробления
Рост
отсутствует
11.
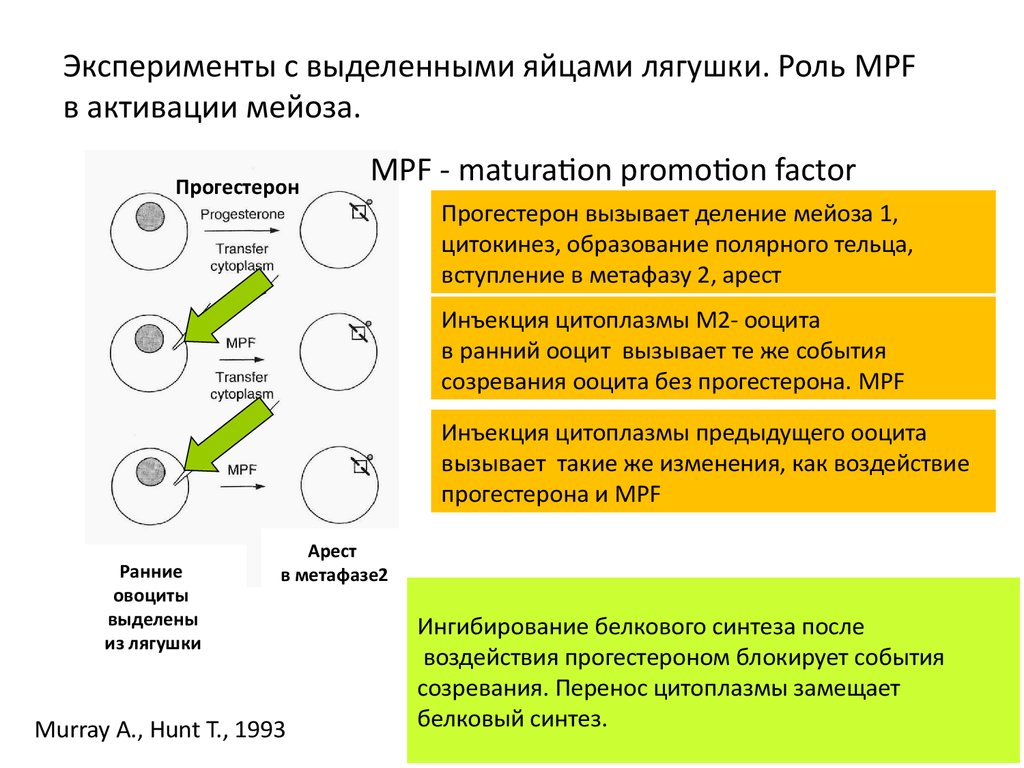
Эксперименты с выделенными яйцами лягушки. Роль MPFв активации мейоза.
Прогестерон
MPF - maturation promotion factor
Прогестерон вызывает деление мейоза 1,
цитокинез, образование полярного тельца,
вступление в метафазу 2, арест
Инъекция цитоплазмы М2- ооцита
в ранний ооцит вызывает те же события
созревания ооцита без прогестерона. MPF
Инъекция цитоплазмы предыдущего ооцита
вызывает такие же изменения, как воздействие
прогестерона и MPF
Ранние
овоциты
выделены
из лягушки
Арест
в метафазе2
Murray A., Hunt T., 1993
Ингибирование белкового синтеза после
воздействия прогестероном блокирует события
созревания. Перенос цитоплазмы замещает
белковый синтез.
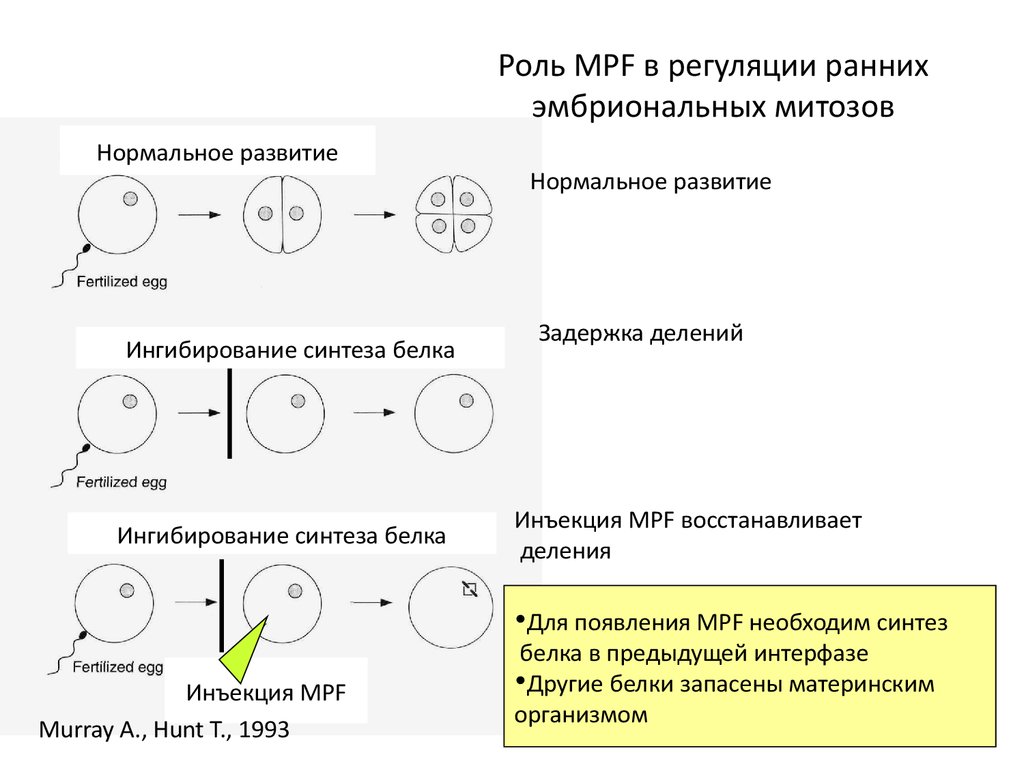
12. Роль MPF в регуляции ранних эмбриональных митозов
Нормальное развитиеИнгибирование синтеза белка
Ингибирование синтеза белка
Инъекция MPF
Murray A., Hunt T., 1993
Нормальное развитие
Задержка делений
Инъекция MPF восстанавливает
деления
•Для появления MPF необходим синтез
белка в предыдущей интерфазе
•Другие белки запасены материнским
организмом
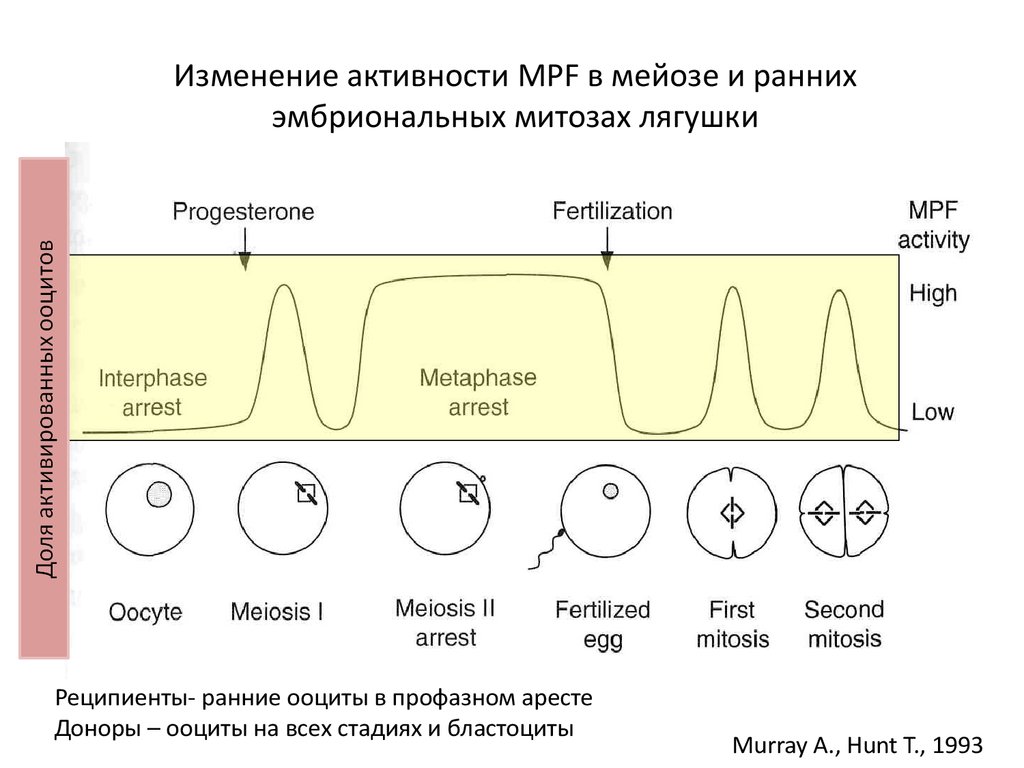
13. Изменение активности MPF в мейозе и ранних эмбриональных митозах лягушки
Реципиенты- ранние ооциты в профазном арестеДоноры – ооциты на всех стадиях и бластоциты
Murray A., Hunt T., 1993
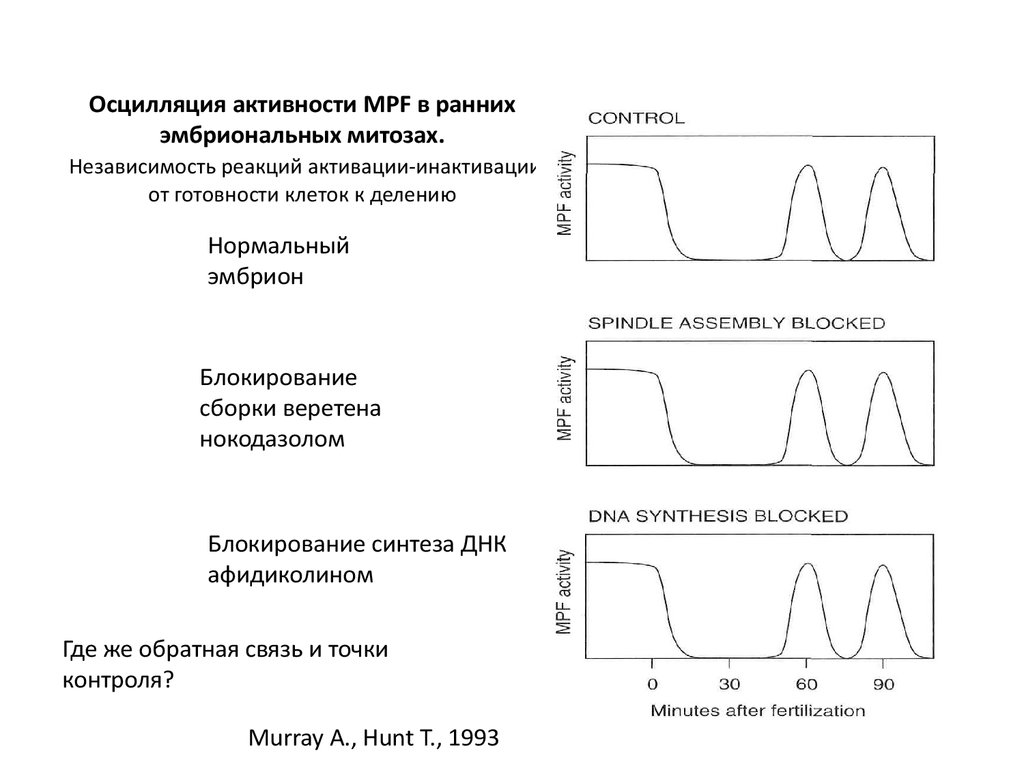
14. Осцилляция активности MPF в ранних эмбриональных митозах. Независимость реакций активации-инактивации от готовности клеток к делению
Нормальныйэмбрион
Блокирование
сборки веретена
нокодазолом
Блокирование синтеза ДНК
афидиколином
Где же обратная связь и точки
контроля?
Murray A., Hunt T., 1993
15.
Мейоз и ранние эмбриональные митозыКосвенные данные о существовании MPF – по видимым
изменениям, происходящим в клетке
Появлению MPF всегда предшествует белковый синтез – поиск
белка, синтезируемого к метафазе.
В остальном «машина» клеточного цикла работает автономно
Блокирование репликации и разрушение ядра не останавливает
остальных событий цикла – это не типично для большинства
клеток
16.
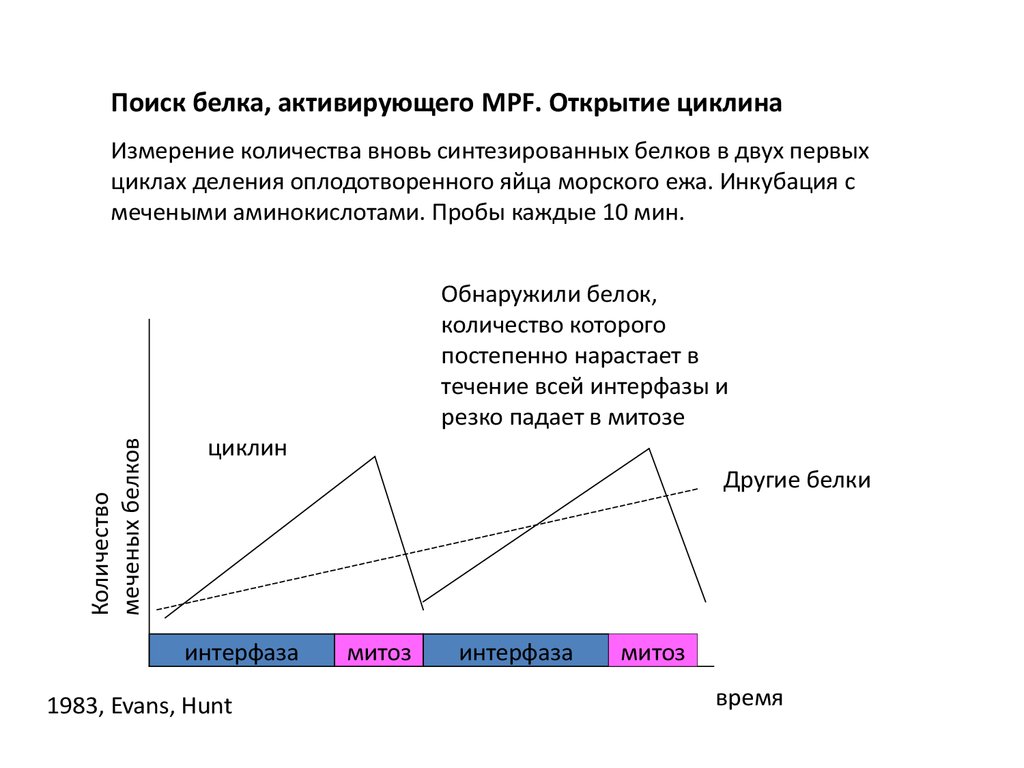
Поиск белка, активирующего MPF. Открытие циклинаКоличество
меченых белков
Измерение количества вновь синтезированных белков в двух первых
циклах деления оплодотворенного яйца морского ежа. Инкубация с
мечеными аминокислотами. Пробы каждые 10 мин.
Обнаружили белок,
количество которого
постепенно нарастает в
течение всей интерфазы и
резко падает в митозе
циклин
Другие белки
интерфаза
1983, Evans, Hunt
митоз
интерфаза
митоз
время
17.
Циклины нашли у всех эукариот: дрожжей, кольчатыхчервей, насекомых, моллюсков, иглокожих, амфибий,
млекопитающих и растений
Первая простая модель активации MPF:
Аккумуляция циклина активирует MPF и митоз: циклин- часть MPF?
Активный MPF вызывает деградацию циклина и выход из митоза?
Деградация циклина инактивирует MPF?
Как соотносятся циклин и MPF?
Противоречивость фактов, полученных при
изучении клеточных культур млекопитающих и
цикла ранних эмбриональных делений.
Необходимость нового объекта
18.
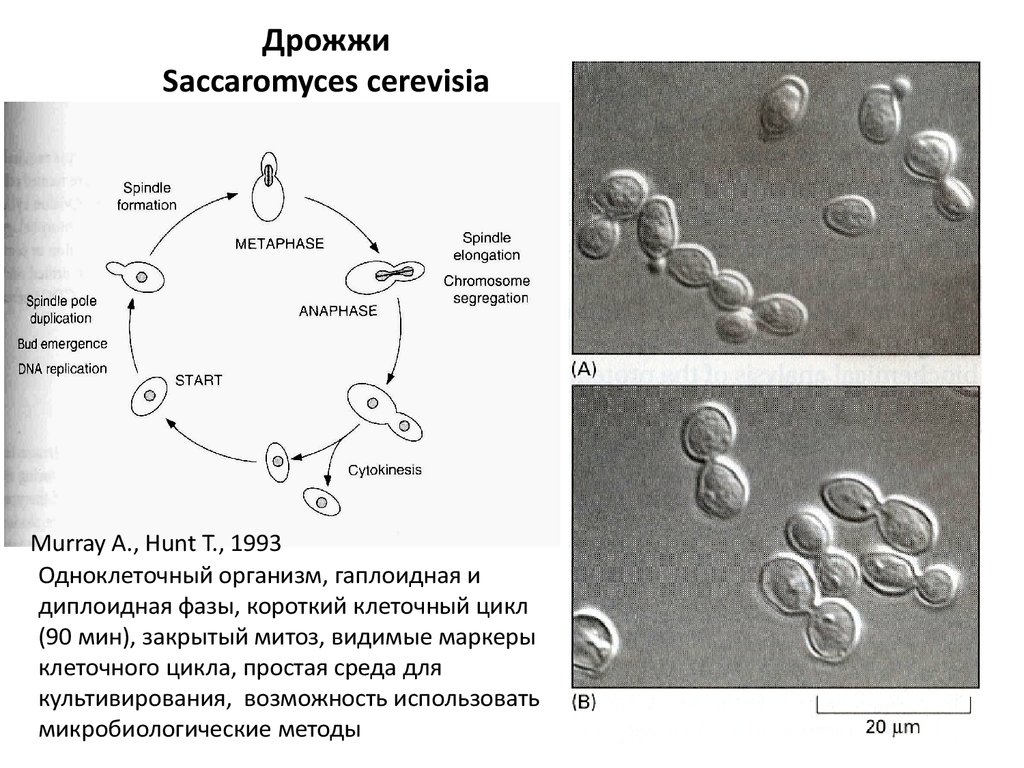
ДрожжиSaccaromyces cerevisia
Murray A., Hunt T., 1993
Одноклеточный организм, гаплоидная и
диплоидная фазы, короткий клеточный цикл
(90 мин), закрытый митоз, видимые маркеры
клеточного цикла, простая среда для
культивирования, возможность использовать
микробиологические методы
19.
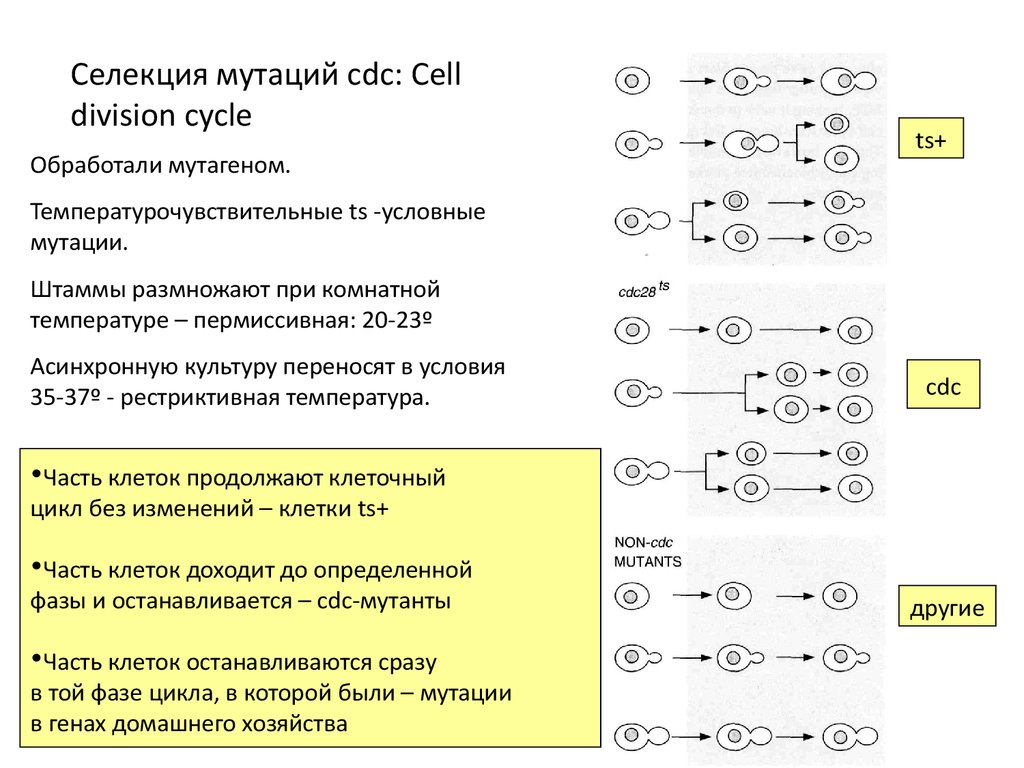
Селекция мутаций cdc: Celldivision cycle
Обработали мутагеном.
ts+
Температурочувствительные ts -условные
мутации.
Штаммы размножают при комнатной
температуре – пермиссивная: 20-23º
Асинхронную культуру переносят в условия
35-37º - рестриктивная температура.
cdc
•Часть клеток продолжают клеточный
цикл без изменений – клетки ts+
•Часть клеток доходит до определенной
фазы и останавливается – cdc-мутанты
•Часть клеток останавливаются сразу
в той фазе цикла, в которой были – мутации
в генах домашнего хозяйства
другие
20.
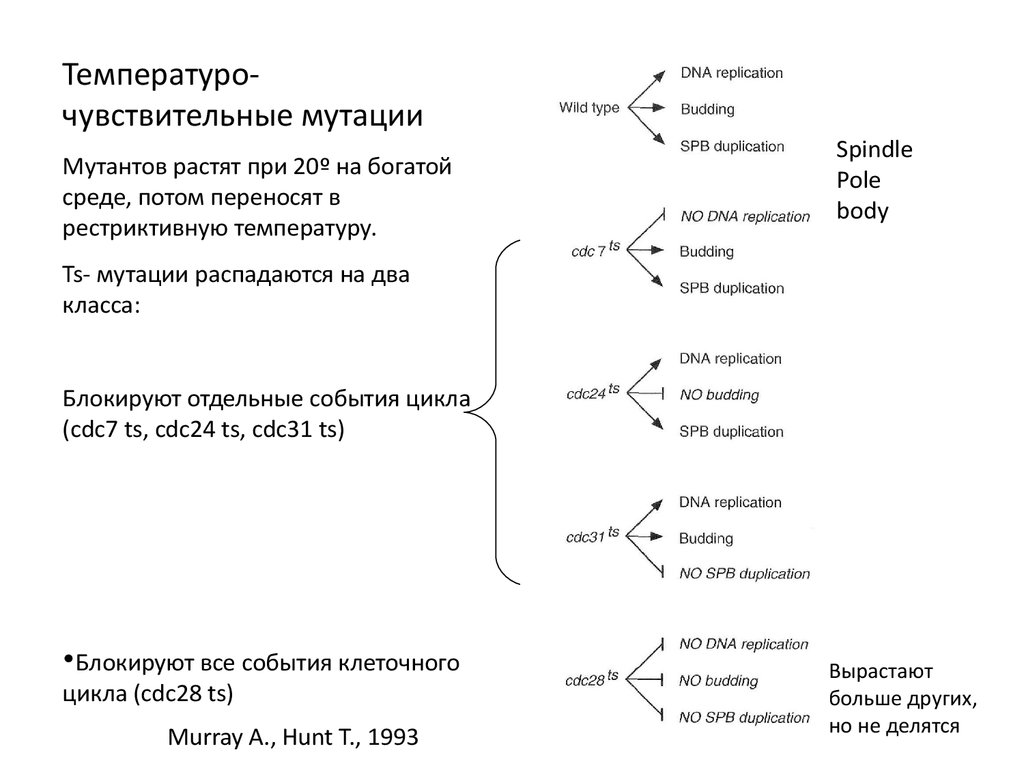
Температурочувствительные мутацииМутантов растят при 20º на богатой
среде, потом переносят в
рестриктивную температуру.
Spindle
Pole
body
Ts- мутации распадаются на два
класса:
Блокируют отдельные события цикла
(cdc7 ts, cdc24 ts, cdc31 ts)
•Блокируют все события клеточного
цикла (cdc28 ts)
Murray A., Hunt T., 1993
Вырастают
больше других,
но не делятся
21.
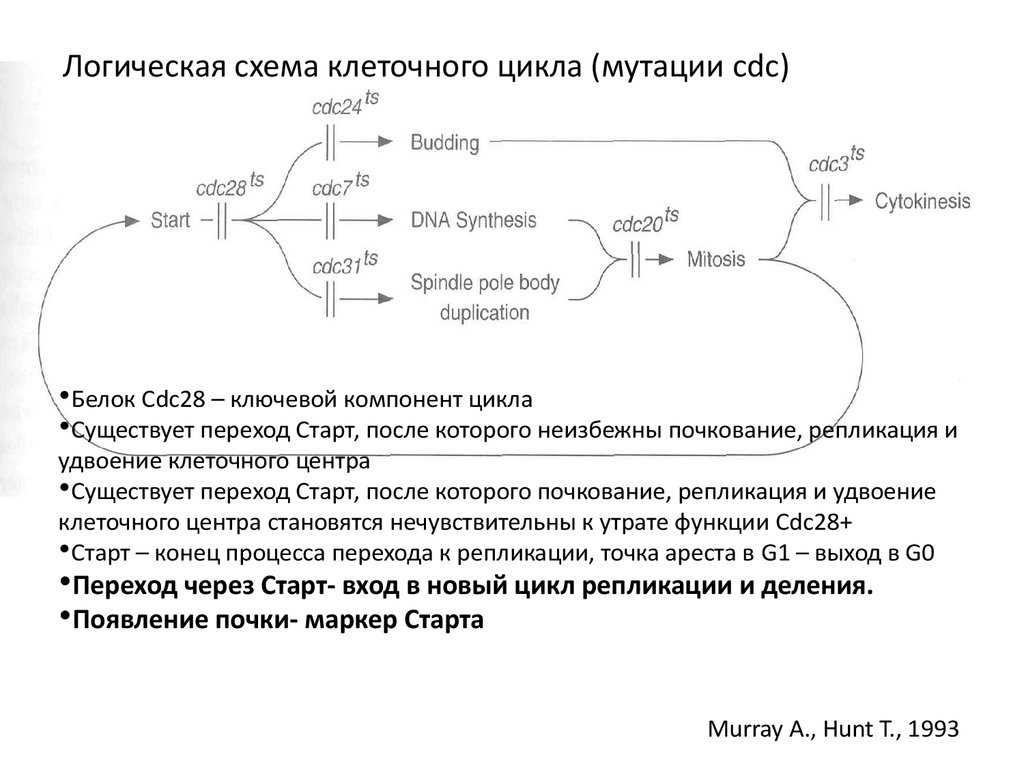
Логическая схема клеточного цикла (мутации cdc)•Белок Сdc28 – ключевой компонент цикла
•Существует переход Старт, после которого неизбежны почкование, репликация и
удвоение клеточного центра
•Существует переход Старт, после которого почкование, репликация и удвоение
клеточного центра становятся нечувствительны к утрате функции Cdc28+
•Старт – конец процесса перехода к репликации, точка ареста в G1 – выход в G0
•Переход через Старт- вход в новый цикл репликации и деления.
•Появление почки- маркер Старта
Murray A., Hunt T., 1993
22.
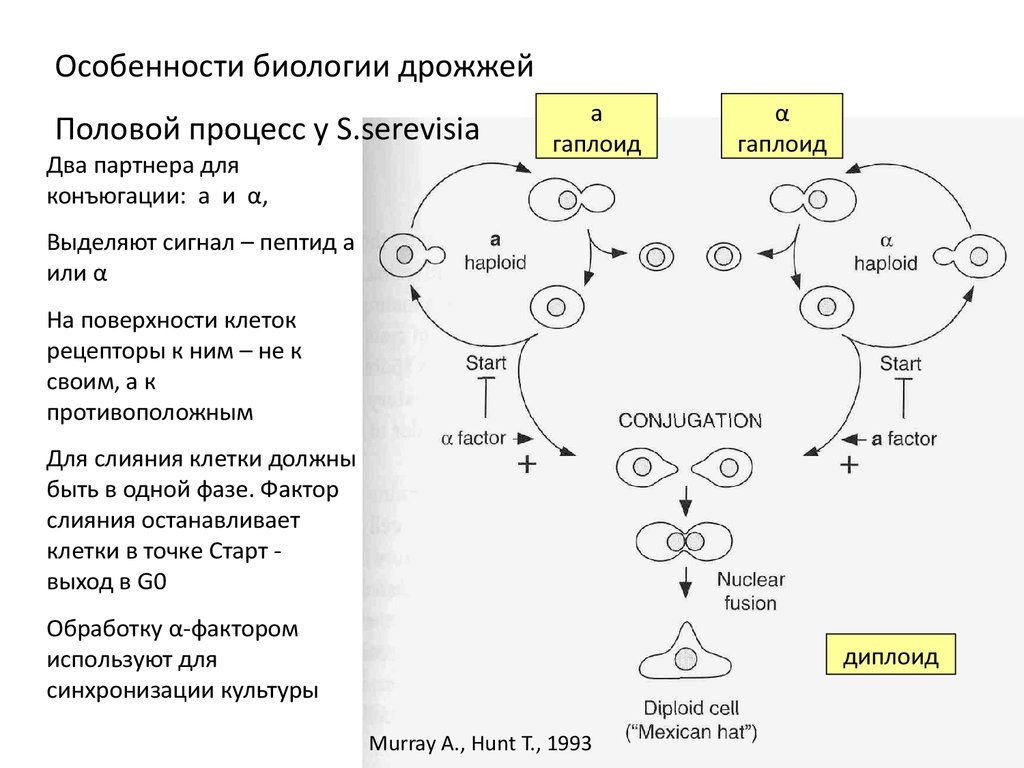
Особенности биологии дрожжейПоловой процесс у S.serevisia
Два партнера для
конъюгации: a и α,
a
гаплоид
α
гаплоид
Выделяют сигнал – пептид а
или α
На поверхности клеток
рецепторы к ним – не к
своим, а к
противоположным
Для слияния клетки должны
быть в одной фазе. Фактор
слияния останавливает
клетки в точке Старт выход в G0
Обработку α-фактором
используют для
синхронизации культуры
диплоид
Murray A., Hunt T., 1993
23.
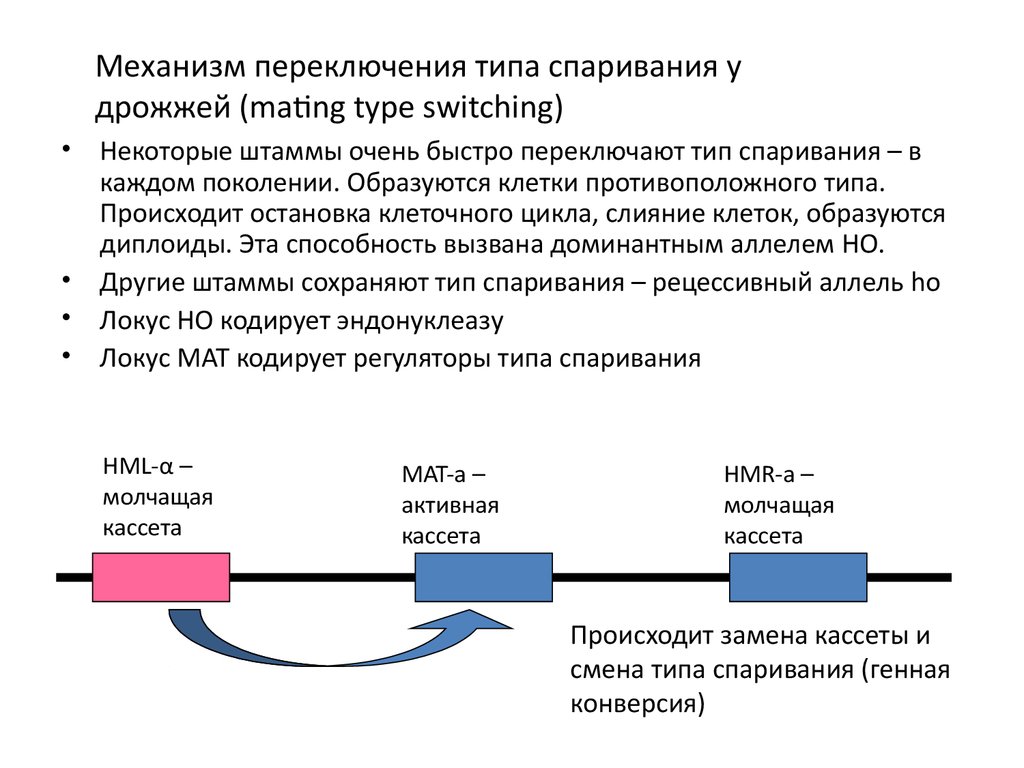
Механизм переключения типа спаривания удрожжей (mating type switching)
Некоторые штаммы очень быстро переключают тип спаривания – в
каждом поколении. Образуются клетки противоположного типа.
Происходит остановка клеточного цикла, слияние клеток, образуются
диплоиды. Эта способность вызвана доминантным аллелем HO.
Другие штаммы сохраняют тип спаривания – рецессивный аллель ho
Локус HO кодирует эндонуклеазу
Локус МАТ кодирует регуляторы типа спаривания
HML-α –
молчащая
кассета
MAT-a –
активная
кассета
HMR-a –
молчащая
кассета
Происходит замена кассеты и
смена типа спаривания (генная
конверсия)
24.
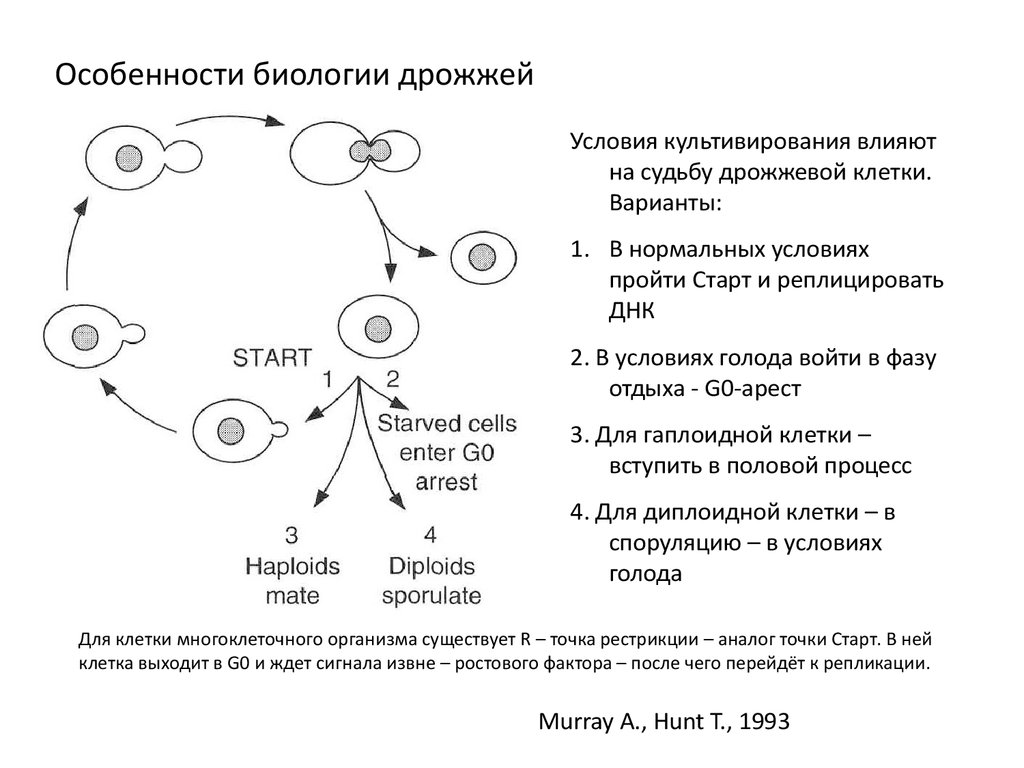
Особенности биологии дрожжейУсловия культивирования влияют
на судьбу дрожжевой клетки.
Варианты:
1. В нормальных условиях
пройти Старт и реплицировать
ДНК
2. В условиях голода войти в фазу
отдыха - G0-арест
3. Для гаплоидной клетки –
вступить в половой процесс
4. Для диплоидной клетки – в
споруляцию – в условиях
голода
Для клетки многоклеточного организма существует R – точка рестрикции – аналог точки Старт. В ней
клетка выходит в G0 и ждет сигнала извне – ростового фактора – после чего перейдёт к репликации.
Murray A., Hunt T., 1993
25.
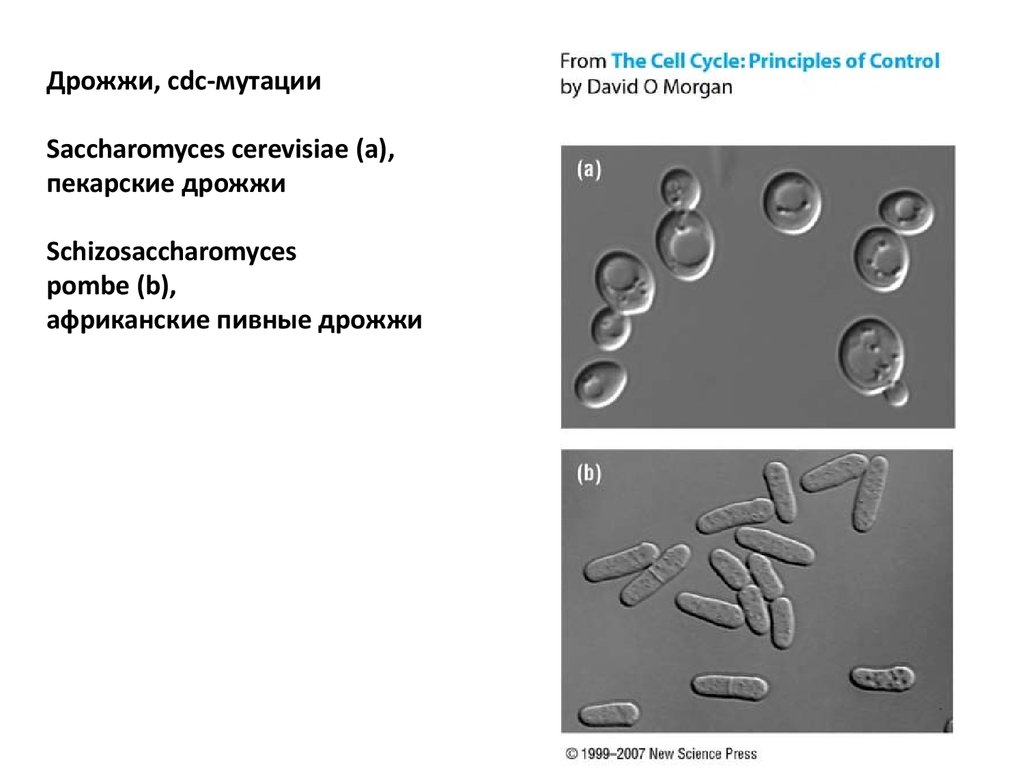
Дрожжи, cdc-мутацииSaccharomyces cerevisiae (a),
пекарские дрожжи
Schizosaccharomyces
pombe (b),
африканские пивные дрожжи
26.
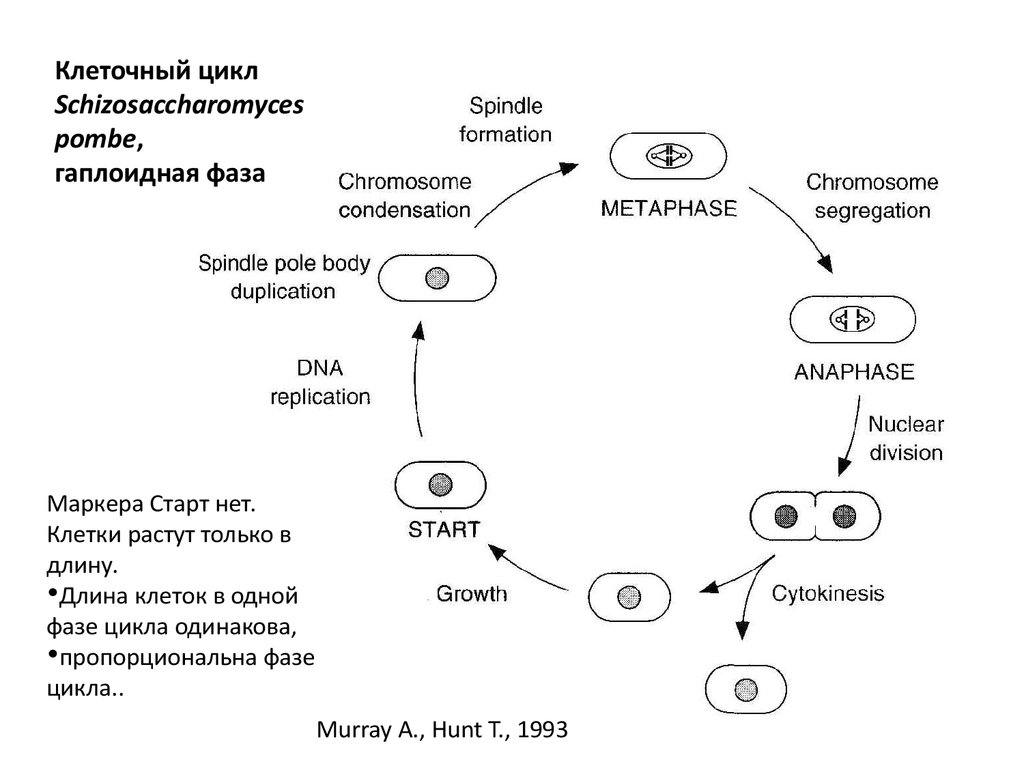
Клеточный циклSchizosaccharomyces
pombe,
гаплоидная фаза
Маркера Старт нет.
Клетки растут только в
длину.
•Длина клеток в одной
фазе цикла одинакова,
•пропорциональна фазе
цикла..
Murray A., Hunt T., 1993
27.
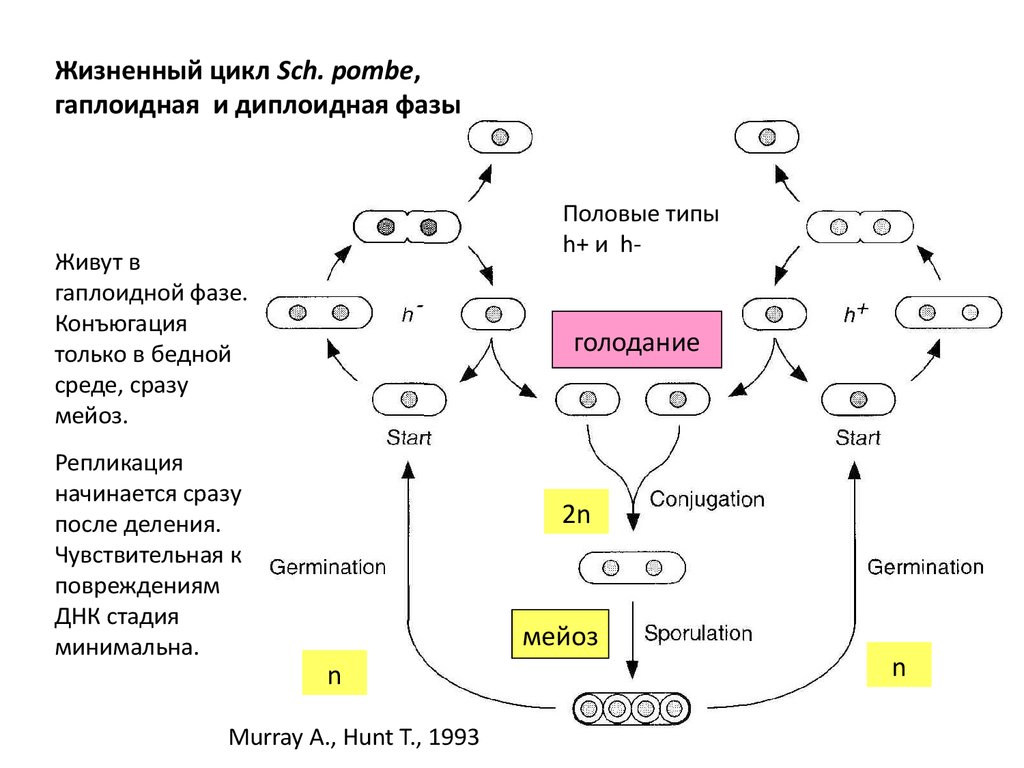
Жизненный цикл Sch. pombe,гаплоидная и диплоидная фазы
Половые типы
h+ и h-
Живут в
гаплоидной фазе.
Конъюгация
только в бедной
среде, сразу
мейоз.
Репликация
начинается сразу
после деления.
Чувствительная к
повреждениям
ДНК стадия
минимальна.
голодание
2n
мейоз
n
Murray A., Hunt T., 1993
n
28.
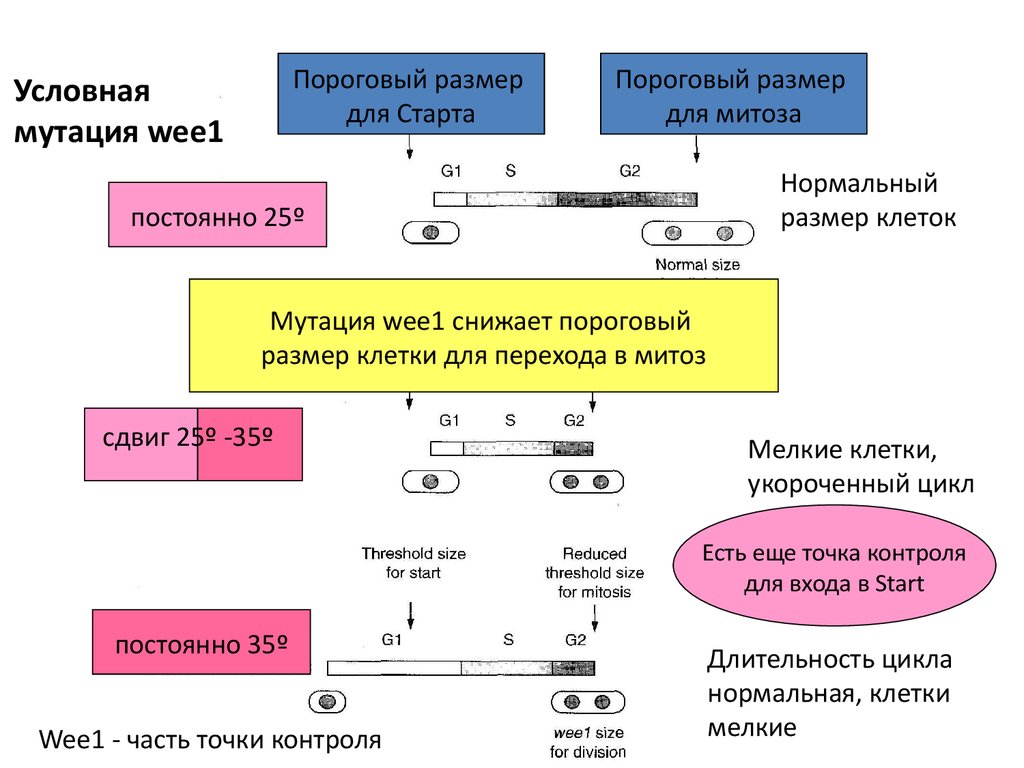
Пороговый размердля Старта
Условная
мутация wee1
Пороговый размер
для митоза
Нормальный
размер клеток
постоянно 25º
Мутация wee1 снижает пороговый
размер клетки для перехода в митоз
сдвиг 25º -35º
Мелкие клетки,
укороченный цикл
Есть еще точка контроля
для входа в Start
постоянно 35º
Wee1 - часть точки контроля
Длительность цикла
нормальная, клетки
мелкие
29.
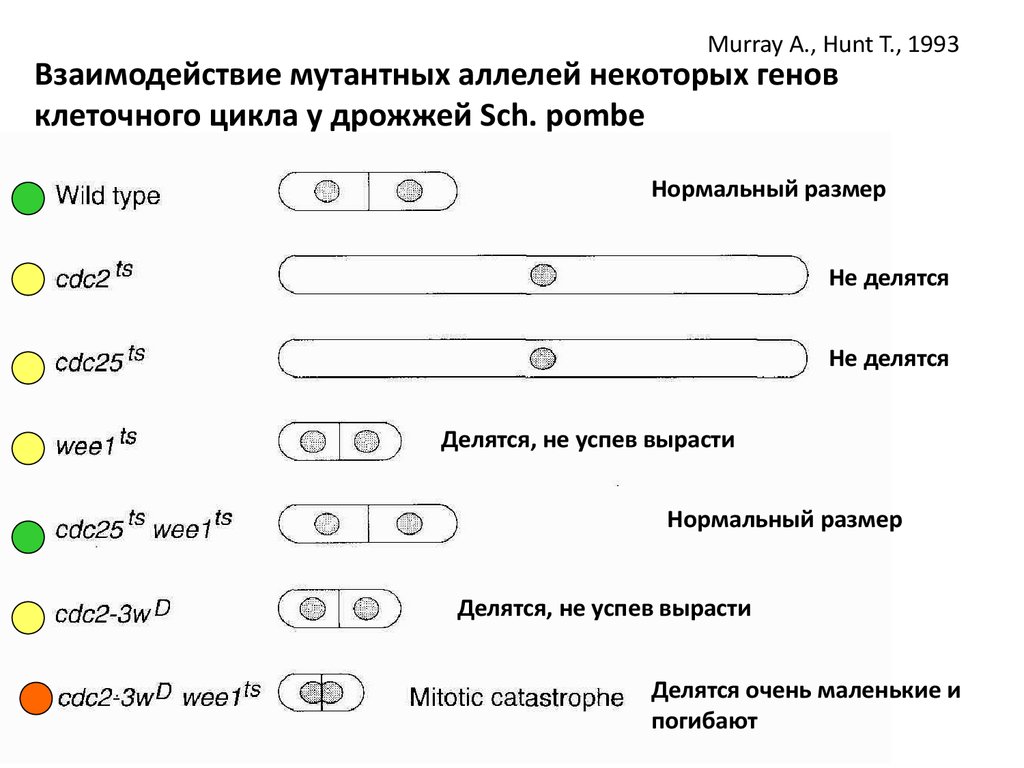
Murray A., Hunt T., 1993Взаимодействие мутантных аллелей некоторых генов
клеточного цикла у дрожжей Sch. pombe
Нормальный размер
Не делятся
Не делятся
Делятся, не успев вырасти
Нормальный размер
Делятся, не успев вырасти
Делятся очень маленькие и
погибают
30.
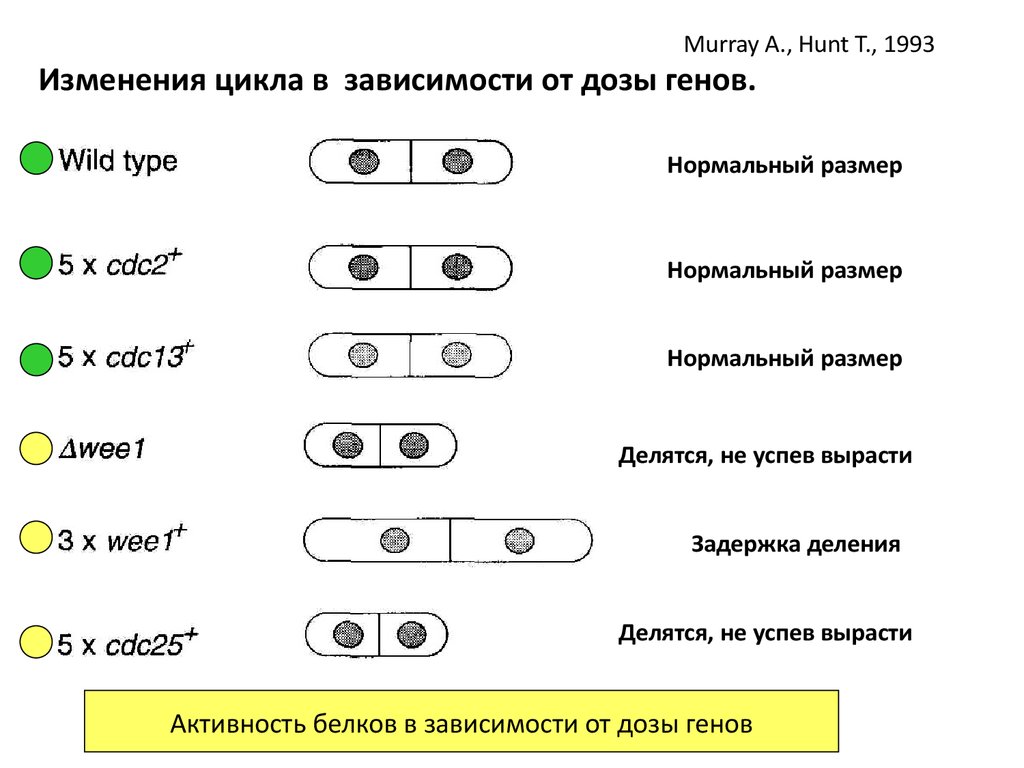
Murray A., Hunt T., 1993Изменения цикла в зависимости от дозы генов.
Нормальный размер
Нормальный размер
Нормальный размер
Делятся, не успев вырасти
Задержка деления
Делятся, не успев вырасти
Активность белков в зависимости от дозы генов
31.
Проанализировав взаимодействия, пришли к выводам:• Cdc2-главный индуктор митоза
• Wee1 – ингибирует Cdc2
• Cdc25 – активирует Cdc2
регуляторы
32.
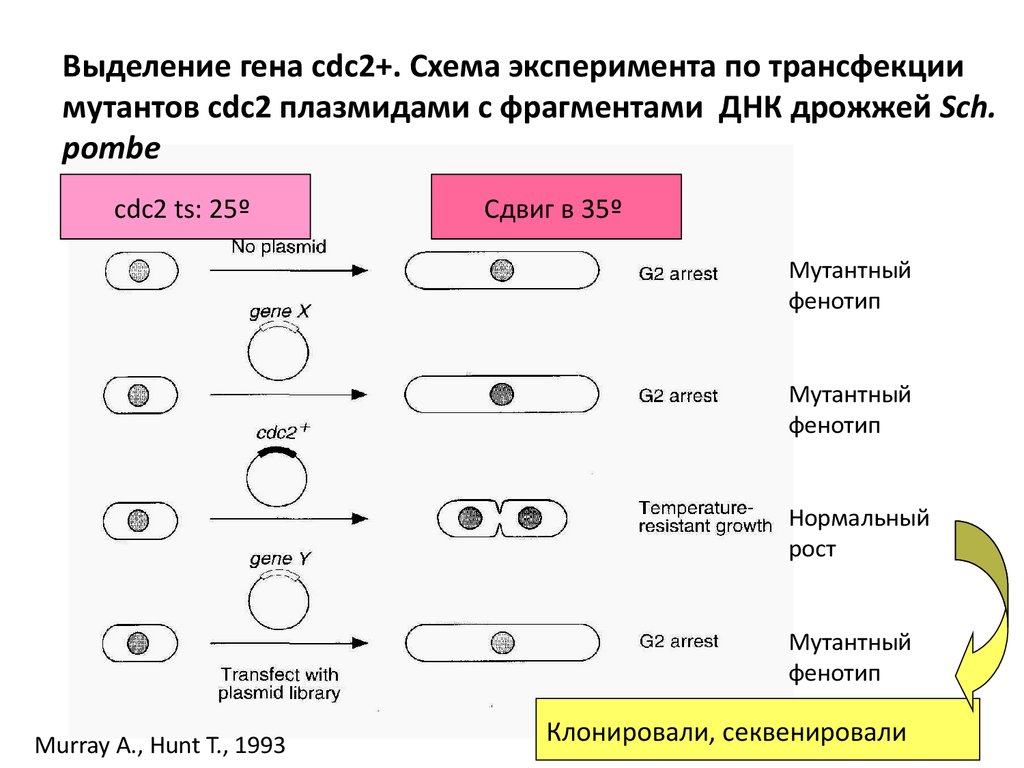
Выделение гена cdc2+. Схема эксперимента по трансфекциимутантов cdc2 плазмидами с фрагментами ДНК дрожжей Sch.
pombe
cdc2 ts: 25º
Сдвиг в 35º
Мутантный
фенотип
Мутантный
фенотип
Нормальный
рост
Мутантный
фенотип
Murray A., Hunt T., 1993
Клонировали, секвенировали
33.
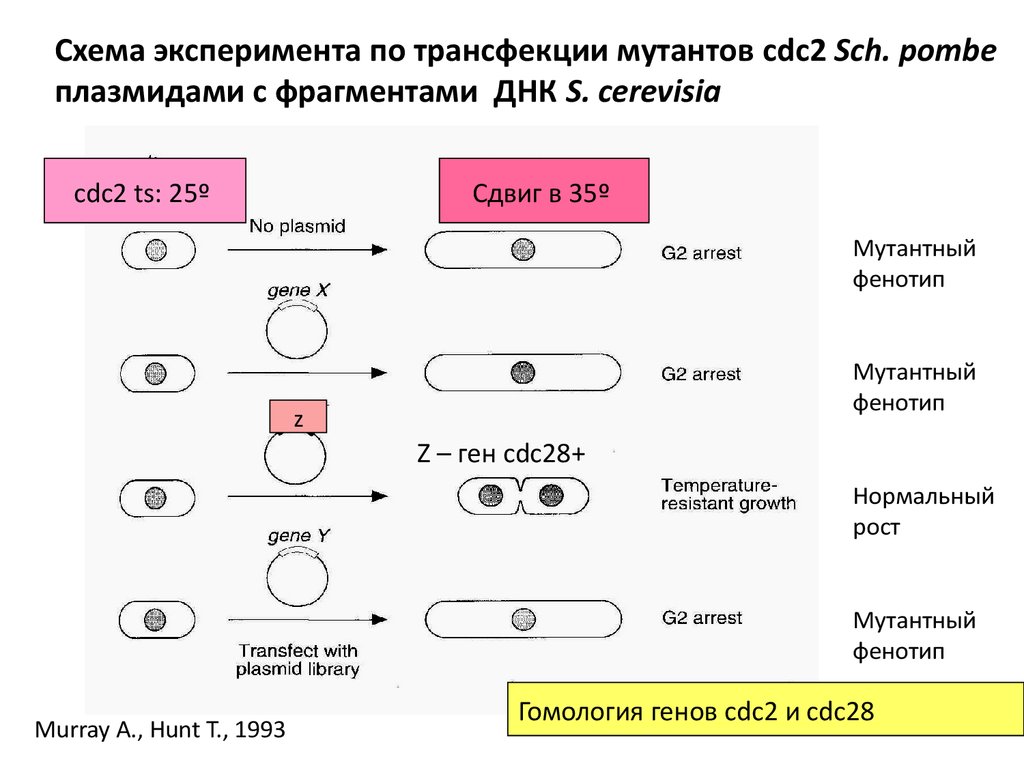
Схема эксперимента по трансфекции мутантов cdc2 Sch. pombeплазмидами с фрагментами ДНК S. cerevisia
cdc2 ts: 25º
Сдвиг в 35º
Мутантный
фенотип
Мутантный
фенотип
z
Z – ген cdc28+
Нормальный
рост
Мутантный
фенотип
Murray A., Hunt T., 1993
Гомология генов сdc2 и cdc28
34.
Клонировали и секвенировали гены -аналогисdc2 (Sch. pombe) и cdc28 (S. cerevisia) - 60 % гомологии.
Играют ключевую роль в регуляции цикла.
Продукт гена – полипептид длиной 297 ак (34 кДа).
Протеинкиназа: Серин-треонинкиназа p34 cdc2
Аналогичным способом получили ген cdc2+ человека в культуре cdc2 ts
при рестриктивной температуре.
Таким же способом получили и клонировали гены cdc13+, cdc25+,
wee1+.
cdc13+ - продукт длиной 482 ак оказался гомологичен уже известным
циклинам группы В.
cdc25+ - фосфатаза
wee1+ - протеинкиназа
35.
К 1988 г:•генетики показали, что цикл регулируется киназами
Cdc2/Cdc28 у всех видов,
•биохимики и физиологи – что MPF универсален для митоза и
мейоза,
•количество циклина меняется в клеточном цикле, какова
его роль?
Из 1 литра лягушачьих яиц выделили 1 мкг MPF:
антитела на циклин дрожжей выявили субъединицу 46 кДа.
антитела на Cdc2 дрожжей выявили субъединицу 34 кДа.
Выявили киназную активность – по фосфорилированию гистона Н1
Свойства MPF изучали в бесклеточной системе
36.
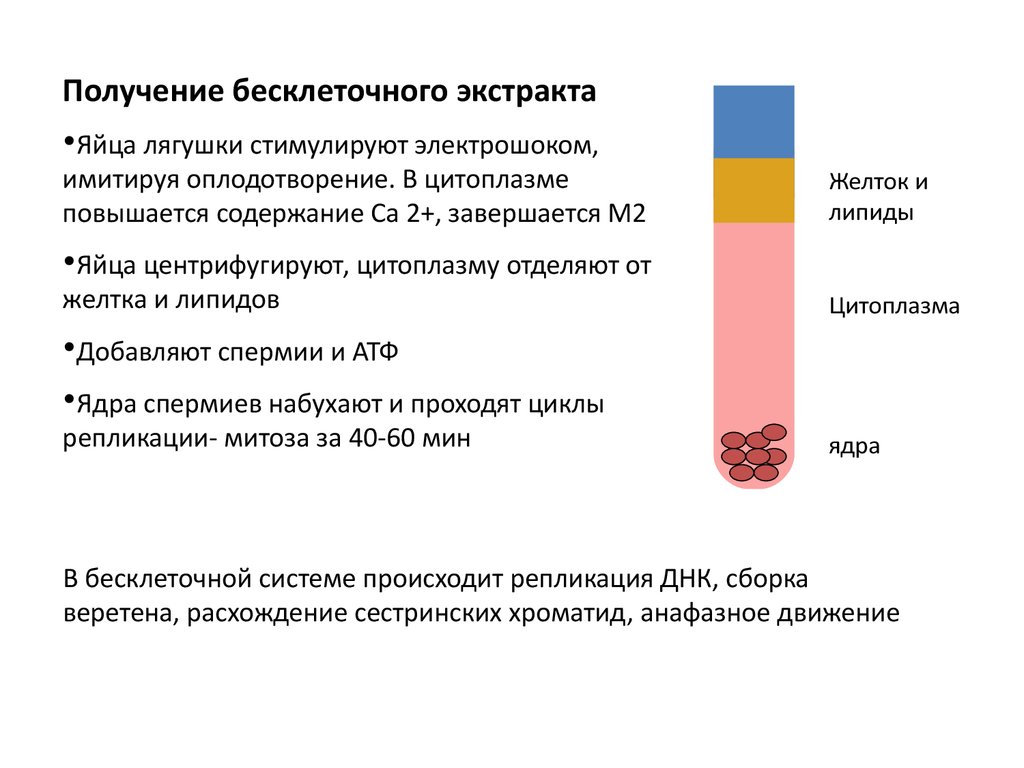
Получение бесклеточного экстракта•Яйца лягушки стимулируют электрошоком,
имитируя оплодотворение. В цитоплазме
повышается содержание Са 2+, завершается М2
Желток и
липиды
•Яйца центрифугируют, цитоплазму отделяют от
желтка и липидов
Цитоплазма
•Добавляют спермии и АТФ
•Ядра спермиев набухают и проходят циклы
репликации- митоза за 40-60 мин
ядра
В бесклеточной системе происходит репликация ДНК, сборка
веретена, расхождение сестринских хроматид, анафазное движение
37.
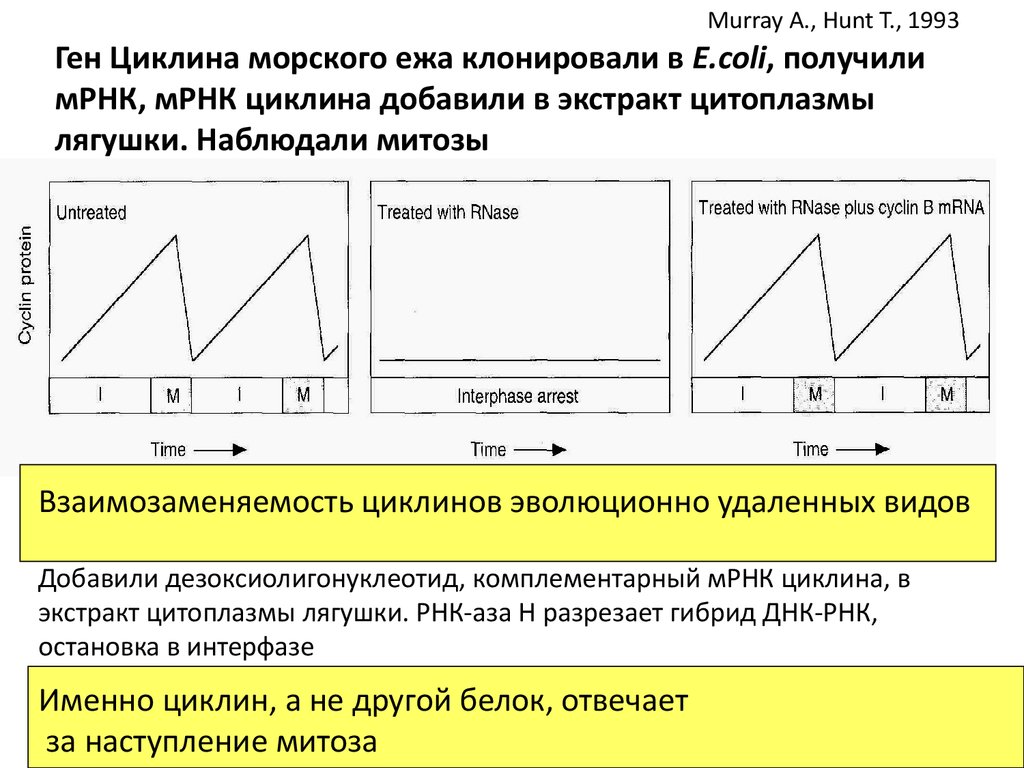
Murray A., Hunt T., 1993Ген Циклина морского ежа клонировали в E.coli, получили
мРНК, мРНК циклина добавили в экстракт цитоплазмы
лягушки. Наблюдали митозы
Взаимозаменяемость циклинов эволюционно удаленных видов
Добавили дезоксиолигонуклеотид, комплементарный мРНК циклина, в
экстракт цитоплазмы лягушки. РНК-аза Н разрезает гибрид ДНК-РНК,
остановка в интерфазе
Именно циклин, а не другой белок, отвечает
за наступление митоза
38.
Проверка гипотезы:для инактивации MPF нужна деградация циклина.
Отсутствие деградации должно остановить цикл в митозе.
Мутантная форма циклина: в белке отсутствует концевой фрагмент из
90 ак. Добавили в бесклеточный экстракт, деления остановились
За деградацию циклина отвечает концевой фрагмент
39.
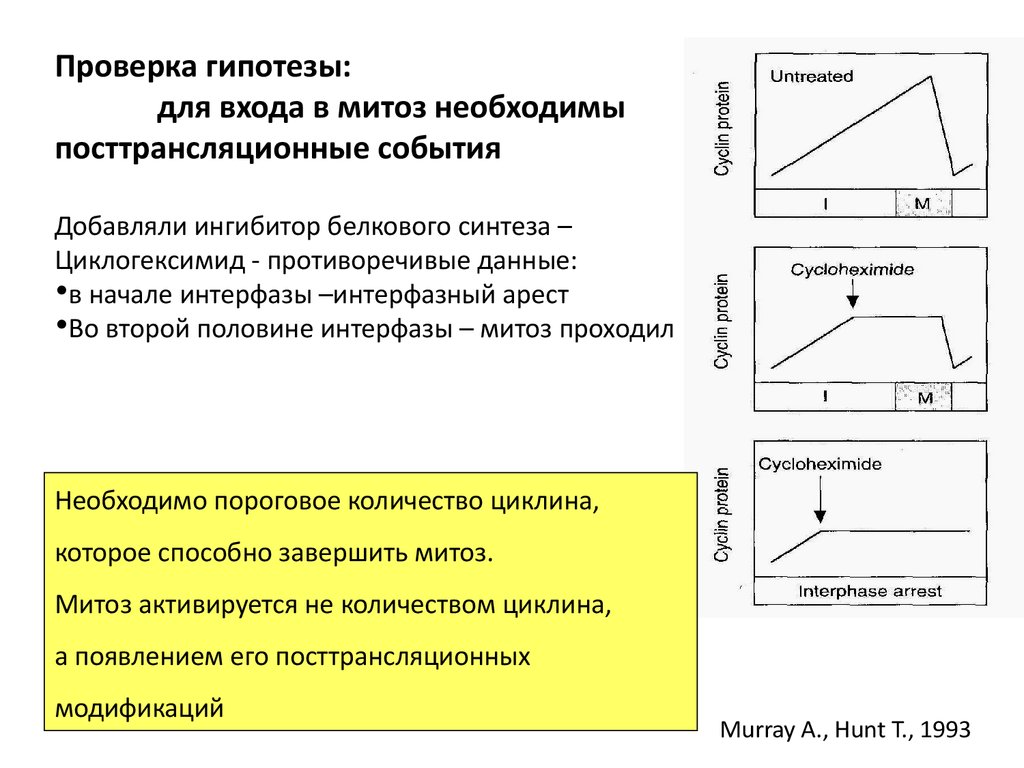
Проверка гипотезы:для входа в митоз необходимы
посттрансляционные события
Добавляли ингибитор белкового синтеза –
Циклогексимид - противоречивые данные:
•в начале интерфазы –интерфазный арест
•Во второй половине интерфазы – митоз проходил
Необходимо пороговое количество циклина,
которое способно завершить митоз.
Митоз активируется не количеством циклина,
а появлением его посттрансляционных
модификаций
Murray A., Hunt T., 1993
40.
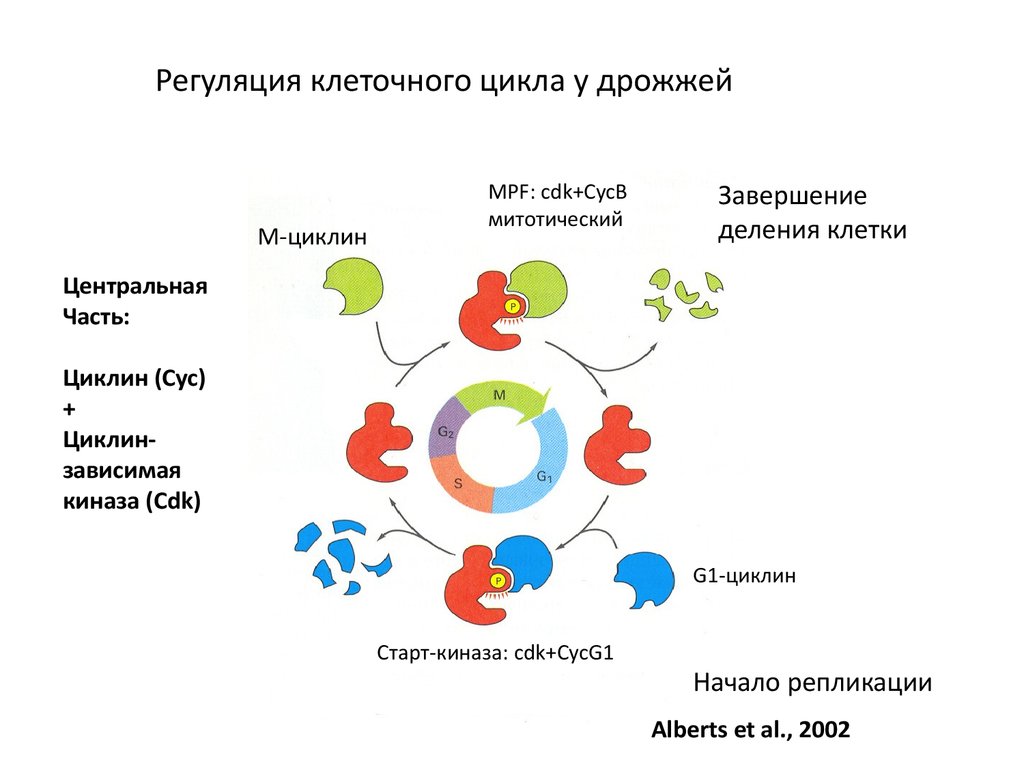
Регуляция клеточного цикла у дрожжейМ-циклин
MPF: cdk+CycB
митотический
Завершение
деления клетки
Центральная
Часть:
Циклин (Cyc)
+
Циклинзависимая
киназа (Cdk)
G1-циклин
Старт-киназа: cdk+CycG1
Начало репликации
Alberts et al., 2002
41.
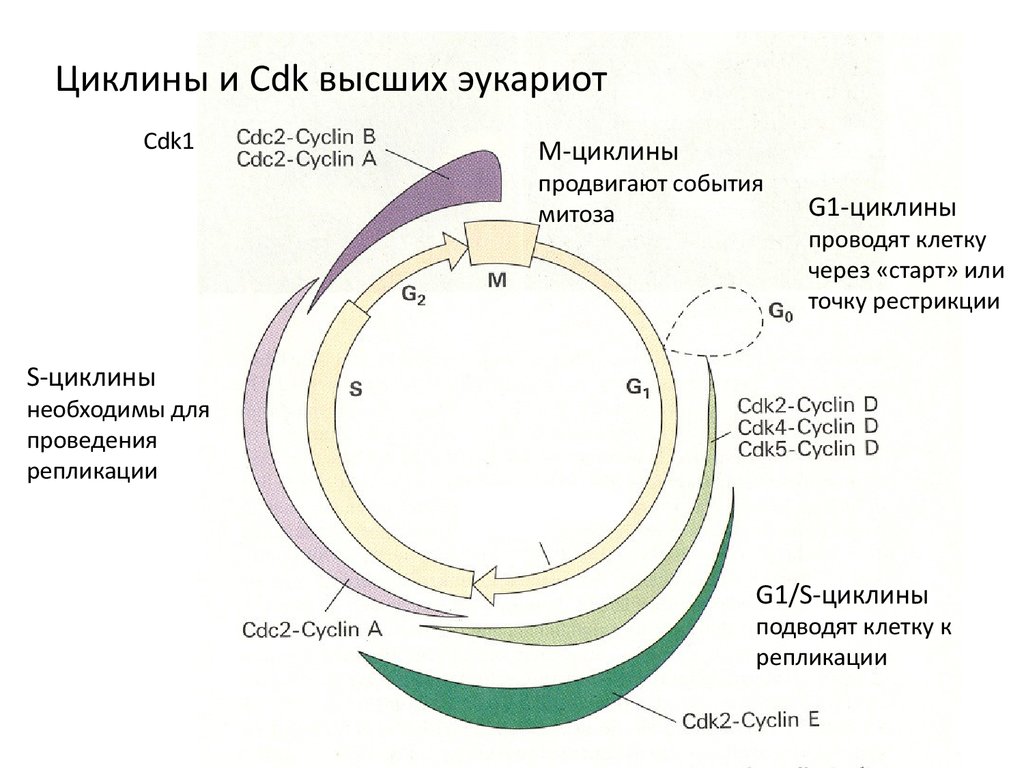
Циклины и Cdk высших эукариотCdk1
М-циклины
продвигают события
митоза
G1-циклины
проводят клетку
через «старт» или
точку рестрикции
S-циклины
необходимы для
проведения
репликации
G1/S-циклины
подводят клетку к
репликации
42. CDK-каталитическая субъединица MPF, циклин - активаторная
В настоящее время известно восемь циклинов, обозначаемых латинскими
буквами от А до Н. Все циклины имеют общую последовательность длиной 100150 аминокислотных остатков - консервативный циклиновый бокс, который
необходим для связывания с CDK. На основании анализа кристаллической
структуры циклин А1 состоит из двух компактных центральных доменов, каждый
из которых представлен пятью спиралями, и двух дополнительных спиралей у Си N-конца.
CDK1 ассоциируется с циклинами A и B и участвуют в переходе G2-M .
CDK2 может связываться с циклинами A , E , D2 и D3 (но не D1) и является
одной из основных киназ, регулирующих переход G1-S и прохождение через Sпериод.
CDK3 экспрессируется в большинстве линий на незначительном уровне, и ее
функция пока не выяснена, хотя предполагается, что она, подобно CDK2,
участвует в переходе G1-S. Данные о роли CDK5 и о взаимодействующих с ней
циклинах противоречивы.
СDK4 и CDK6 участвуют в регуляции перехода G1-S . Они являются основными
каталитическими партнерами циклинов D -типа, образуя с ними
функциональные комплексы, обладающие субстратной специфичностью к белку
Rb.
43.
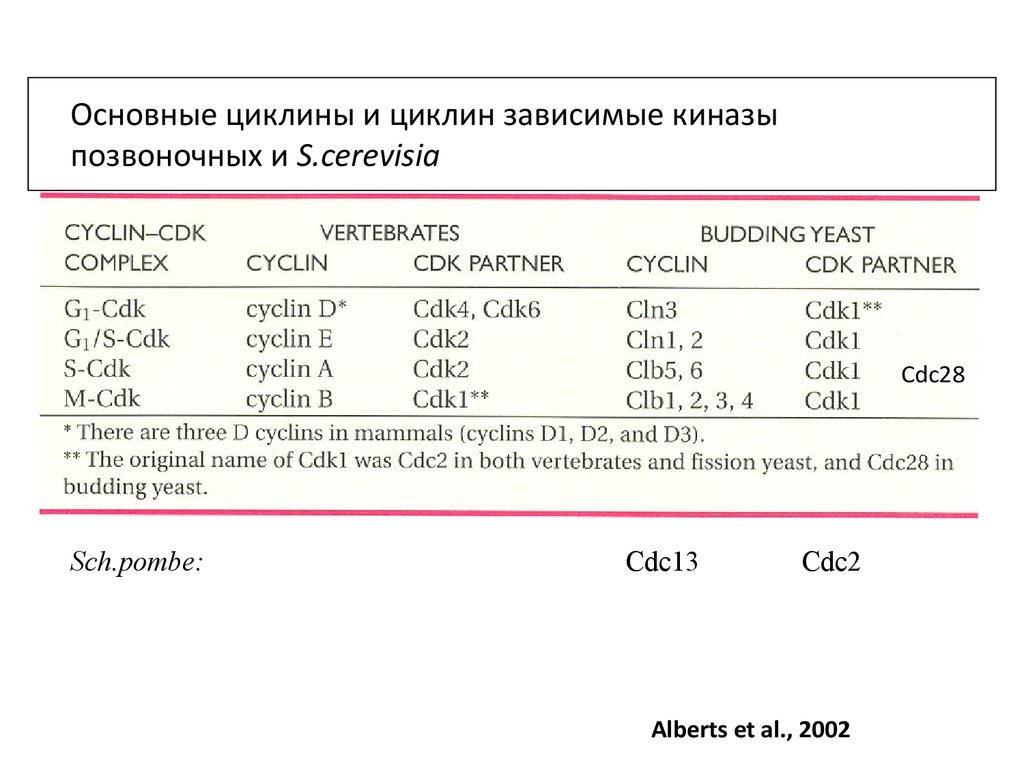
Основные циклины и циклин зависимые киназыпозвоночных и S.cerevisia
Cdc28
Sch.pombe:
Cdc13
Cdc2
Alberts et al., 2002
44.
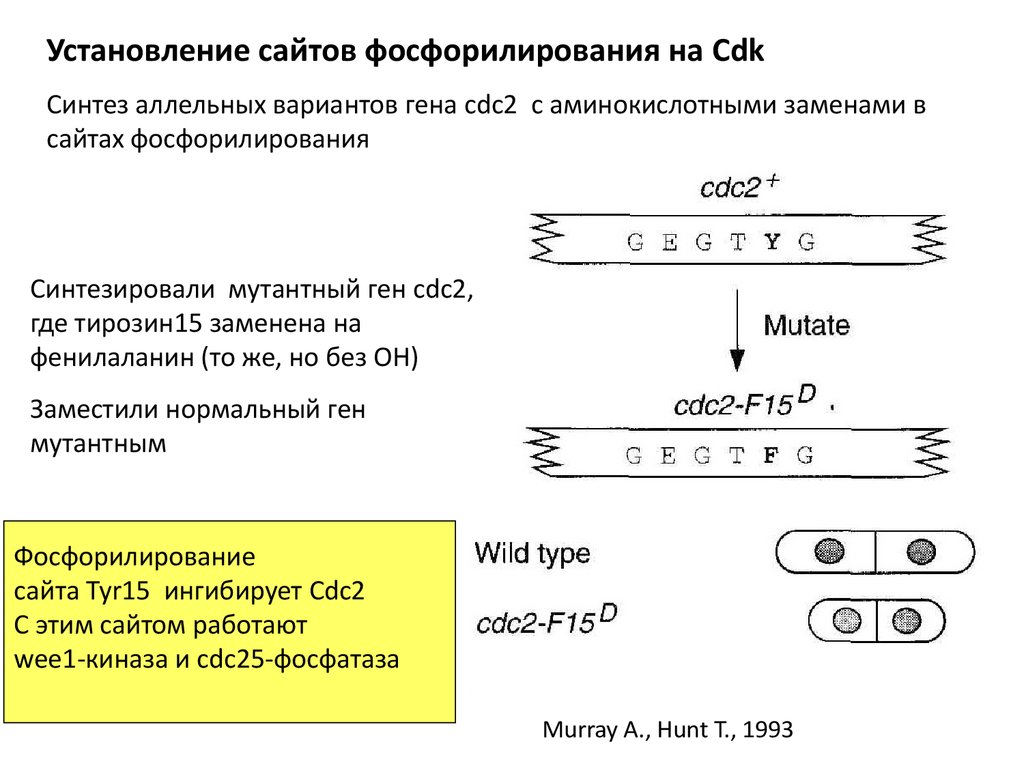
Установление сайтов фосфорилирования на CdkСинтез аллельных вариантов гена cdc2 с аминокислотными заменами в
сайтах фосфорилирования
Синтезировали мутантный ген cdc2,
где тирозин15 заменена на
фенилаланин (то же, но без ОН)
Заместили нормальный ген
мутантным
Фосфорилирование
сайта Tyr15 ингибирует Cdc2
С этим сайтом работают
wee1-киназа и cdc25-фосфатаза
Murray A., Hunt T., 1993
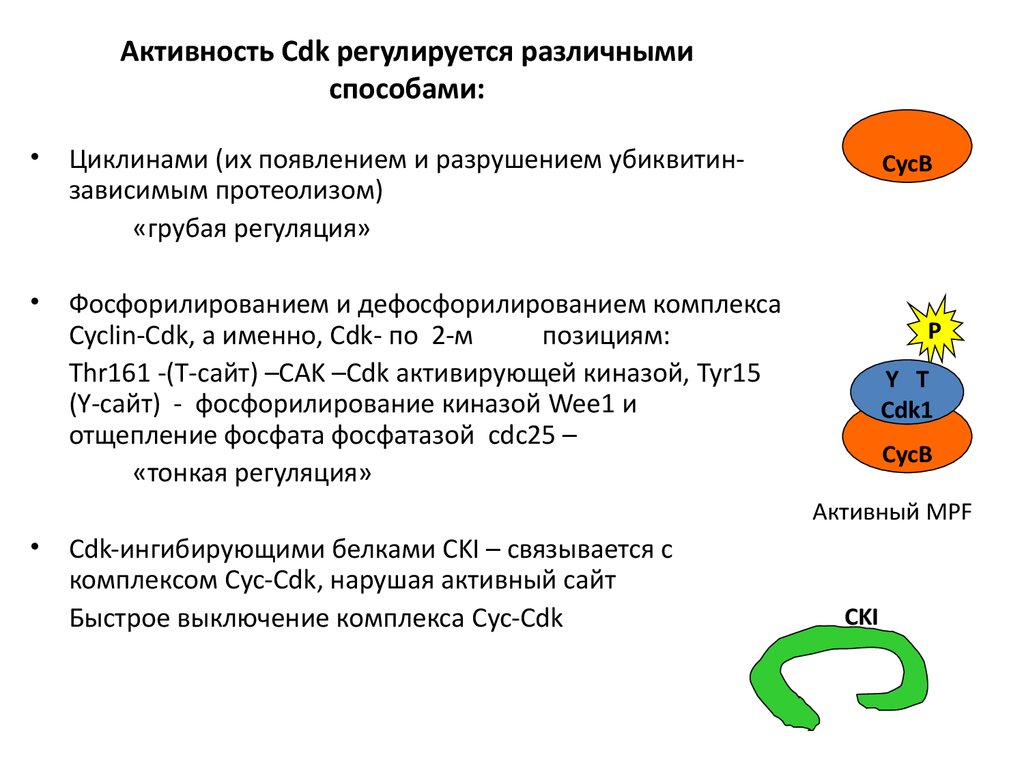
45. Активность Cdk регулируется различными способами:
Циклинами (их появлением и разрушением убиквитинзависимым протеолизом)
«грубая регуляция»
Фосфорилированием и дефосфорилированием комплекса
Cyclin-Cdk, а именно, Cdk- по 2-м
позициям:
Thr161 -(T-сайт) –CAK –Cdk активирующей киназой, Tyr15
(Y-сайт) - фосфорилирование киназой Wee1 и
отщепление фосфата фосфатазой cdc25 –
«тонкая регуляция»
CycB
P
Y T
Cdk1
CycB
Активный MPF
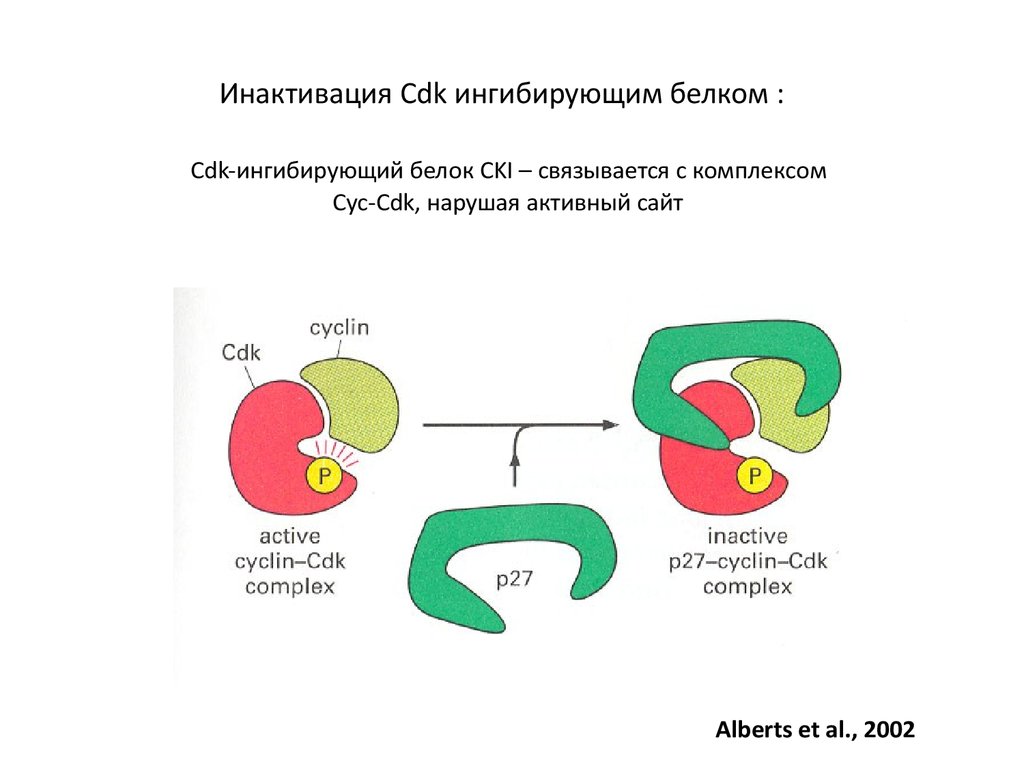
Cdk-ингибирующими белками CKI – связывается с
комплексом Cyc-Cdk, нарушая активный сайт
Быстрое выключение комплекса Cyc-Cdk
CKI
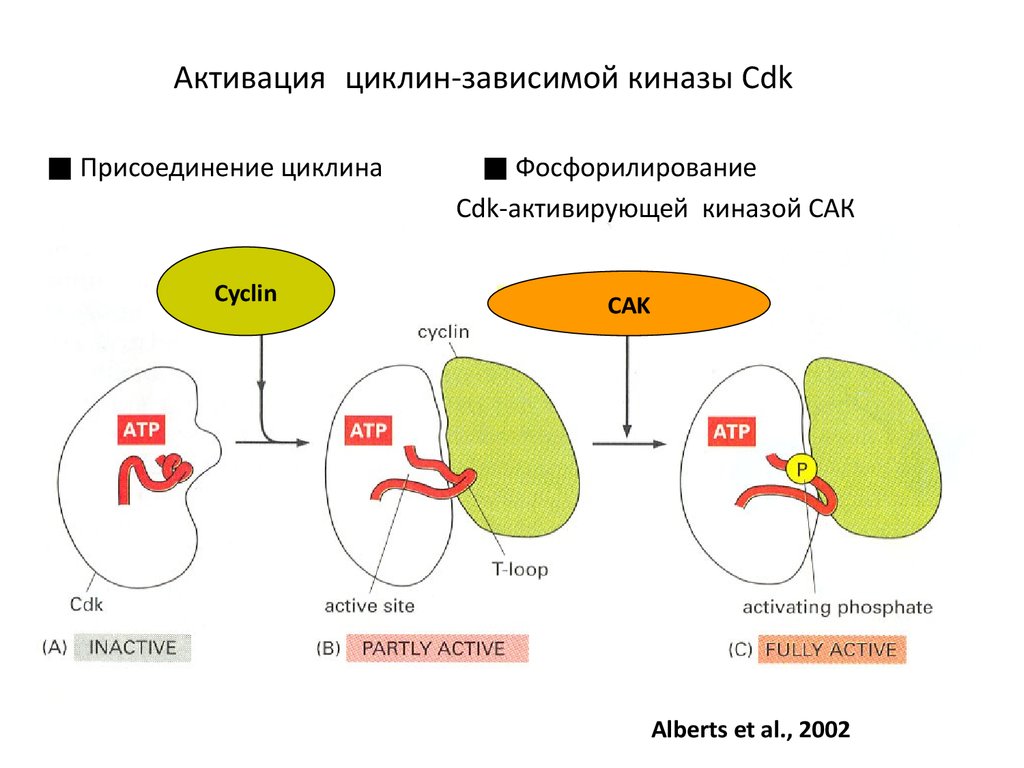
46. Активация циклин-зависимой киназы Cdk
■ Присоединение циклинаCyclin
■ Фосфорилирование
Cdk-активирующей киназой САК
CAK
Alberts et al., 2002
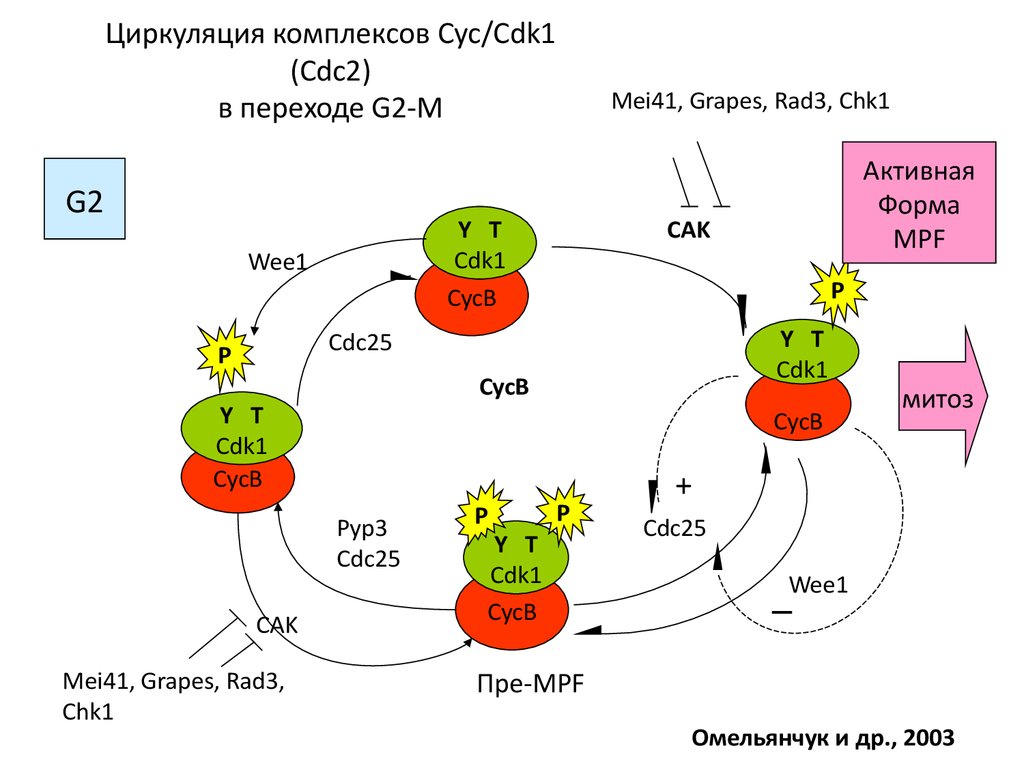
47. Циркуляция комплексов Cyc/Cdk1 (Cdc2) в переходе G2-M
G2Mei41, Grapes, Rad3, Chk1
CAK
Y T
Cdk1
CycB
Wee1
P
Y T
Cdk1
Cdc25
P
CycB
Y T
Cdk1
CycB
CycB
Pyp3
Cdc25
CAK
Mei41, Grapes, Rad3,
Chk1
Активная
Форма
MPF
P
P
Y T
Cdk1
CycB
митоз
+
Cdc25
Wee1
─
Пре-MPF
Омельянчук и др., 2003
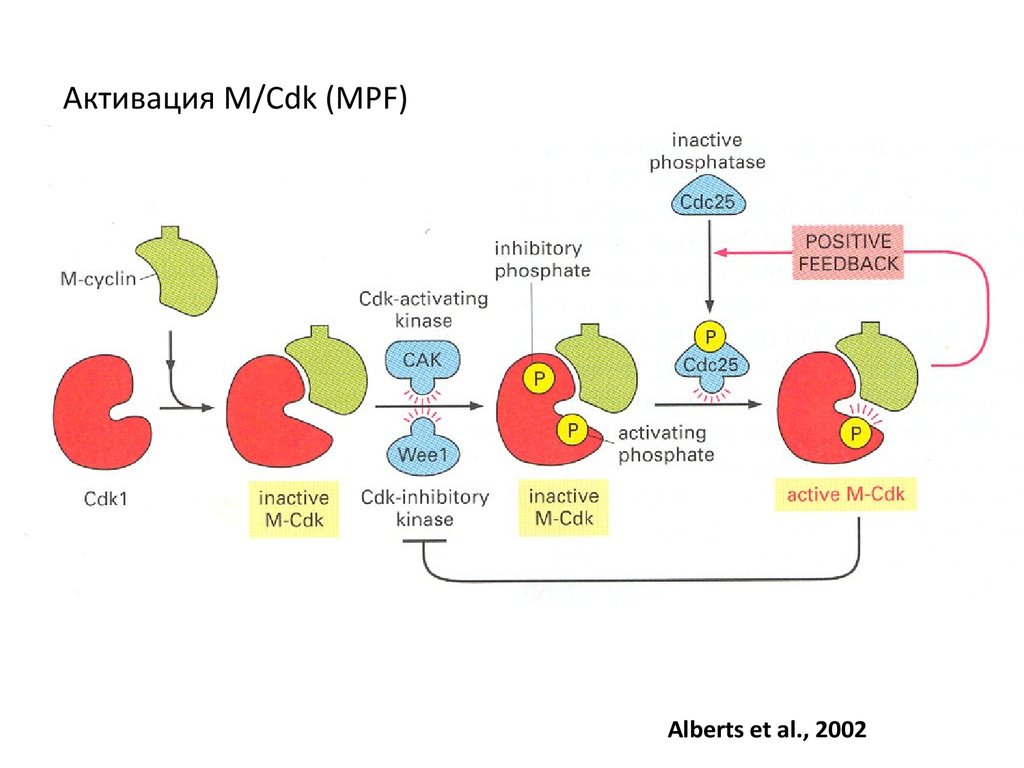
48.
Активация M/Cdk (MPF)Alberts et al., 2002
49. Инактивация Cdk ингибирующим белком : Cdk-ингибирующий белок CKI – связывается с комплексом Cyc-Cdk, нарушая активный сайт
Alberts et al., 200250.
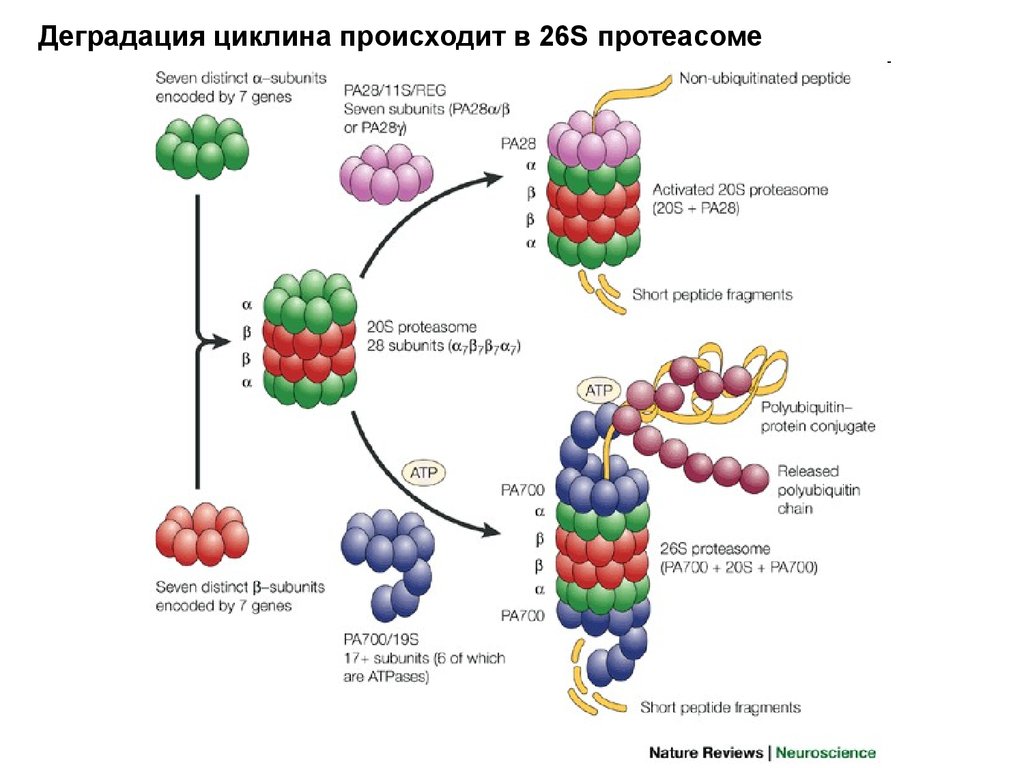
Деградация циклина происходит в 26S протеасоме51.
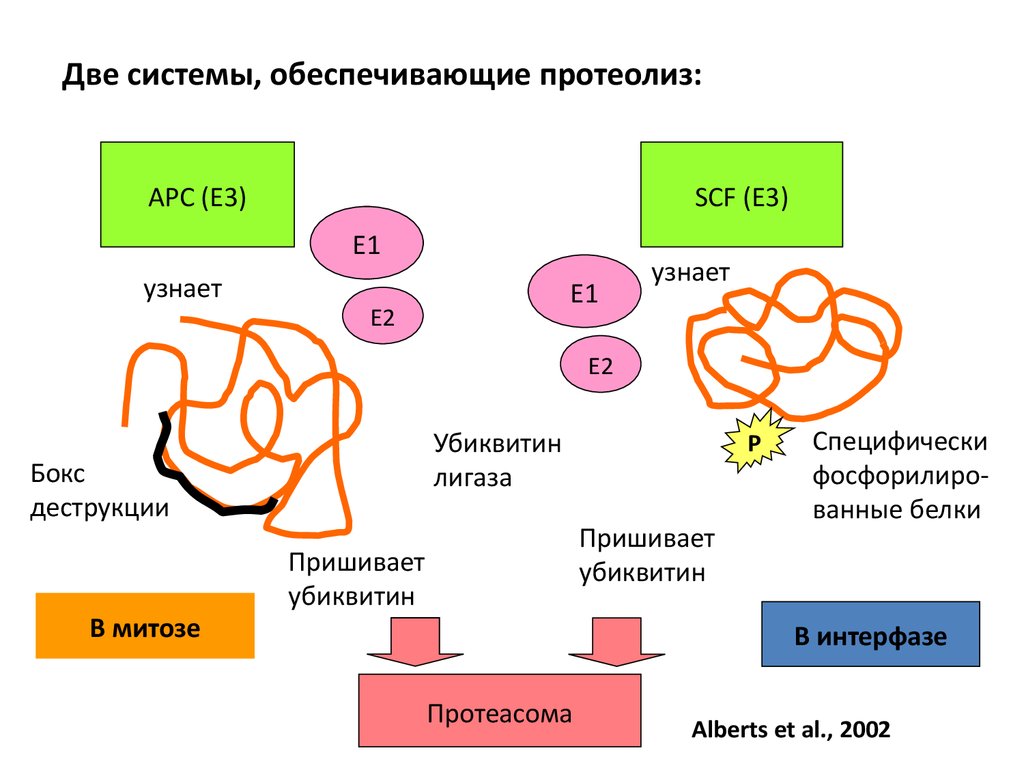
Две системы, обеспечивающие протеолиз:APC (Е3)
SCF (Е3)
E1
узнает
E1
E2
узнает
E2
Убиквитин
лигаза
Бокс
деструкции
В митозе
P
Пришивает
убиквитин
Пришивает
убиквитин
Специфически
фосфорилированные белки
В интерфазе
Протеасома
Alberts et al., 2002
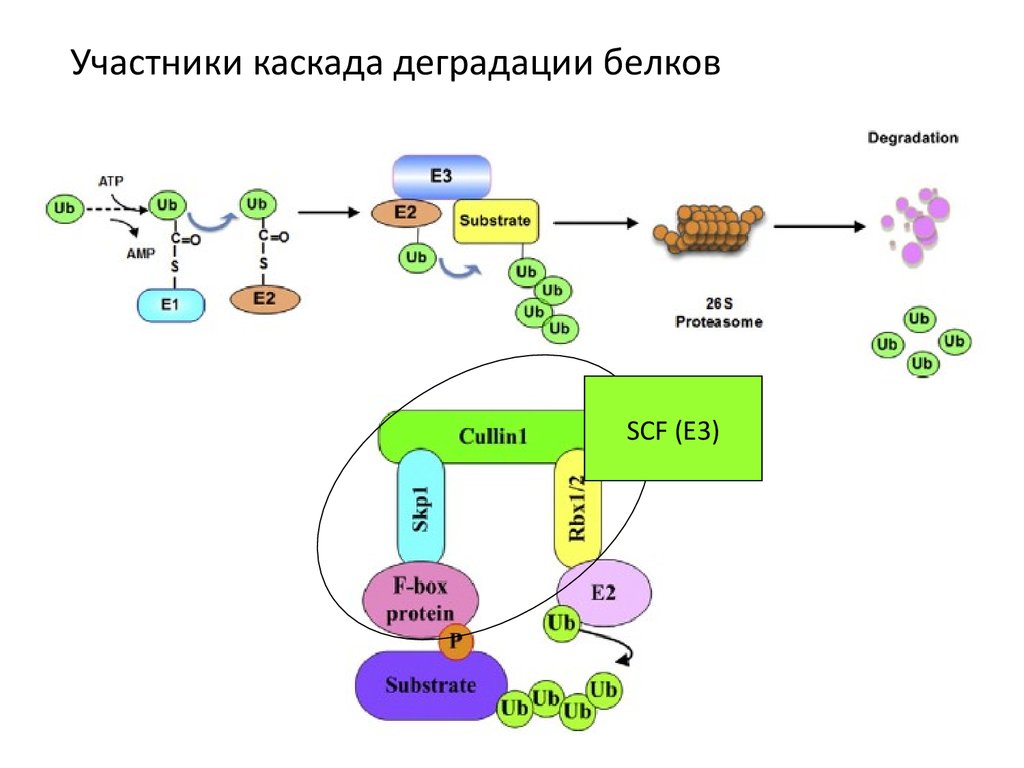
52.
Участники каскада деградации белковSCF (Е3)
53.
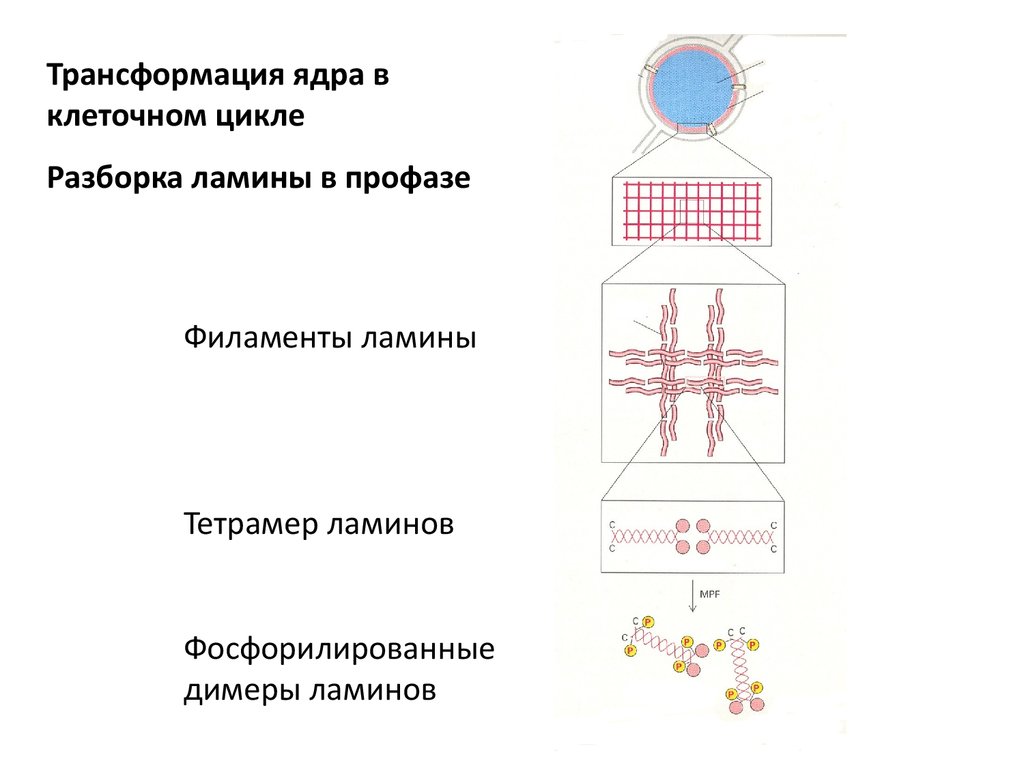
Трансформация ядра вклеточном цикле
Разборка ламины в профазе
Филаменты ламины
Тетрамер ламинов
Фосфорилированные
димеры ламинов
54.
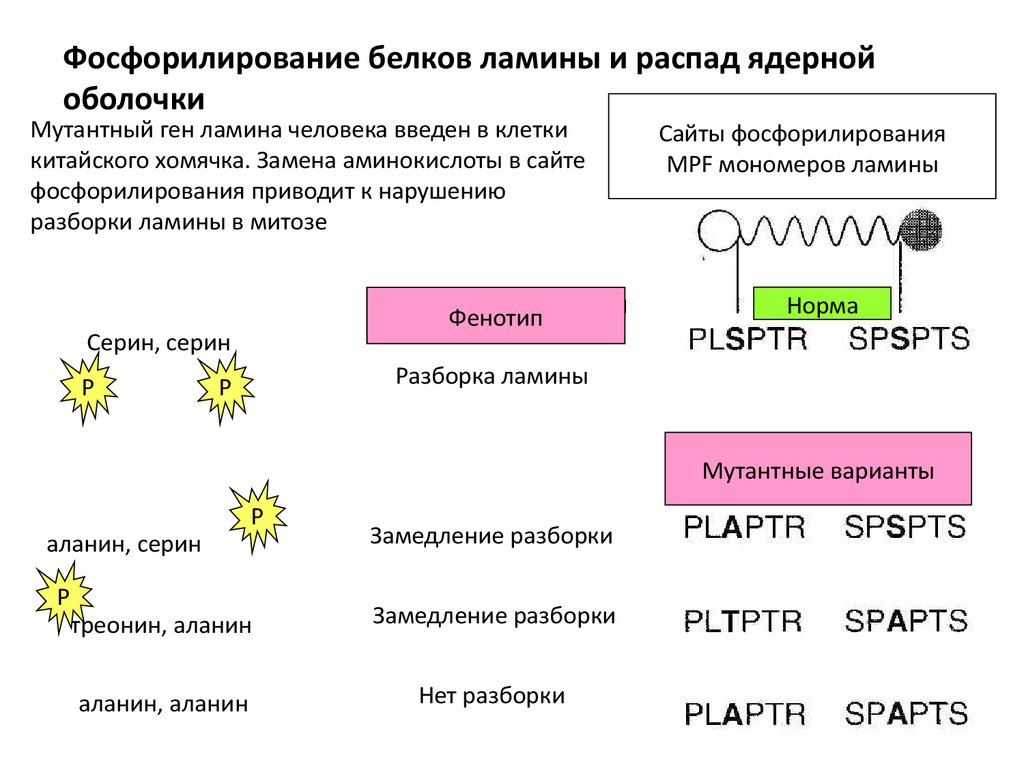
Фосфорилирование белков ламины и распад ядернойоболочки
Мутантный ген ламина человека введен в клетки
китайского хомячка. Замена аминокислоты в сайте
фосфорилирования приводит к нарушению
разборки ламины в митозе
Фенотип
Серин, серин
P
Сайты фосфорилирования
MPF мономеров ламины
Норма
Разборка ламины
P
Мутантные варианты
аланин, серин
P
P
Замедление разборки
треонин, аланин
Замедление разборки
аланин, аланин
Нет разборки
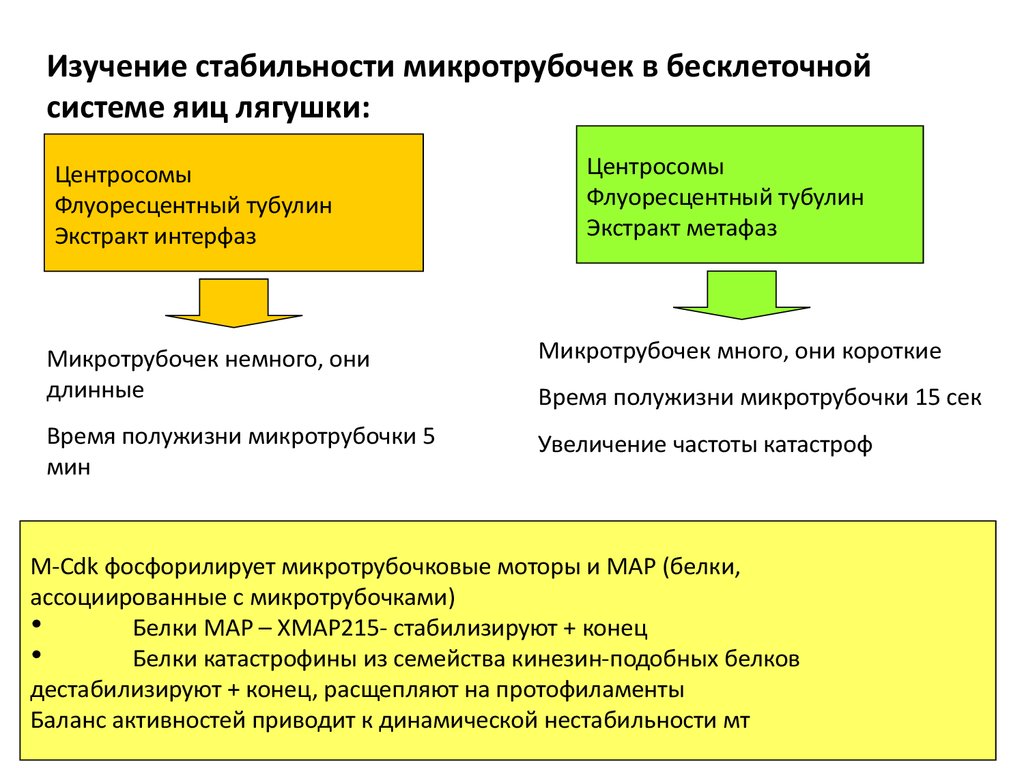
55.
Изучение стабильности микротрубочек в бесклеточнойсистеме яиц лягушки:
Центросомы
Флуоресцентный тубулин
Экстракт интерфаз
Центросомы
Флуоресцентный тубулин
Экстракт метафаз
Микротрубочек немного, они
длинные
Микротрубочек много, они короткие
Время полужизни микротрубочки 5
мин
Увеличение частоты катастроф
Время полужизни микротрубочки 15 сек
M-Cdk фосфорилирует микротрубочковые моторы и МАР (белки,
ассоциированные с микротрубочками)
Белки МАР – ХМАР215- стабилизируют + конец
Белки катастрофины из семейства кинезин-подобных белков
дестабилизируют + конец, расщепляют на протофиламенты
Баланс активностей приводит к динамической нестабильности мт
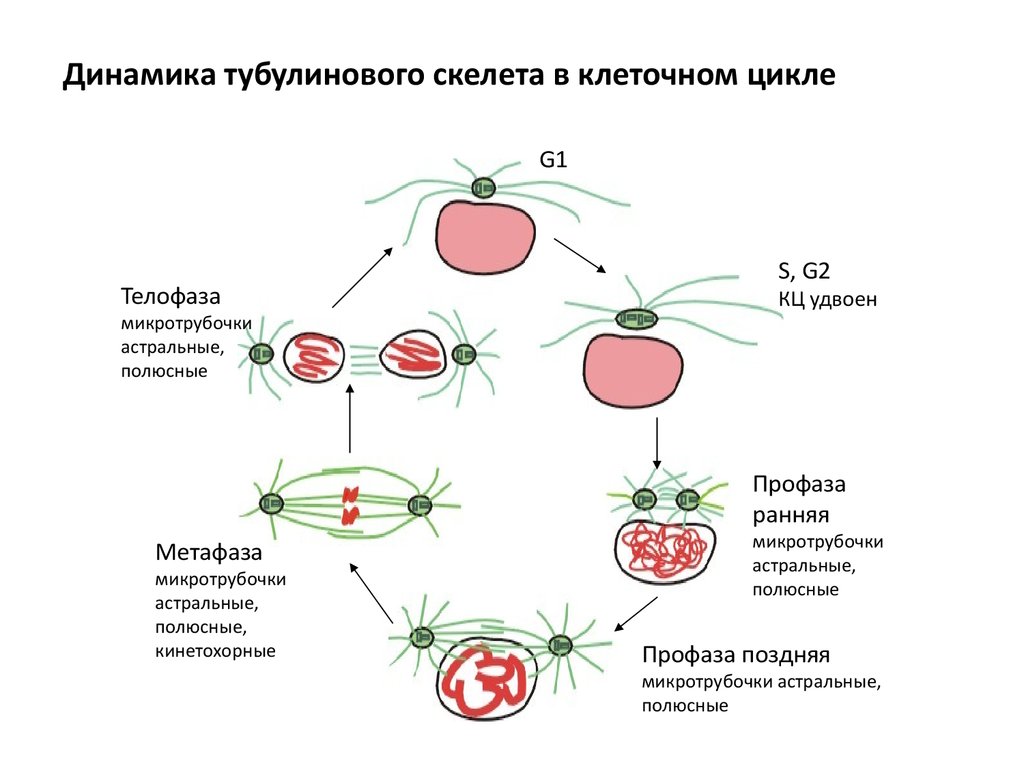
56.
Динамика тубулинового скелета в клеточном циклеG1
Телофаза
микротрубочки
астральные,
полюсные
S, G2
КЦ удвоен
Профаза
ранняя
Метафаза
микротрубочки
астральные,
полюсные,
кинетохорные
микротрубочки
астральные,
полюсные
Профаза поздняя
микротрубочки астральные,
полюсные
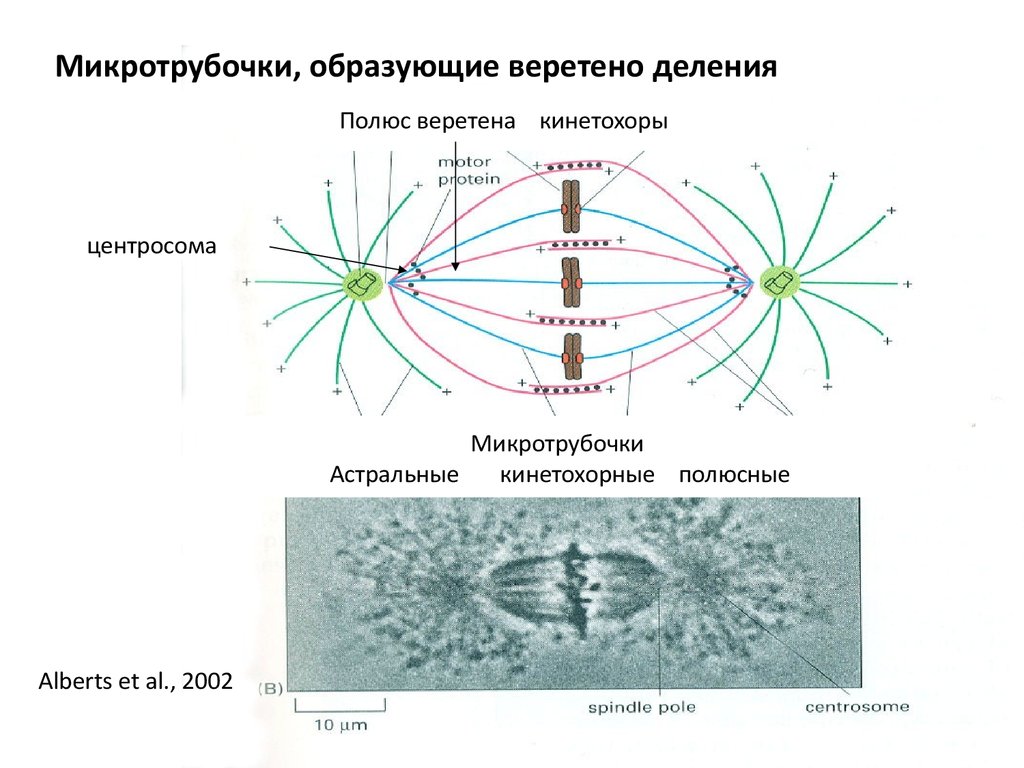
57.
Микротрубочки, образующие веретено деленияПолюс веретена кинетохоры
центросома
Микротрубочки
Астральные
кинетохорные полюсные
Alberts et al., 2002
58.
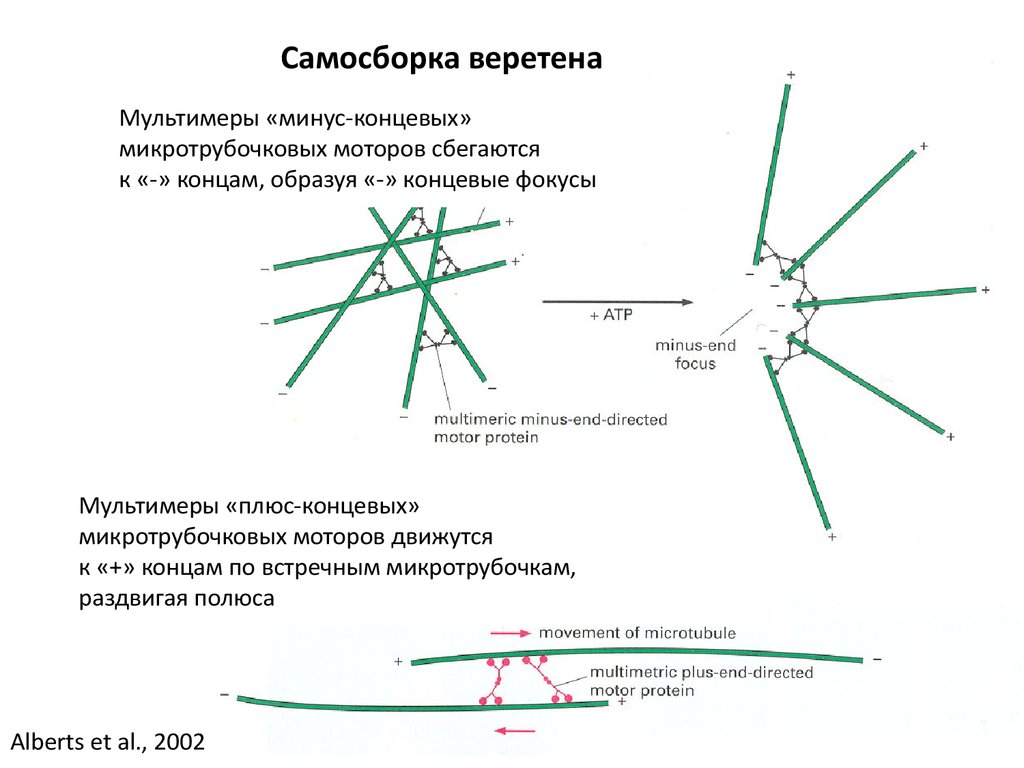
Самосборка веретенаМультимеры «минус-концевых»
микротрубочковых моторов сбегаются
к «-» концам, образуя «-» концевые фокусы
Мультимеры «плюс-концевых»
микротрубочковых моторов движутся
к «+» концам по встречным микротрубочкам,
раздвигая полюса
Alberts et al., 2002
59.
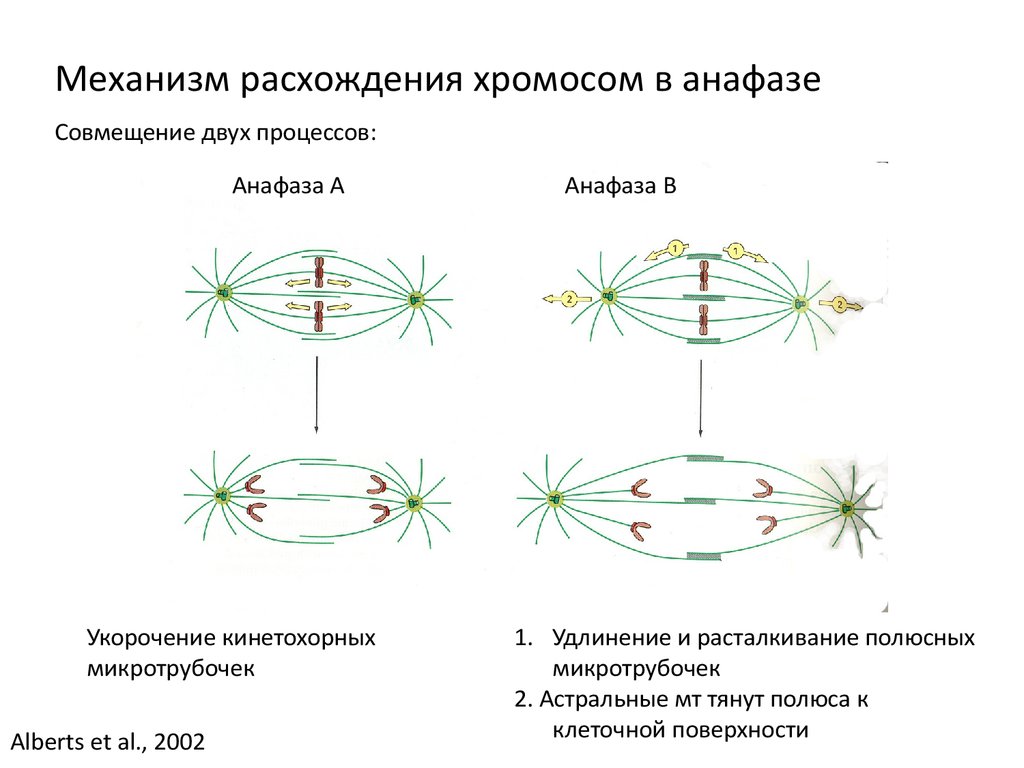
Механизм расхождения хромосом в анафазеСовмещение двух процессов:
Анафаза А
Укорочение кинетохорных
микротрубочек
Alberts et al., 2002
Анафаза В
1. Удлинение и расталкивание полюсных
микротрубочек
2. Астральные мт тянут полюса к
клеточной поверхности
60.
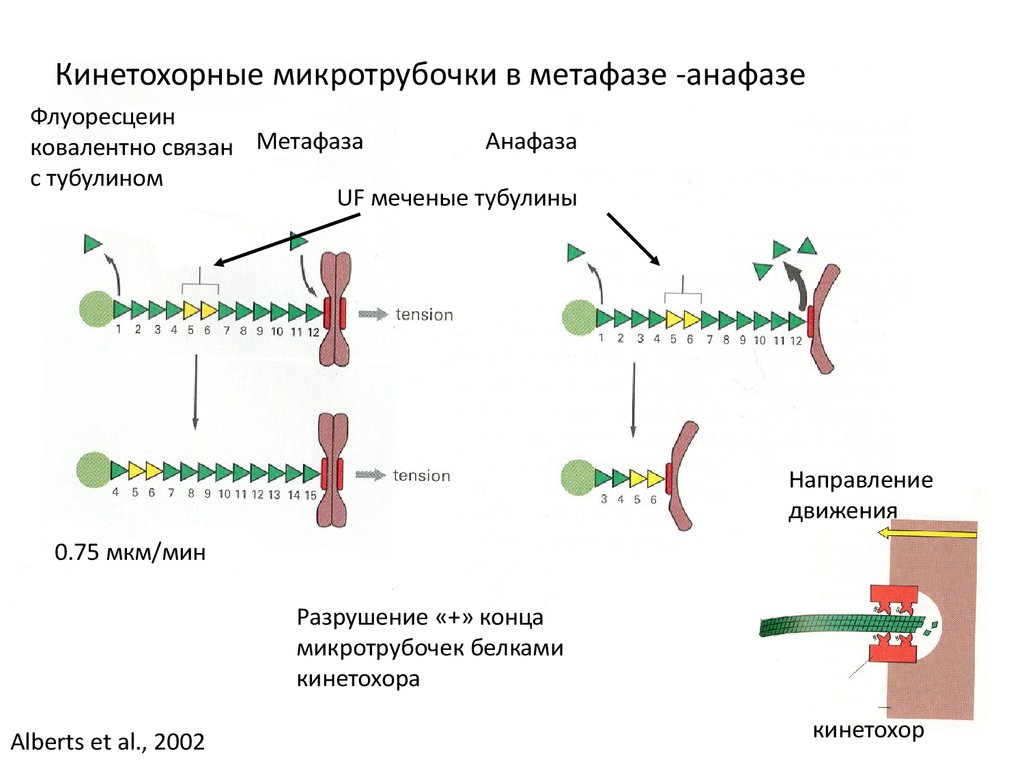
Кинетохорные микротрубочки в метафазе -анафазеФлуоресцеин
Анафаза
ковалентно связан Метафаза
с тубулином
UF меченые тубулины
Направление
движения
0.75 мкм/мин
Разрушение «+» конца
микротрубочек белками
кинетохора
Alberts et al., 2002
кинетохор
61.
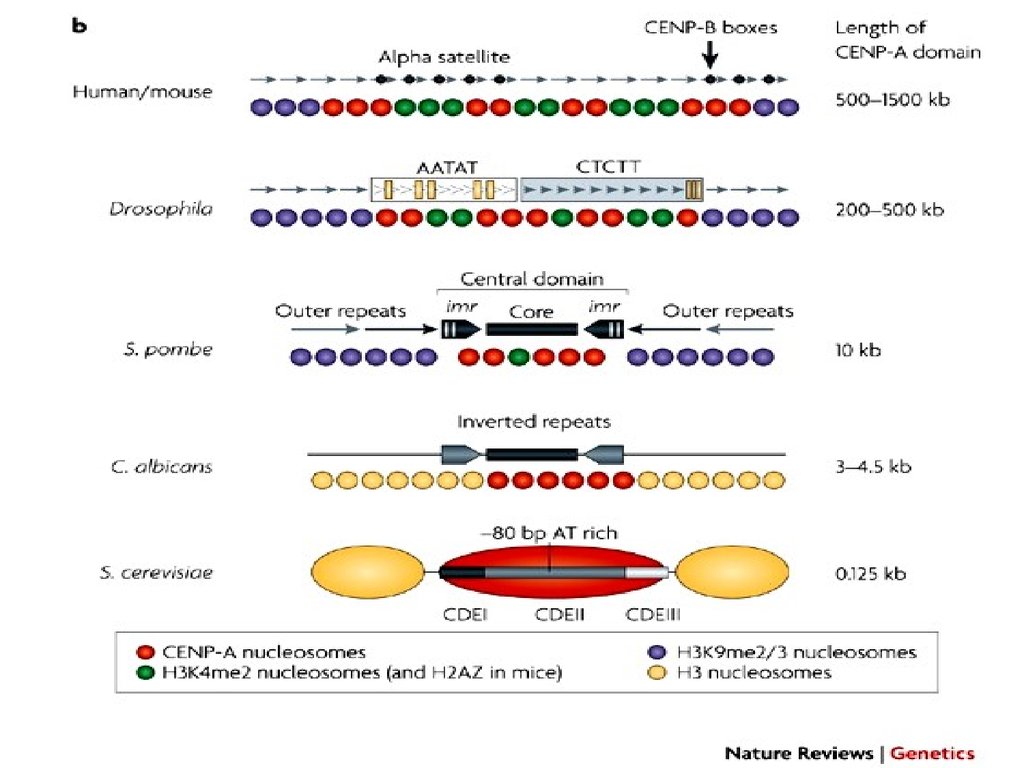
Центромера и кинетохорЦентромера- участок хромосомы, имеющий
возможность прикрепляться к микротрубочкам. У
высших организмов формируется сложная структуракинетохор.
Генетический скрининг проводили на клетках дрожжей, изучалась
стабильность передачи минихромосомы в клеточных поколениях.
chl – chromosome loss,
msm- minichromosome maintenance,
st - chromosome transmission fidelity,
ndc – nonedisjunction
cin – chromosome instability
dis – defective in sister chromatid disjoining
mis - minichromosome instability
62.
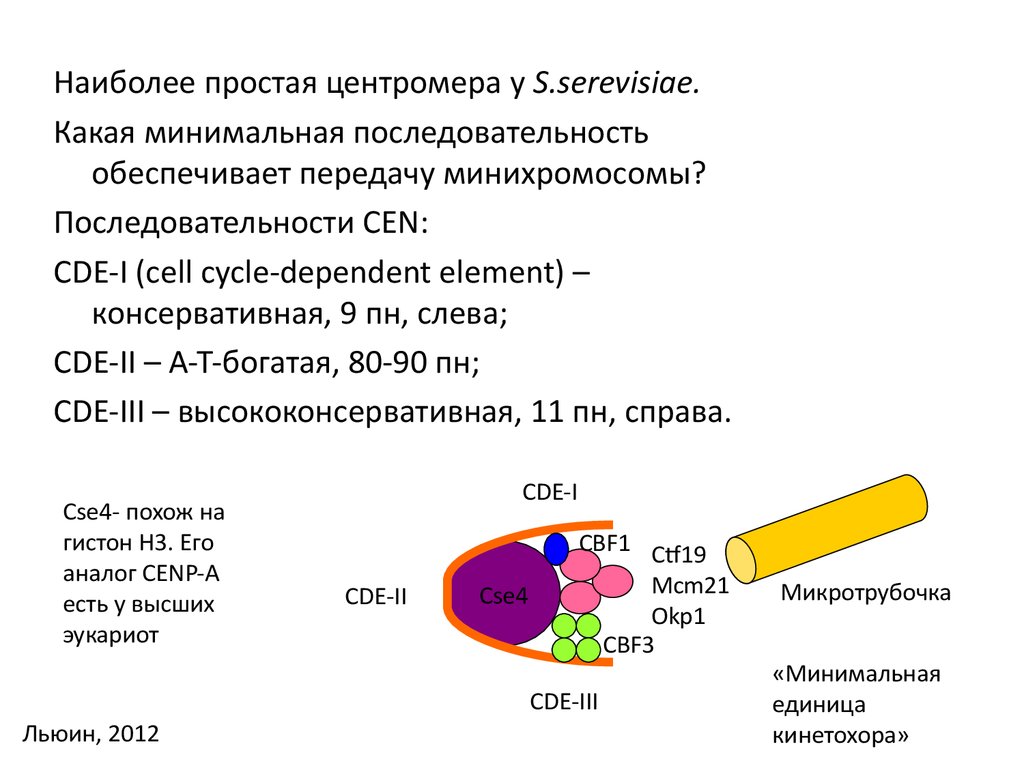
Наиболее простая центромера у S.serevisiae.Какая минимальная последовательность
обеспечивает передачу минихромосомы?
Последовательности CEN:
CDE-I (cell cycle-dependent element) –
консервативная, 9 пн, слева;
CDE-II – А-Т-богатая, 80-90 пн;
CDE-III – высококонсервативная, 11 пн, справа.
Cse4- похож на
гистон H3. Его
аналог CENP-A
есть у высших
эукариот
CDE-I
CDE-II
Cse4
CBF1 Ctf19
Mcm21
Okp1
CBF3
CDE-III
Льюин, 2012
Микротрубочка
«Минимальная
единица
кинетохора»
63.
64.
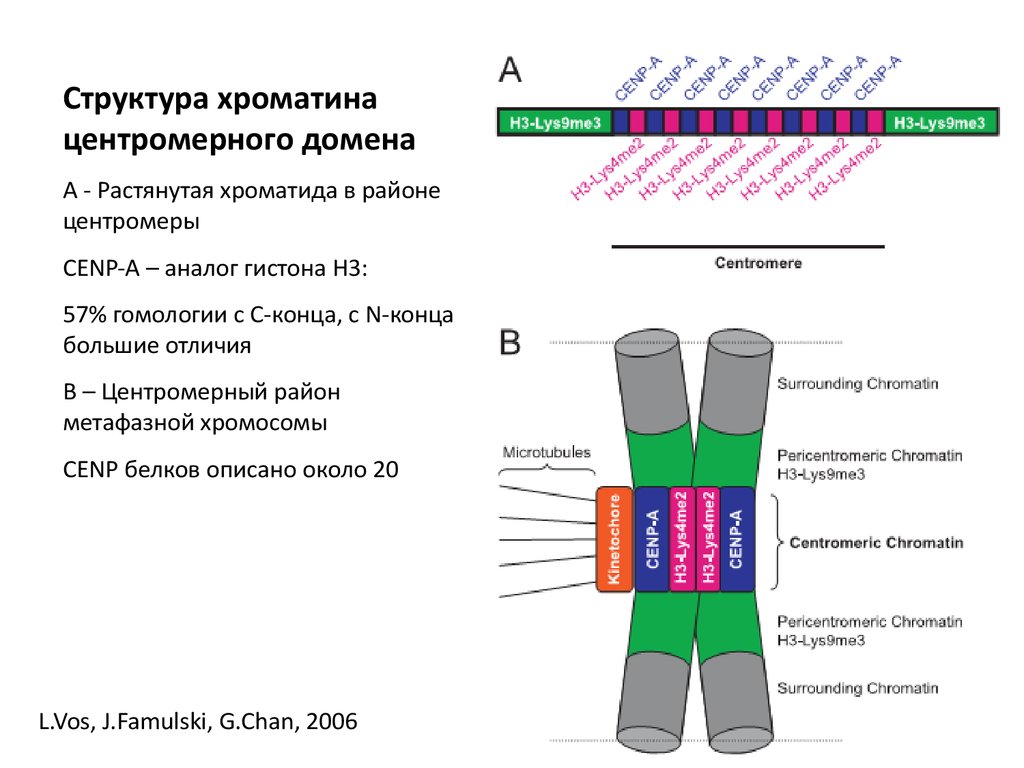
Структура хроматинацентромерного домена
А - Растянутая хроматида в районе
центромеры
CENP-A – аналог гистона Н3:
57% гомологии с С-конца, с N-конца
большие отличия
В – Центромерный район
метафазной хромосомы
CENP белков описано около 20
L.Vos, J.Famulski, G.Chan, 2006
65.
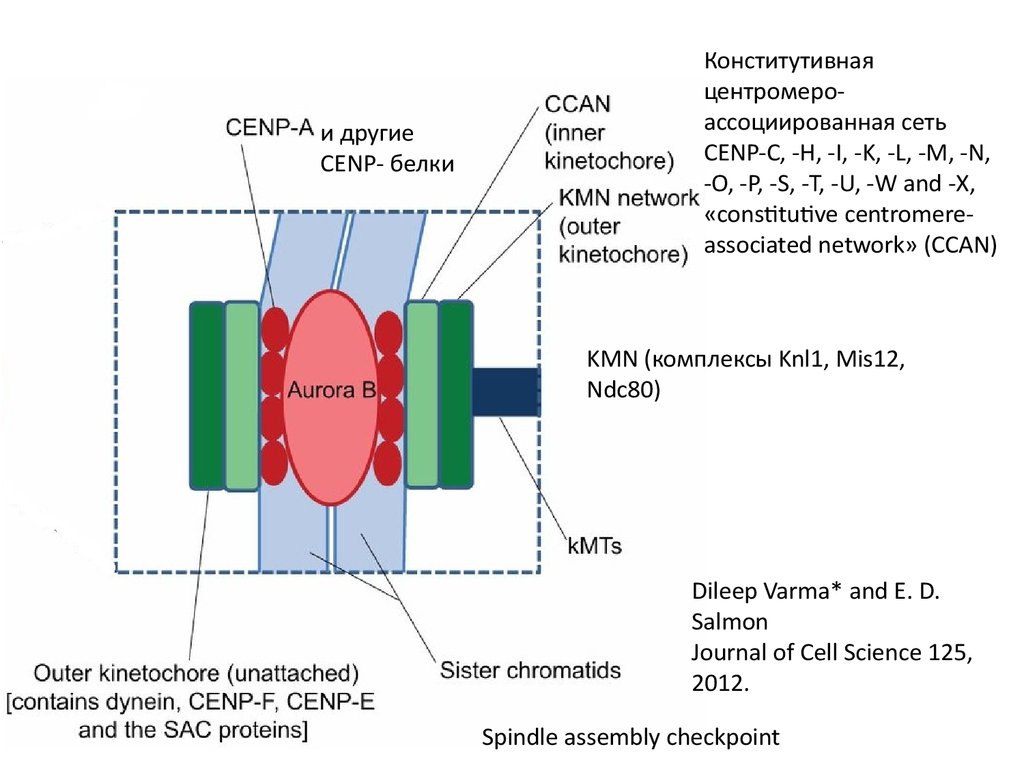
и другиеCENP- белки
Конститутивная
центромероассоциированная сеть
CENP-C, -H, -I, -K, -L, -M, -N,
-O, -P, -S, -T, -U, -W and -X,
«constitutive centromereassociated network» (CCAN)
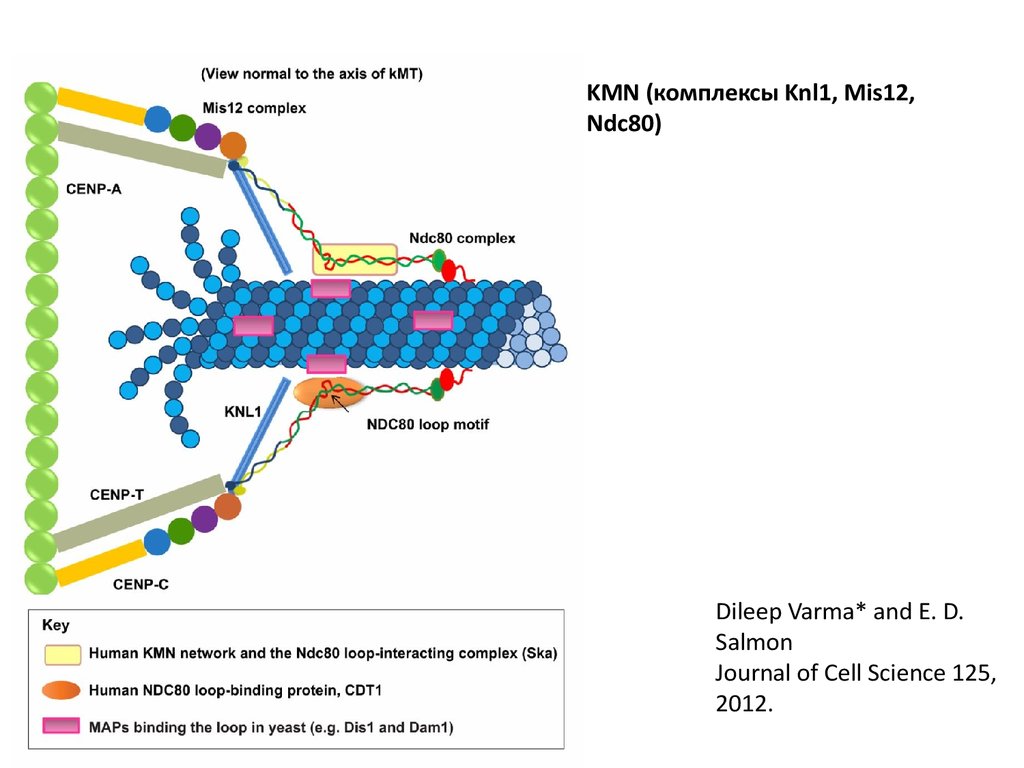
KMN (комплексы Knl1, Mis12,
Ndc80)
Dileep Varma* and E. D.
Salmon
Journal of Cell Science 125,
2012.
Spindle assembly checkpoint
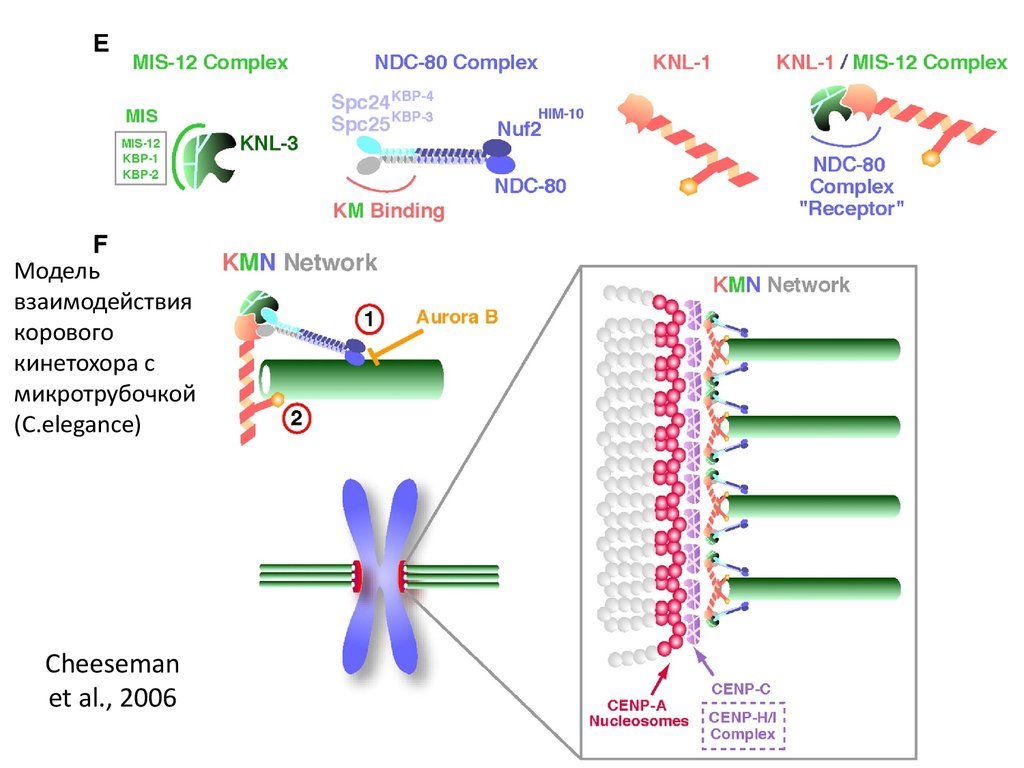
66. Cheeseman et al., 2006
Модельвзаимодействия
корового
кинетохора с
микротрубочкой
(C.elegance)
Cheeseman
et al., 2006
67.
KMN (комплексы Knl1, Mis12,Ndc80)
Dileep Varma* and E. D.
Salmon
Journal of Cell Science 125,
2012.
68.
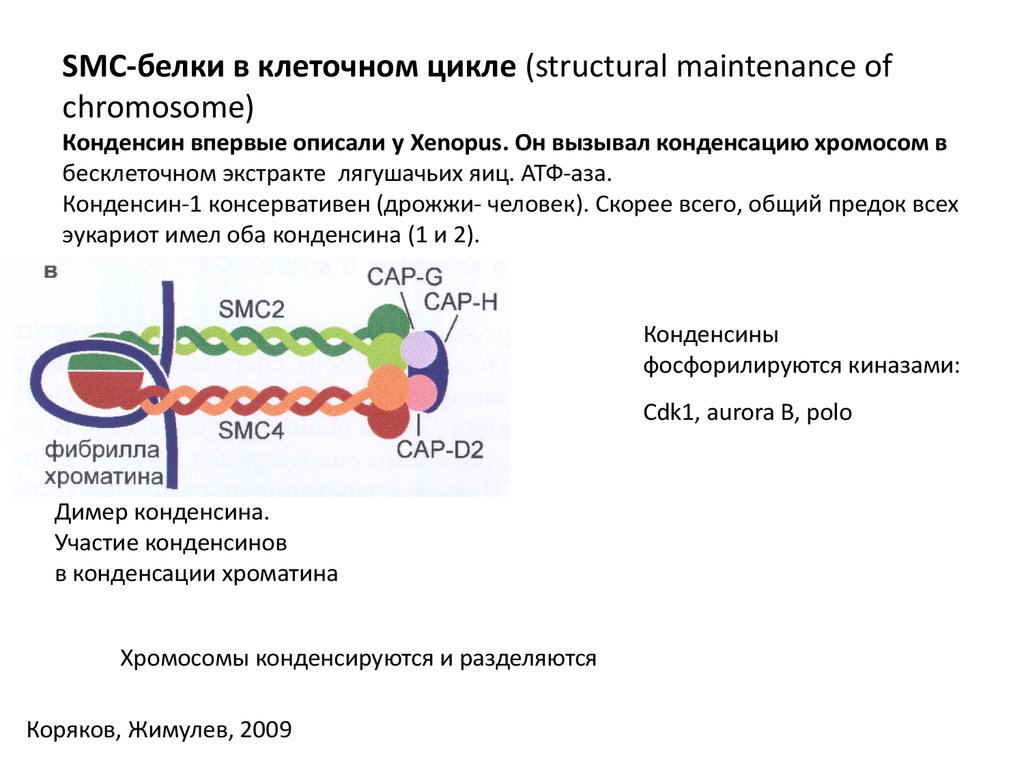
SMC-белки в клеточном цикле (structural maintenance ofchromosome)
Конденсин впервые описали у Xenopus. Он вызывал конденсацию хромосом в
бесклеточном экстракте лягушачьих яиц. АТФ-аза.
Конденсин-1 консервативен (дрожжи- человек). Скорее всего, общий предок всех
эукариот имел оба конденсина (1 и 2).
Конденсины
фосфорилируются киназами:
Cdk1, aurora B, polo
Димер конденсина.
Участие конденсинов
в конденсации хроматина
Хромосомы конденсируются и разделяются
Коряков, Жимулев, 2009
69.
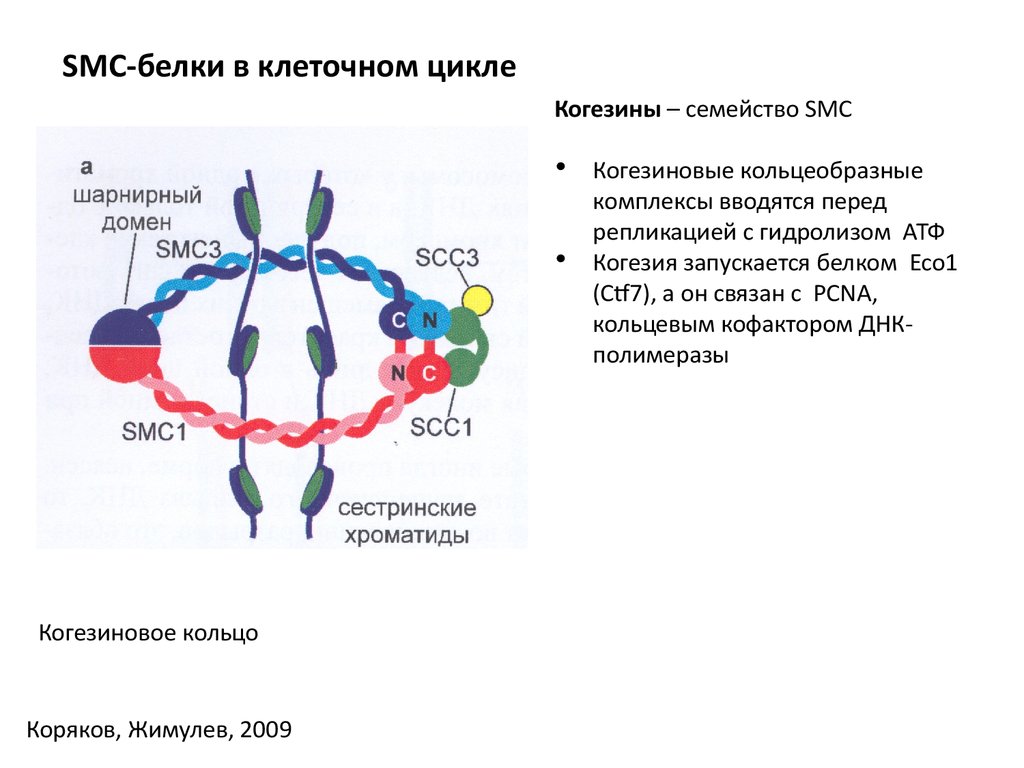
SMC-белки в клеточном циклеКогезины – семейство SMC
Когезиновое кольцо
Коряков, Жимулев, 2009
Когезиновые кольцеобразные
комплексы вводятся перед
репликацией с гидролизом АТФ
Когезия запускается белком Eco1
(Ctf7), а он связан с PCNA,
кольцевым кофактором ДНКполимеразы
70.
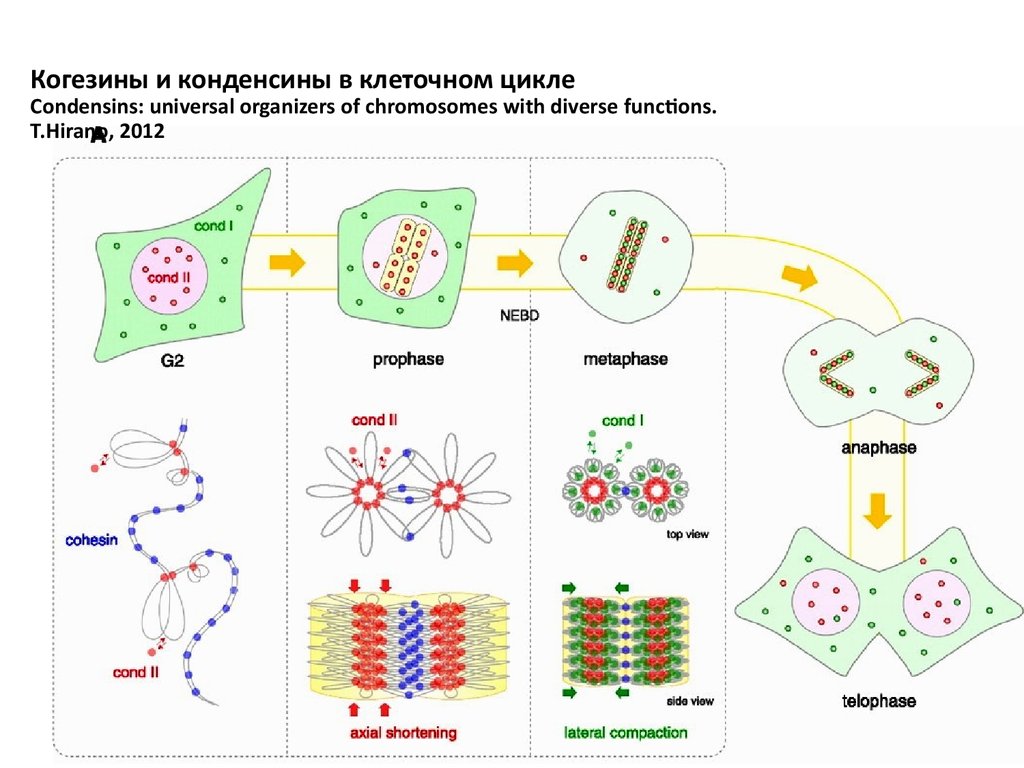
Когезины и конденсины в клеточном циклеCondensins: universal organizers of chromosomes with diverse functions.
T.Hirano, 2012
71.
Когезины и конденсины в клеточном цикле. Морфология хроматина взависимости от соотношения конденсинов 1 и 2
Condensins: universal organizers of chromosomes with diverse functions. T.Hirano, 2012
Культуры клеток
млекопитающих,
курицы,
бесклеточный
экстракт яиц
Xenopus
72.
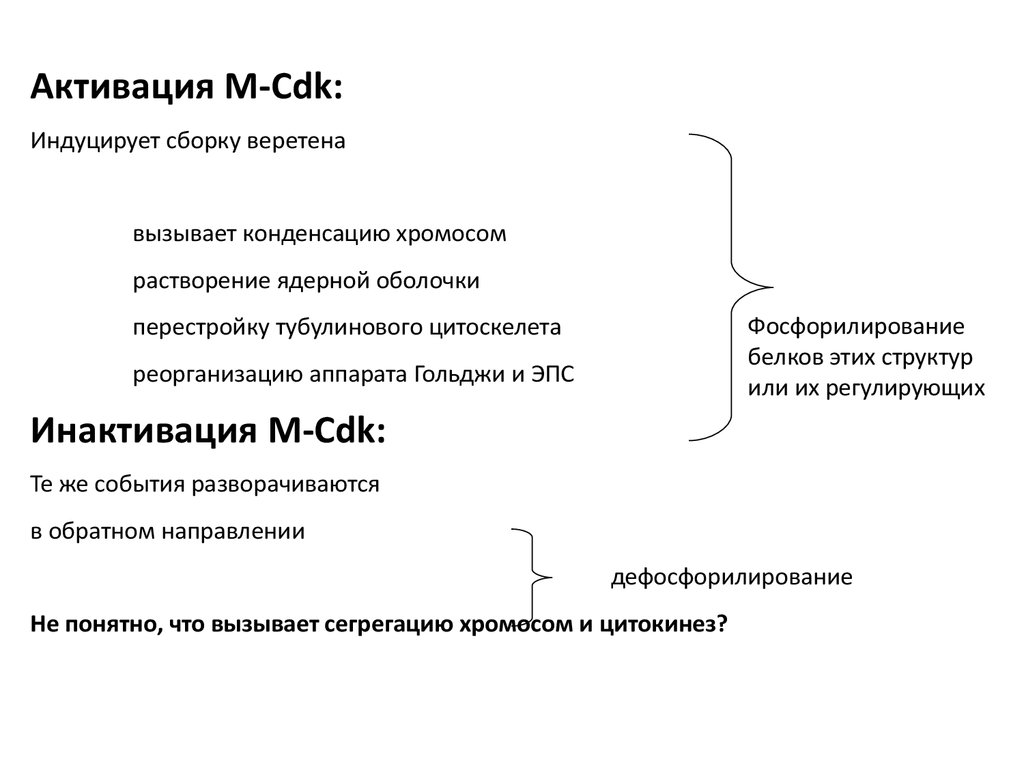
Активация M-Cdk:Индуцирует сборку веретена
вызывает конденсацию хромосом
растворение ядерной оболочки
Фосфорилирование
белков этих структур
или их регулирующих
перестройку тубулинового цитоскелета
реорганизацию аппарата Гольджи и ЭПС
Инактивация M-Cdk:
Те же события разворачиваются
в обратном направлении
дефосфорилирование
Не понятно, что вызывает сегрегацию хромосом и цитокинез?
73.
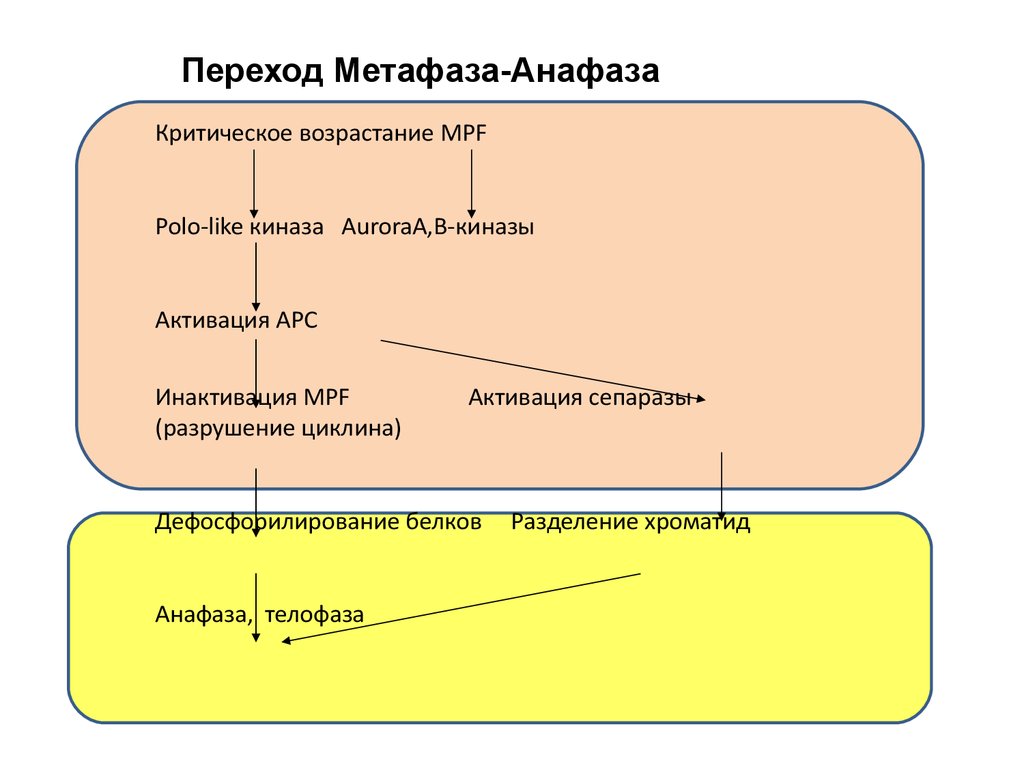
Переход Метафаза-АнафазаКритическое возрастание MPF
Polo-like киназа AuroraA,В-киназы
Активация APC
Инактивация MPF
(разрушение циклина)
Активация сепаразы
Дефосфорилирование белков
Анафаза, телофаза
Разделение хроматид
74.
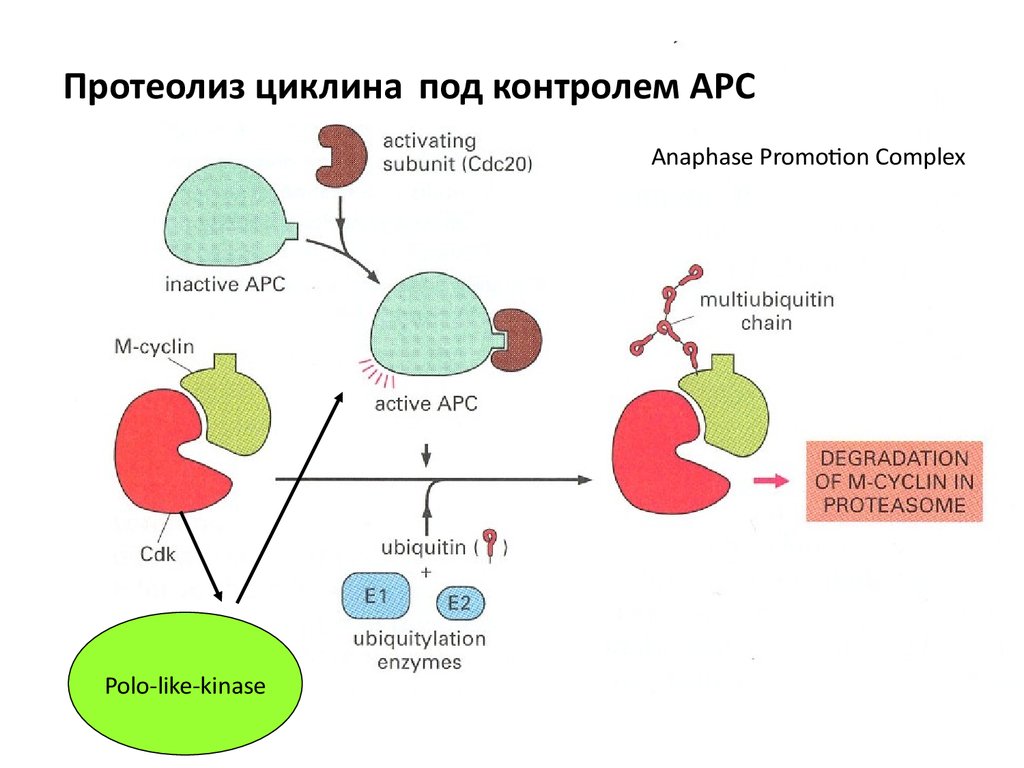
Протеолиз циклина под контролем АРСAnaphase Promotion Complex
Polo-like-kinase
75.
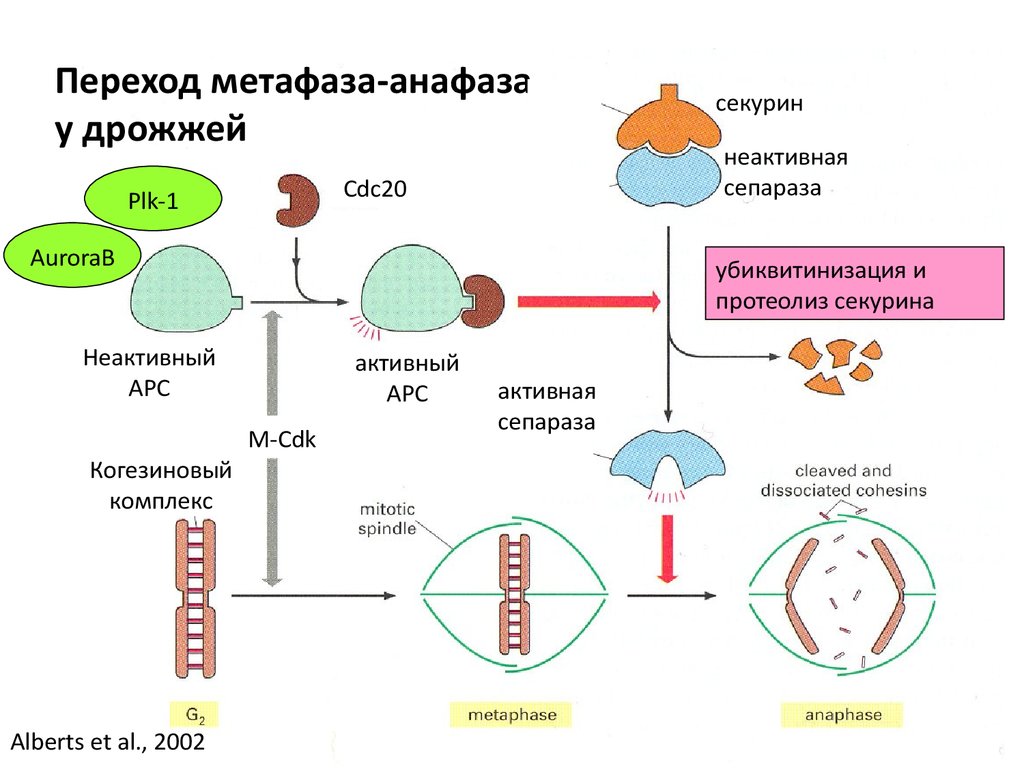
Переход метафаза-анафазау дрожжей
Cdc20
Plk-1
AuroraB
Alberts et al., 2002
неактивная
сепараза
убиквитинизация и
протеолиз секурина
Неактивный
АРС
Когезиновый
комплекс
секурин
активный
АРС
M-Cdk
активная
сепараза
76.
Переход метафаза- анафаза у дрожжейОсновные участники:
•APC - anaphase promotion complex – при добавлении субъединиц Е1 и Е2 служит
убиквитин лигазой
•Cdc20 - белок, активирующий APC
•Сепараза – протеаза, разрезающая один из когезинов (Rad21, Scc1)
•Секурин- белок, инактивирующий протеазу
•Polo-like – киназа 1 – активирует АРС (Plk-1)
77.
Разделение сестринских хроматид в митозеДрожжи:
Сепараза разрезает когезины по всей длине хромосом в переходе М-А
Позвоночные (человек, HeLa):
1. Профаза-прометафаза:
• Polo-подобная киназа и Aurora- киназа фосфорилируют и удаляют когезины по
плечам хромосом в течение профазы. Обособление сестринских хроматид
•Белок шугошин препятствует отделению когезинов в центромерном районе
(присоединяет фосфатазу).
•Количество конденсинов нарастает
2. Переход М-А:
Сепараза разрезает когезины в центромерном районе
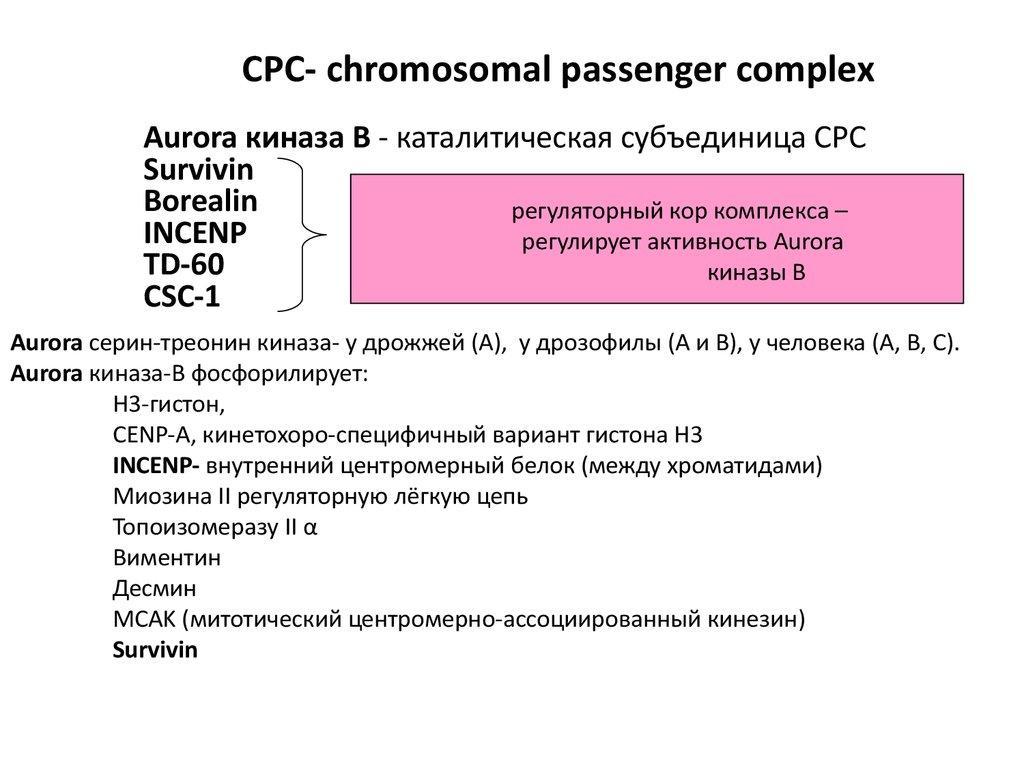
78. СРС- chromosomal passenger complex
Aurora киназа В - каталитическая субъединица СРСSurvivin
Borealin
регуляторный кор комплекса –
INCENP
регулирует активность Aurora
TD-60
киназы В
CSC-1
Aurora серин-треонин киназа- у дрожжей (А), у дрозофилы (А и В), у человека (А, В, С).
Aurora киназа-В фосфорилирует:
Н3-гистон,
CENP-A, кинетохоро-специфичный вариант гистона Н3
INCENP- внутренний центромерный белок (между хроматидами)
Миозина II регуляторную лёгкую цепь
Топоизомеразу II α
Виментин
Десмин
MCAK (митотический центромерно-ассоциированный кинезин)
Survivin
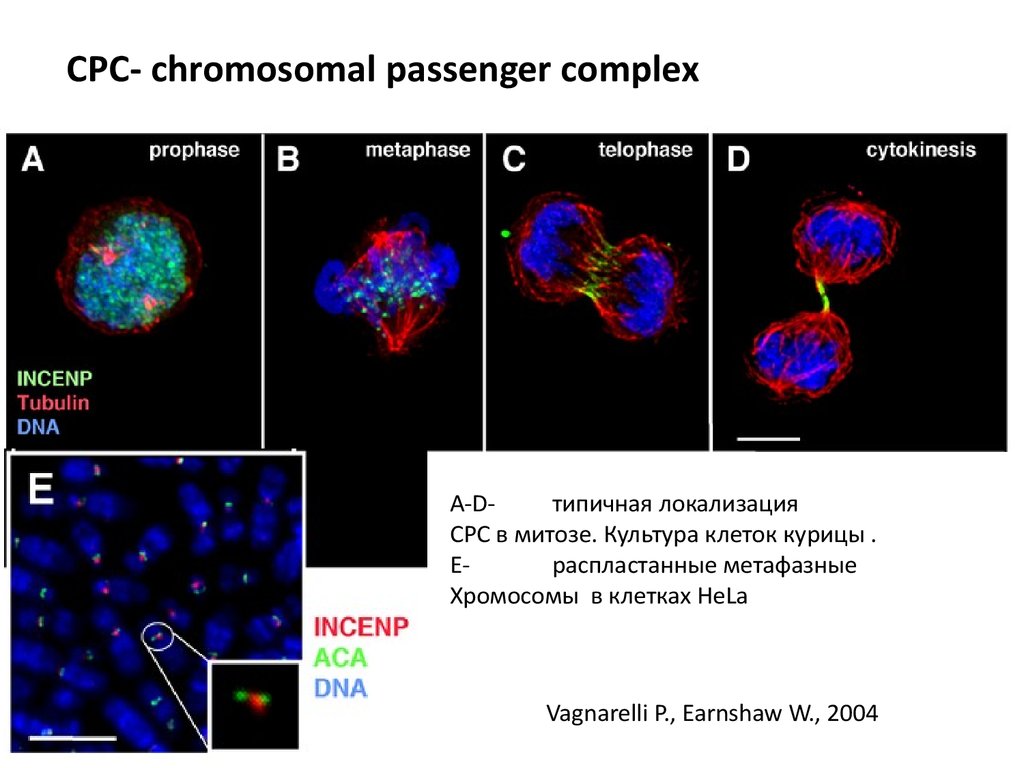
79.
СРС- chromosomal passenger complexA-Dтипичная локализация
СРС в митозе. Культура клеток курицы .
Ераспластанные метафазные
Хромосомы в клетках HeLa
Vagnarelli P., Earnshaw W., 2004
80.
СРС- chromosomal passenger complexCPC, хромосомные пассажиры: белки, локализованные в специфических
районах:
• в G2 – внутриядерно,
• в профазе митоза – вдоль конденсирующихся хромосом,
• в метафазе – в центромерных районах хромосом,
• в анафазе – в центральном веретене,
• в телофазе- в остаточном тельце веретена
Комплекс работает в митозе и мейозе, контролирует:
– Хромосомную модификацию (фосфорилирование гистона Н3)
– Хромосомную конгрессию (построение)
– Прикрепление кинетохоров к микротрубочкам, коррекция
– Формирование стабильного биполярного веретена
– Участвует в митотической точке контроля
81.
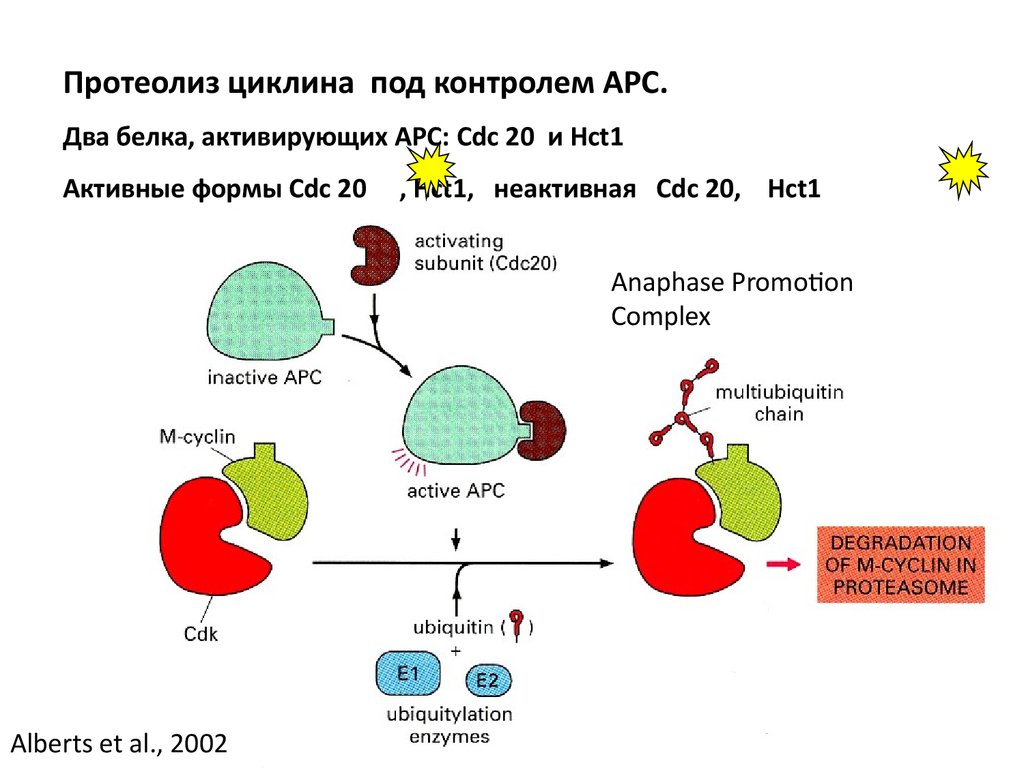
Протеолиз циклина под контролем АРС.Два белка, активирующих АРС: Cdc 20 и Hct1
Активные формы Cdc 20
, Hct1, неактивная Cdc 20, Hct1
Anaphase Promotion
Complex
Alberts et al., 2002
82.
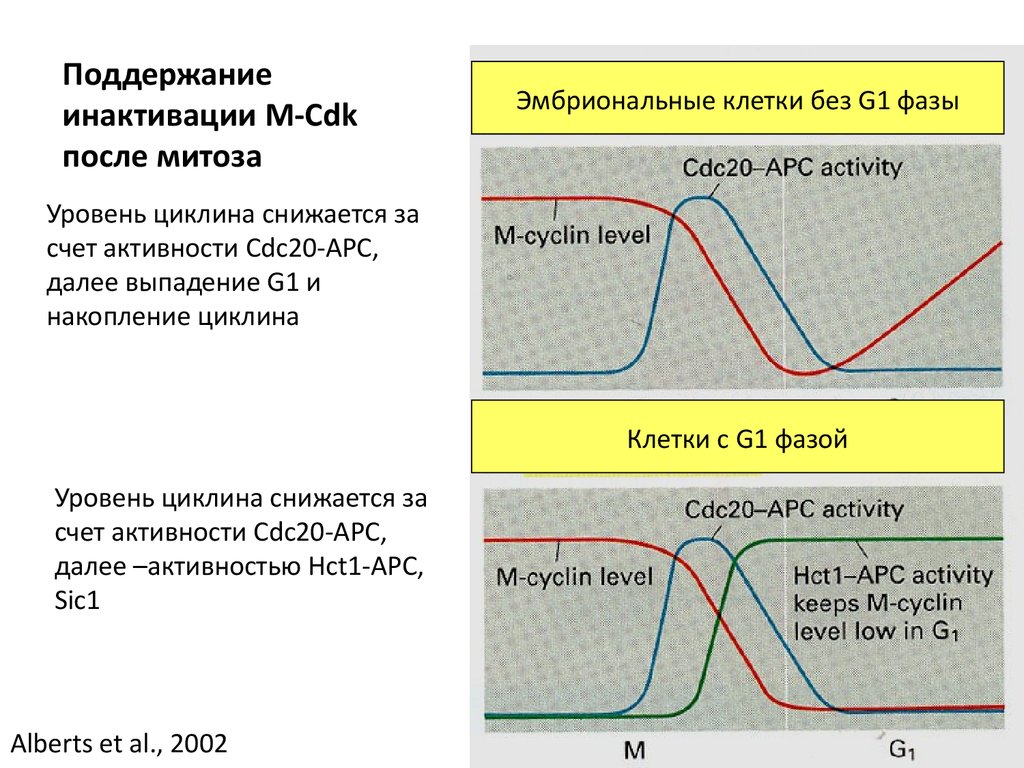
Поддержаниеинактивации M-Cdk
после митоза
Эмбриональные клетки без G1 фазы
Уровень циклина снижается за
счет активности Cdc20-APC,
далее выпадение G1 и
накопление циклина
Клетки с G1 фазой
Уровень циклина снижается за
счет активности Cdc20-APC,
далее –активностью Hct1-APC,
Sic1
Alberts et al., 2002
83.
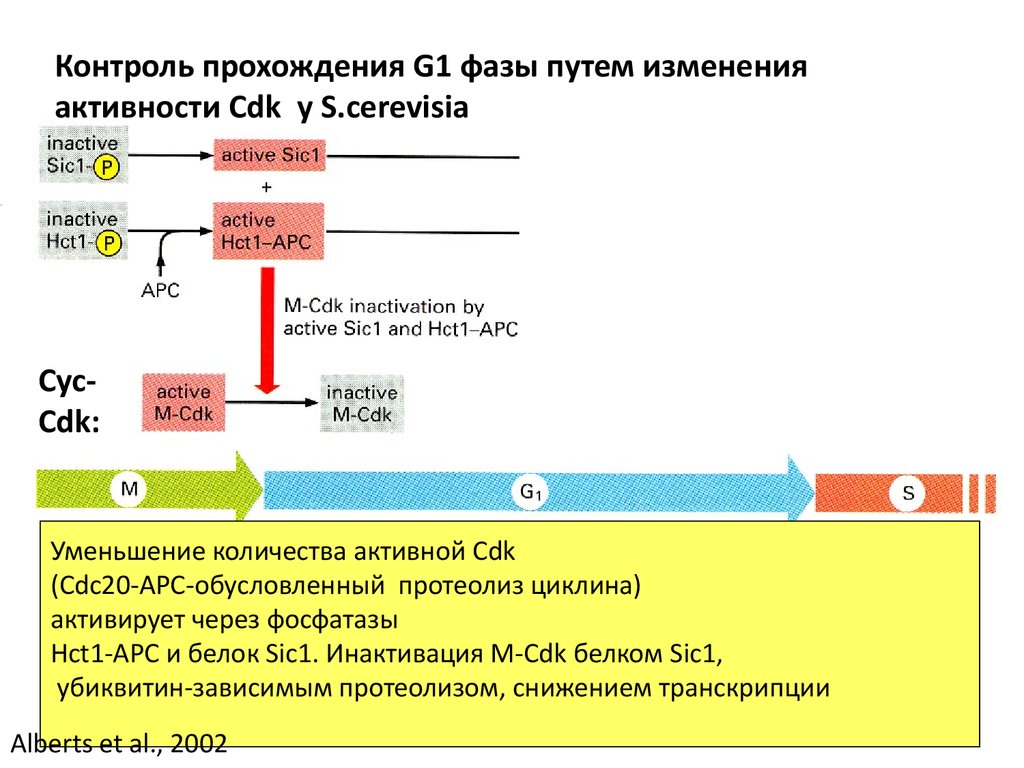
Контроль прохождения G1 фазы путем измененияактивности Cdk у S.cerevisia
CycCdk:
Уменьшение количества активной Cdk
(Cdc20-APC-обусловленный протеолиз циклина)
активирует через фосфатазы
Hct1-APC и белок Sic1. Инактивация M-Cdk белком Sic1,
убиквитин-зависимым протеолизом, снижением транскрипции
Alberts et al., 2002
84.
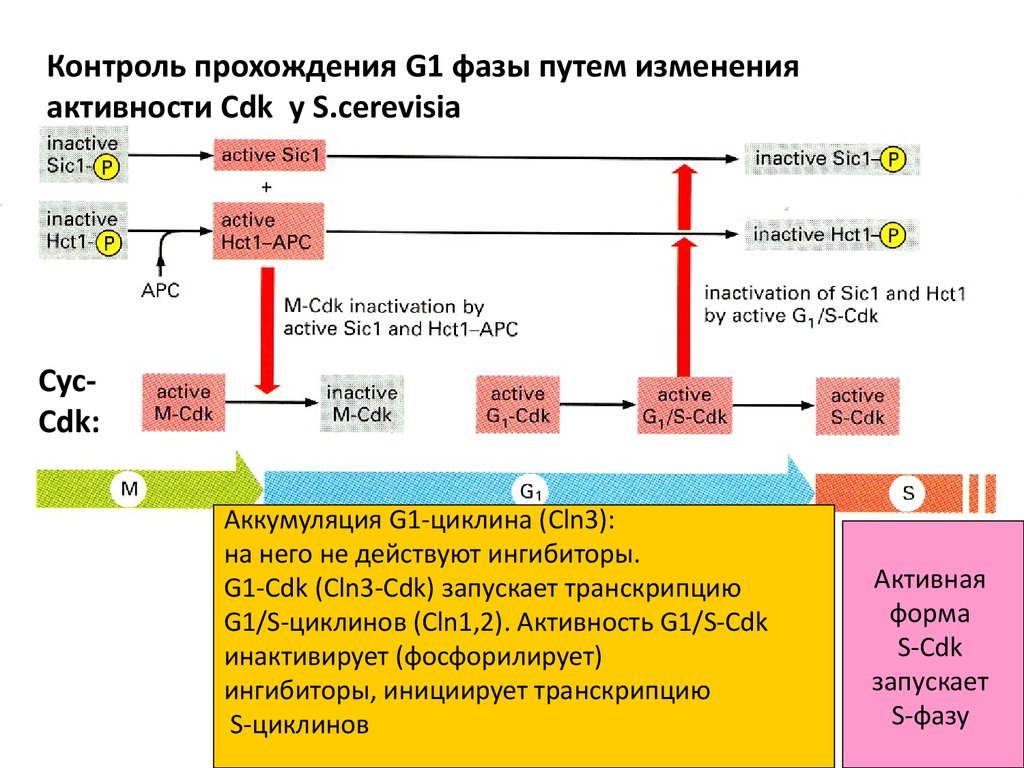
Контроль прохождения G1 фазы путем измененияактивности Cdk у S.cerevisia
CycCdk:
Аккумуляция G1-циклина (Cln3):
на него не действуют ингибиторы.
G1-Cdk (Cln3-Cdk) запускает транскрипцию
G1/S-циклинов (Cln1,2). Активность G1/S-Cdk
инактивирует (фосфорилирует)
ингибиторы, инициирует транскрипцию
S-циклинов
Активная
форма
S-Cdk
запускает
S-фазу
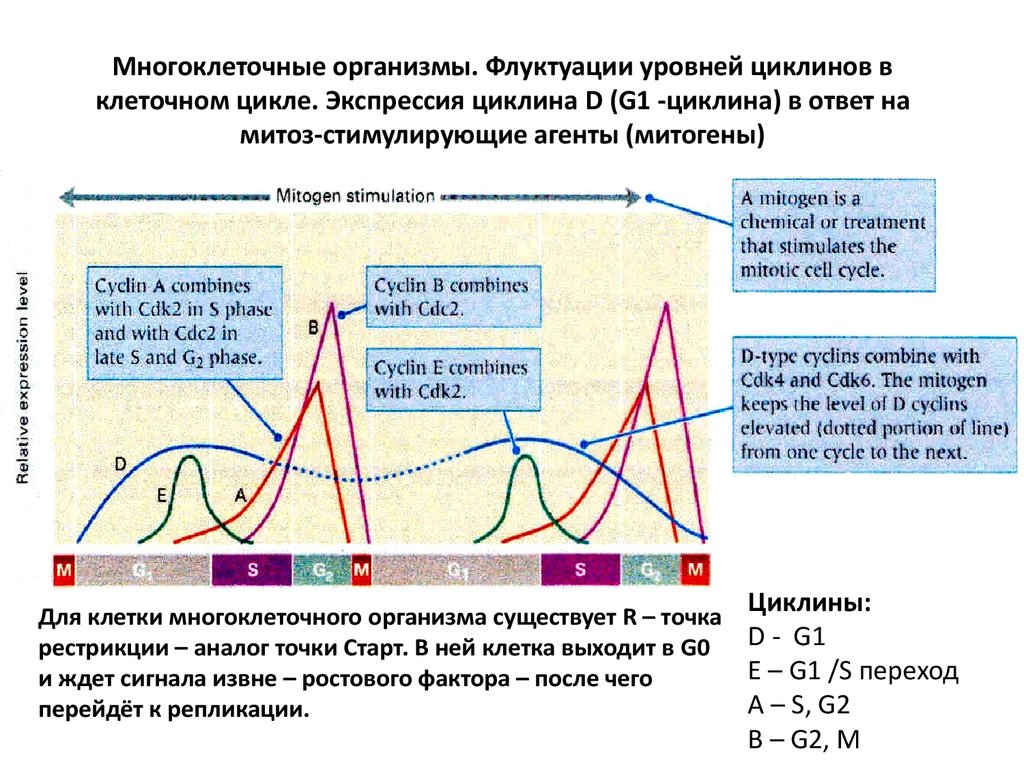
85. Многоклеточные организмы. Флуктуации уровней циклинов в клеточном цикле. Экспрессия циклина D (G1 -циклина) в ответ на митоз-стимулирующие а
Многоклеточные организмы. Флуктуации уровней циклинов вклеточном цикле. Экспрессия циклина D (G1 -циклина) в ответ на
митоз-стимулирующие агенты (митогены)
Для клетки многоклеточного организма существует R – точка
рестрикции – аналог точки Старт. В ней клетка выходит в G0
и ждет сигнала извне – ростового фактора – после чего
перейдёт к репликации.
Циклины:
D - G1
E – G1 /S переход
A – S, G2
B – G2, M
86.
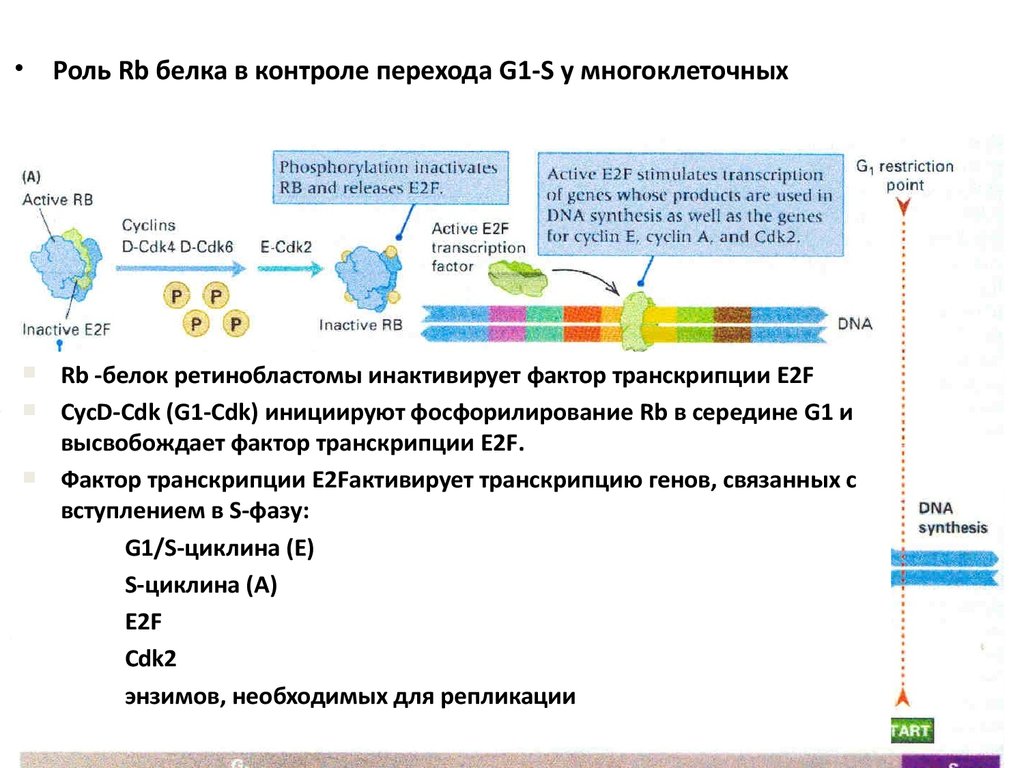
• Роль Rb белка в контроле перехода G1-S у многоклеточныхRb -белок ретинобластомы инактивирует фактор транскрипции E2F
CycD-Cdk (G1-Cdk) инициируют фосфорилирование Rb в середине G1 и
высвобождает фактор транскрипции E2F.
Фактор транскрипции E2Fактивирует транскрипцию генов, связанных с
вступлением в S-фазу:
G1/S-циклина (Е)
S-циклина (А)
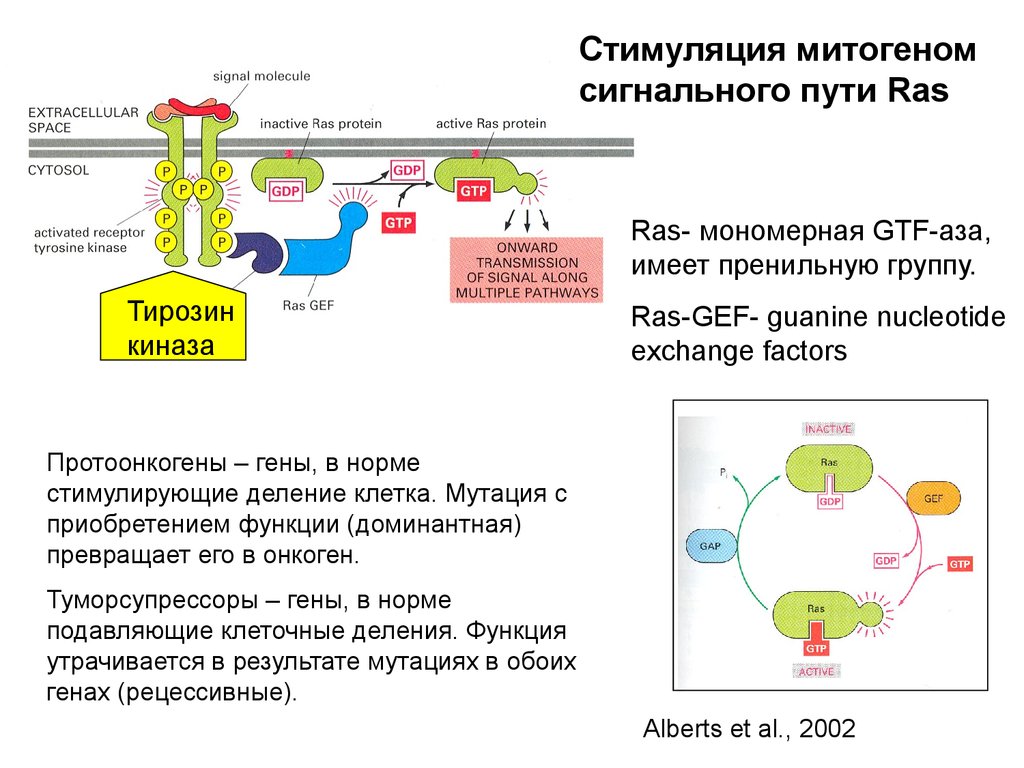
E2F
Cdk2
энзимов, необходимых для репликации
87.
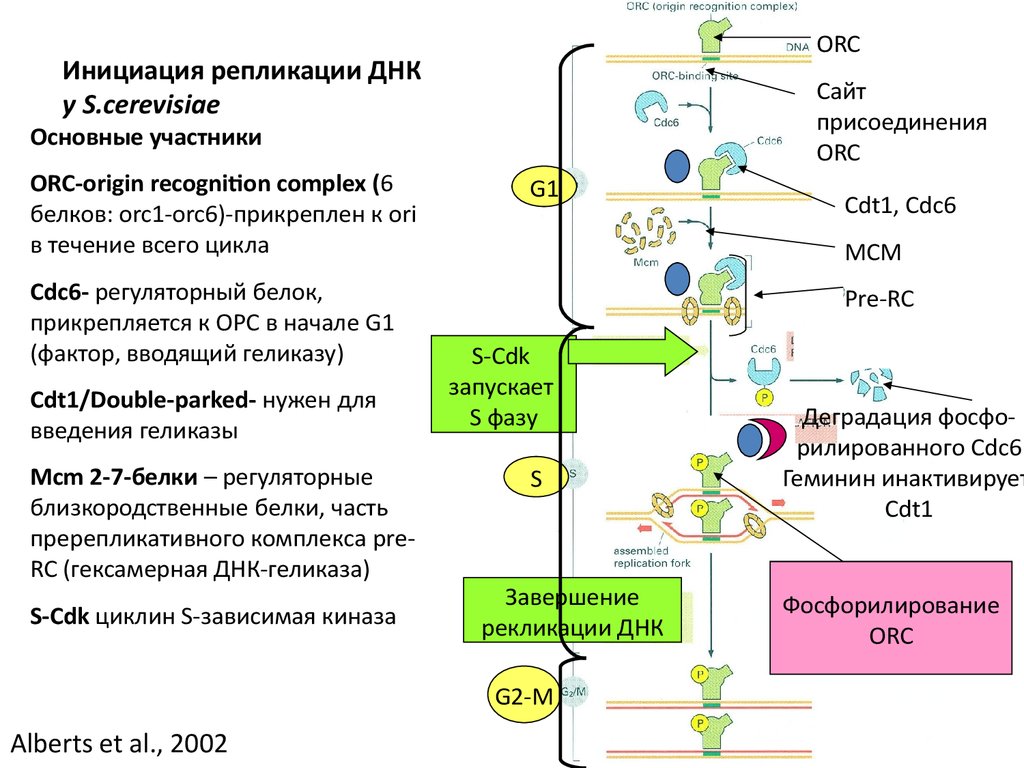
ORCИнициация репликации ДНК
у S.cerevisiae
Сайт
присоединения
ORC
Основные участники
ОRС-origin recognition complex (6
белков: orc1-orc6)-прикреплен к ori
в течение всего цикла
Сdc6- регуляторный белок,
прикрепляется к ОРС в начале G1
(фактор, вводящий геликазу)
Cdt1/Double-parked- нужен для
введения геликазы
Mcm 2-7-белки – регуляторные
близкородственные белки, часть
пререпликативного комплекса preRC (гексамерная ДНК-геликаза)
S-Cdk циклин S-зависимая киназа
G1
MCM
Pre-RC
S-Cdk
запускает
S фазу
S
Завершение
рекликации ДНК
G2-M
Alberts et al., 2002
Cdt1, Cdc6
Деградация фосфорилированного Cdc6
Геминин инактивирует
Cdt1
Фосфорилирование
ORC
88.
Предотвращение повторной репликацииS-Cdk:
•-запускает репликацию ДНК
•-фосфорилирует Сdc6, он отделяется от ОRС- предотвращение репликации с
этого ori. Фосфорилированный Сdc6 узнается комплексом SCF,
убиквитинизируется.
•-фосфорилирует Mcm-белки , это вызывает их экспорт из ядра – гарантия
того, что комплекс Mcm больше не соберется
• -фосфорилирует Cdt1
Geminin у многоклеточных накапливается в S, G2, M
Связывается - инактивирует Cdt1 и препятствует повторной сборке
пререпликативного сомплекса -лицензированию репликации
•RESET: в конце митоза активность всех Cdk падает до нуля.
•Сdc6 и Mcm-белки и Cdt1 дефосфорилируются,.
•Геминин и все циклины Е, А и В разрушаются с помощью APC.
•pre-ORC может собираться снова
89.
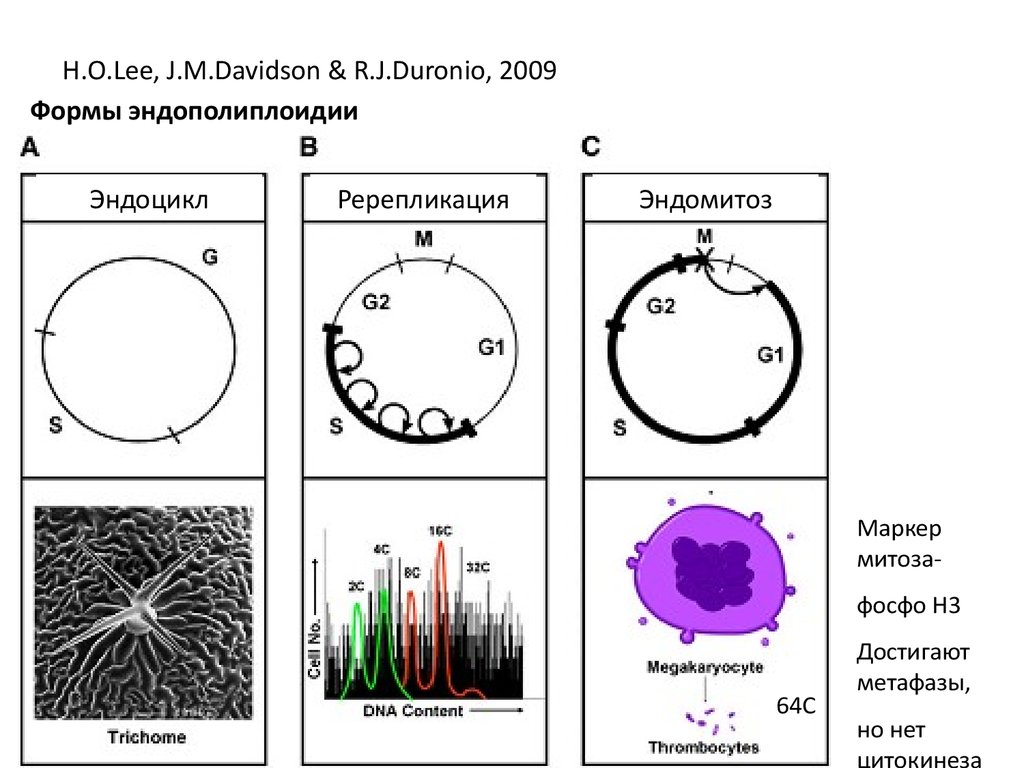
H.O.Lee, J.M.Davidson & R.J.Duronio, 2009Формы эндополиплоидии
Эндоцикл
Ререпликация
Эндомитоз
Маркер
митозафосфо Н3
64С
Достигают
метафазы,
но нет
цитокинеза
90.
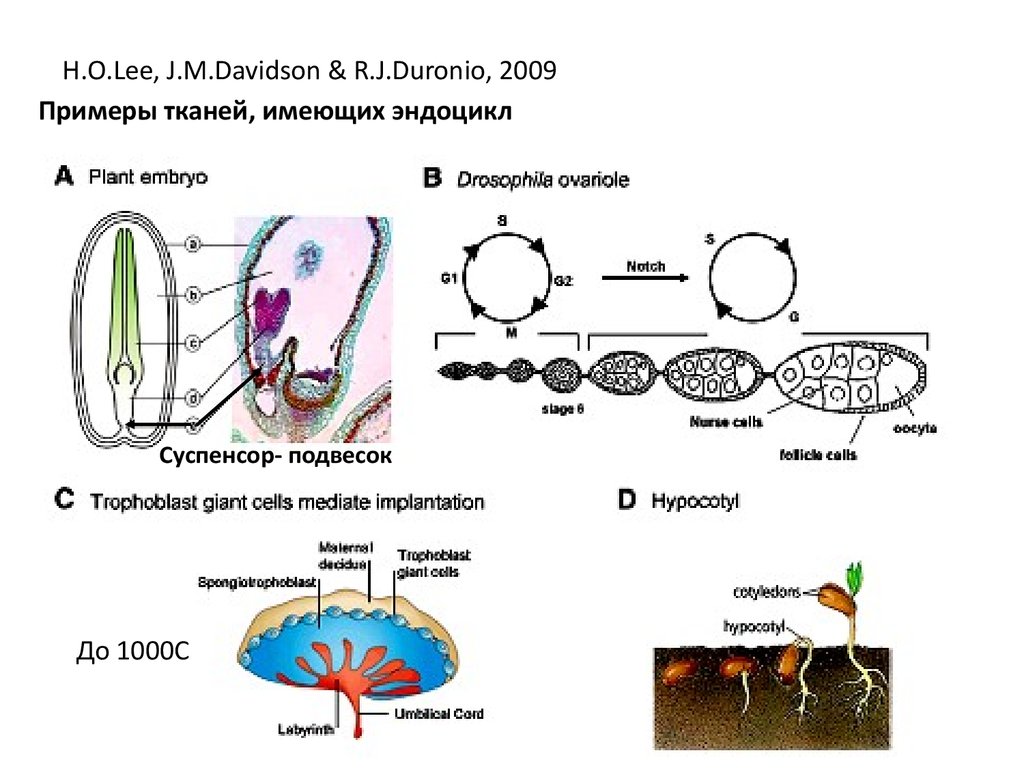
H.O.Lee, J.M.Davidson & R.J.Duronio, 2009Примеры тканей, имеющих эндоцикл
Суспенсор- подвесок
До 1000С
91.
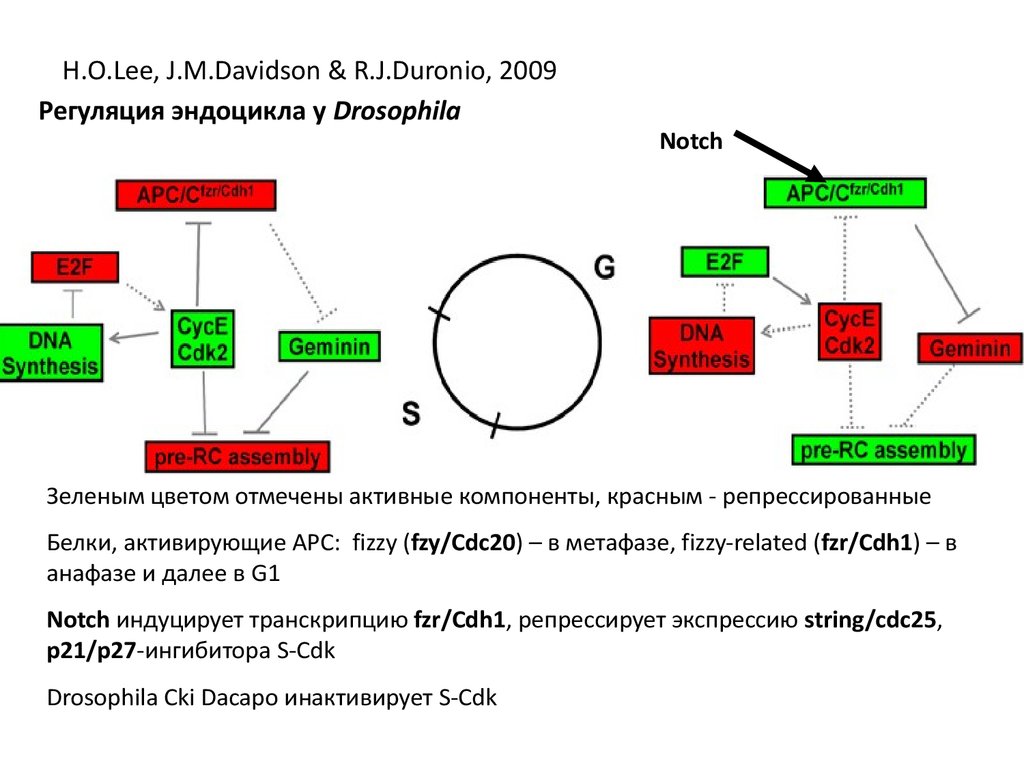
H.O.Lee, J.M.Davidson & R.J.Duronio, 2009Регуляция эндоцикла у Drosophila
Notch
Зеленым цветом отмечены активные компоненты, красным - репрессированные
Белки, активирующие АРС: fizzy (fzy/Cdc20) – в метафазе, fizzy-related (fzr/Cdh1) – в
анафазе и далее в G1
Notch индуцирует транскрипцию fzr/Cdh1, репрессирует экспрессию string/cdc25,
p21/p27-ингибитора S-Cdk
Drosophila Cki Dacapo инактивирует S-Cdk
92.
93.
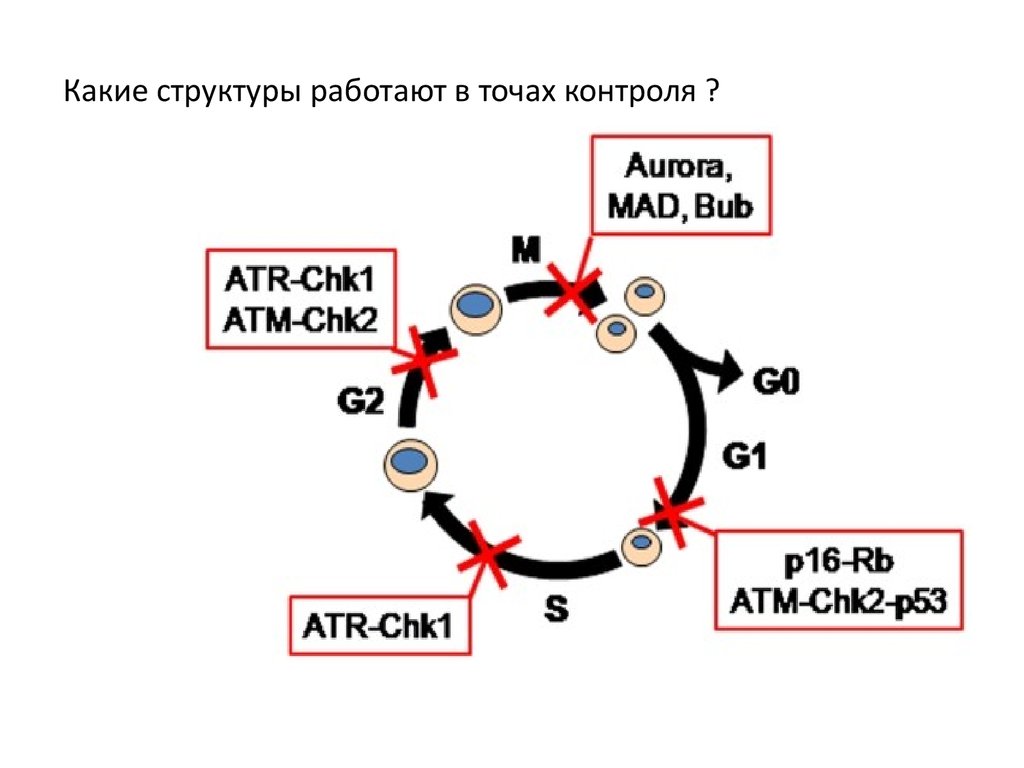
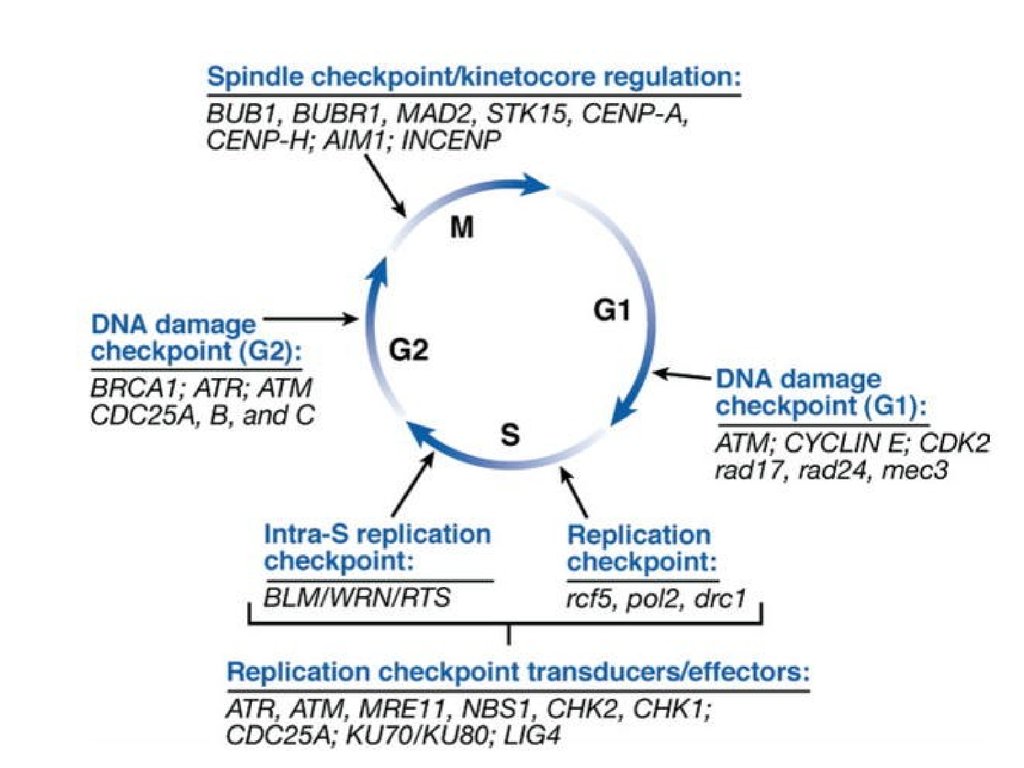
Какие структуры работают в точах контроля ?94.
Изучение точек контроля у дрожжей:Получение условных мутагенчувствительных мутаций
• Обработка слабой дозой радиации (мутации rad)
• веществами, блокирующими репликацию (гидроксимочевина)
(мутации hus)
• веществами, блокирующими сборку веретена деления (мутации mad
- mitotic arrest deficient, мутации bub - budding uninhibited by
benzimadazole)
Селекция мутантов с неправильной реакцией на обработку (не
останавливали клеточный цикл)
95.
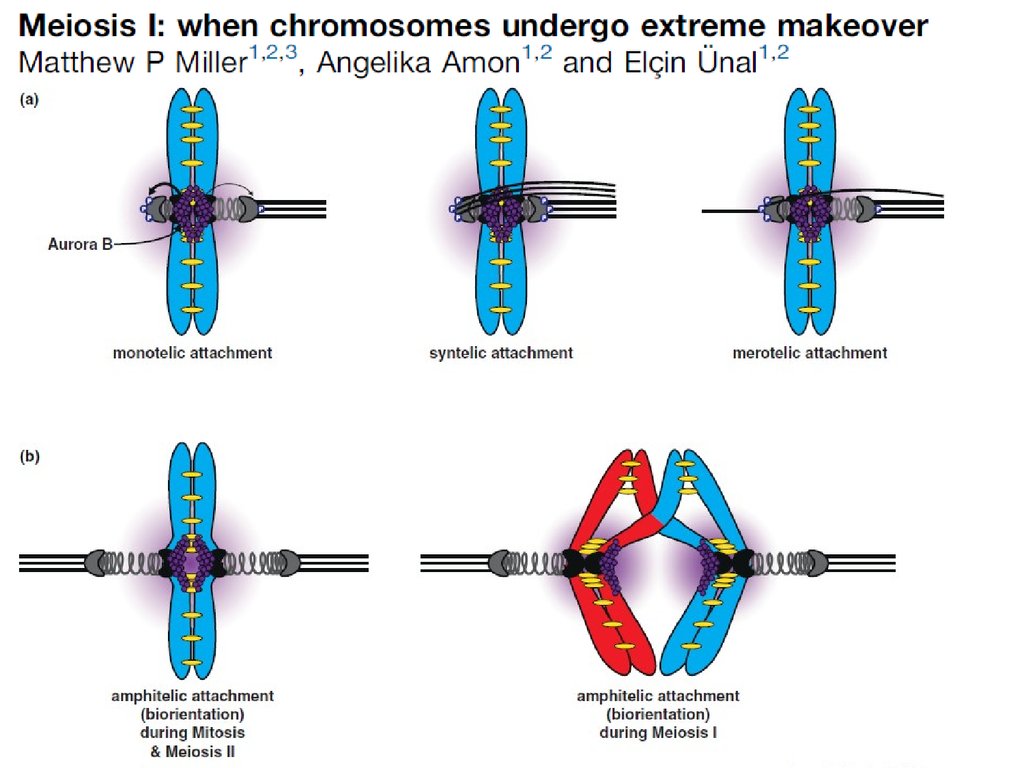
Точки контроля клеточного цикла. Переход М-А-дефект веретена
-дефект полюсов (в т.ч. нереплицированная центросома)
-дефект кинетохоров
К неприкрепленному кинетохору присоединяется
белок Mad2, ингибирует Cdc20-APC
Мутации:
mad- metaphase arrest deficient,
bub – budding uninhibited Benzimadazole
Кинетохорный белок Bub1 (киназа):
запускает сборку компонентов кинетохора (BubR1, CENP-F),
Контролирует правильное формирование кинетохора.
96.
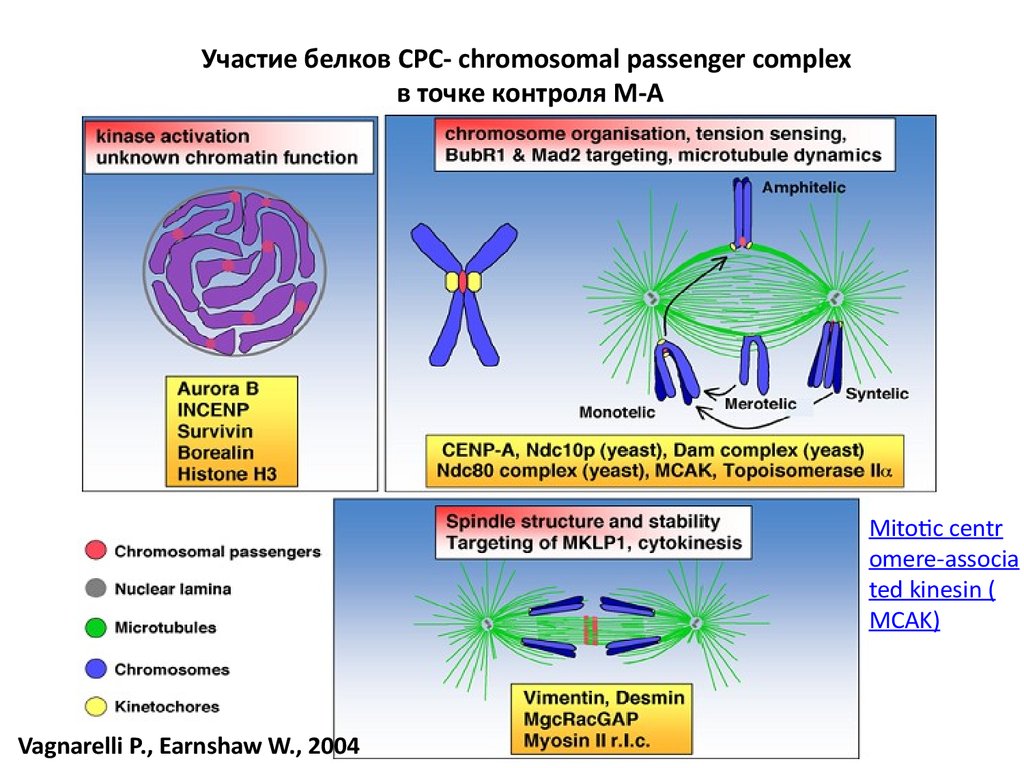
Участие белков СРС- chromosomal passenger complexв точке контроля М-А
Mitotic centr
omere-associa
ted kinesin (
MCAK)
Vagnarelli P., Earnshaw W., 2004
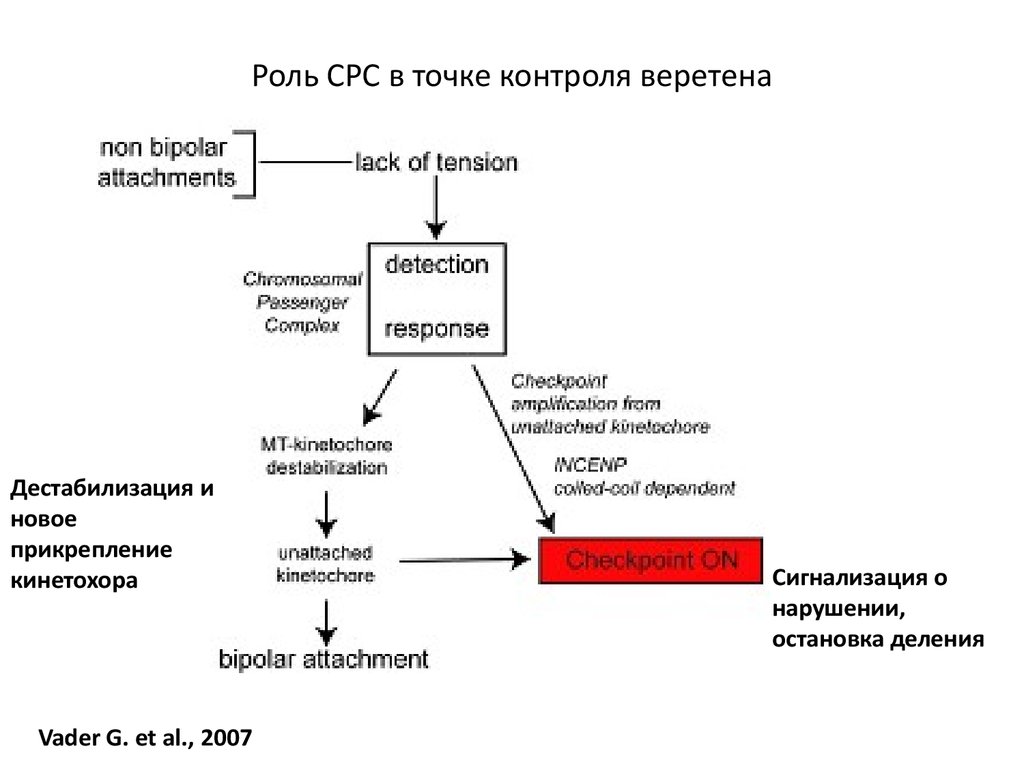
97. Роль СРС в точке контроля веретена
Дестабилизация иновое
прикрепление
кинетохора
Vader G. et al., 2007
Сигнализация о
нарушении,
остановка деления
98.
99.
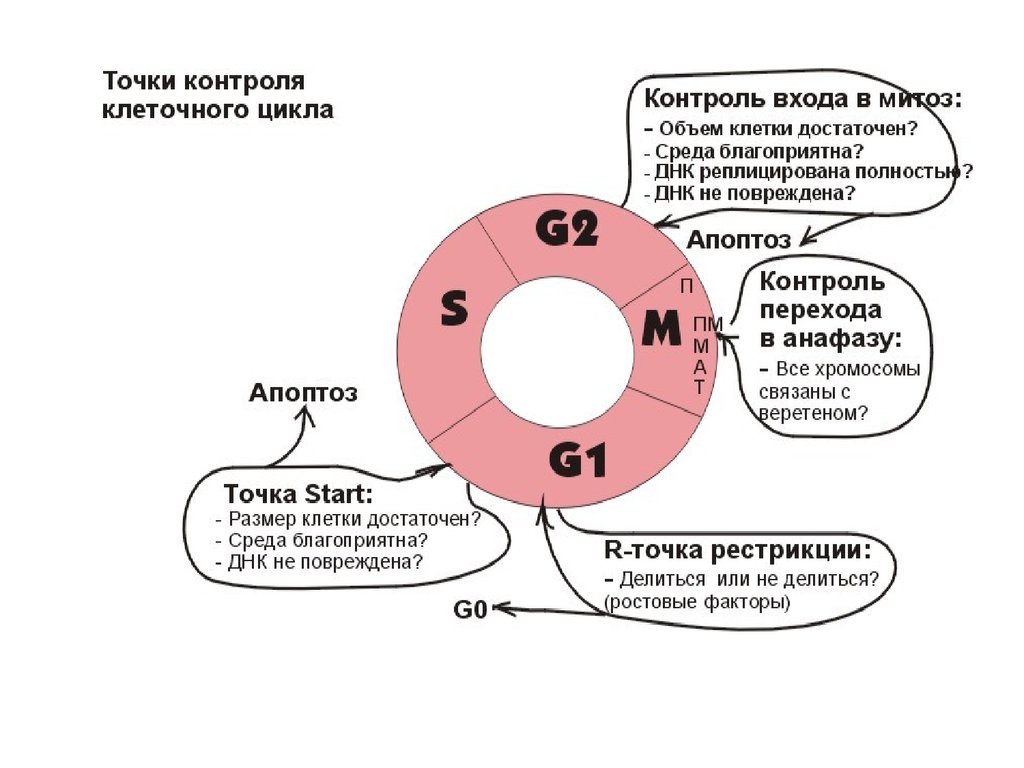
Точка контроля клеточного цикла. G1G1 контроль размера клетки перед Стартом
Сln3 у дрожжей
G1 контроль повреждения ДНК.
Поврежденная ДНК – активация р53 – CKI
Блок активации G1/S-Cdk, S-Cdk
Повышенная стимуляция митогеном.
Активация р53 – CKI - апоптоз
Блок активации G1/S-Cdk, S-Cdk
100.
Точки контроля клеточного цикла:Повреждения ДНК
Болезнь «атаксия телангиэктазия»- синдром Луи-Бара – дефект одной
из протеинкиназ, фосфорилирующих р53 в ответ на облучение - ATМкиназа (ATM – ataxia telangiectasia mutated) (ответ на двунитевые
разрывы)
• ATR – ATM and Rad3 related – ответ на многие формы повреждения ДНК
(генотоксический стресс )
• киназы фосфатидилинозитол 3-подобные.
Центральные компоненты ответа на повреждения ДНК
• Белок RPA взаимодействует с однонитевыми разрывами ДНК
(остановленные вилки репликации, двунитевые разрывы ДНК, сайты
репарации эксцизионные, мисматч)
• привлекает ATR-киназу и белок ATRIP (ATR-interacting protein)
– Rad17- подобен репликативному фактору С
– Rad9 – кольцевой белковый комплекс, подобный PCNA
ATM и ATR активируют серин-треонин-киназы точки контроля Chk1 и
Chk2
• Chk1 и Chk2 ингибируют фосфорилированием Cdc25 фосфатазу,
предотвращая вступление в митоз, фосфорилируют р53.
101.
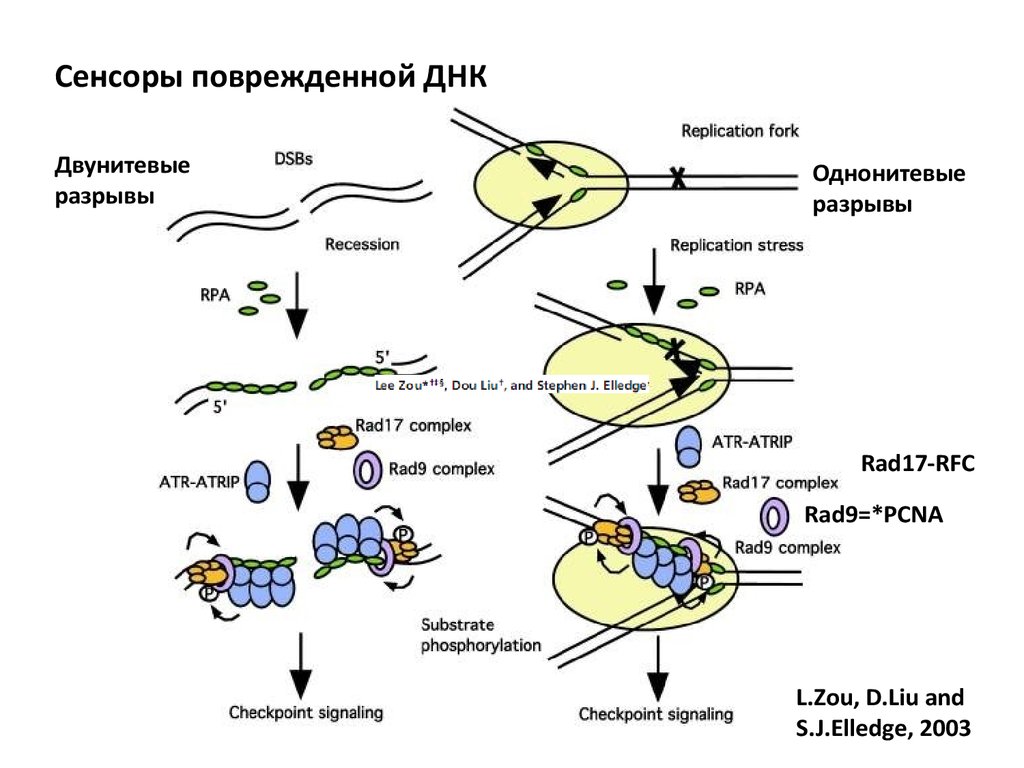
Cенсоры поврежденной ДНКДвунитевые
разрывы
Однонитевые
разрывы
Rad17-RFC
Rad9=*PCNA
L.Zou, D.Liu and
S.J.Elledge, 2003
102.
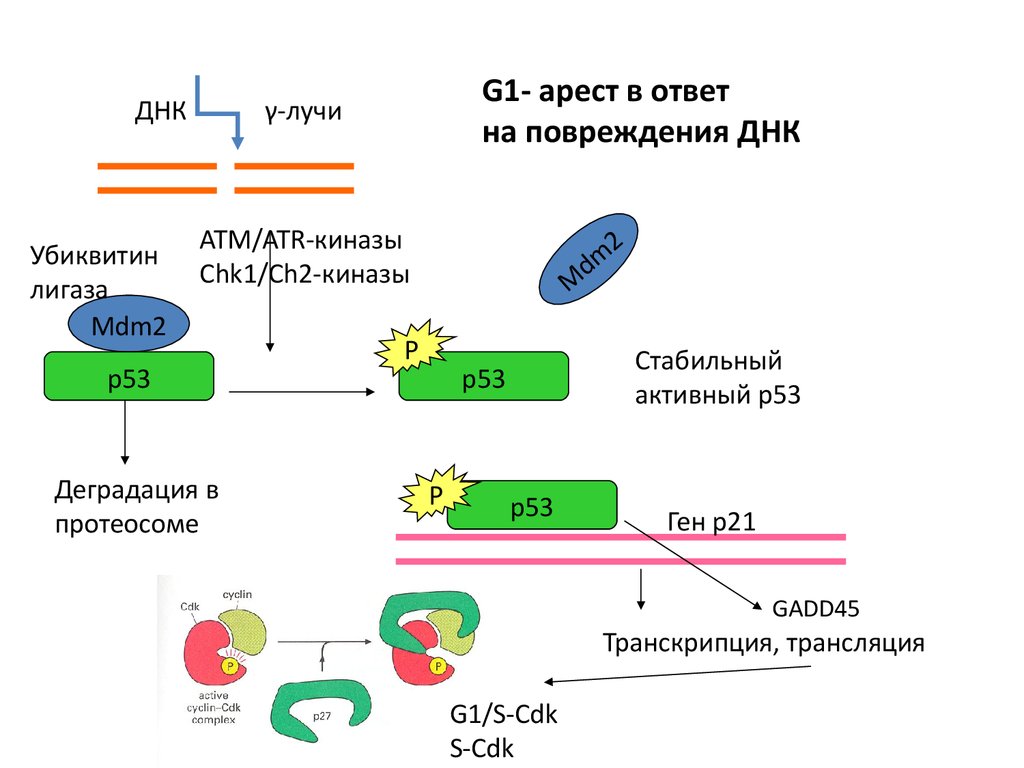
ДНКУбиквитин
лигаза
Mdm2
G1- арест в ответ
на повреждения ДНК
γ-лучи
ATМ/ATR-киназы
Chk1/Ch2-киназы
p53
Деградация в
протеосоме
M
P
Стабильный
активный р53
p53
P
2
m
d
p53
Ген р21
GADD45
Транскрипция, трансляция
G1/S-Cdk
S-Cdk
103.
Сенсоры повреждения ДНК:RPA –
ATR - амплификация сигнала
ATRIP
Передача сигнала:
Активация Chk 1, 2 киназ
Эффекторная часть:
Фосфорилирование Cdc25 – остановка входа в митоз
Фосфорилирование р53 – транскрипция гена белка CKI –
ингибитора комплекса cdk-cyclin
104.
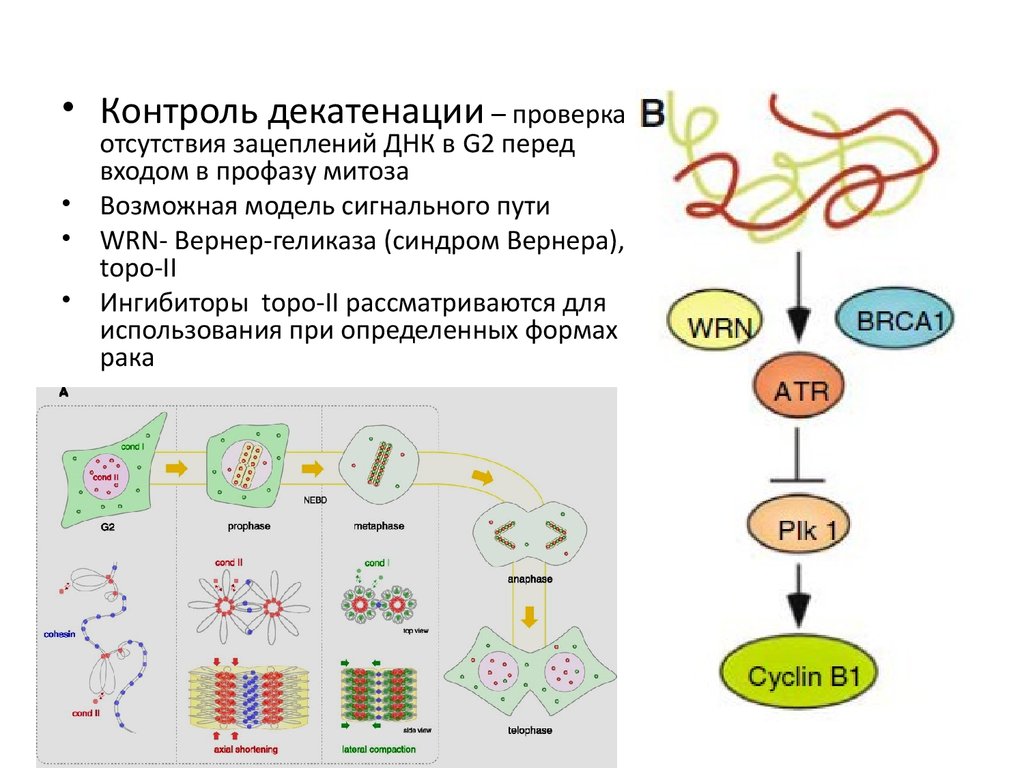
• Контроль декатенации – проверкаотсутствия зацеплений ДНК в G2 перед
входом в профазу митоза
Возможная модель сигнального пути
WRN- Вернер-геликаза (синдром Вернера),
topo-II
Ингибиторы topo-II рассматриваются для
использования при определенных формах
рака
105.
• Antephase checkpoint.• Точка контроля в Антефазе отлична от контроля
декатенации.
• Клетки откладывают вступление в профазу митоза
(конденсацию хроматина) при обработке Х-лучами,
микротрубочковыми ядами (колхицином), низкой
температурой. Клетки, вступившие в профазу,
деконденсируют свой хроматин (в нейробластах саранчи
после облучения уменьшилось число клеток в профазе)
• Короткий промежуток в конце G2
Ключевой белок – CHFR – неканоническая убиквитин-лигаза.
Убиквитинизирует polo-like (Plk) киназу, тем самым
воздействуя на Cdk-1, откладывая вхождение в митоз.
P38 – киназа играет роль в ответе на UV-облучение,
осмотический стресс
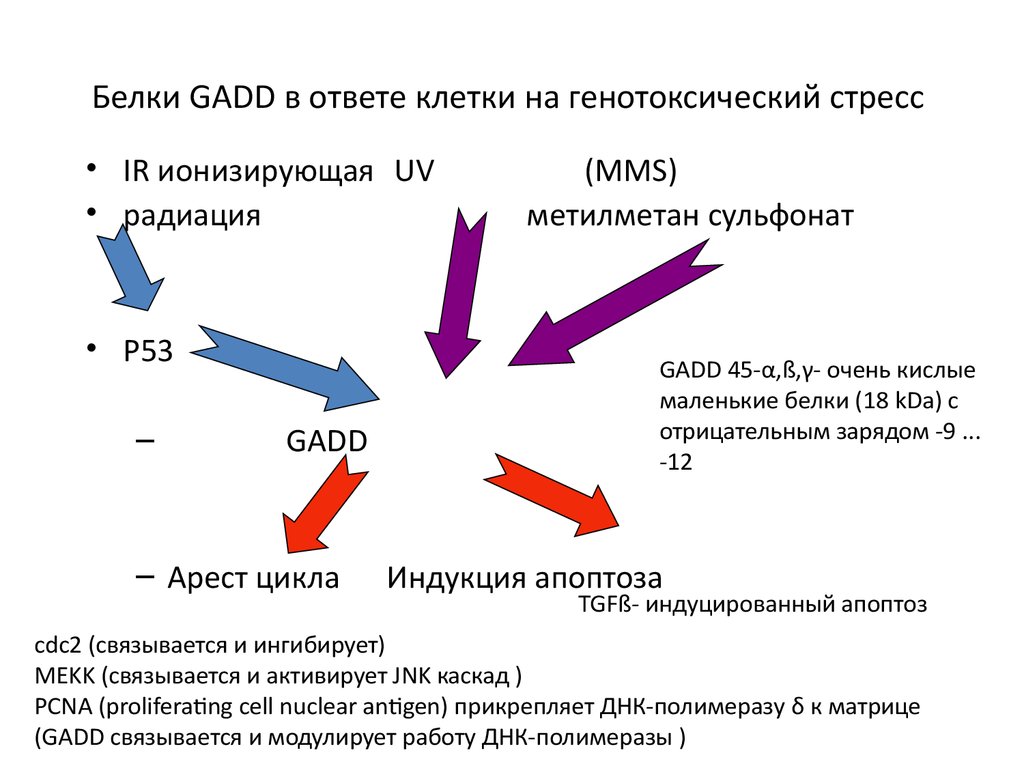
106. Белки GADD в ответе клетки на генотоксический стресс
• IR ионизирующая UV• радиация
• P53
–
GADD
– Арест цикла
(MMS)
метилметан сульфонат
GADD 45-α,ß,γ- очень кислые
маленькие белки (18 kDa) с
отрицательным зарядом -9 ...
-12
Индукция апоптоза
TGFß- индуцированный апоптоз
cdc2 (связывается и ингибирует)
MEKK (связывается и активирует JNK каскад )
PCNA (proliferating cell nuclear antigen) прикрепляет ДНК-полимеразу δ к матрице
(GADD связывается и модулирует работу ДНК-полимеразы )
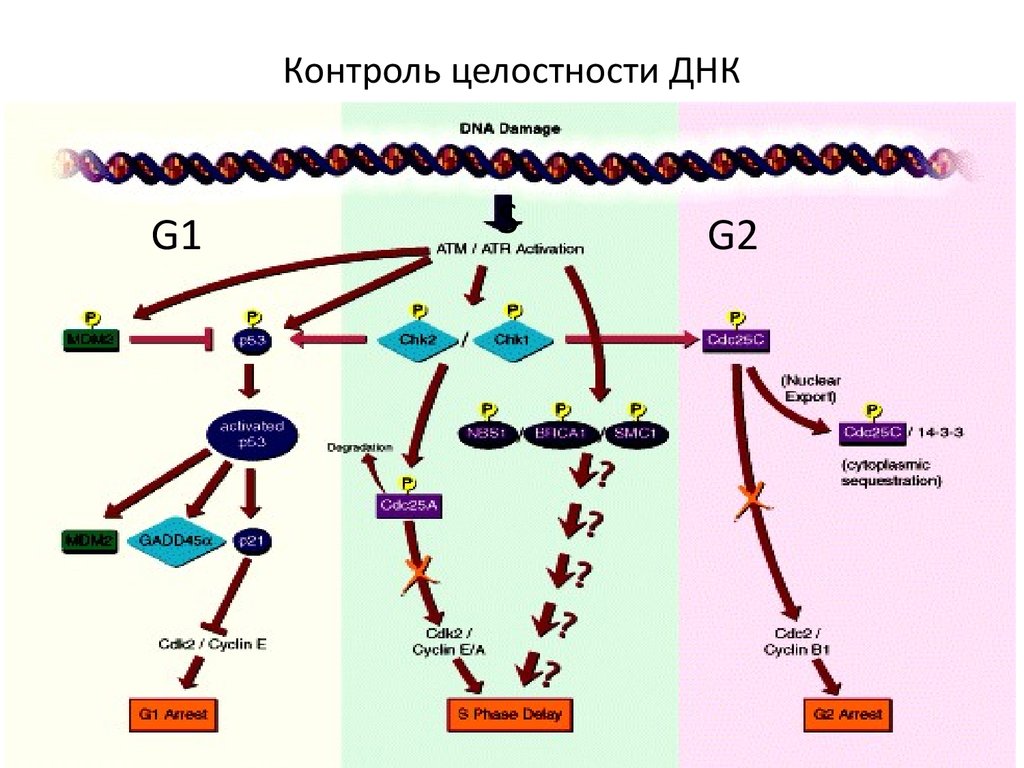
107. Контроль целостности ДНК
G1S
G2
108.
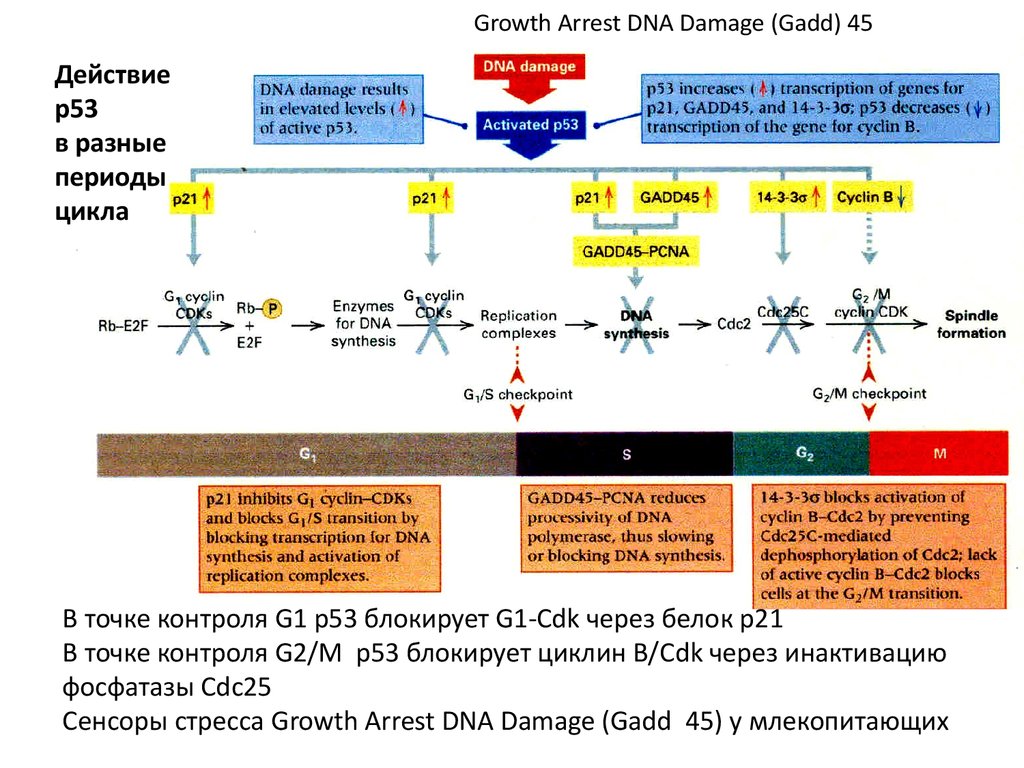
Growth Arrest DNA Damage (Gadd) 45Действие
р53
в разные
периоды
цикла
В точке контроля G1 р53 блокирует G1-Cdk через белок р21
В точке контроля G2/М р53 блокирует циклин В/Cdk через инактивацию
фосфатазы Cdc25
Сенсоры стресса Growth Arrest DNA Damage (Gadd 45) у млекопитающих
109.
110.
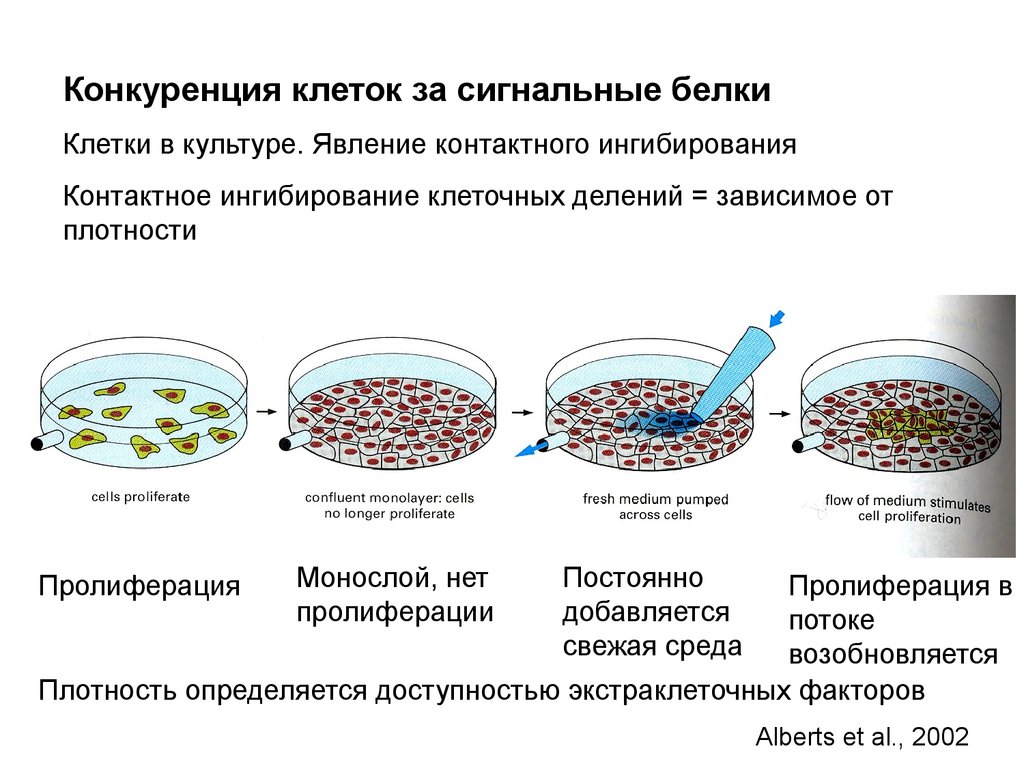
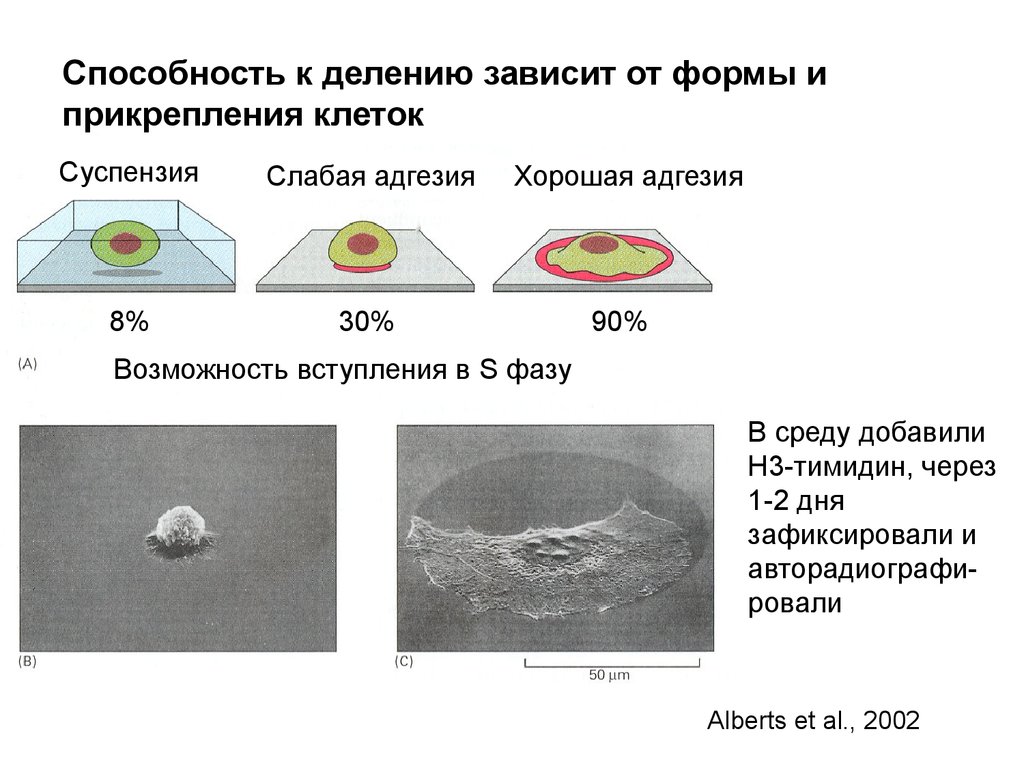
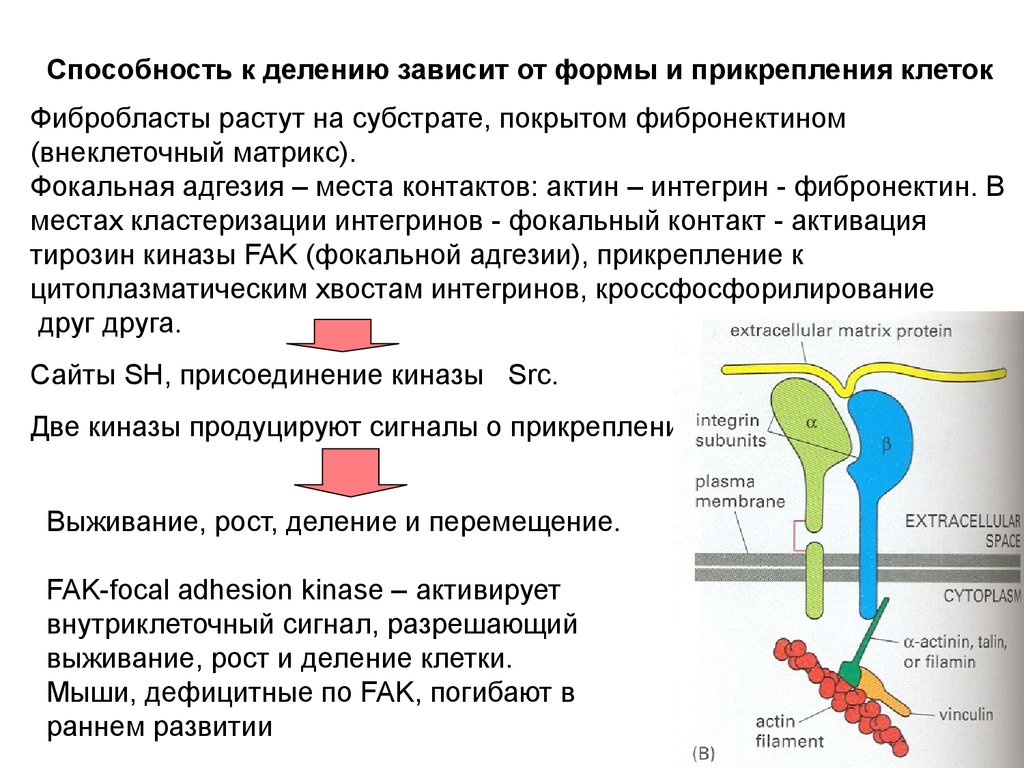
Надклеточный контроль клеточного деления,роста и апоптоза
Размер организма и органа зависит от числа клеток и их
массы. Число клеток определяется их рождением и гибелью
Экстраклеточные сигналы, регулирующие эти процессы, часто
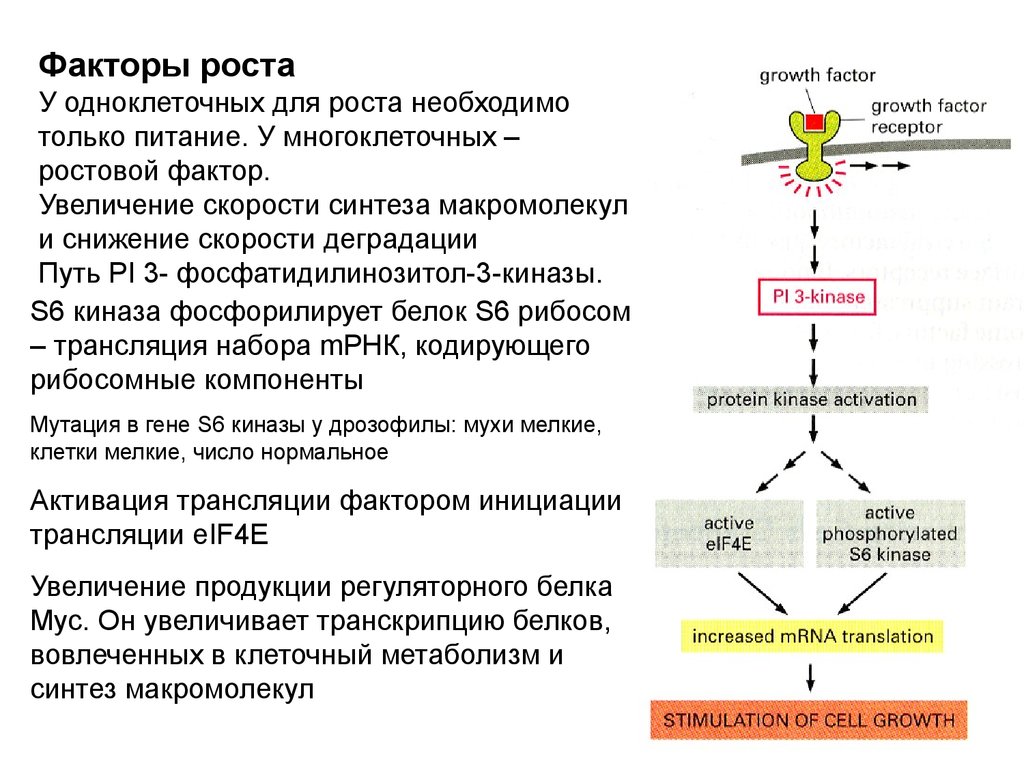
называют «факторы роста» в широком смысле. Для точного
выражения следует различать:
1. Митогены – стимулируют клеточные деления,
снимая внутриклеточный блок с продвижения по
циклу.
2. Ростовые факторы – стимулируют увеличение
массы клетки, вызывая синтез макромолекул и
ингибируя их деградацию
3. Факторы выживания – супрессируют апоптоз
111.
Апоптоз,морфологические изменения:
•Конденсация хроматина, фрагментация и разрушение ядра.
•Цитоскелет сжимается.
•Клеточная мембрана вспухает.
•Клетки фрагментируются, образуются «апоптозные тела».
Молекулярные изменения:
•Возрастает концентрация Са2+
•Активируются протеазы-каспазы
•Разрушение ламины.
•Разрезание белка, инактивирующего эндонуклеазу.
•ДНК режется на фрагменты
•Клеточная поверхность меняется- теряется сиаловая кислота на
гликопротеинах и гликолипидах-, что вызывает быстрый фагоцитоз
клетки макрофагами или соседями
•На мембране появляются рецепторы витронектина, притягивающие
макрофаги, фосфатидилсерин появляется на внешнем мембранном слое,
фосфатидилсерин появляется на внешнем мембранном слое,
112.
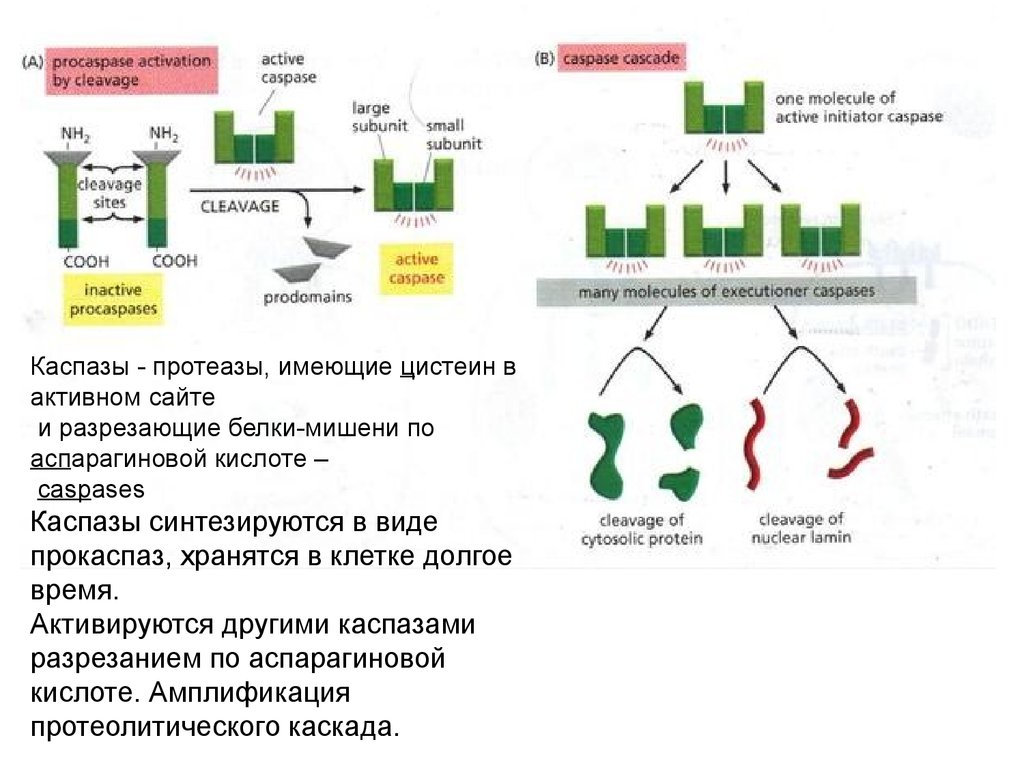
Каспазы - протеазы, имеющие цистеин вактивном сайте
и разрезающие белки-мишени по
аспарагиновой кислоте –
caspases
Каспазы синтезируются в виде
прокаспаз, хранятся в клетке долгое
время.
Активируются другими каспазами
разрезанием по аспарагиновой
кислоте. Амплификация
протеолитического каскада.
113.
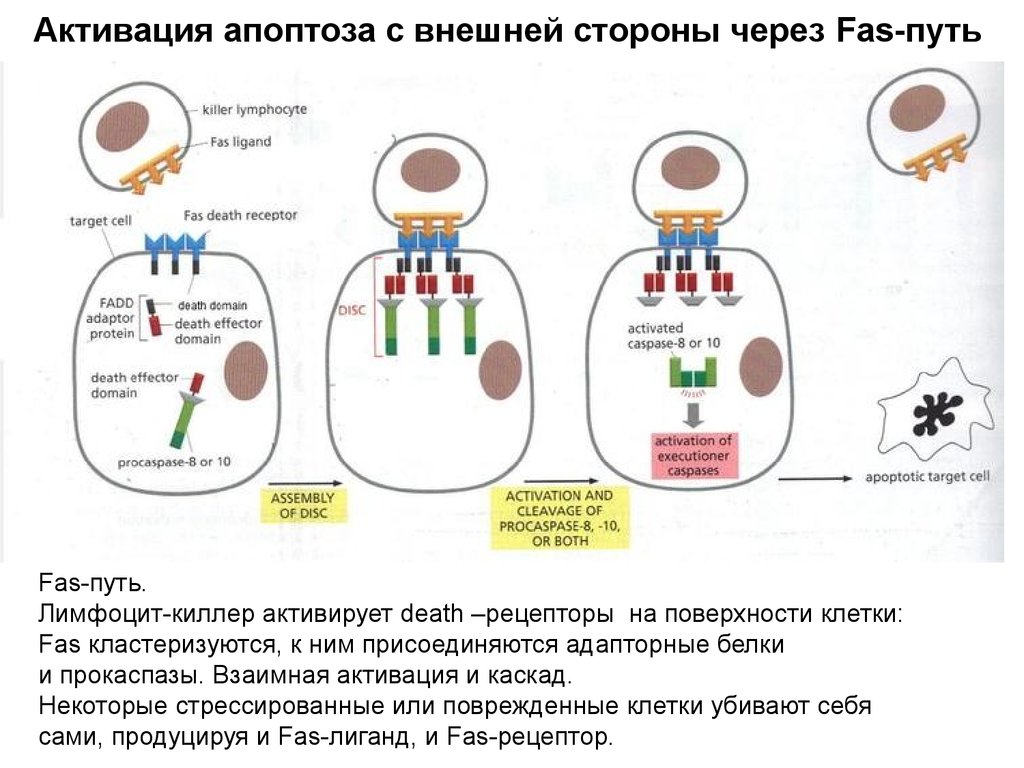
Активация апоптоза с внешней стороны через Fas-путьFas-путь.
Лимфоцит-киллер активирует death –рецепторы на поверхности клетки:
Fas кластеризуются, к ним присоединяются адапторные белки
и прокаспазы. Взаимная активация и каскад.
Некоторые стрессированные или поврежденные клетки убивают себя
сами, продуцируя и Fas-лиганд, и Fas-рецептор.
114.
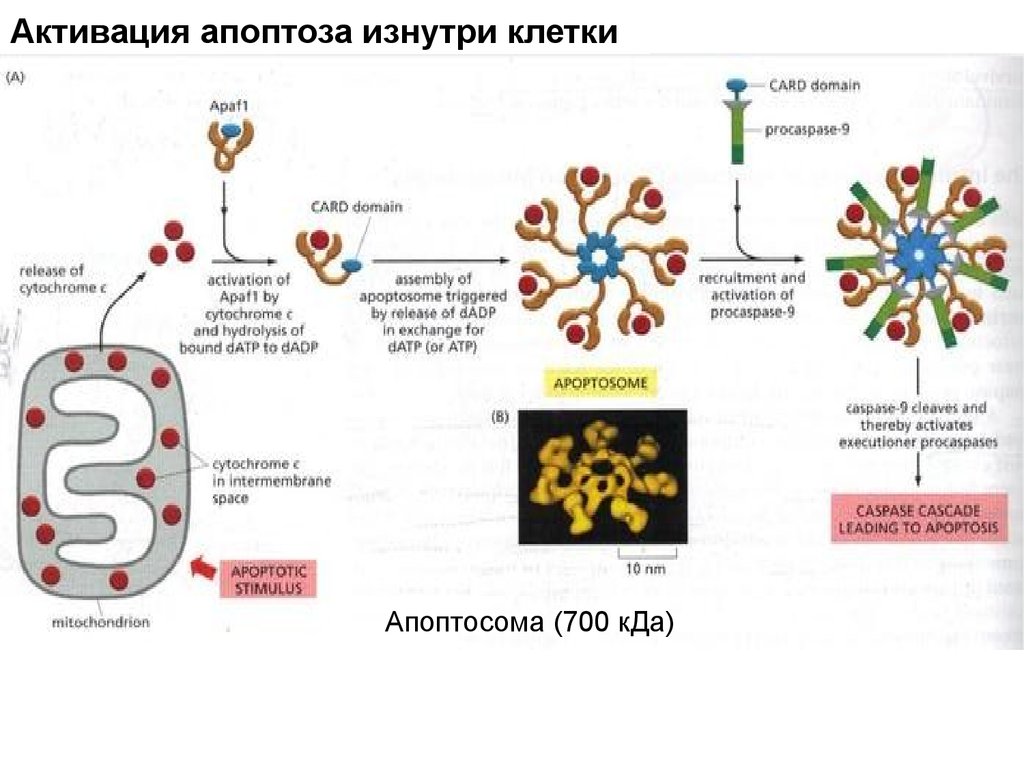
Активация апоптоза изнутри клеткиАпоптосома (700 кДа)
115.
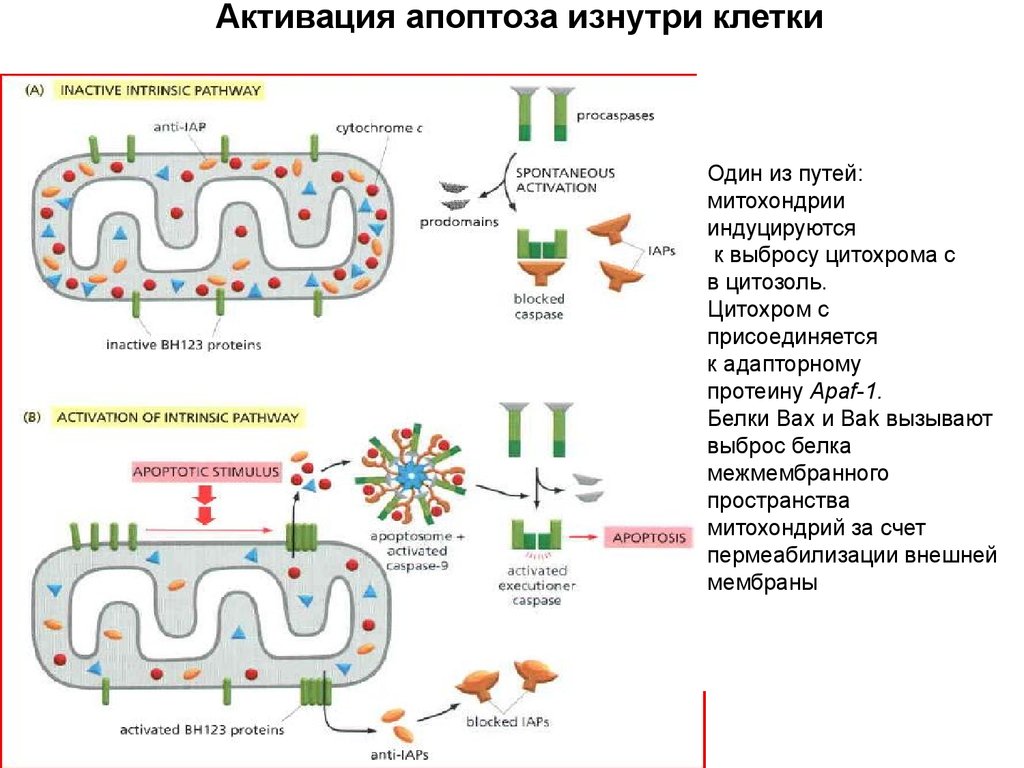
Активация апоптоза изнутри клеткиПрокаспаза-3
Один из путей:
митохондрии
индуцируются
к выбросу цитохрома с
в цитозоль.
Цитохром с
присоединяется
к адапторному
протеину Apaf-1.
Белки Bax и Bak вызывают
выброс белка
межмембранного
пространства
митохондрий за счет
пермеабилизации внешней
мембраны
116.
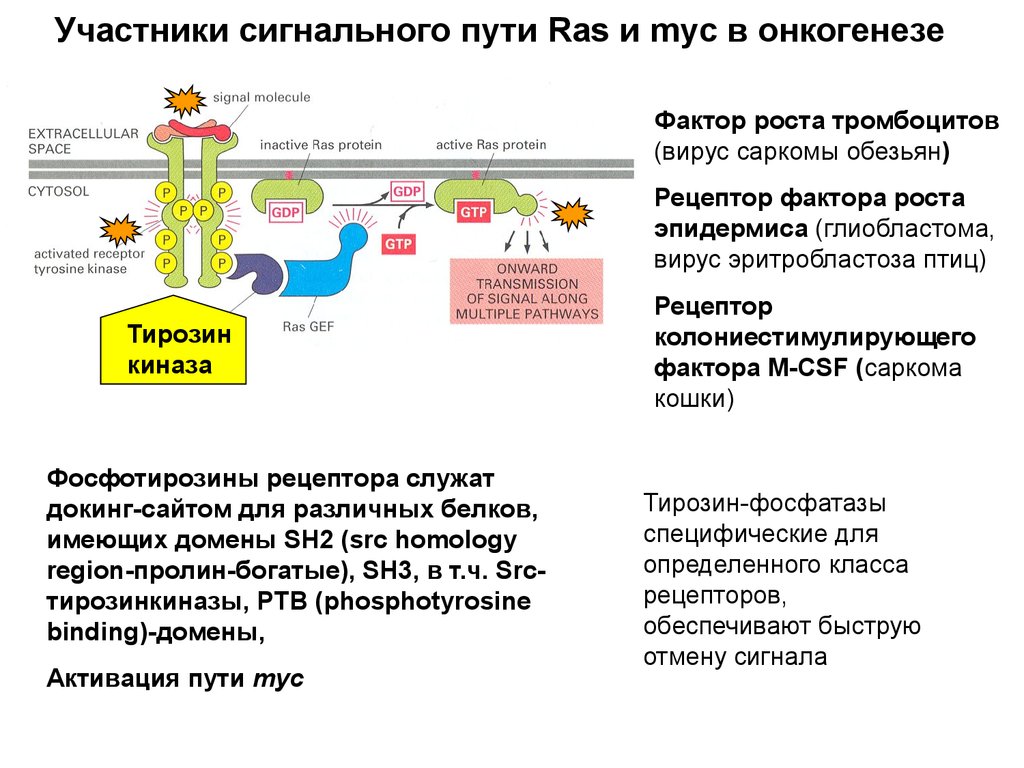
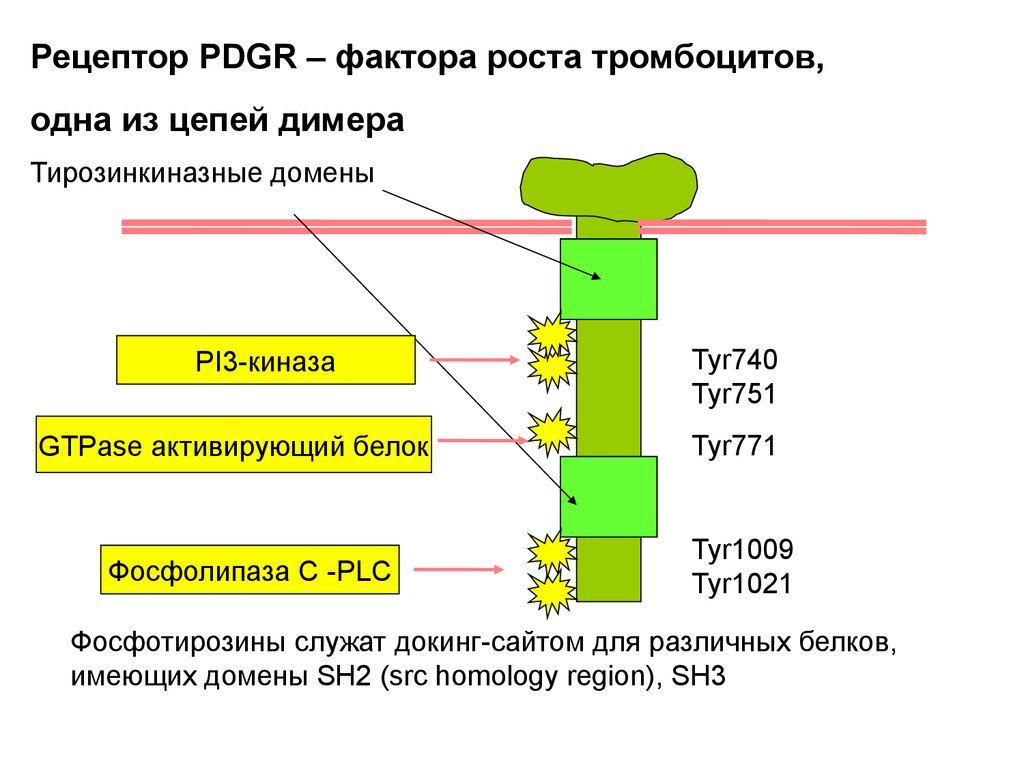
Митогены (более 50 белков)Фактор роста тромбоцитов PDGF –platelet-derived grows factor
Клетки фибробластов в культуре делились с добавлением
сыворотки крови и не делились в плазме.
Плазма – забирают жидкую часть крови без образования сгустка.
Сыворотка – то же после образования сгустка.
Клетки делились при добавлении экстракта фибробластов
В организме тромбоциты стимулируют деление клеток при
заживлении ран.
EGF –epidermal growth factor
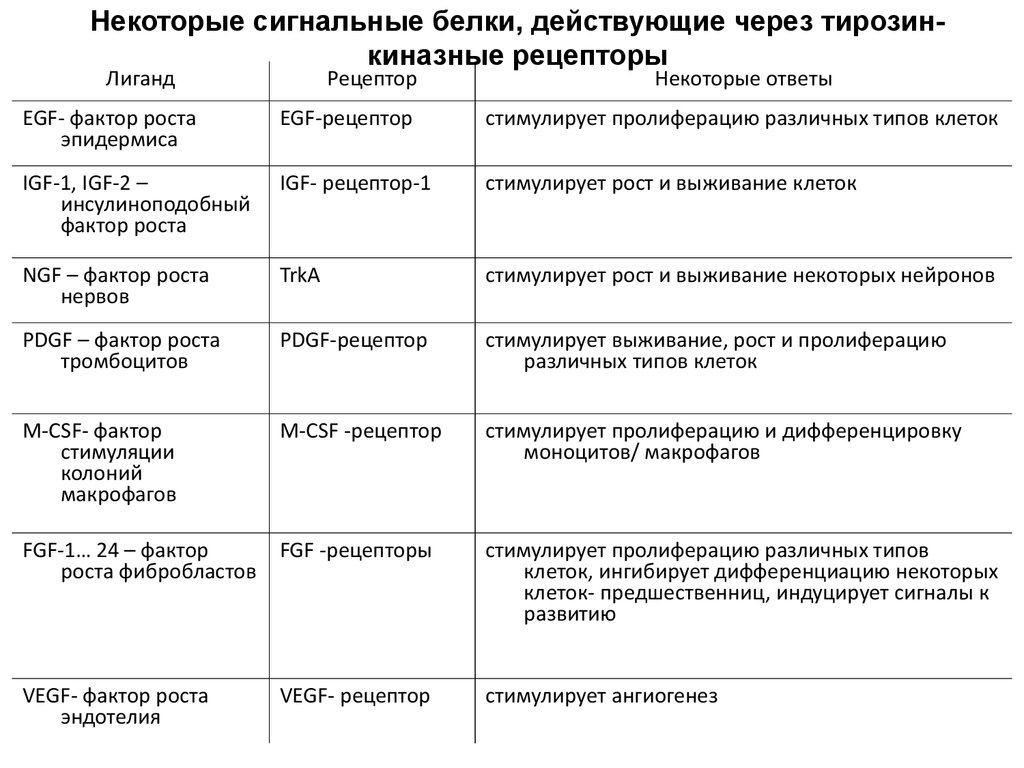
PDGF (фибробласты, гладкие мышечные, нейроглиальные) и EGF
– широкого спектра дейстия
Эритропоэтин – только для эритроцитов
TGF-β – трансформирующий фактор роста – одни клетки
стимулирует, другие ингибирует
117.
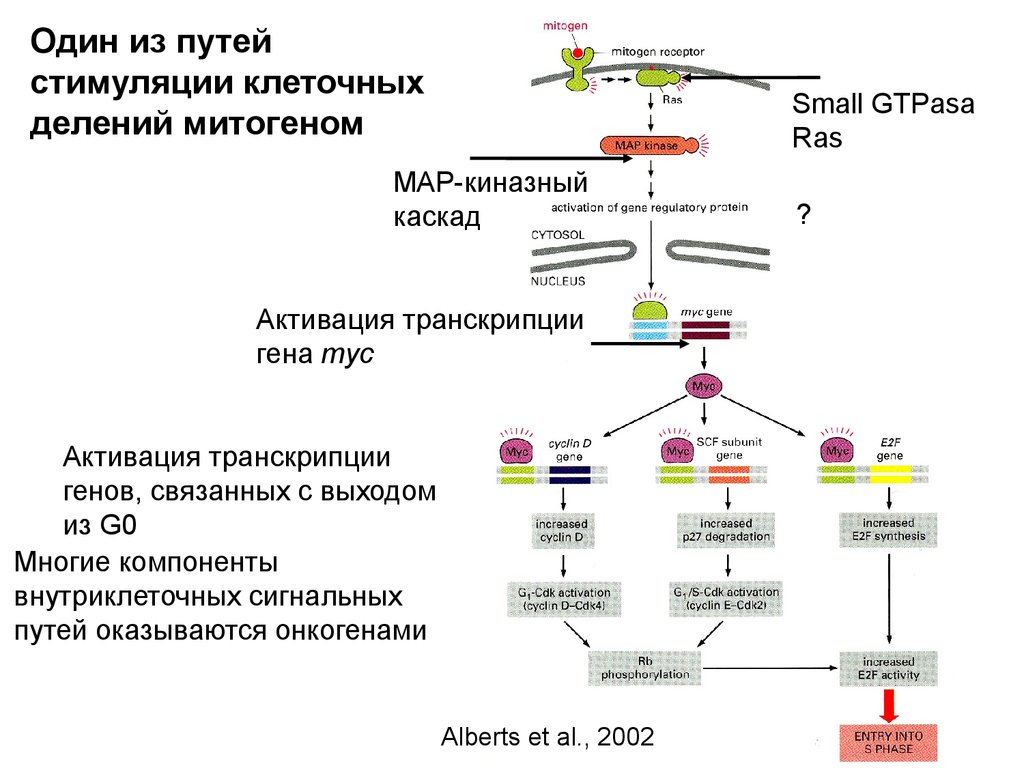
Один из путейстимуляции клеточных
делений митогеном
Small GTPasa
Ras
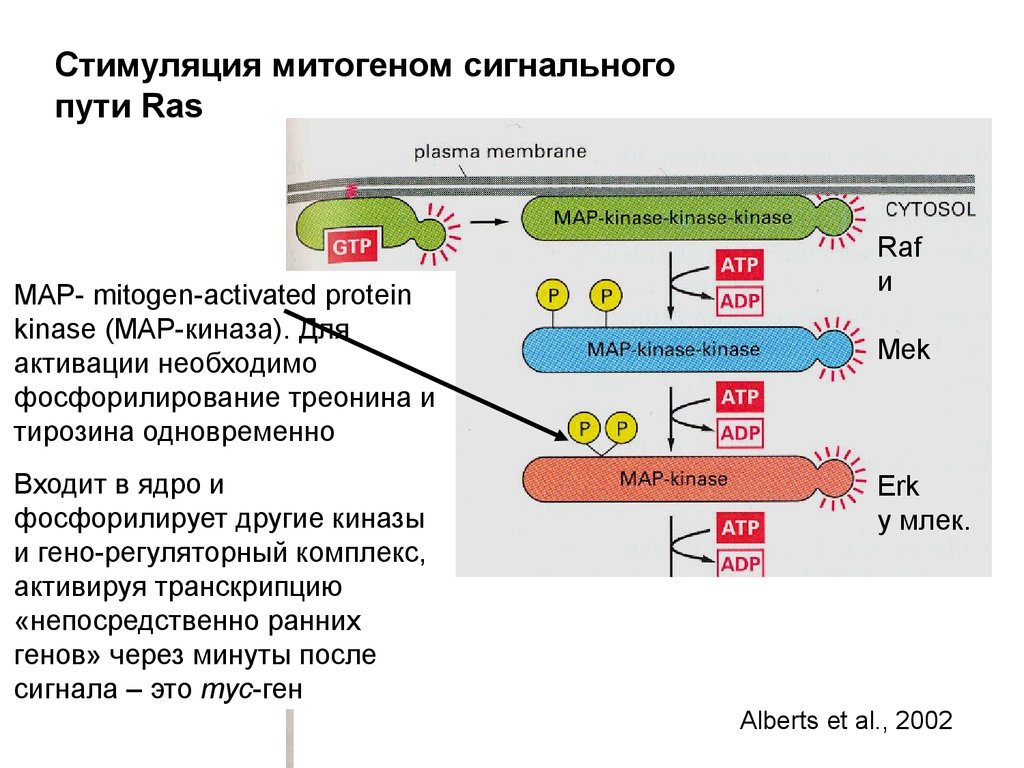
MAP-киназный
каскад
Активация транскрипции
гена myc
Активация транскрипции
генов, связанных с выходом
из G0
Многие компоненты
внутриклеточных сигнальных
путей оказываются онкогенами
Alberts et al., 2002
?
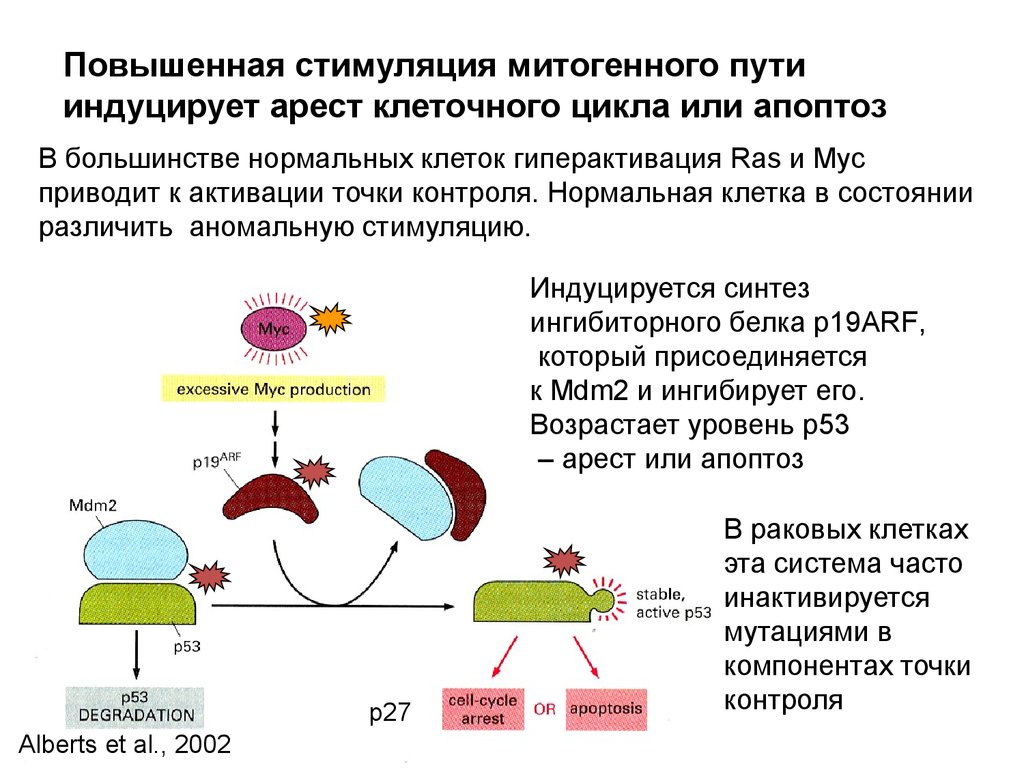
118.
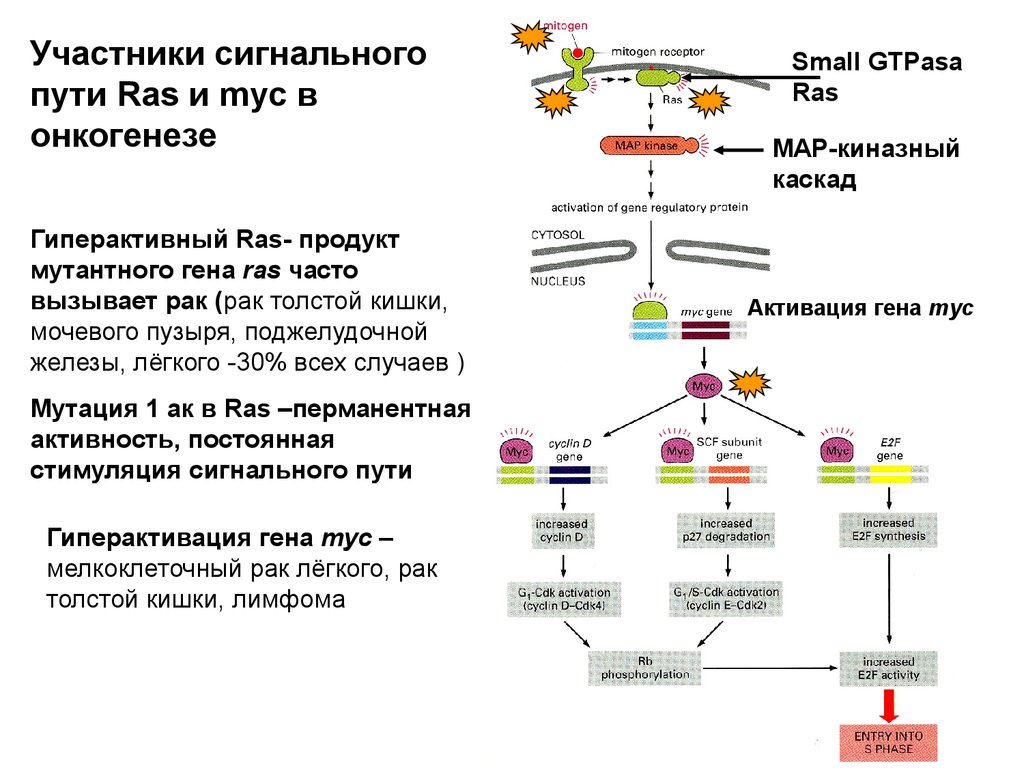
Участники сигнальногопути Ras и myc в
онкогенезе
Гиперактивный Ras- продукт
мутантного гена ras часто
вызывает рак (рак толстой кишки,
мочевого пузыря, поджелудочной
железы, лёгкого -30% всех случаев )

























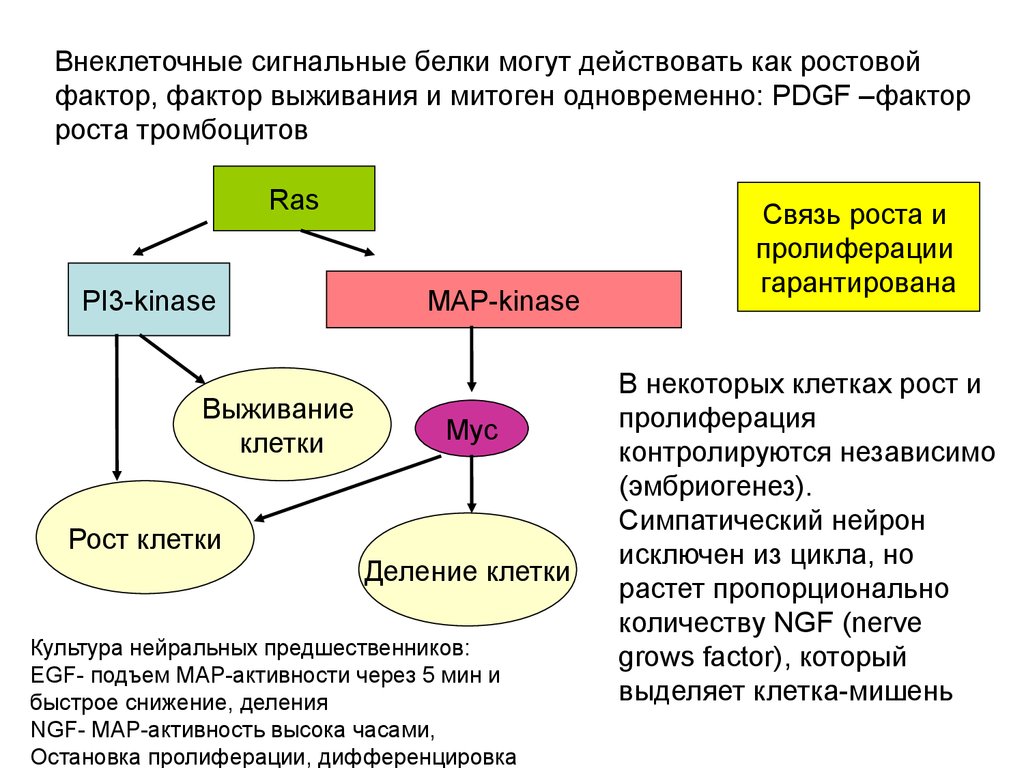
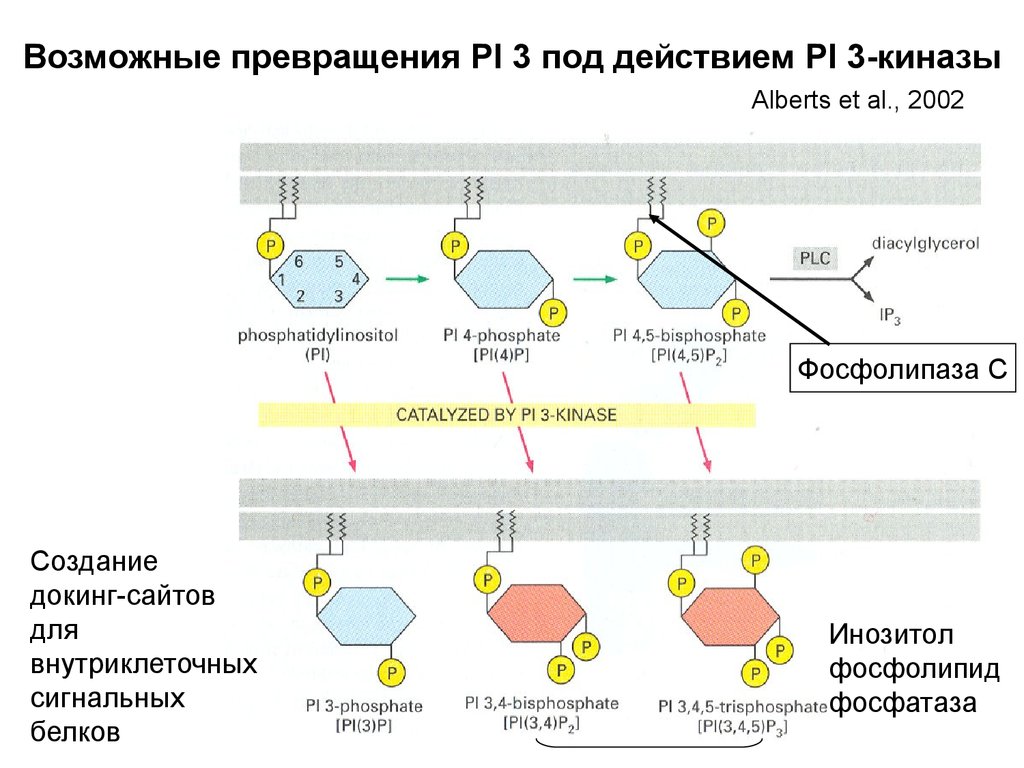
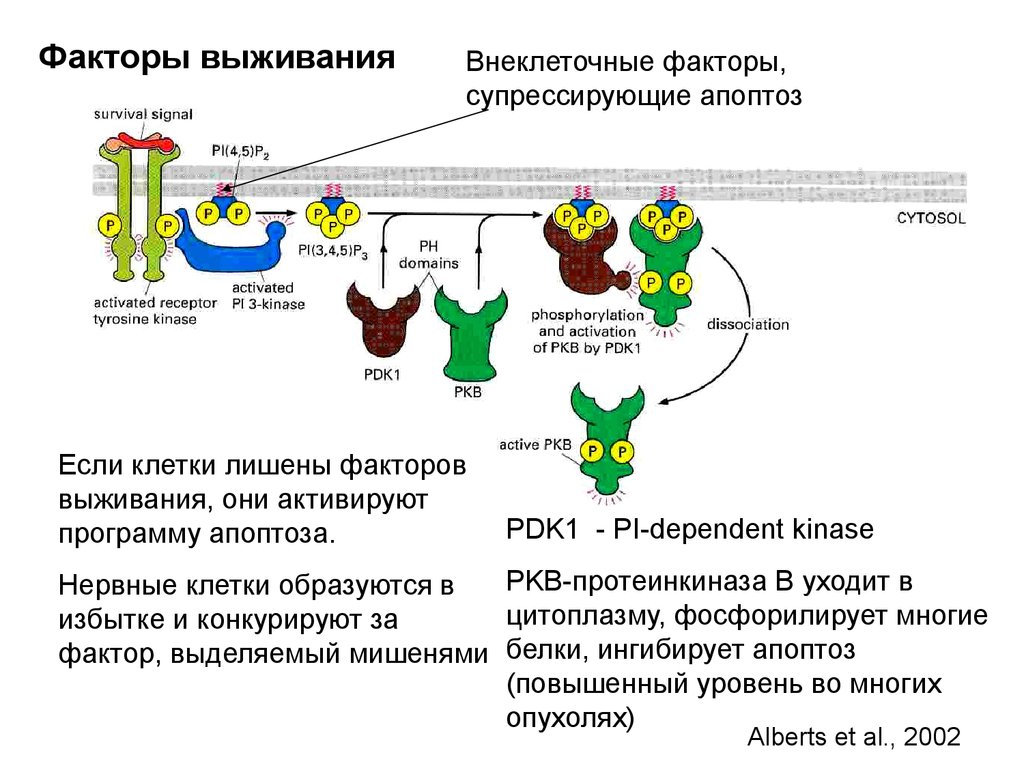
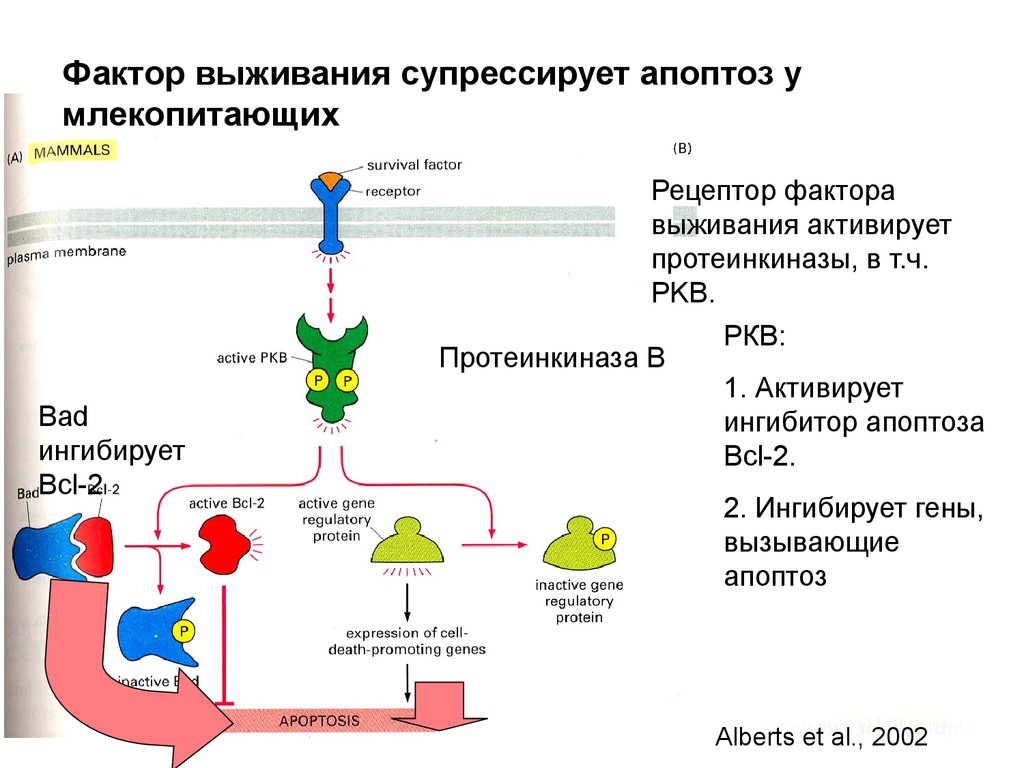


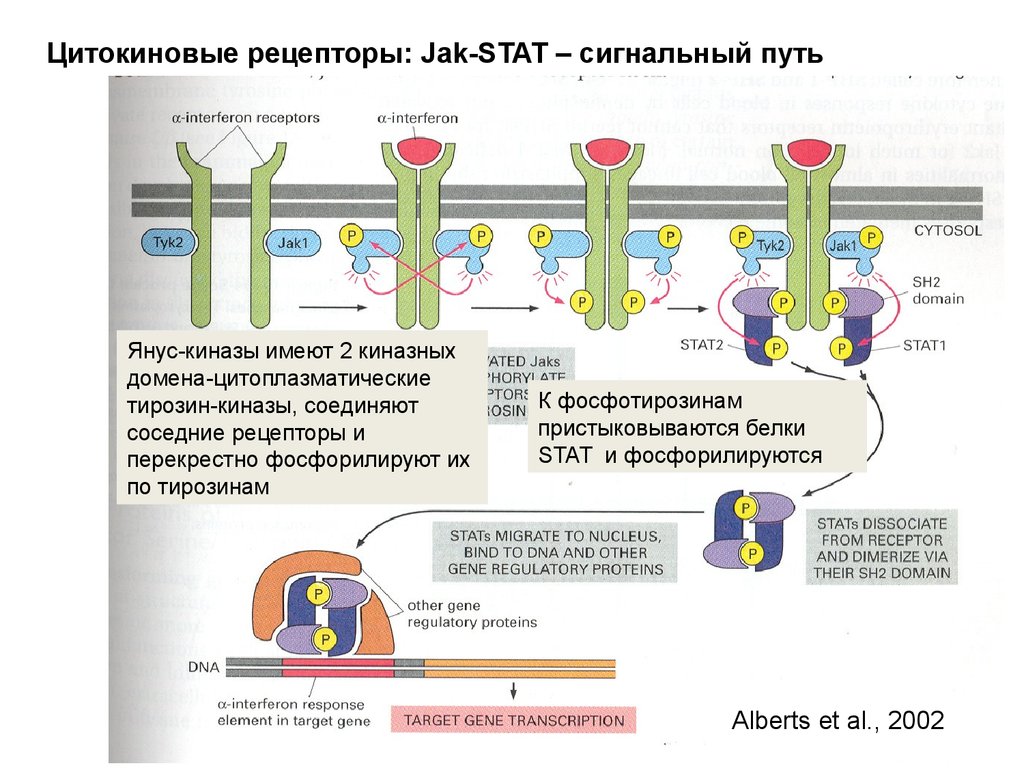


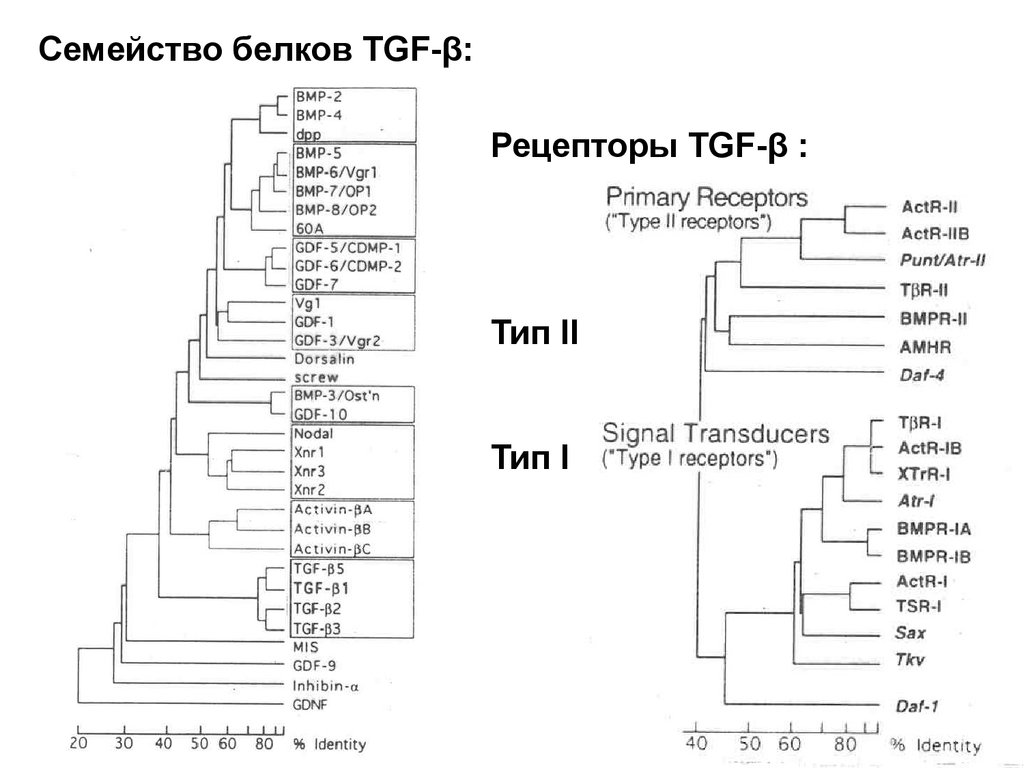
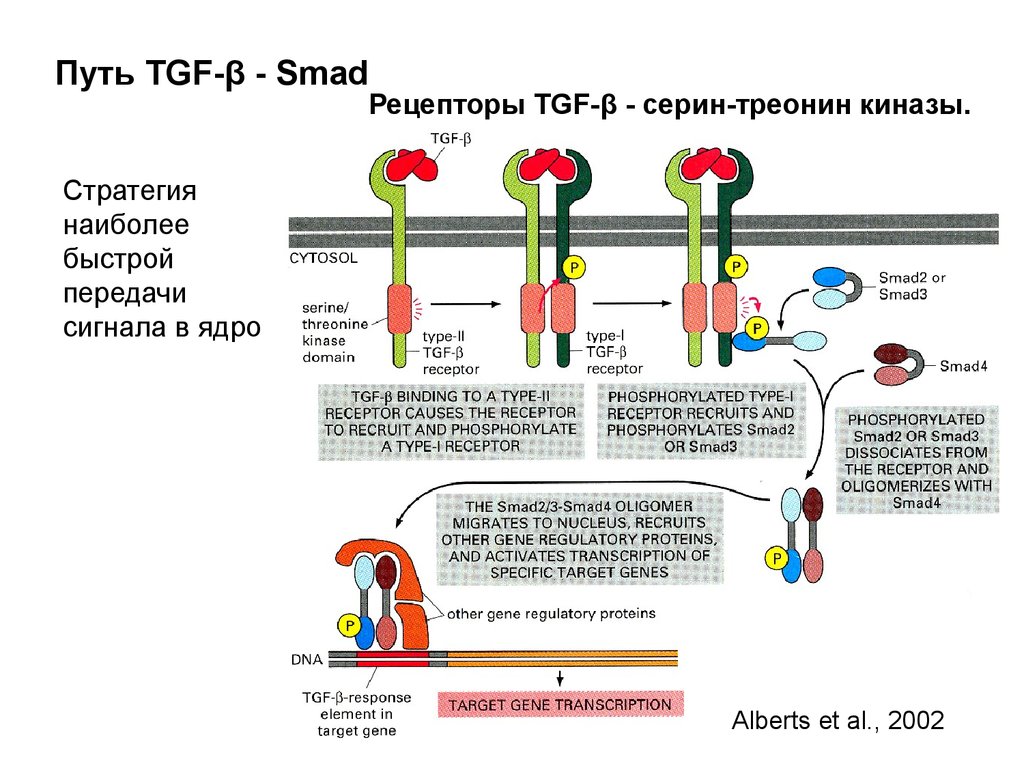
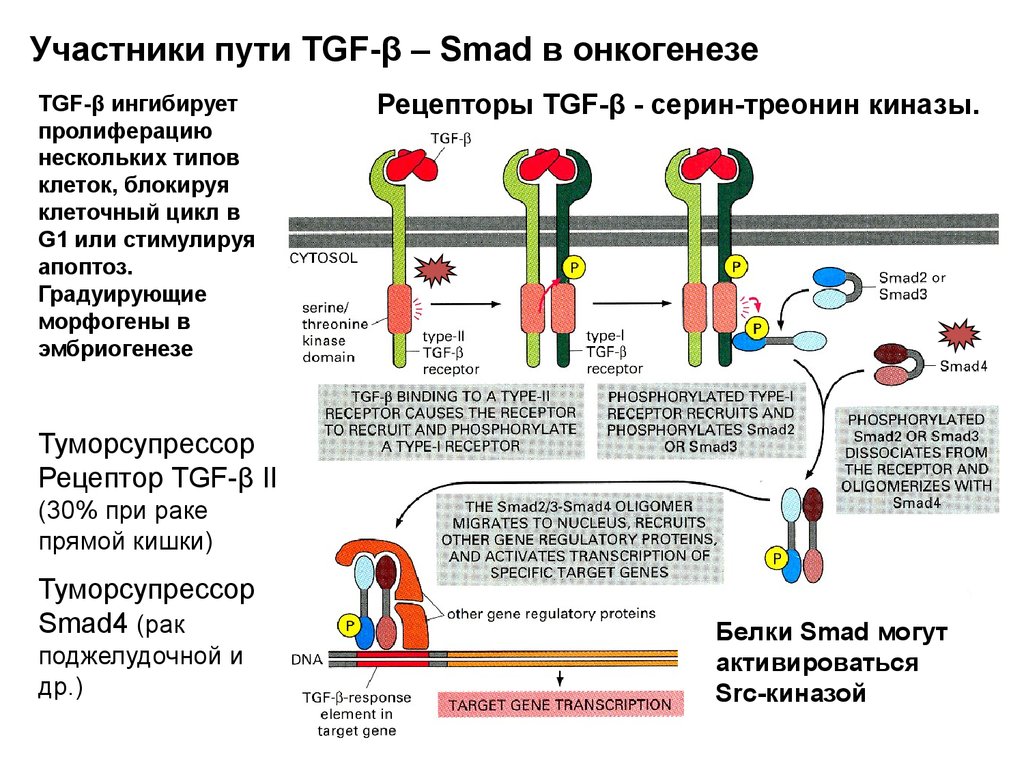
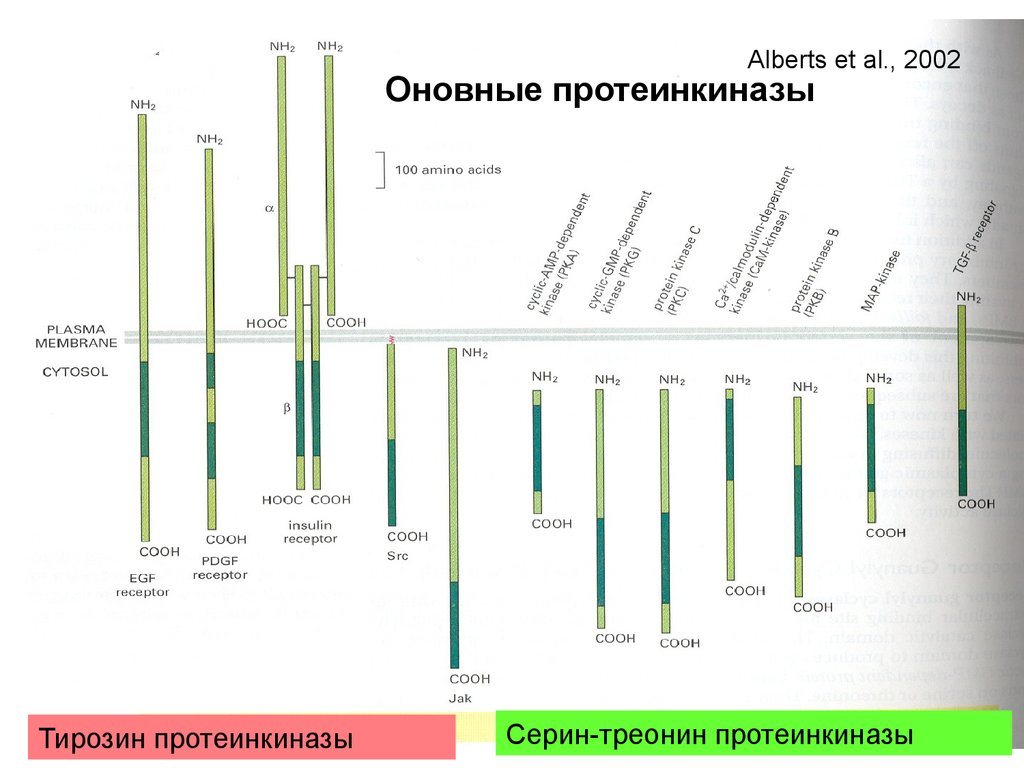
 Биология
Биология Химия
Химия








