Похожие презентации:
Карбоновые кислоты
1.
2. Историческая справка
ИСТОРИЧЕСКАЯ СПРАВКА• С ДРЕВНЕЙШИХ ВРЕМЕН ИСПОЛЬЗОВАЛИ УКСУС,
ОБРАЗУЮЩИЙСЯ ПРИ СКИСАНИИ ВИНА, ЛИСТЬЯ
ЩАВЕЛЯ, СТЕБЛИ РЕВЕНЯ, СОК ЛИМОНА, ЛИСТЬЯ
КИСЛИЦЫ В КАЧЕСТВЕ КИСЛОЙ ПРИПРАВЫ
фермент
СН3 – СН2 – ОН + О2 → СН3 – СООН + Н2О
Что вызывает кислый вкус?
3. Кто получил кислоты?
КТО ПОЛУЧИЛ КИСЛОТЫ?• УКСУСНАЯ КИСЛОТА СН3СООН –
ИЗВЕСТНА С 8 ВЕКА
• БЕЗВОДНАЯ УКСУСНАЯ КИСЛОТА –
1789Г., ТОВИЙ ЕГОРОВИЧ ЛОВИЦ,
ОБЕЗВОЖИВАЛ
АКТИВИРОВАННЫМ УГЛЕМ
• ПРИ T=16,50С КРИСТАЛЛИЗУЕТСЯ,
НАПОМИНАЕТ ЛЕД → «ЛЕДЯНАЯ
КИСЛОТА»
4. Муравьиная кислота
МУРАВЬИНАЯ КИСЛОТА• 16 ВЕК – ОБНАРУЖЕНО, ЧТО «КИСЛЫЙ ПАР» ИЗ
МУРАВЕЙНИКОВ ИЗМЕНЯЕТ ЦВЕТ
РАСТИТЕЛЬНЫХ КРАСИТЕЛЕЙ НА КРАСНЫЙ
• ДЖ. РЕЙ – ПОЛУЧИЛ МУРАВЬИНУЮ КИСЛОТУ
ПЕРЕГОНКОЙ МУРАВЬЕВ И ДАЛ ЕЙ НАЗВАНИЕ
5. Карл Вильгельм Шееле
КАРЛВИЛЬГЕЛЬМ
ШЕЕЛЕ
• КОНЕЦ 18 ВЕКА – ВЫДЕЛИЛ И
ОПИСАЛ ЛИМОННУЮ,
МОЛОЧНУЮ, БЕНЗОЙНУЮ,
ЩАВЕЛЕВУЮ И ДРУГИЕ
КИСЛОТЫ
• НО ДО 60-Х ГОДОВ 19 ВЕКА
ХИМИЧЕСКОЕ СТРОЕНИЕ
КАРБОНОВЫХ КИСЛОТ
ОСТАВАЛОСЬ НЕВЫЯСНЕННЫМ
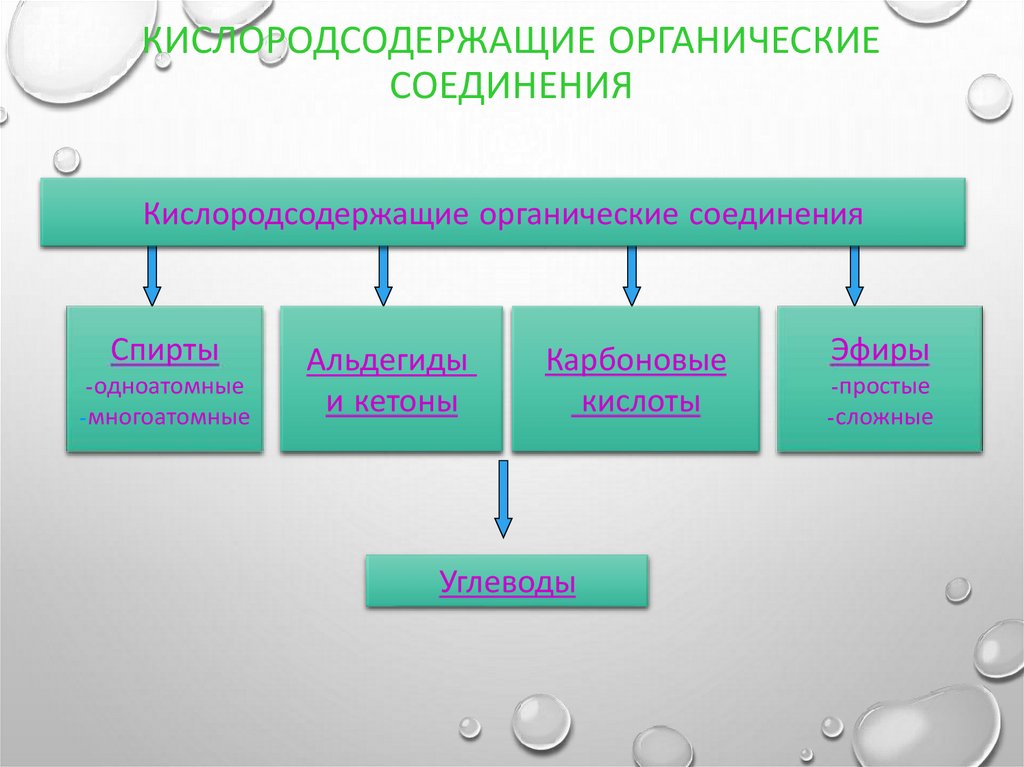
6. Кислородсодержащие органические соединения
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕСОЕДИНЕНИЯ
Кислородсодержащие органические соединения
Спирты
-одноатомные
-многоатомные
Альдегиды
и кетоны
Карбоновые
кислоты
Углеводы
Эфиры
-простые
-сложные
7.
КАРБОНОВЫЕ КИСЛОТЫ — КЛАССОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, МОЛЕКУЛЫ
КОТОРОГО СОДЕРЖАТ КАРБОКСИЛЬНУЮ
ГРУППУ - COOH. СОСТАВ ПРЕДЕЛЬНЫХ
ОДНООСНОВНЫХ КАРБОНОВЫХ КИСЛОТ
СООТВЕТСТВУЕТ ОБЩЕЙ ФОРМУЛЕ
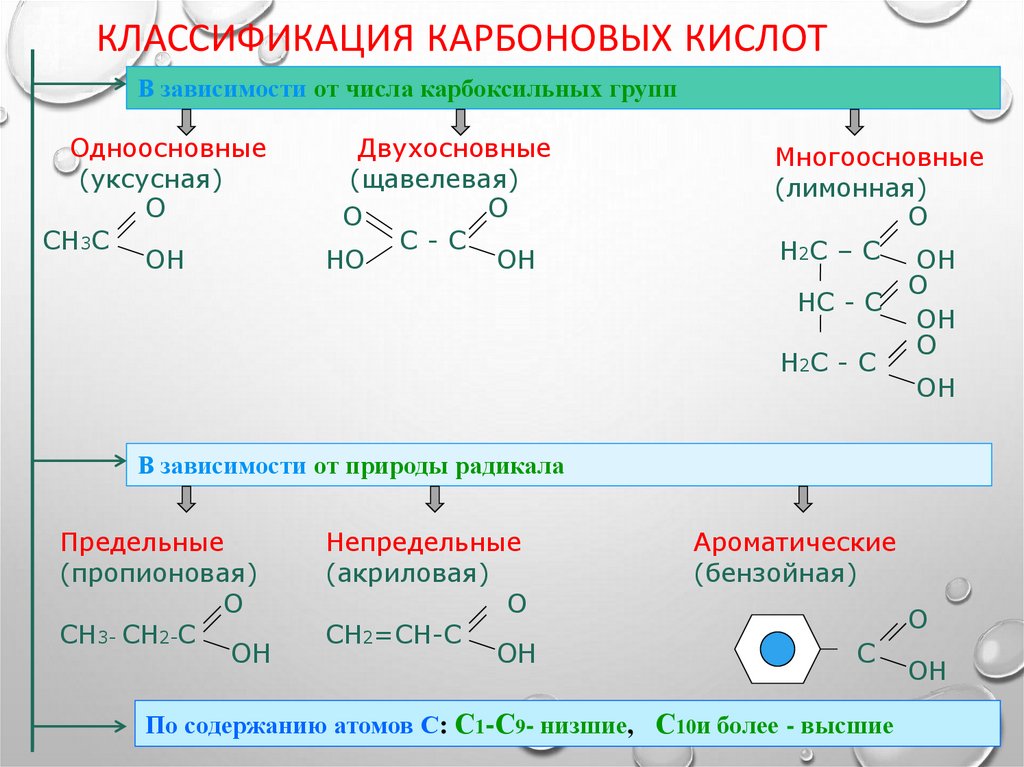
8. Классификация карбоновых кислот
КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТВ зависимости от числа карбоксильных групп
Одноосновные
(уксусная)
О
СН3С
ОН
Двухосновные
(щавелевая)
О
О
С-С
НО
ОН
Многоосновные
(лимонная)
О
Н2С – С ОН
О
НС - С
ОН
О
Н2С - С
ОН
В зависимости от природы радикала
Предельные
(пропионовая)
О
СН3- СН2-С
ОН
Непредельные
(акриловая)
О
СН2=СН-С
ОН
Ароматические
(бензойная)
О
С
По содержанию атомов С: С1-С9- низшие, С10и более - высшие
ОН
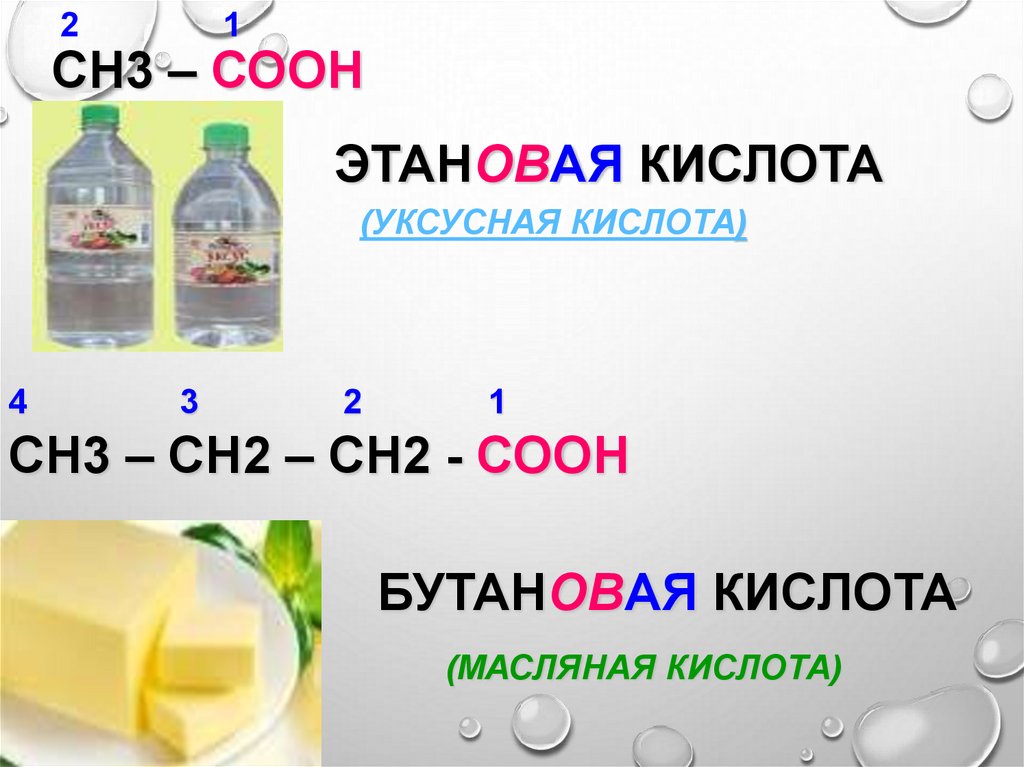
9.
21
СН3 – СООН
ЭТАНОВАЯ КИСЛОТА
(УКСУСНАЯ КИСЛОТА)
4
3
2
1
СН3 – СН2 – СН2 - СООН
БУТАНОВАЯ КИСЛОТА
(МАСЛЯНАЯ КИСЛОТА)
10.
54
3
2
1
СН3 – СН2 – СН2 – СН2 – СООН
ПЕНТАНОВАЯ КИСЛОТА
(ВАЛЕРИАНОВАЯ КИСЛОТА)
2
1
НООС – СООН
ЭТАНДИОВАЯ КИСЛОТА
(ЩАВЕЛЕВАЯ КИСЛОТА)
11.
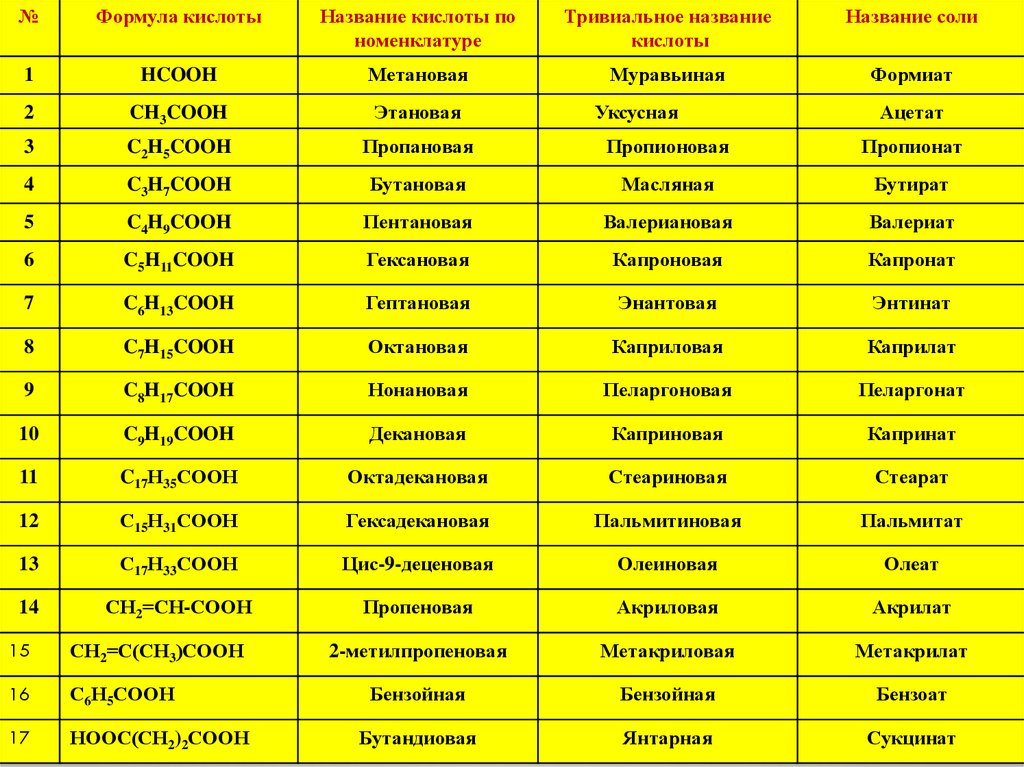
№Формула кислоты
Название кислоты по
номенклатуре
Тривиальное название
кислоты
Название соли
1
HCOOH
Метановая
Муравьиная
Формиат
2
CH3COOH
Этановая
3
C2H5COOH
Пропановая
Пропионовая
Пропионат
4
C3H7COOH
Бутановая
Масляная
Бутират
5
C4H9COOH
Пентановая
Валериановая
Валериат
6
C5H11COOH
Гексановая
Капроновая
Капронат
7
C6H13COOH
Гептановая
Энантовая
Энтинат
8
C7H15COOH
Октановая
Каприловая
Каприлат
9
C8H17COOH
Нонановая
Пеларгоновая
Пеларгонат
10
C9H19COOH
Декановая
Каприновая
Капринат
11
C17Н35СООН
Октадекановая
Стеариновая
Стеарат
12
С15Н31СООН
Гексадекановая
Пальмитиновая
Пальмитат
13
С17Н33СООН
Цис-9-деценовая
Олеиновая
Олеат
14
СН2=СН-СООН
Пропеновая
Акриловая
Акрилат
2-метилпропеновая
Метакриловая
Метакрилат
Бензойная
Бензойная
Бензоат
Бутандиовая
Янтарная
Сукцинат
15
СН2=С(СН3)СООН
16
С6Н5СООН
17
НООС(СН2)2СООН
Уксусная
Ацетат
12.
Алгоритм названия карбоновых кислот:1. Находим главную цепь атомов углерода и нумеруем её,
начиная с карбоксильной группы.
2. Указываем положение заместителей и их название
(названия).
3. После корня, указывающего число атомов углерода в
цепи, идет суффикс «-овая» кислота.
4. Если карбоксильных групп несколько, то перед
«овая» ставится числительное ( -ди, - три…)
Пример:
4
CH3
3
CH
2
CH2
1
COOH
CH3
3- метилбутан + -овая = 3-метилбутановая
кислота
кислота
13.
Алгоритм записи формулкарбоновых кислот
1. Выделить корень слова на основании,
которого
:
записать углеродный скелет в состав, которого входит
карбоксильная группа.
2. Нумеруем атомы углерода, начиная с карбоксильной
группы.
3. Указываем заместители согласно нумерации.
4. Необходимо дописать недостающие атомы водорода
(углерод четырёхвалентен).
5. Проверить правильность записи формулы.
4
Пример:
3
2
CH3 - CH2 - CH - COOH
2-метилбутановая кислота.
CH3
4
3
2
1
1
C - C - C - COOH
4
3
2
1
C - C - C - COOH
CH3
14. :
ФИЗИЧЕСКИЕ СВОЙСТВАС1 – С3
Жидкости с характерным
резким запахом,
хорошо растворимые в воде
С4 – С9
C10 и
более
Вязкие маслянистые
жидкости с
неприятным запахом, плохо
растворимые
в воде
Твердые вещества,
не имеющие запаха,
не растворимые
в воде
15.
Физические свойства уксуснойкислоты:
Агрегатное состояние жидкое
Цвет бесцветная прозрачная
жидкость
Запах резкий уксусный
Растворимость в воде хорошая
Температура кипения 118 º С
Температура плавления 17ºС
16.
ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТІ. Общие с неорганическими кислотами
1. Растворимые карбоновые кислоты в водных растворах
диссоциируют:
СН3 – СООН
СН3 – СОО + Н+
2. Взаимодействие с металлами , стоящими в
электрохимическом ряду напряжений до водорода:
2СН3 – СООН +Мg
Уксусная кислота
2СН3 - СООН + Zn
Уксусная кислота
(СН3 –СОО)2Мg + Н2
Ацетат магния
(СН3 –СОО)2Zn
Ацетат цинка
+ Н2
При взаимодействии металла с раствором карбоновой кислоты образуется
водород и соль
17. Химические свойства карбоновых кислот
3.Взаимодействие с основными оксидами:2 СН3 – СООН + СuО t
(СН3 – СОО)2Сu
Уксусная кислота
Ацетат меди
+ Н 2О
4. Взаимодействие с гидроксидами металлов (реакция
нейтрализации)
СН3 – СООН + НО –Na
СН3СООNa + Н2О
Уксусная кислота
Ацетат натрия
2СН3 – СООН + Cu(ОН)2
Уксусная кислота
(СН3СОО)2Cu
Ацетат меди
+ Н2О
5.Взаимодействие с солями более слабых и летучих кислот
кислот (н-р, угольной, кремниевой, сероводородной, стеариновой,
пальмитиновой…)
СО2
2СН3СООNa + Н2СО3
2СН3– СООН
+ Na2CO3
Н 2О
Ацетат натрия
Уксусная кислота карбонат натрия
18.
Специфические свойства муравьиной кислотыРеакция «Серебряного зеркала»
Н- С
О
ОН
+ Ag2O
Муравьиная кислота
t
Оксид серебра
2Ag + Н2СО3
серебро
СО2
Н2О
19.
ПРИМЕНЕНИЕМУРАВЬИНОЙ КИСЛОТЫ
Муравьиная кислота обладает ярко выраженными бактерицидными
свойствами. Поэтому ее водные растворы используют как:
- Пищевой консервант;
-Парами дезинфицируют тару для продовольственных товаров
( в том числе винные бочки);
-В пчеловодстве - эффективное средство от варроатоза – болезни
пчел, вызываемой клещами-паразитами ;
-Консервант при заготовке силоса;
- В медицине слабый водно-спиртовой раствор муравьиной
кислоты(муравьиный спирт) используется при ревматических и
неврологических болях для растирания;
-В органическом синтезе в качестве восстановителя ;
-Протрава при крашении тканей;
-В кожевенном производстве – для отмывания извести,
используемой при обработке шкур;
-При изготовлении тяжелых жидкостей – водных растворов,
обладающих большой плотностью, в которых не тонут даже камни.
Такие жидкости нужны геологам для разделения минералов по
плотности. Насыщенный раствор формиата таллия НСООТl в
зависимости от температуры может иметь плотность от 3,40г/см³
(при 20°С) до 4,76 г/см³( при 90°С)
20. Применение муравьиной кислоты
ВОПРОС:ПОЧЕМУ НЕЛЬЗЯ СМАЧИВАТЬ ВОДОЙ МЕСТО МУРАВЬИНОГО УКУСА
ИЛИ ОЖОГА КРАПИВОЙ? ЭТО ПРИВОДИТ ТОЛЬКО К УСИЛЕНИЮ
БОЛЕВЫХ ОЩУЩЕНИЙ.
ПОЧЕМУ БОЛЬ УТИХАЕТ, ЕСЛИ ПОРАНЕННОЕ МЕСТО СМОЧИТЬ
НАШАТЫРНЫМ СПИРТОМ?
ЧТО ЕЩЁ МОЖНО ИСПОЛЬЗОВАТЬ В ДАННОМ СЛУЧАЕ?
При растворении муравьиной кислоты в воде происходит
процесс электролитической диссоциации:
НСООН
НСОО +
Н
В результате кислотность среды повышается, и процесс
разъедания кожи усиливается.
Чтобы боль утихла, нужно нейтрализовать кислоту, для чего
необходимо использовать растворы, обладающие щелочной
реакцией, н-р, раствор нашатырного спирта.
НСООН + NН4ОН
НСООН + NaHCO3
НСООNH4 +
НСООNa
Н2О
или
+ CO2 + H2O
21. Вопрос: Почему нельзя смачивать водой место муравьиного укуса или ожога крапивой? Это приводит только к усилению болевых
Уксусная кислота(этановая кислота)
-Это – первая кислота, полученная и использованная
человеком.
-«Родилась» более 4 тыс.лет назад в Древнем Египте.
-На рубеже ХVII – ХVIII вв.в России ее называли «кислая
влажность».
-Впервые получили при скисании вина.
-Латинское название – Acetum acidum, отсюда название солей –
ацетаты.
-Ледяная уксусная кислота при температуре ниже 16,8 ºС
твердеет и становится похожей на лед
- Уксусная эссенция - 70%-раствор кислоты.
- Столовый уксус - 6 %или 9%-й раствор кислоты.
Уксусная кислота
- содержится в выделениях животных (моче, желчи,
испражнениях), в растениях (в частности ,в зеленых листьях) , в
кислом молоке и сыре;
- образуется при брожении, гниении, скисании вина и пива, при
окислении многих органических веществ;
22.
ПРИМЕНЕНИЕ УКСУСНОЙ КИСЛОТЫ- Водные растворы уксусной кислоты широко используются в пищевой
промышленности (пищевая добавка E- 260) и бытовой кулинарии, а также в
консервировании;
при производстве:
- лекарств, н-р, аспирина;
-искусственных волокон, н-р, ацетатного шелка;
-красителей-индиго, негорючей кинопленки, органического стекла;
-растворителей лаков;
-химических средств защиты растений ,
- стимуляторов роста растений;
-Ацетат натрия СН3СООNа применяется в качестве консерванта крови,
предназначенной для переливания;
-Ацетат калия СН3СООК – как мочегонное средство;
-Ацетат свинца (СН3СОО)2 Pb - для определения сахара в моче;
Ацетаты железа (III) (СН3СОО)3Fe, алюминия (СН3СОО)3Al и хрома (III)
(СН3СОО)3Сr используют в текстильной промышленности для протравного
крашения;
-Ацетат меди (II) (СН3СОО)2Сu входит в состав препарата для борьбы с
вредителями растений, так называемой парижской зелени;
23. Применение уксусной кислоты
Лимонная кислотаCOOH
HOOC – CH2 – C – CH2 – COOH
OH
Муравьиная кислота
Н –– COOH
Щавелевая кислота
HOOC –– COOH
новые
Ацетилсалициловая
кислота
СООН
кислоты
ОСОСН3
Винная кислота
HOOC – СН - СН –– COOH
ОН ОН
Карбо-
в
Молочная кислота
СН3 - СН –– COOH
ОН
порядке
увеличе-
Янтарная кислота
HOOC – СН2 - СН2 –– COOH
Яблочная кислота
HOOC – СН - СН2 –– COOH
ОН
ния их
кислот-
Бензойная
кислота
СООН
Аскорбиновая
кислота
НО ОН
Н
=О
НОН2С-НОНС
Уксусная кислота
H3C –– COOH
О
ности
24.
ЗАДАНИЕ25.
С КАКИМИ ИЗ НИЖЕ ПЕРЕЧИСЛЕННЫХВЕЩЕСТВ БУДЕТ РЕАГИРОВАТЬ УКСУСНАЯ КИСЛОТА? НАПИШИТЕ
УРАВНЕНИЯ ВОЗМОЖНЫХ РЕАКЦИЙ И НАЗОВИТЕ ВЕЩЕСТВА.
AL(OH)3, CU, NACL, MG, BACO3, FEO, CO2, KOH,
СН3ОН, НСОН, NA2SO4, О2





















 Химия
Химия