Похожие презентации:
Химические свойства металлов
1. Химические свойства металлов
2.
В результате изучения темы ,вы будетеспособны:
1. Cистематизировать и углубить
знания о химических свойствах
металлов, подчеркнув их функцию как
восстановителей.
2. Закреплять умения составлять
уравнения реакций
3. Развивать познавательный интерес
при выполнении теоретических заданий
4.Осуществлять рефлексию своей
деятельности
3.
Домашнее задание1.Составить конспект по теме,
выполнить задания
презентации
2.Выполнить пр. занятие 9 –
контрольные вопросы
4.
«Свои способностичеловек может
узнать только
попытавшись
приложить их»
Сенека (младший)
5. Взаимодействие металлов:
I.С простыми веществами;II.Со сложными веществами.
6. Ряд активности металлов
Увеличениевосстановительных свойств
7. I. Взаимодействие металлов с простыми веществами – неметаллами
1. с кислородом;2. с галогенами;
3. с водородом.
8. I. Взаимодействие металлов с простыми веществами – неметаллами
1.с кислородома)щелочные металлы (кроме
лития) образуют пероксиды:
1
2
1
2
2 K O2 K O
0
0
2е
В-ль
ок-ль
9. I. Взаимодействие металлов с простыми веществами – неметаллами
1.с кислородомб) металлы средней активности
и литий образуют оксиды:
Составьте уравнение реакции
взаимодействия
0 лития с кислородом
0
1 2
и рассмотрите2его как ОВР.2
4Li O 2Li O
4е
В-ль
ок-ль
10. Взаимодействие железа с кислородом – горение железа
11. I. Взаимодействие металлов с простыми веществами – неметаллами
1.с кислородом:в) железо с кислородом при
нагревании образует
смешанный оксид
(железную окалину):
2
2
3
2
3Fe 2O
Fe O Fe O
0
8е
В-ль
0
2
ок-ль
t
Смешанный
оксид железа II - III
2
3
12. I. Взаимодействие металлов с простыми веществами – неметаллами
1.с кислородомг) металлы неактивные –
Ag, Au, Pt с кислородом не
взаимодействуют,
т.е. не окисляются
Аg O2
0
0
13. I. Взаимодействие металлов с простыми веществами – неметаллами
2. с галогенами14. Взаимодействие железа с хлором – горение железа в хлоре.
Составьте уравнениехимической реакции.
Рассмотрите его как ОВР.
15. I. Взаимодействие металлов с простыми веществами – неметаллами
2. с галогенами:3
2Fe 3Cl2 2Fe Cl3
0
0
6е
В-ль
ок-ль
1
16. Взаимодействие меди с хлором – горение меди в хлоре.
* Составьте уравнение химическойреакции. Рассмотрите его как ОВР.
17. I. Взаимодействие металлов с простыми веществами – неметаллами
3. с водородом1
2 Na H 2 2 Na H
0
0
2е
В-ль
ок-ль
1
Гидрид натрия
* Составить уравнение реакции
для алюминия с водородом.
18.
19. II. Взаимодействие металлов со сложными веществами
1. с водой2. с растворами кислот
3. с оксидами
металлов
4. с растворами солей
20. II. Взаимодействие металлов со сложными веществами
1. с водойВспомните, при каких
условиях металлы
взаимодействуют с
водой?
21. II. Взаимодействие металлов со сложными веществами
1. с водойLi K Ca Na
При обычных
условиях
Mе + H2O →
МеOH +H2
Mg Al Zn Cr Fe Ni Pb
(H2)
Cu Hg Ag Pt
Au
При нагревании
Me + H2O ≠
Me+H2O→H2+оксид
22. Взаимодействие натрия с водой
23. II. Взаимодействие металлов со сложными веществами
1. с водойа) щелочные и
щелочноземельные металлы
в реакции с водой образуют
щелочь:
1
2
1
2 Na 2H O 2 Na OH H
0
2е
В-ль
ок-ль
0
2
24. II. Взаимодействие металлов со сложными веществами
1. с водойб) металлы средней активности
в реакции с водой образуют
оксид:
Составьте уравнение
реакции
и0
0
1между цинком
2
Zn
H 2 O Zn O H 2
водой:
2е
В-ль
ок-ль
25. II. Взаимодействие металлов со сложными веществами
1. с водойа) металлы неактивные в
реакцию с водой не
вступают:
Au H 2O
При составлении уравнения
реакций металла с водой смотри
электрохимический ряд
напряжения металлов.
26. II. Взаимодействие металлов со сложными веществами
2. с растворами кислотВспомните, при каких
• если металл активней водорода;
условиях металлы
• если металл не щелочной;
взаимодействуют
• если образуется растворимая с
соль;
растворами
кислот, если при
• если
в реакцию вступает
этом
окислителем
является
растворимая кислота;
водород?
• если кислота
не азотная и не
концентрированная серная.
27.
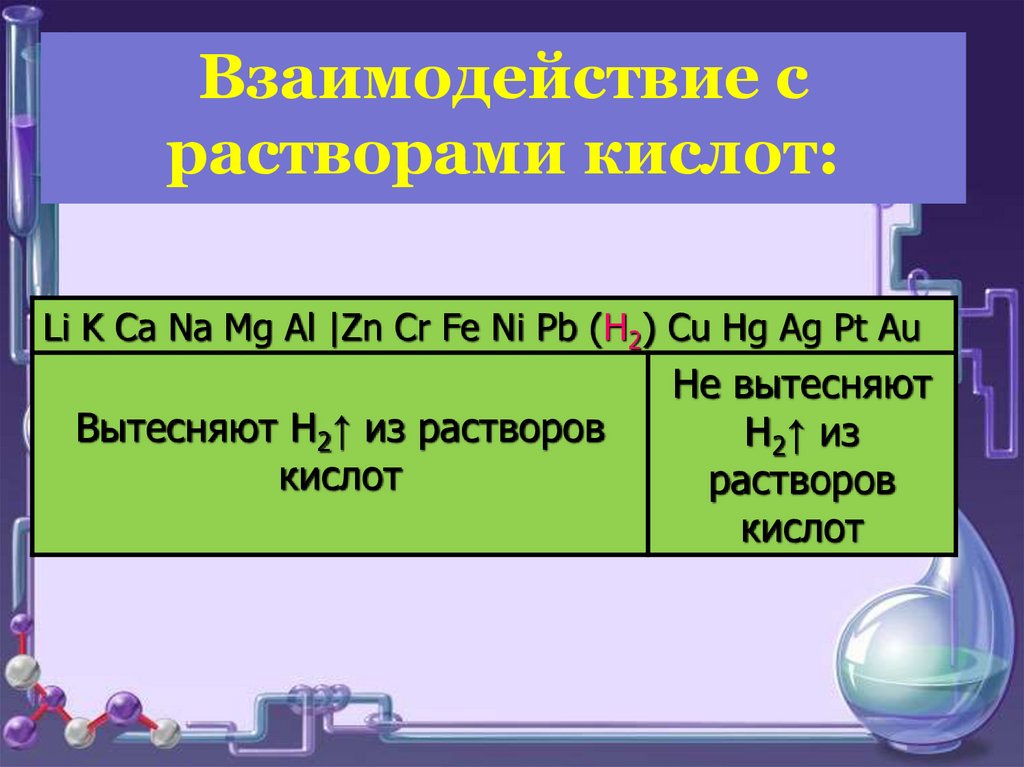
Взаимодействие срастворами кислот:
Li K Ca Na Mg Al |Zn Cr Fe Ni Pb (H2) Cu Hg Ag Pt Au
Вытесняют H2↑ из растворов
кислот
Не вытесняют
H2↑ из
растворов
кислот
28. Взаимодействие цинка с раствором соляной кислоты
29. II. Взаимодействие металлов со сложными веществами
2. с растворами кислота) не щелочные металлы и металлы
средней активности реагируют с
растворами кислот:
1
Составьте
0
1 уравнение
1
2 реакции
0
Zn
2
H
Cl
Zn
Cl
H
2
между цинком и соляной 2
2е
кислотой.
в-ль
ок-ль
30. Взаимодействие металлов с растворами кислот
31. II. Взаимодействие металлов со сложными веществами
2. с растворами кислота) не активные металлы не реагируют с
растворами кислот:
Аu H 2SO4
0
* Составьте уравнение реакции
между кальцием и серной кислотой.
При составлении уравнения химической
реакции между металлом и раствором
кислоты смотри электрохимический ряд
напряжения металлов и таблицу
растворимости.
32. II. Взаимодействие металлов со сложными веществами
3.с оксидами металловНо эта реакция
характерна не для всех
металлов.
33. II. Взаимодействие металлов со сложными веществами
3. Магний, кальций и алюминиймогут взаимодействовать с
оксидами металлов:
3
2
3
2
2
3
2 Al Fe2 O3 Al O 2Fe
0
0
6е
* Составьте уравнение реакции между
кальцием и оксидом меди (II).
34. II. Взаимодействие металлов со сложными веществами
4. с растворами солей• если
металл
активней
Вспомните, при
металла соли;
каких
условиях
• если металл не
металлы
щелочной;
взаимодействуют
• если
в реакцию
вступают
и
с растворами
образуются
солей?
растворимые соли;
35. II. Взаимодействие металлов со сложными веществами
4. с растворами солей3
2
3
2 Al Fe (SO4 )3 Al 2 (SO4 )3 2Fe
0
6е
В-ль
0
ок-ль
* Составьте уравнение реакции
для меди и нитрата серебра.
При составлении уравнения химической
реакции между металлом и солью смотри
электрохимический ряд напряжения
металлов
и таблицу растворимости.
36. Самостоятельная работа
Для металлов Na, Zn, Hg –составить возможные уравнения
с веществами из списка:
O2 ; F2 ; S ;
H 2O; HCl ;
FeSO4 ; AgNO3
37.
Катон СтаршийЖизнь человеческая подобна
железу.
Если употреблять его в дело,
оно истирается;
если же не употреблять,
ржавчина его съедает.
Так,
Пусть ваш мозг истирается от
работы мысли, а не
пожирается ржавчиной от
лени.




































 Химия
Химия








