Похожие презентации:
Периодический закон Д.И. Менделеева
1.
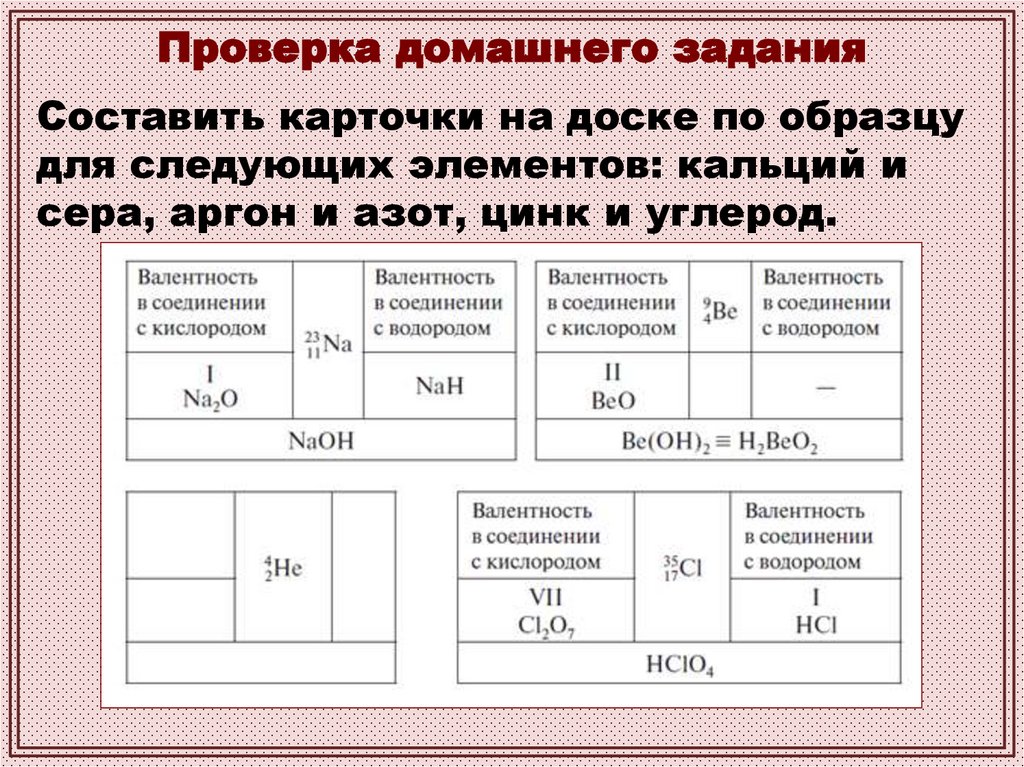
Проверка домашнего заданияСоставить карточки на доске по образцу
для следующих элементов: кальций и
сера, аргон и азот, цинк и углерод.
2.
Проверка домашнегозадания
1. Дайте характеристику 1
варианта классификации
химических элементов
2. Дайте характеристику 2
варианта классификации
химических элементов
3.
1.Какой элемент относится к щелочным металлам:а) Na
б) Аl
в) Са
г) Cs
2Какой элемет относится к галогенам:
а) Cl
б) Mn
в) Re
г) Ва
3. К инертным элементам принадлежат:
а) Сl
б) Не
в) К
г) Аг
4. К неметаллам принадлежат:
а) Р
б) Аl
в) Fе
г) О
5.Щелочные металлы – это металлы:
а) тяжелые
б) тугоплавкие
в) мягкие
г)неактивные
6. Установите соответствие между элементом и его
естественным семейством:
а) Натрий
1. Галогены
б) Аргон
2. Щелочноземельные металлы
в) Хлор
3. Щелочные металлы
г) Барий
4. Инертные газы
4.
Периодическийзакон
Д. И. Менделеева
«Периодическому закону будущее не грозит
разрушением, а только надстройка и
развитие обещаются»
5.
Предшественники Д.И.МенделееваИ. В. Деберейнер
Л. Ю. Мейер
Дж. А. Ньюлендс
6.
Дмитрий Иванович Менделеев(08.02.1834 – 02.02.1907)
7.
1 марта 1869 г. Формулировка периодического закона Д.И. Менделеева.Свойства простых веществ, а также формы и свойства
соединений элементов находятся в периодической
зависимости от величины атомных весов элементов.
8.
1870 г. Дмитрий Иванович предсказал существование трехэлементов: эка-силиция, эка-алюминия и эка-бора.
В 1886 г. К. Винклер в Германии
открыл германий
В 1875 г.
В четырёх местах
периодической системы
Д. И. Менделеев
расположил элементы не
в порядке возрастания
атомных масс:
Ar – K, Со – Ni, Te – I,
Th - Pa
В 1879 г.
9.
Современная формулировкапериодического закона:
свойства химических элементов и
их соединений находятся в
периодической зависимости от
величины заряда ядер их атомов,
выражающейся в периодической
повторяемости структуры внешней
валентной электронной оболочки.
10.
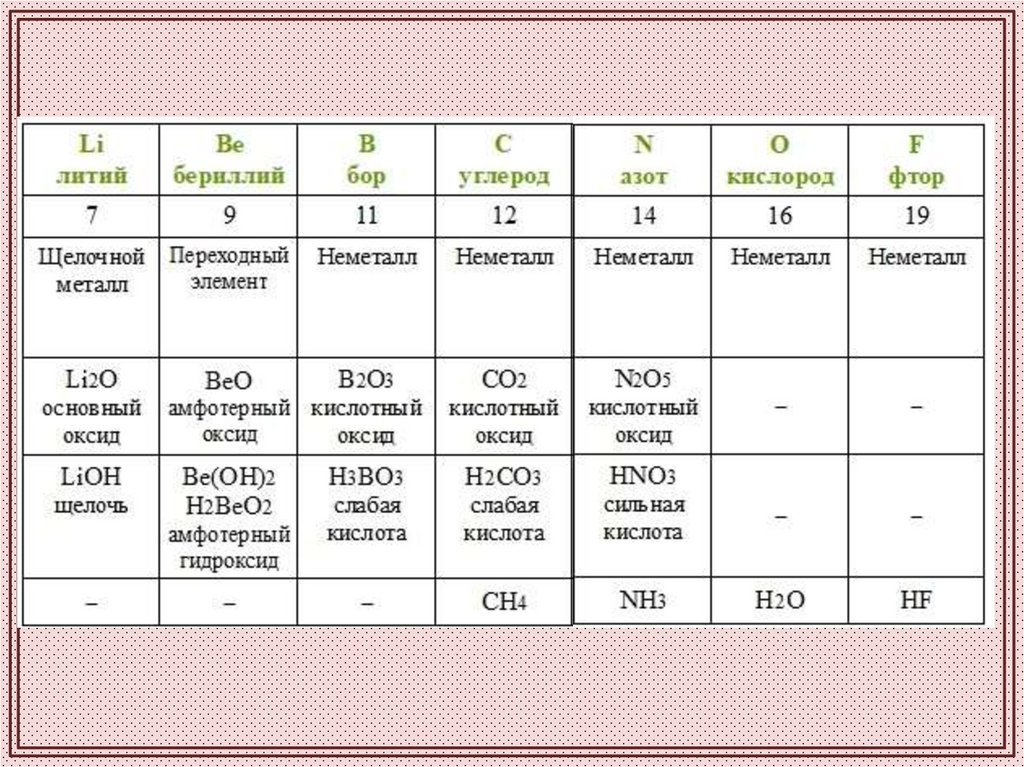
Изменения свойств в периодической системес ростом величины атомных весов в периоде
(слева направо):
1.Металлические свойства уменьшаются
2.Неметаллические свойства возрастают
3.Свойства высших оксидов и гидроксидов
изменяются от основных через амфотерные
к кислотным.
4.Валентность элементов в формулах
высших оксидов возрастает от I до VII, а в
формулах летучих водородных соединений
уменьшается от IV до I.
11.
12.
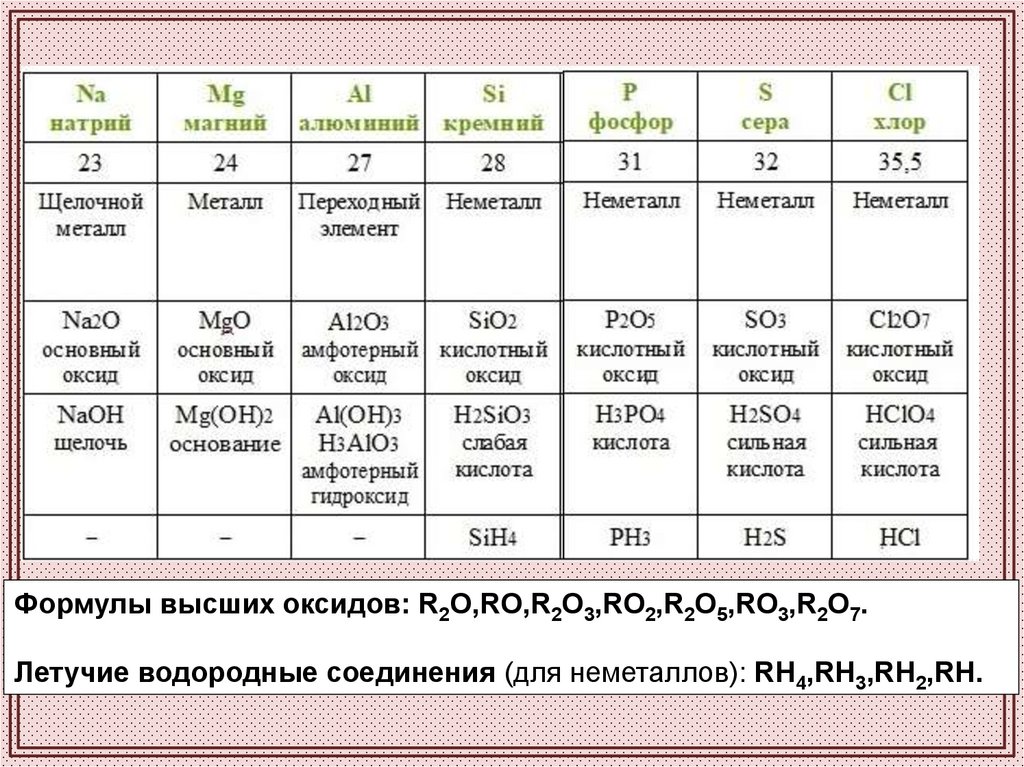
Формулы высших оксидов: R2O,RO,R2O3,RO2,R2O5,RO3,R2O7.Летучие водородные соединения (для неметаллов): RH4,RH3,RH2,RH.
13.
1. В ряду Si → P → S → Cl неметаллические свойства1) усиливаются 3) не изменяются
2) ослабевают 4) изменяются периодически
2. В ряду Mg → Ca → Sr → Ba металлические свойства
1) усиливаются 3) не изменяются
2) ослабевают 4) изменяются периодически
3. В ряду оксидов MgО → CaО → SrО → BaО основные
свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала усиливаются, затем ослабевают
4. В ряду H2SiO3 → H3PO4 → H2SO4 → HClO4 кислотные
свойства?
5. Формула летучего водородного соединения химического
элемента H3R. Группа химических элементов периодической
системы Д. И. Менделеева, к которой принадлежит этот элемент:
1) III 2) V 3) VII 4) IV
14.
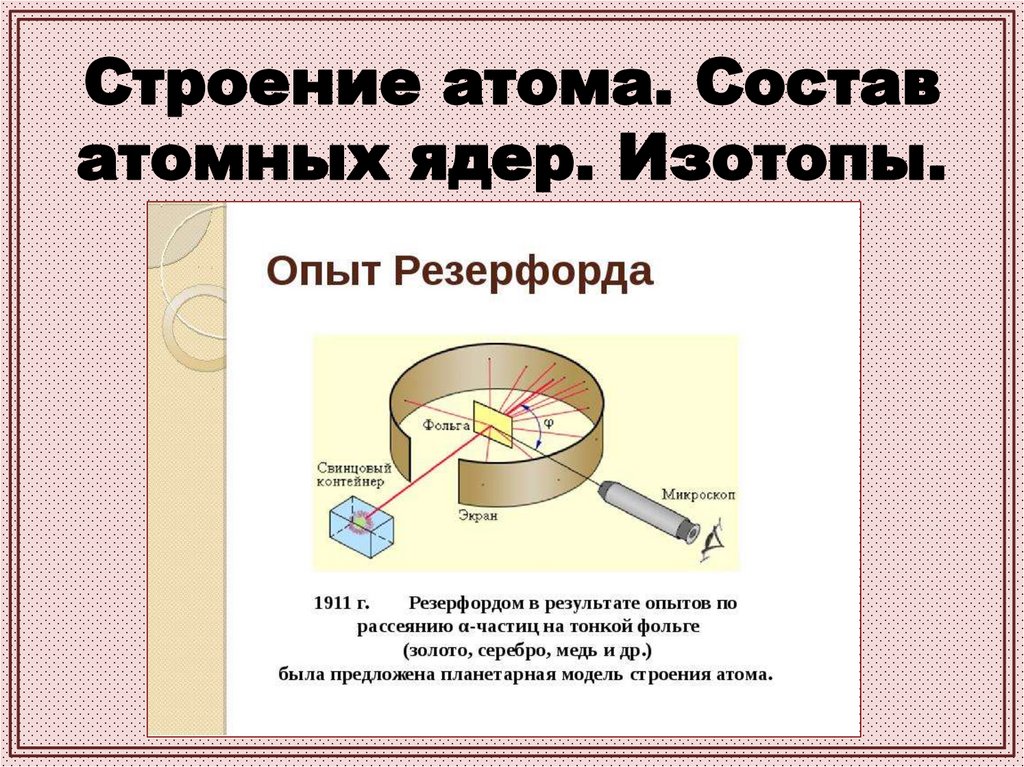
Строение атома. Составатомных ядер. Изотопы.
15.
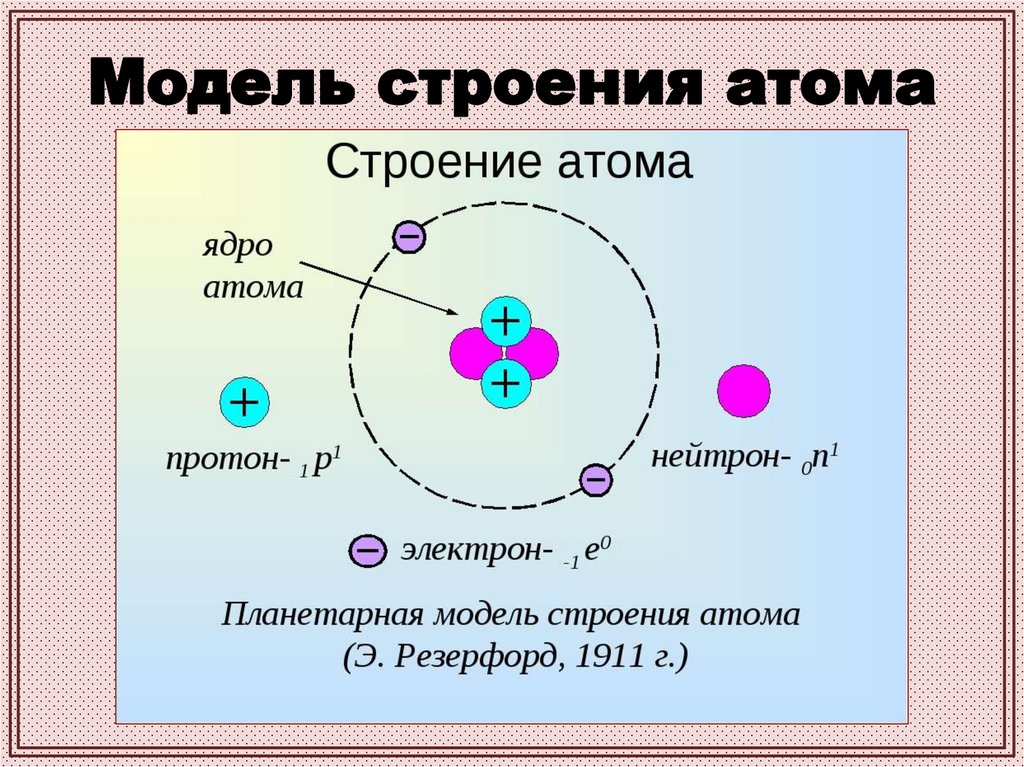
Модель строения атома16.
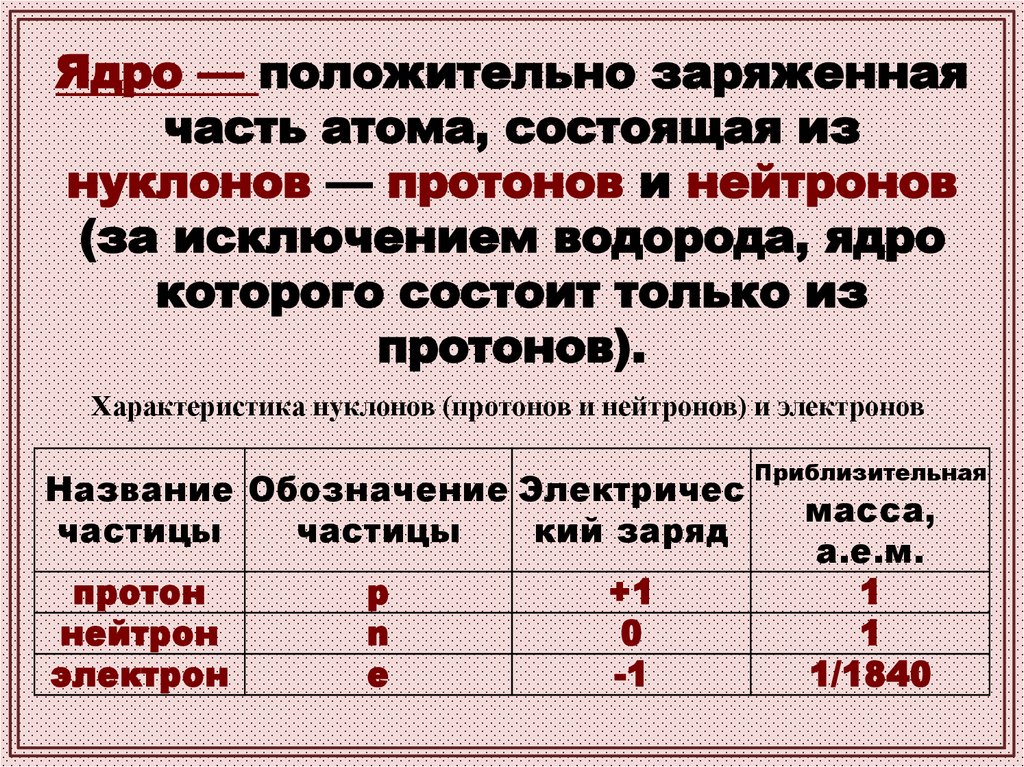
Ядро — положительно заряженнаячасть атома, состоящая из
нуклонов — протонов и нейтронов
(за исключением водорода, ядро
которого состоит только из
протонов).
Характеристика нуклонов (протонов и нейтронов) и электронов
Название Обозначение Электричес
частицы
частицы
кий заряд
протон
нейтрон
электрон
p
n
e
+1
0
-1
Приблизительная
масса,
а.е.м.
1
1
1/1840
17.
Заряд ядра равен порядковомуномеру химического элемента
Заряд ядра атома = Порядковому номеру (N) =
Числу протонов = Число электронов
Число нейтронов = Атомная масса (Ar) –
Порядковый номер (N)
Задача №1. Определите состав атома бора?
Бор
N (порядковый номер) –
Ar(B) =
e-= Порядковому номеру (N) =
p+= Порядковому номеру (N) =
n0= Атомная масса (Ar) – Порядковый номер (N) =
18.
Задача №2. Определите состав атома хлораПочему в атоме хлора дробное число
нейтронов?
Изотопы одного и того же химического элемента
имеют разную массу, так как в их атомных ядрах
содержится разное количество нейтронов.
19.
Химический элемент – это видатомов с одинаковым зарядом
ядра
В природе химические элементы существуют в
виде смесей изотопов. Изотопный состав
одного и того же химического элемента
выражают в атомных долях (ω ат.), которые
указывают какую часть составляет число
атомов данного изотопа от общего числа
атомов всех изотопов данного элемента,
принятого за единицу или 100%.
Например:
ωат (35Сl) = 0,754 или 75,4%
ωат (37Сl) = 0,246 или 24,6%
20.
Почему в таблице Д. И. Менделеева дляхимических элементов относительные
атомные массы представлены в виде дробных
чисел?
Ar средняя= ωат.(1) ∙ Ar(1) + … + ωат.(n) ∙ Ar(n)
Задача: Вычислите относительную атомную массу
химического элемента хлора, если известно, что он
состоит из двух изотопов: 35Cl (атомная доля 75,4%) и 37Cl
(24.6%).
Дано:
ωат.(35Cl) = 75,4%
ωат.(37Cl) = 24,6%
--------------------------Найти: Arсредняя (Cl) = ?
Решение:
Arсредняя (Cl) = 0,754 ∙ 35 + 0,246 ∙ 37 = 35,453
21.
Задания для закрепления№1. Определите атомный состав изотопов
хлора 35Cl и 37Сl. Почему изотопы хлора имеют
разное массовое число?
№2. Определите относительную атомную
массу элемента кремния, если известно, что
он состоит из трёх изотопов: 28Si (атомная доля
92,3%), 29Si (4,7%), 30Si (3%).















 Химия
Химия








