Похожие презентации:
Щелочные металлы
1. Щелочные металлы
2. Щелочные металлы
Литий(Li)Натрий(Na)
Рубидий(Rb)
Калий(K)
Цезий(Cs)
Франций(Fr)
3.
Щелочны́е мета́ллы — это элементыглавной подгруппы первой группы
Периодической системы Д.И.Менделеева.
4.
При взаимодействии щелочных металлов сводой образуется едкая щёлочь, отсюда и
название.
5.
На внешнем энергетическом уровне атомыэтих элементов содержат по одному
электрону.
Они легко отдают этот электрон, поэтому
являются сильными восстановителями.
Во всех своих соединениях щелочные
металлы проявляют степень окисления +1
Восстановительные свойства усиливаются
при переходе от Li к Cs (это связано с
увеличением радиуса их атома).
6.
7. Химические свойства
Активно взаимодействуют почти со всеминеметаллами:
2M+H2=2MH (гидрид),
2M+Cl2=2MCl (хлорид),
2M+S=M2S (сульфид).
8.
При взаимодействии с кислородом натрийобразует пероксид:
2Na+O2=Na2O2.
9.
Только литий образует оксид привзаимодействии с кислородом:
4Li+O2=2Li2O.
10.
Все щелочные металлы активновзаимодействуют с водой, образуя щелочи
и восстанавливая воду до водорода(Н):
2M+2HOH=2MOH+H2
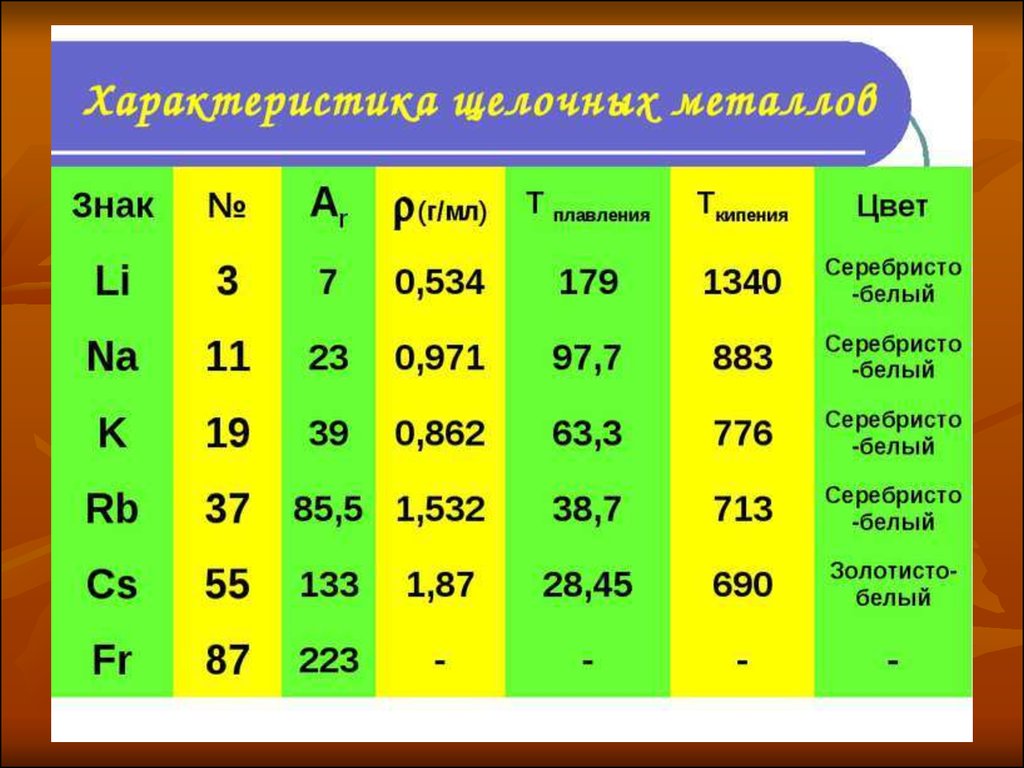
11. Физические свойства
12. Литий
Был открыт в 1817шведским химиком А.
Арфведсоном;
От греч. lithos —
камень.
13. Натрий
Название «натрий»,происходящее от араб.
натрун, греч. nitron,
первоначально относилось к
природной соде.
14. Рубидий
Открыли в 1861 Р.Бунзен и Г. Кирхгоф.
Название дано по цвету
наиболее характерных
красных линий спектра
(от лат. rubidus —
красный, тёмнокрасный).
15. Калий
Некоторые соединения Калия были известныуже в древности; однако их не отличали от
соединений натрия.
Только в 18 в. было показано различие между
«растительной щёлочью» и «минеральной
щёлочью». В 1807 Г. Дэви выделил калий и
натрий.
В 1809 Л. В. Гильберт предложил название
«калий» (от араб. аль-кали — поташ) и
«натроний» (от араб. натрун — природная
сода); последнее И. Я. Берцелиус в 1811
изменил на «натрий».
16. Цезий
Цезий открыт в 1860 Р.В. Бунзеном и Г. Р.
Кирхгофом.
Назван Цезий (от лат.
caesius — небесноголубой) по двум ярким
линиям в синей части
спектра.
17. Франций
Существование и главные свойствасамого тяжёлого аналога щелочных
металлов были предсказаны Д. И.
Менделеевым в 1870, однако долгое
время попытки обнаружить этот
элемент в природе оканчивались
неудачами.
Только в 1939 французской
исследовательнице М. Перей
удалось доказать, что ядра 227 Ac в
12 случаях из 1000 испускают
a(альфа) -частицы и при этом
переходят в ядра элемента № 87 с
массовым числом 223, который и
выделила Перей. Новый элемент
исследовательница назвала в честь
своей родины.
Уран(235),
из которого получают франций.
18. Оксиды
Оксиды M2O- твердые вещества,взаимодействующие с водой, кислотами и
кислотными оксидами:
2Na+Na2O2=2Na2O
19. Гидроксиды
Гидроксиды (МОН- твердые белые вещества)взаимодействуют с:
Кислотами
Кислотными оксидами
Солями (если образуется нерастворимое основание).
Амфотерными оксидами
Гидроксидами
20. Образование гидроксидов
Оксид+Вода=ГидроксидK2O + H2O= 2KOH
21. Реакции с кислотами
2KOH + H2SO4 = K2SO4 + 2H2Oсоль +вода
22. Реакции с солями
2NaOH + CuSO4Cu(OH)2 + Na2SO4
нерастворимое основание + соль
23. Реакции с кислотными оксидами
2KOH + SiO2 = K2SiO3 + H2Oсоль + вода























 Химия
Химия








