Похожие презентации:
Периодический закон и Периодическая система химических элементов. ( 9 класс)
1. Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева
9 классТема «Периодический закон и
Периодическая система химических
элементов»
1
2. План
1. Положение элемента в ПСХЭ и строение его атома2. Характер простого вещества (металл, неметалл)
3. Сравнение свойств простого вещества со свойствами
простых веществ, образованных соседними по группе
элементами.
4.Сравнение свойств простого вещества со свойствами
простых веществ, образованных соседними по периоду
элементами.
5. Состав высшего оксида, его характер (основный,
кислотный , амфотерный)
6. Состав высшего гидроксида, его характер (основный,
кислотный , амфотерный)
7. Состав летучего водородного соединения ( для
неметаллов)
2
3. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
В периодах
Заряд ядра Z
Число заполненных
энергетических уровней
Число электронов на внешнем
уровне (Ne)
Радиус атома Ra
Восстановительные свойства
Высшая степень окисления
Низшая степень окисления
3
4. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Заряд ядра Z
Изменения свойств
В главных
подгруппах
В периодах
Увеличивается
Число заполненных
энергетических уровней
Число электронов на внешнем
уровне (Ne)
Радиус атома
Восстановительные свойства
Высшая степень окисления
Низшая степень окисления
4
5. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
Заряд ядра Z
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
В периодах
Число электронов на внешнем
уровне (Ne)
Радиус атома
Восстановительные свойства
Высшая степень окисления
Низшая степень окисления
5
6. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
Заряд ядра Z
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
В периодах
Радиус атома
Восстановительные свойства
Высшая степень окисления
Низшая степень окисления
6
7. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
Заряд ядра Z
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Радиус атома
Увеличивается
В периодах
Восстановительные свойства
Высшая степень окисления
Низшая степень окисления
7
8. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
Заряд ядра Z
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Радиус атома
Увеличивается
Восстановительные свойства
Усиливаются
В периодах
Высшая степень окисления
Низшая степень окисления
8
9. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
Заряд ядра Z
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Радиус атома
Увеличивается
Восстановительные свойства
Усиливаются
Высшая степень окисления
Постоянная и
равна № группы
В периодах
Низшая степень окисления
9
10. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
Заряд ядра Z
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Радиус атома
Увеличивается
Восстановительные свойства
Усиливаются
Высшая степень окисления
Постоянная и
равна № группы
Низшая степень окисления
Не изменяется и
равна (8-№
группы)
В периодах
10
11. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
В периодах
Заряд ядра Z
Увеличивается
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Радиус атома
Увеличивается
Восстановительные свойства
Усиливаются
Высшая степень окисления
Постоянная и
равна № группы
Низшая степень окисления
Не изменяется и
равна (8-№
группы)
11
12. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
В периодах
Заряд ядра Z
Увеличивается
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Не изменяется и
равно № группы
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Радиус атома
Увеличивается
Восстановительные свойства
Усиливаются
Высшая степень окисления
Постоянная и
равна № группы
Низшая степень окисления
Не изменяется и
равна (8-№
группы)
12
13. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
В периодах
Заряд ядра Z
Увеличивается
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Не изменяется и
равно № группы
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Увеличивается
Радиус атома
Увеличивается
Восстановительные свойства
Усиливаются
Высшая степень окисления
Постоянная и
равна № группы
Низшая степень окисления
Не изменяется и
равна (8-№
группы)
13
14. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
В периодах
Заряд ядра Z
Увеличивается
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Не изменяется и
равно № группы
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Увеличивается
Радиус атома
Увеличивается
Уменьшается
Восстановительные свойства
Усиливаются
Высшая степень окисления
Постоянная и
равна № группы
Низшая степень окисления
Не изменяется и
равна (8-№
группы)
14
15. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
В периодах
Заряд ядра Z
Увеличивается
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Не изменяется и
равно № группы
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Увеличивается
Радиус атома
Увеличивается
Уменьшается
Восстановительные свойства
Усиливаются
Ослабевают
Высшая степень окисления
Постоянная и
равна № группы
Низшая степень окисления
Не изменяется и
равна (8-№
группы)
15
16. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
В периодах
Заряд ядра Z
Увеличивается
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Не изменяется и
равно № группы
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Увеличивается
Радиус атома
Увеличивается
Уменьшается
Восстановительные свойства
Усиливаются
Ослабевают
Высшая степень окисления
Постоянная и
равна № группы
Увеличивается от
Низшая степень окисления
Не изменяется и
равна (8-№
группы)
+1 до +7 (+8)
16
17. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и их
свойства
А
Т
О
М
Ы
Изменения свойств
В главных
подгруппах
В периодах
Заряд ядра Z
Увеличивается
Увеличивается
Число заполненных
энергетических уровней
Увеличивается
Не изменяется и
равно № группы
Число электронов на внешнем
уровне (Ne)
Не изменяется и
равно № группы
Увеличивается
Радиус атома
Увеличивается
Уменьшается
Восстановительные свойства
Усиливаются
Ослабевают
Высшая степень окисления
Постоянная и
равна № группы
Увеличивается от
Не изменяется и
равна (8-№
группы)
Увеличивается
от -4 до -1
Низшая степень окисления
+1 до +7 (+8)
17
18. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и
их свойства
Простые
вещества
Изменения свойств
В главных В периодах
подгруппах
Металлические
свойства
Неметаллические
свойства
Соединения
элементов
Характер
химических
свойств высшего
оксида и высшего
гидроксида
18
19. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и
их свойства
Простые
вещества
Металлические
свойства
Изменения свойств
В главных В периодах
подгруппах
Усиливаются
Неметаллические
свойства
Соединения
элементов
Характер
химических
свойств высшего
оксида и высшего
гидроксида
19
20. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и
их свойства
Простые
вещества
Соединения
элементов
Изменения свойств
В главных В периодах
подгруппах
Металлические
свойства
Усиливаются
Неметаллические
свойства
ослабевают
Характер
химических
свойств высшего
оксида и высшего
гидроксида
20
21. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и
их свойства
Простые
вещества
Соединения
элементов
Изменения свойств
В главных В периодах
подгруппах
Металлические
свойства
Усиливаются
Неметаллические
свойства
ослабевают
Характер
химических
свойств высшего
оксида и высшего
гидроксида
Усиление
основных
свойств и
усиление
кислотных
свойств
21
22. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и
их свойства
Простые
вещества
Соединения
элементов
Изменения свойств
В главных В периодах
подгруппах
Металлические
свойства
Усиливаются
Неметаллические
свойства
ослабевают
Характер
химических
свойств высшего
оксида и высшего
гидроксида
Усиление
основных
свойств и
усиление
кислотных
свойств
Ослабевают
22
23. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и
их свойства
Простые
вещества
Соединения
элементов
Изменения свойств
В главных В периодах
подгруппах
Металлические
свойства
Усиливаются
Ослабевают
Неметаллические
свойства
ослабевают
Усиливаются
Характер
химических
свойств высшего
оксида и высшего
гидроксида
Усиление
основных
свойств и
усиление
кислотных
свойств
23
24. Закономерности изменения свойств атомов , простых веществ и соединений
Формы существованияхимического элемента и
их свойства
Простые
вещества
Соединения
элементов
Изменения свойств
В главных В периодах
подгруппах
Металлические
свойства
Усиливаются
Ослабевают
Неметаллические
свойства
ослабевают
Усиливаются
Характер
химических
свойств высшего
оксида и высшего
гидроксида
Усиление
основных
свойств и
усиление
кислотных
свойств
Осн.→амф.→кисл.
Усиление
кислотных свойств
и ослабление
основных
24
25.
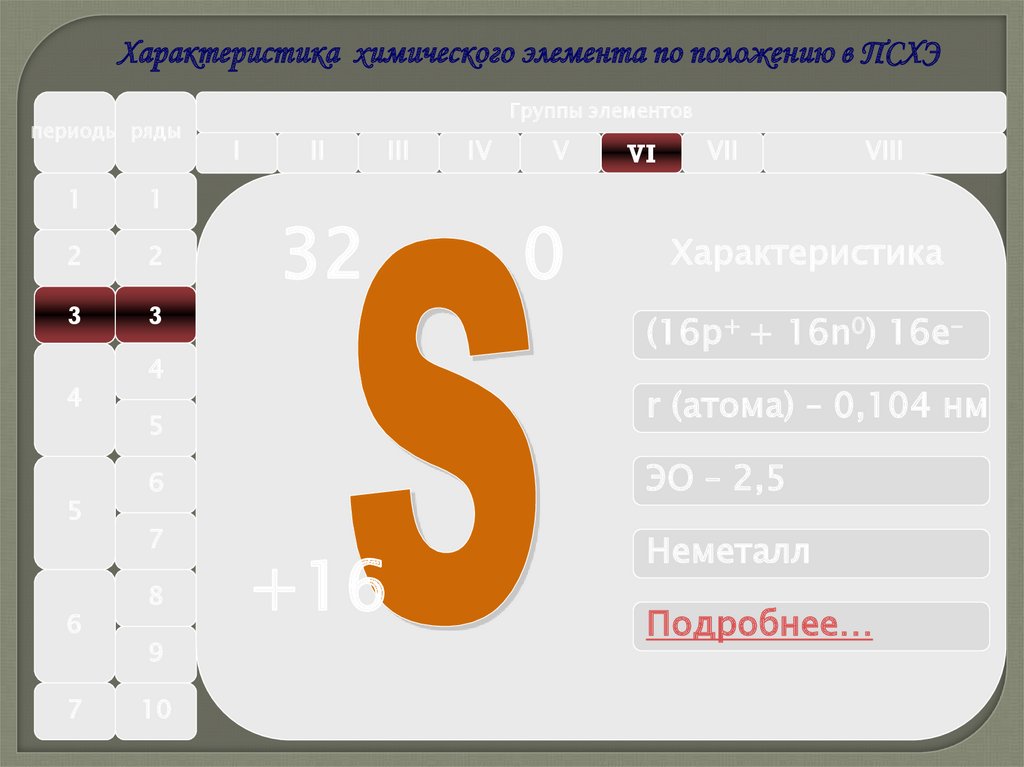
Характеристика химического элемента по положению в ПСХЭпериоды ряды
1
1
2
2
3
3
4
5
6
7
Группы элементов
I
II
III
32
IV
V
0
VI
VII
Характеристика
(16р+ + 16n0) 16e-
4
r (атома) – 0,104 нм
5
6
ЭО – 2,5
7
Неметалл
8
9
10
VIII
+16
Подробнее…
Pd
26. Характеристика неметалла на примере серы
1.Положение элемента в ПСХЭ и
строение его атома
Период
Группа
подгруппа
Строение атома
26
27. Характеристика неметалла на примере серы
1.Положение элемента в ПСХЭ и
строение его атома
Период 3
Группа VI подгруппа A
Строение атома 2e, 8e, 6e
27
28.
1. Электронное строениеглавная
0
32
Порядок заполнения
Валентные возможности
+16
286
3S2
2S2
3p4
3d2
2p6
Проявляет степени окисления: -2,+2,+4,+6
1S2
Краткая электронная запись:
29.
АллотропияСуществует несколько аллотропных
модификаций серы
ромбическая
моноклинная
пластическая
Причина аллотропии в разном строении кристаллов
30.
Физические свойстваСера – твердое
кристаллическое
вещество желтого цвета.
Не растворима в воде.
Мелкие кристаллы серы не
смачиваются водой, плавают
на поверхности (флотация).
Сера хорошо растворима в
сероуглероде.
31. 3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по группе элементами.
+826
+16
28 6
+34
2 8 18 6
Н
Е
М
Е
Т
А
Л
Л
И
Ч
Н
О
С
Т
Ь
31
32. 3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
30+15
32
285
+16
0
28 6
35,5
+17
287
Неметаллические свойства
32
33. 5. Состав высшего оксида, его характер (основный, кислотный , амфотерный)
P2O5SO3
Cl2O7
Кислотность
7. Состав высшего гидроксида, его характер
(основный, кислотный , амфотерный)
H3PO4
H2SO4 HClO4
33
34. Закономерности по группе
КислотностьSO3
SeO3
H2SO4
H2SeO4
34
35. Водородное соединение
H2Sсероводород
35
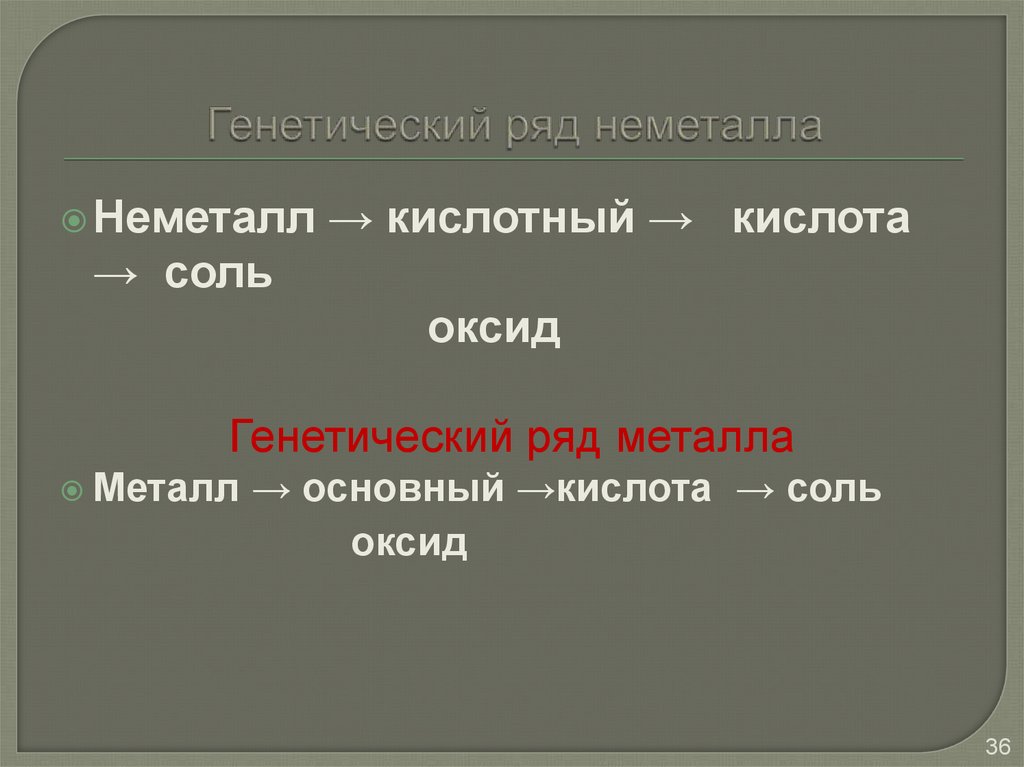
36. Генетический ряд неметалла
Неметалл→ кислотный → кислота
→ соль
оксид
Генетический ряд металла
Металл
→ основный →кислота → соль
оксид
36
37. Генетический ряд неметалла
Неметалл → кислотный → кислота→ соль
оксид
S → SO3 → H2SO4 → Na2SO4
Генетический ряд металла
Металл → основный →основание → соль
оксид
Mg → MgO → Mg(OH)2 → MgSO4
37



































 Химия
Химия Образование
Образование








