Похожие презентации:
Предмет, задачи, понятия, законы химии
1.
Презирать науку значит нетрудиться над возделыванием
винограда, а желать наслаждаться
плодами его.
Клемент
Александрийский
2.
Кунгурский автотранспортный колледжОформление титульного листа тетради
Тетрадь по химии студента группы
………………………………….
Преподаватель: Афонькина Елена
Анатольевна
2020-2021 учебный год
3.
Предмет, задачи, основныепонятия химии
4.
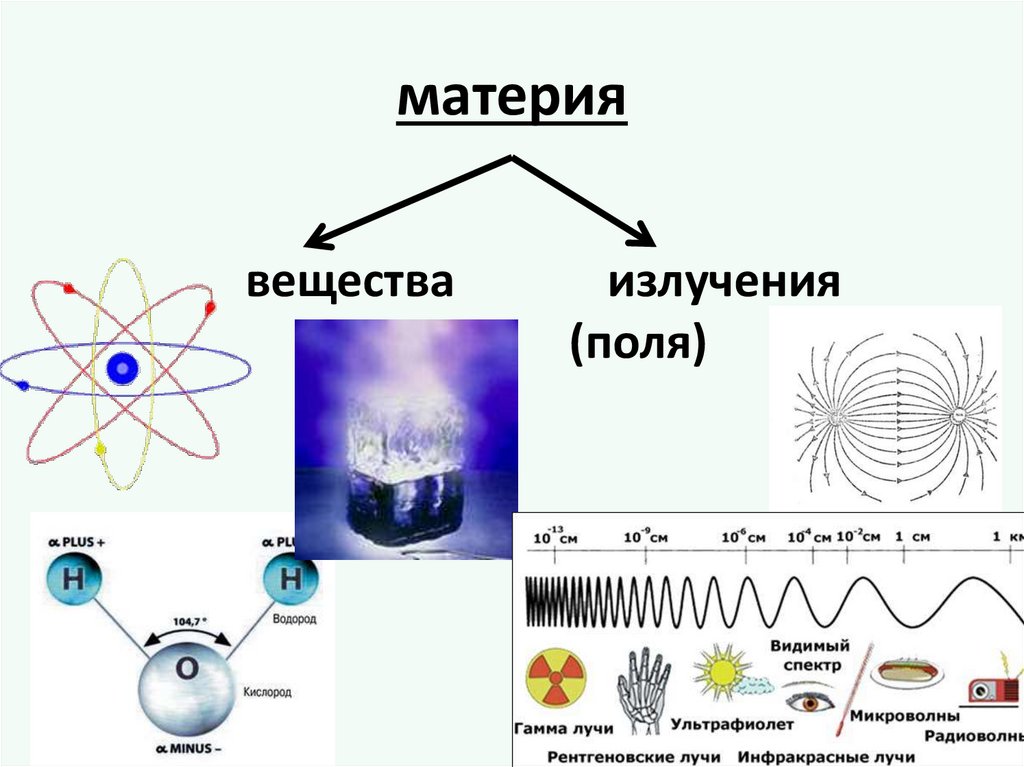
материявещества
излучения
(поля)
5.
Вещество материя, которая имеет массу покояи характеризуется при определенных
условиях постоянными физическими
и химическими свойствами
6.
• основное свойство материи изменяемость• Химия –
• наука о веществах, их строении,
свойствах, превращениях, получении
веществ искусственным путем.
7.
Задачи:1) Получение
веществ с
заданными
свойствами;
Синтетические полимеры
8.
Задачи:2) Интенсификация
промышленного
производства;
P, t, kat
N2+3H2 = 2NH3
Получение аммиака в
промышленных условиях
9.
Задачи:3) Использование безотходных
технологий и экологически чистого
производства
10.
11.
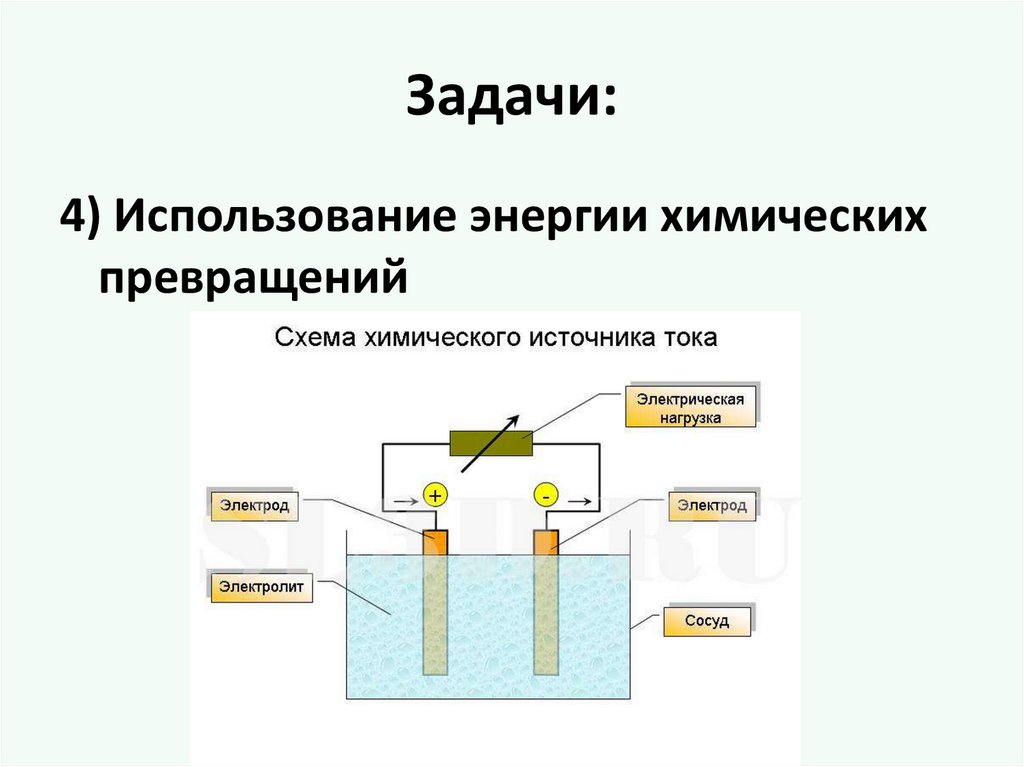
Задачи:4) Использование энергии химических
превращений
12.
Области химии:Неорганическая ( металлы, неметаллы)
13.
Области химии:• Физическая (основные законы и теории)
14.
Области химии:• Радиохимия (строение атома,
ядерные реакции)
15.
Области химии:• Аналитическая (количественный и
качественный анализ веществ)
16.
Области химии:• Органическая (соединения углерода)
17.
Области химии:• Биохимия (вещества живой природы)
18.
Связь с другими предметами:19.
Атомно-молекулярноАТОМНО-МОЛЕКУЛЯРНОЕ
УЧЕНИЕ
20.
Предпосылки:• V-IV века до
н.э., учение
Демокрита о
дискретности
(делимости)
вещества
21.
Предпосылки:• XVII в., Р. Бойль
ввел понятие об
атомах и
молекулах
22.
Предпосылки:• 1741г., М.В.
Ломоносов в
работе «Элементы
математической
химии»
сформулировал
основные понятия
учения
23.
Современная формулировкаатомно-молекулярного учения:
1) Все вещества состоят из молекул,
атомов или ионов;
молекула – мельчайшая частица,
которая сохраняет свойства
вещества;
24.
Снимок, сделанный спомощью особо
мощного
электронного
микроскопа в
Киотском
университете
(Япония) в 1976 году.
Объект – кристалл
хлорированного
фталоцианина меди
25.
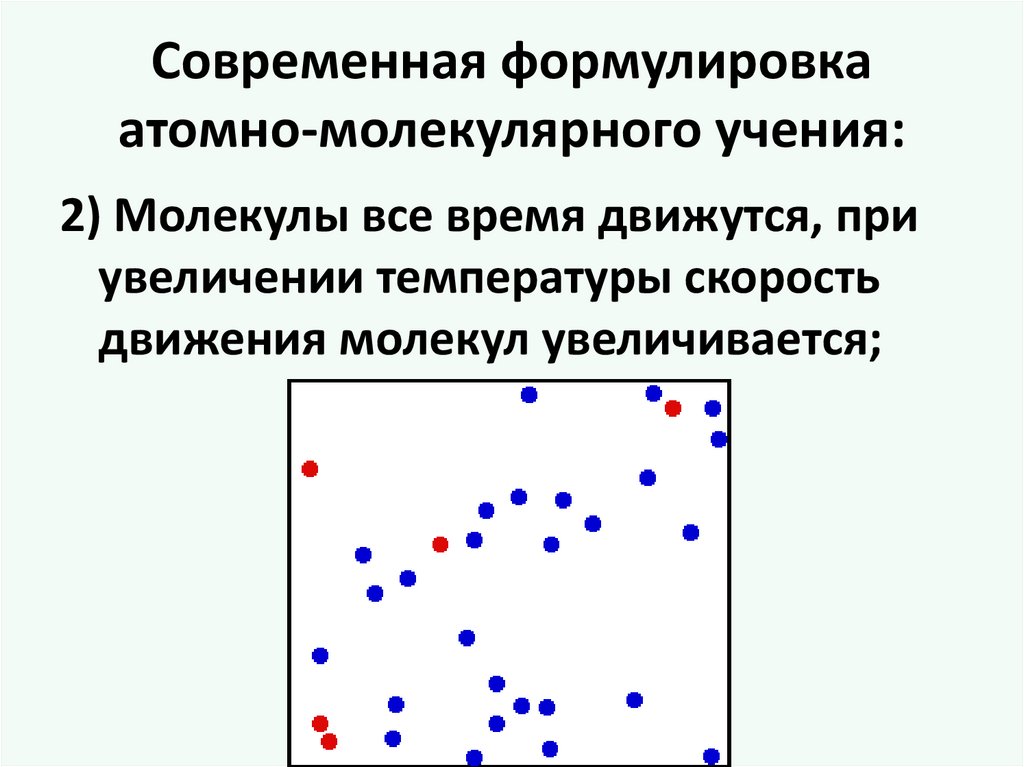
Современная формулировкаатомно-молекулярного учения:
2) Молекулы все время движутся, при
увеличении температуры скорость
движения молекул увеличивается;
26.
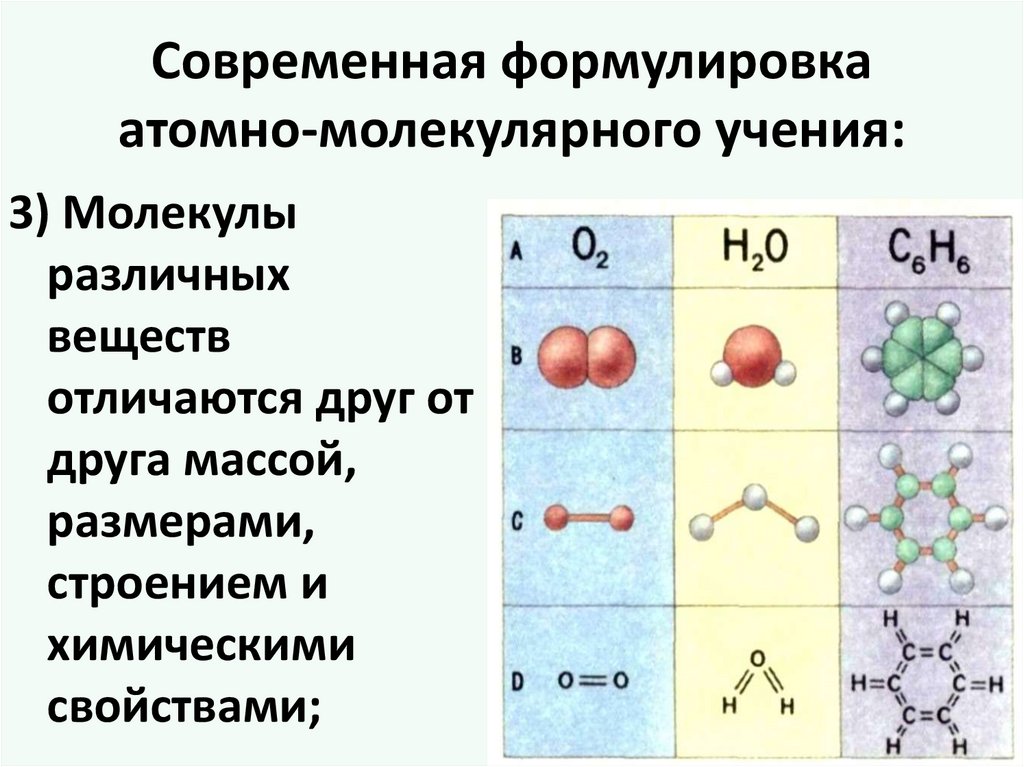
Современная формулировкаатомно-молекулярного учения:
3) Молекулы
различных
веществ
отличаются друг от
друга массой,
размерами,
строением и
химическими
свойствами;
27.
Современная формулировкаатомно-молекулярного учения:
4) Молекулы могут состоять из атомов
одного элемента (простые вещества)
или из атомов разных элементов
(сложные вещества);
существенное значение имеет
количество и взаимное расположение
атомов в молекуле;
28.
Современная формулировкаатомно-молекулярного учения:
5) Атомы – мельчайшие частицы,
которые нельзя разложить
химическим путем, поэтому они
обуславливают свойства химического
элемента
29.
Химический элемент • (до учения о строении атома) этоопределенный вид атомов
• (с учетом учения о строении атома)
это совокупность атомов с
одинаковым зарядом ядра
30.
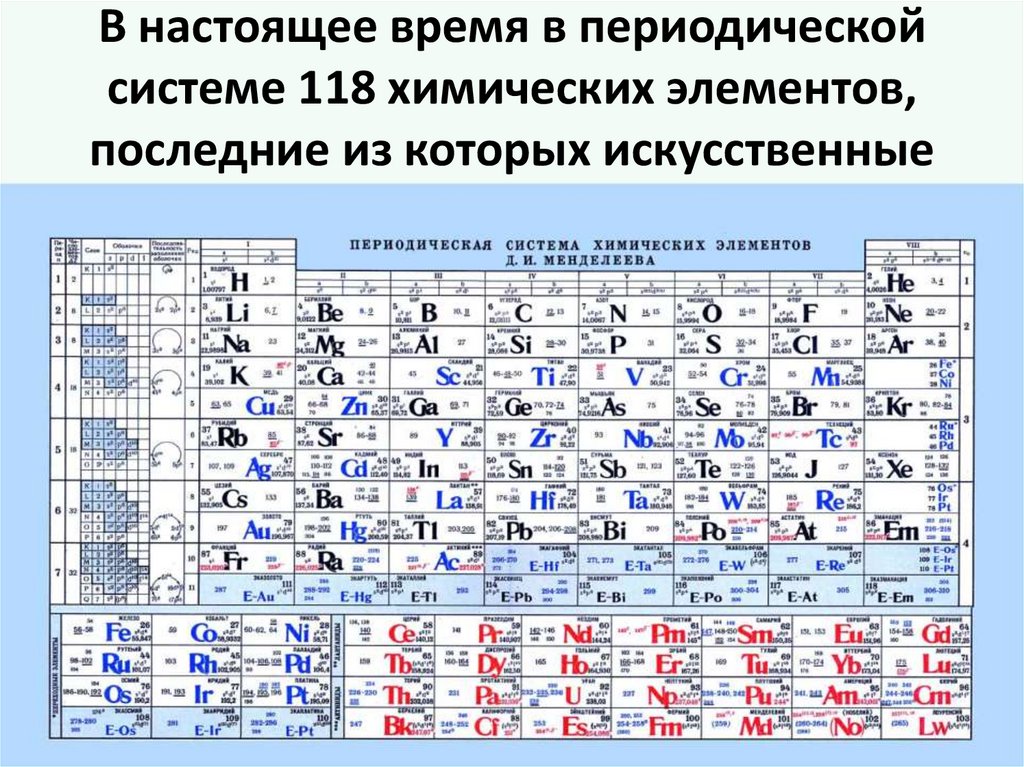
• Д.И. Менделееврасположил в
периодической
системе 64
химических
элемента
31.
В настоящее время в периодическойсистеме 118 химических элементов,
последние из которых искусственные
32.
Знаки химических элементов начальные буквы латинскихназваний веществ.
• Берцелиус в 1814 году предложил
обозначать знаками химические
элементы
• Н (gidrogenium), Hg (gidrargium)
33.
знакназвание чтение
34.
«о»35.
«аш»36.
«це»37.
«эн»38.
«феррум»39.
«натрий»40.
«калий»41.
«кальций»42.
«магний»43.
«купрум»44.
«цинк»45.
«аргентум»46.
«гидраргирум»47.
«хлор»48.
«эс»49.
«барий»50.
«алюминий»51.
«силициум»52.
«пэ»53.
«плюмбум»54.
Аr, относительная атомная масса показывает массу элементаотносительно массы самого
легкого элемента – водорода
55.
Мr, относительная молекулярнаямасса показывает массу молекулы
относительно массы самого
легкого элемента – водорода
56.
Закон постоянства состава вещества(Ж Пруст, ХIХ век)
независимо от способа получения
соединения его состав остается
постоянным
• Закон справедлив для молекулярных
веществ
• Для веществ, в которых
невозможно выделить молекулы
показывают условный состав,
аналогично составу молекулы
57.
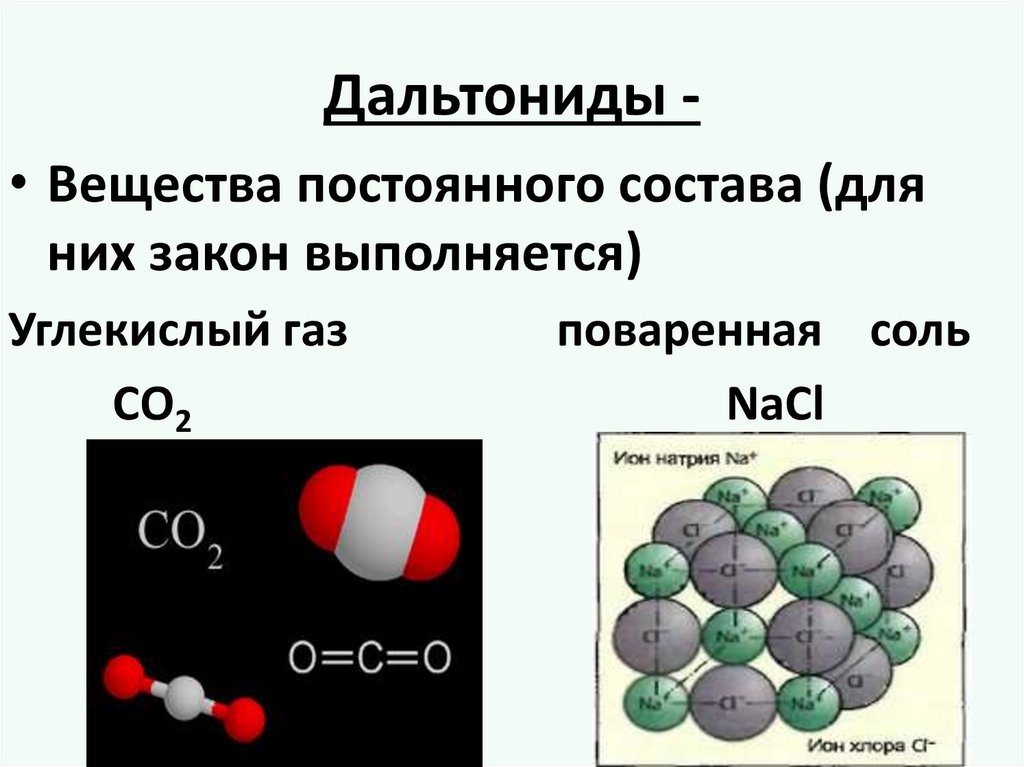
Дальтониды • Вещества постоянного состава (дляних закон выполняется)
Углекислый газ
СО2
поваренная соль
NaCl
58.
Бертоллиды вещества переменного состава(закон не выполняется)
Оксиды титана ТiO, TiO2
Соединения переменного состава
имеют не молекулярную, а атомную
структуру, и отражают только границы
состава вещества.
59.
Закон сохранения массы веществ(М.В. Ломоносов)
60.
Вещества различаются друг отдруга по своим свойствам
• Физическими свойствами
(явлениями) называются такие, при
которых могут изменяться размеры,
форма тел или агрегатное состояние
веществ, но состав их остается
постоянным
61.
Вещества различаются друг отдруга по своим свойствам
• Химическими свойствами
называются такие, при которых из
одних веществ образуются другие
62.
Пять признаков химическихявлений (реакций)
• Свет и тепло
63.
Пять признаков химическихявлений (реакций)
• Выпадение
осадка
64.
Пять признаков химическихявлений (реакций)
• Выделение
газа
65.
Пять признаков химическихявлений (реакций)
• Появление
запаха
66.
Пять признаков химическихявлений (реакций)
• Изменение цвета
67.
Домашнее задание• 1. Выписать не менее пяти высказываний
великих мыслителей, ученых, художников
о значении и роли химии в науке и жизни
• 2. Подобрать не менее пяти омонимов к
слову «химия», указать их значение
Примечание: ссылка на источник
обязательна!
3. Выучить 20 знаков химических элементов




























































 Химия
Химия








