Похожие презентации:
Классы неорганических соединений
1. КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
2.
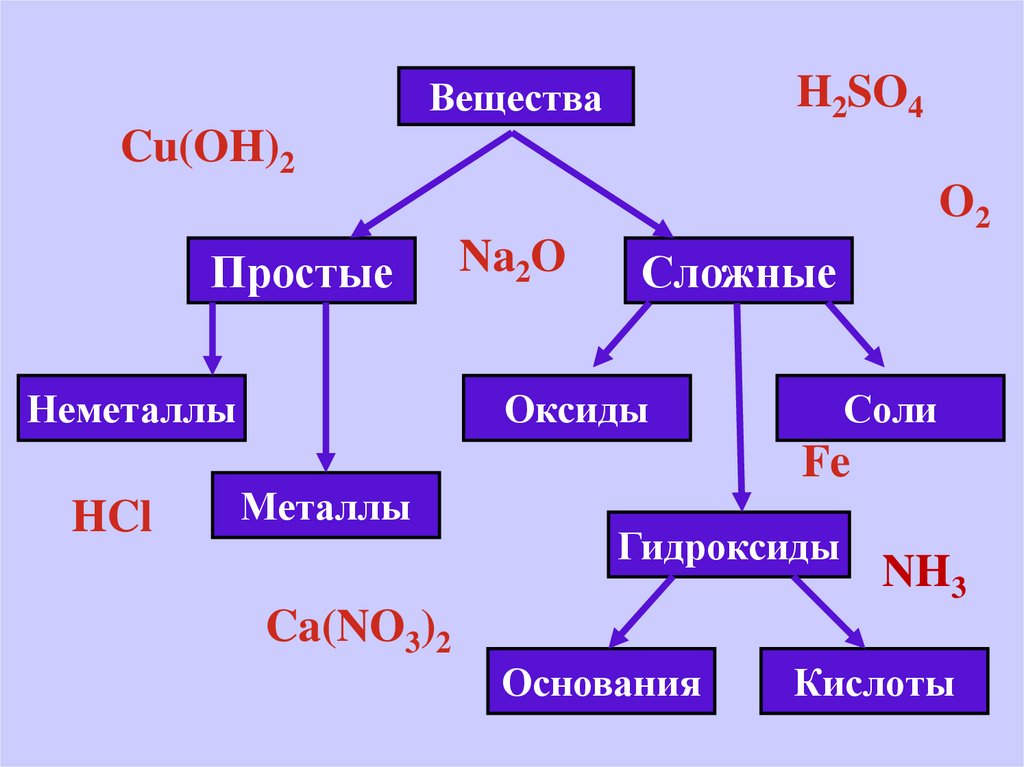
H2SO4Вещества
Cu(OH)2
O2
Простые
Неметаллы
HCl
Na2O
Сложные
Оксиды
Металлы
Соли
Fe
Гидроксиды
NH3
Ca(NO3)2
Основания
Кислоты
NH3
3.
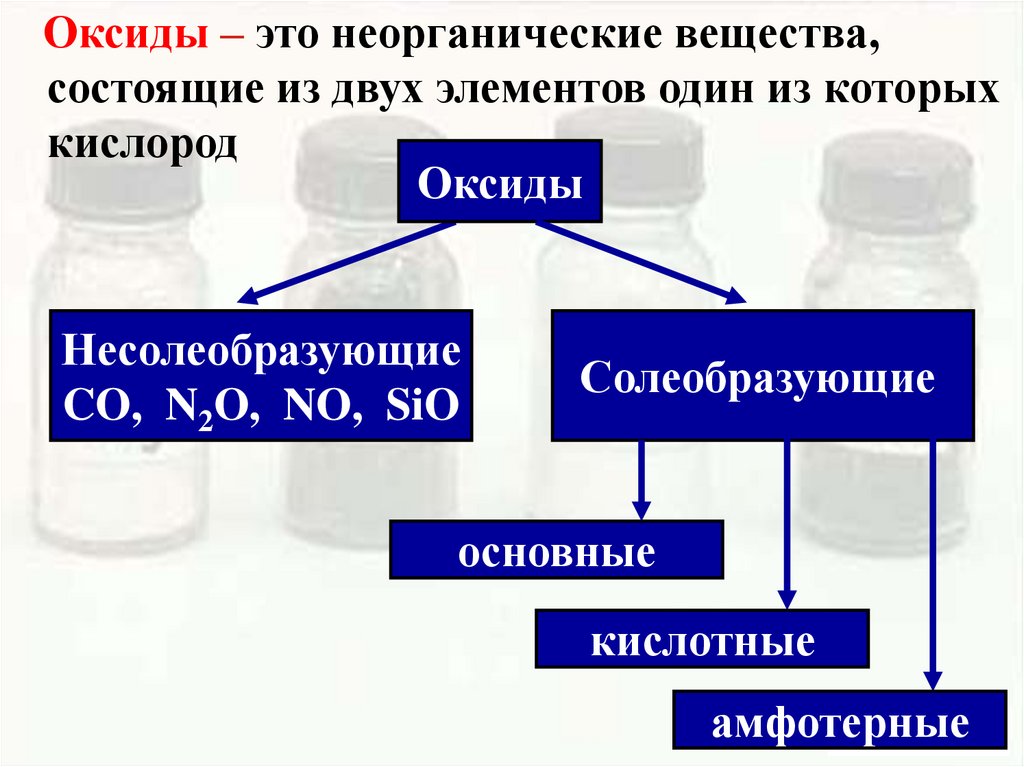
Оксиды – это неорганические вещества,состоящие из двух элементов один из которых
кислород
Оксиды
Несолеобразующие
CO, N2O, NO, SiO
Солеобразующие
основные
кислотные
амфотерные
4.
Основные оксиды образованы металламисо степенью окисления +1, +2:
+
-2
Na2O
+2 -2
MgO
Каждому основному оксиду соответствует
Основание
+
Na2O NaOH
2+
-
MgO Mg(OH)2
5.
Основные оксиды взаимодействуют скислотами, образуя соль и воду:
-
+
-
Na2O + 2HCl = 2NaCl + H2O
2-
2+
2-
MgO + H2SO4 = MgSO4+ H2O
6.
Кислотные оксиды образованынеметаллами и некоторыми
металлами, если в оксиде они
проявляют высшую валентность:
SO2, CO2 и др.
II
III
VI
CrO, Cr2O3, CrO3
7.
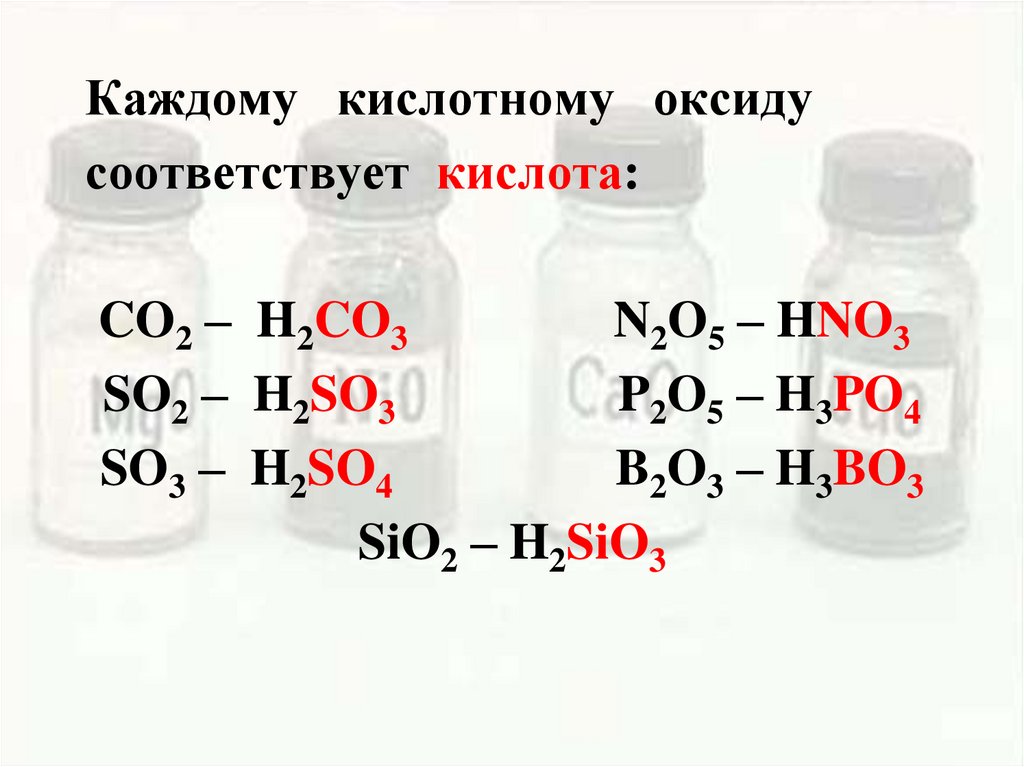
Каждому кислотному оксидусоответствует кислота:
CO2 – H2CO3
N2O5 – HNO3
SO2 – H2SO3
P2O5 – H3PO4
SO3 – H2SO4
B2O3 – H3BO3
SiO2 – H2SiO3
8.
Кислотные оксиды взаимодействуютс основаниями, образуя соль и воду:
+
2-
SO2 + 2NaOH = Na2SO3 + H2O
2+
-
N2O5 + Ca(OH)2 = Ca(NO3)2 + H2O
9.
Амфотерные оксиды образованыметаллами со степенью окисления
+3, +4, реже +2:
ZnO, Al2O3, Fe2O3, Cr2O3
Амфотерным оксидам соответсвуют
и основания, и кислоты:
ZnO
Zn(OH)2 H2ZnO2
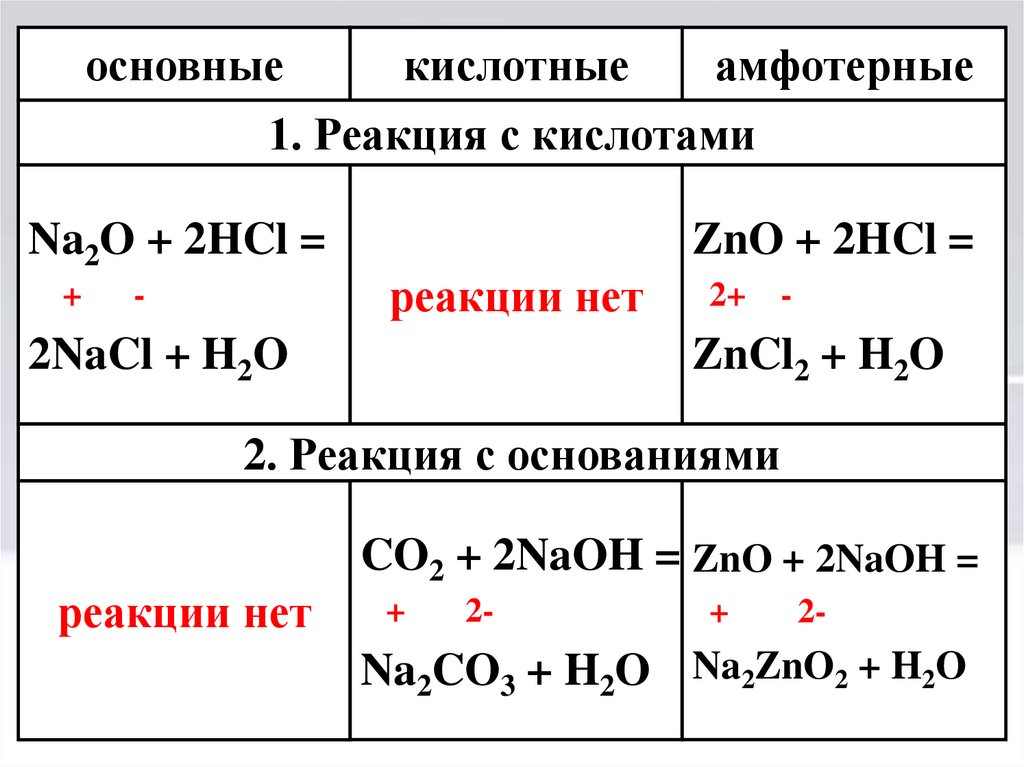
10. Химические свойства оксидов
11.
основныекислотные
амфотерные
1. Реакция с кислотами
Na2O + 2HCl =
+
-
ZnO + 2HCl =
реакции нет
2NaCl + H2O
2+
-
ZnCl2 + H2O
2. Реакция с основаниями
реакции нет
CO2 + 2NaOH = ZnO + 2NaOH =
+
2-
+
2-
Na2CO3 + H2O Na2ZnO2 + H2O
12.
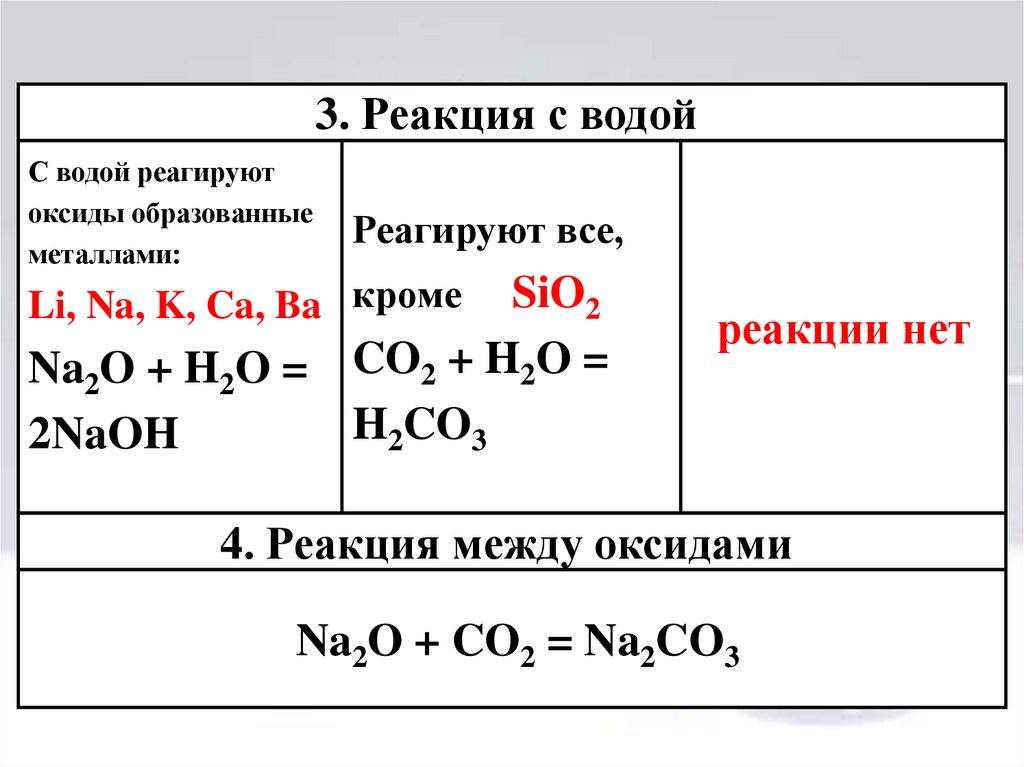
3. Реакция с водойС водой реагируют
оксиды образованные
металлами:
Реагируют все,
Li, Na, K, Ca, Ba кроме
SiO2
Na2O + H2O = CO2 + H2O =
H2CO3
2NaOH
реакции нет
4. Реакция между оксидами
Na2O + CO2 = Na2CO3







 Химия
Химия








