Похожие презентации:
Органическая химия
1.
Органическая химия2. Карбоновые кислоты
Роль в природеОпределение
Номенклатура
Изомерия
Получение
Физические свойства
Химические свойства
Применение
3. Карбоновые кислоты
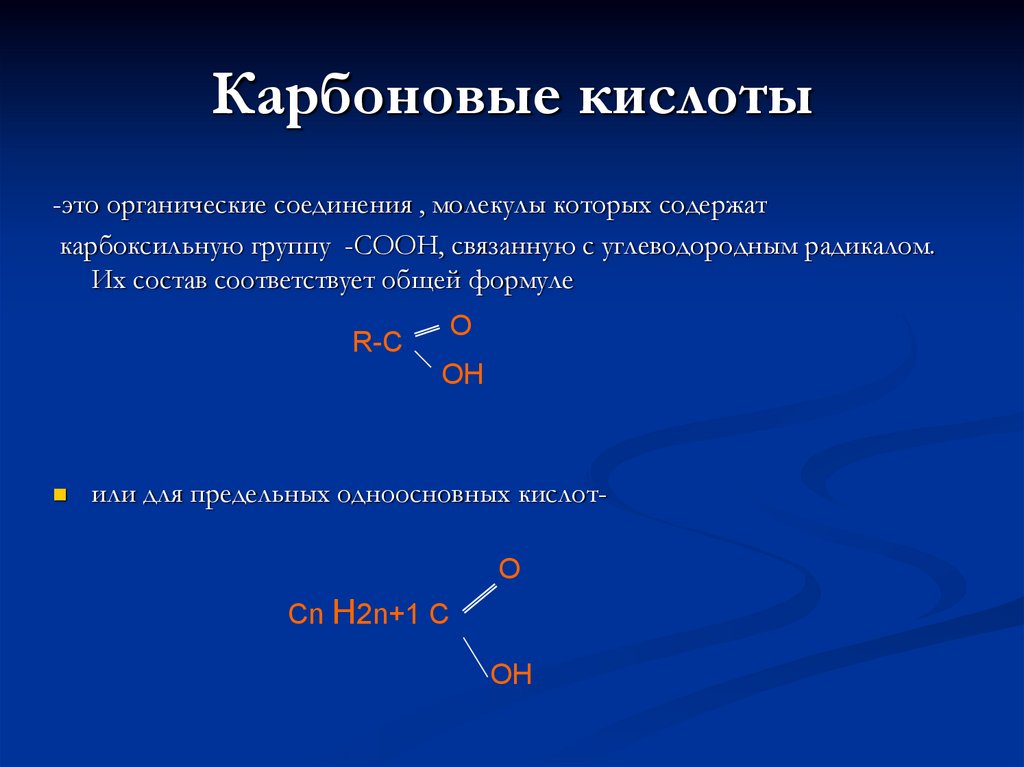
-это органические соединения , молекулы которых содержаткарбоксильную группу -COOH, связанную с углеводородным радикалом.
Их состав соответствует общей формуле
R-C
O
OH
или для предельных одноосновных кислотO
Cn H2n+1 C
OH
4. Содержание в природе :
5.
Содержание в природе :6. Номенклатура
Тривиальное название указывает скорее наисточник выделения, чем на химическую
структуру кислот
Систематические названия одноосновных
предельных карбоновых кислот даются по
названию соответствующего алкана с
добавлением суффикса -овая и слова кислота.
7. Гомологический ряд
Тривиальноеназвание
Название по
ИЮПАК
Формула
муравьиная
метановая
HCOOH
уксусная
этановая
CH3COOH
пропионовая
пропановая
C2H5COOH
маслянная
бутановая
C3H7COOH
8.
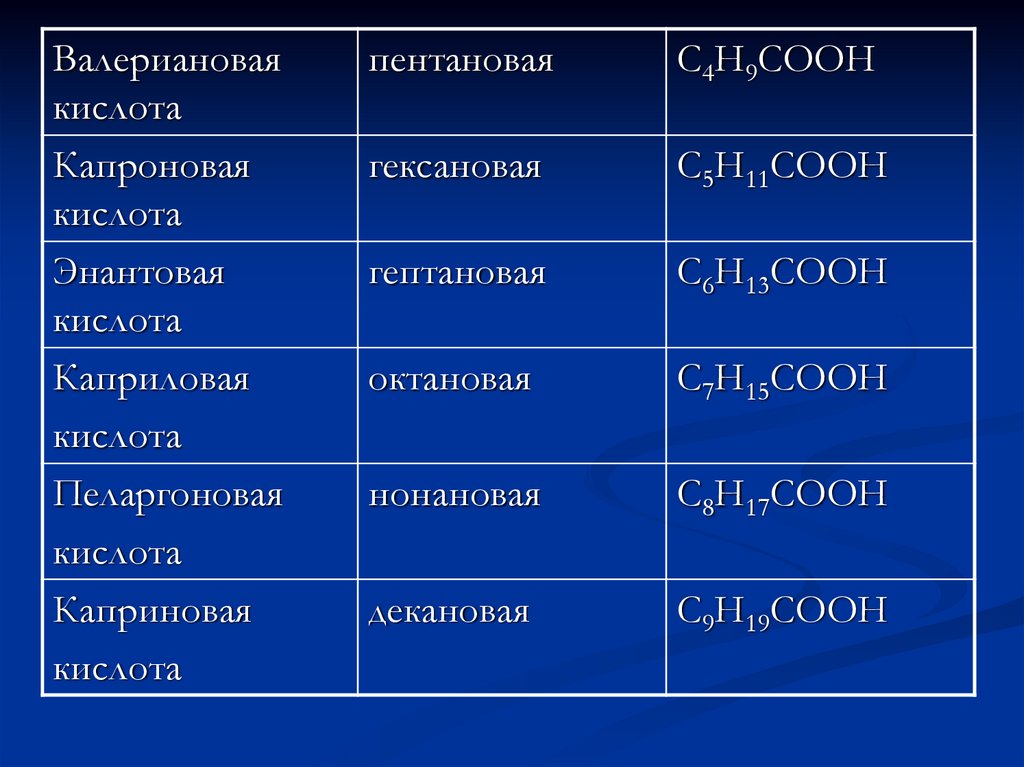
Валериановаякислота
Капроновая
кислота
Энантовая
кислота
Каприловая
кислота
Пеларгоновая
кислота
Каприновая
кислота
пентановая
C4H9COOH
гексановая
C5H11COOH
гептановая
C6H13COOH
октановая
C7H15COOH
нонановая
C8H17COOH
декановая
C9H19COOH
9. Изомерия
Изомерия скелета в углеводородном радикалепроявляется,
начиная с бутановой кислоты, которая имеет
два изомера:
СН3–CH2–CH2–COOH н-бутановая кислота;
СН3–CH(СН3)–COOH 2-метилпропановая
кислота.
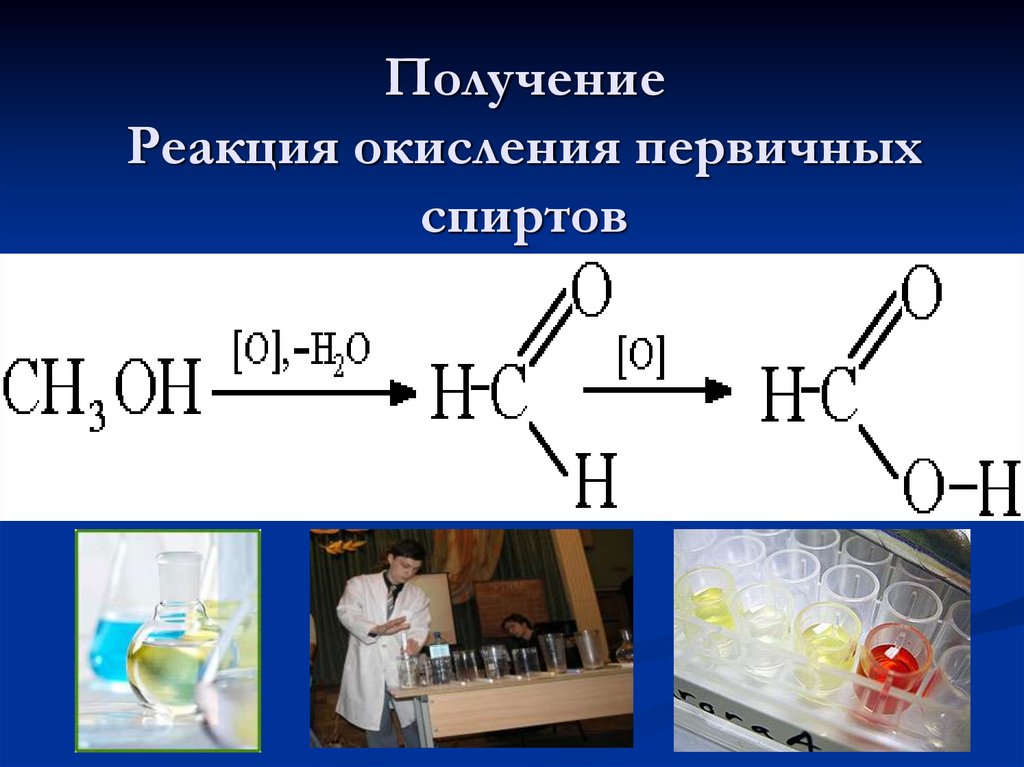
10. Получение Реакция окисления первичных спиртов
11. Физические свойства
Метановая кислота-это жидкость с резким запахом(tкип=100,8 0 С ),хорошо растворимая в воде ,
ядовита! При попадании на кожу вызывает ожоги .
Этановая кислота-это бесцветная жидкость с
характерным резким запахом, смешивается с водой
в любых отношениях
С увеличением Мr в гомологическом ряду
предельных одноосновных карбоновых кислот
увеличивается их плотность, tкип и tплв ,уменьшается
растворимость в воде. Например, пальмитиновая и
стеариновая кислоты- твердые вещества
12. Химические свойства
Наиболее важные химические свойства, характерные длябольшинства карбоновых кислот:
1) Карбоновые кислоты при реакции с металлами или их
основными гидроксидами дают соли соответствующих
металлов:
2 CH3COOH + Mg = (CH3COO)2Mg + H2
CH3COOH + NaOH = CH3COONa + H2O
Также карбоновые кислоты могут вытеснять более слабую
кислоту из её соли, например:
CH3COOH + NaHCO3 = CH3COONa + H2CO3
(потом H2CO3 разлагается на углекислый газ и воду)
13. Химические свойства
2) Карбоновые кислоты в присутствии кислого катализаторареагируют со спиртами, образуя сложные эфиры (реакция
этерификации):
CH3COOH + СН3СН2ОН = CH3COOСН2СН3 + H2O
3) При нагревании аммонийных солей карбоновых кислот
образуются их амиды:
CH3COONH4 = CH3CONH2 + H2O
4) Под действием SOCl2 карбоновые кислоты превращаются
в соответствующие хлорангидриды.
CH3COOH + SOCl2 = CH3COCl + HCl + SO2
14. Применение
Муравьиная кислота обладаетдезинфицирующим действием, поэтому
применяется в пищевой, кожевенной,
фармацевтической промышленности
Уксусная кислота используется в пищевой,
лакокрасочной, химической
промышленности, кожевенном
производстве.











 Химия
Химия