Похожие презентации:
Кинетика химических реакций. Лабораторная работа № 5
1.
Лабораторная работа № 5КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: Исследовать зависимость скорости реакции от температуры и
концентрации исходных реагентов.
Объект исследования:
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3 – 1 стадия, идет очень быстро
Тиосульфат натрия
тиосерная кислота
H2S2O3 = H2O + SO2 ↑ + S↓ - 2 стадия, протекает медленно.
2.
Оп. 1. Зависимость скорости реакции от концентрации реагирующих веществ.№
Объем
Объем Объем
п\п Na2S2O3,
мл
1
2
3
4
5
6
1
2
3
4
5
6
Н2О,
мл
5
4
3
2
1
0
Время до
Скорость
появления
реакции 100/ ,
H2SO4,
̶1
опалесценции,
с
мл
, с
2
164
2
74
2
56
2
40
2
28
2
25
3.
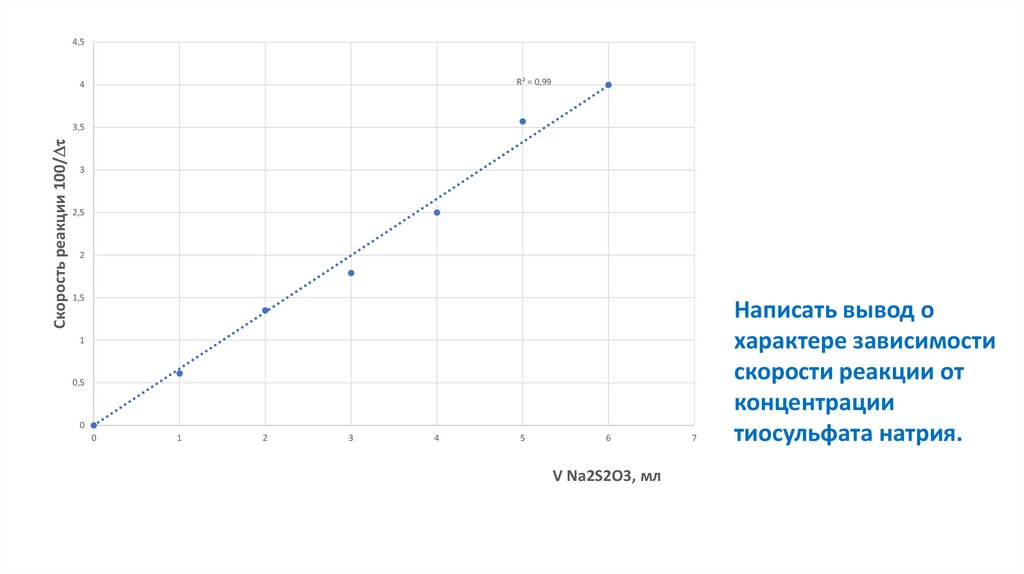
4,5R² = 0,99
4
Скорость реакции 100/
3,5
3
2,5
2
1,5
1
0,5
0
0
1
2
3
4
5
6
V Na2S2O3, мл
7
Написать вывод о
характере зависимости
скорости реакции от
концентрации
тиосульфата натрия.
4.
Оп. 2. Зависимость скорости реакции от температуры.№ Объем,
п/ мл
п
1
2
3
4
5
6
7
Объем Температур Время до
, мл
а, о С
появления
опалесценции
Na2S2O3 H2SO4
, с
2
2
2
2
2
2
2
2
2
2
2
2
2
2
10
15
25
40
50
60
70
120
100
60
35
15
6,7
4
Скорость
реакции 10/ ,
с ̶1
5.
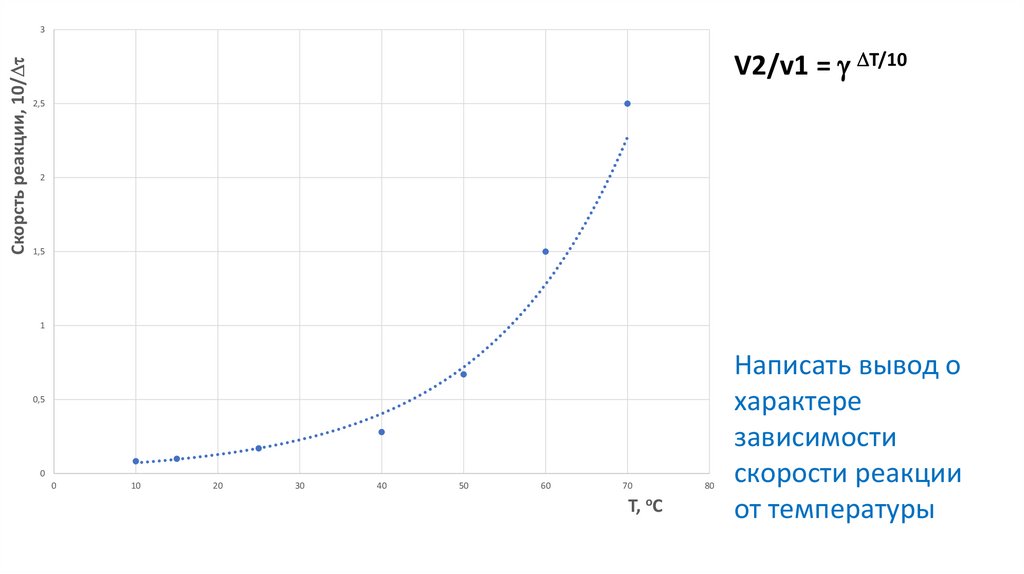
Скорсть реакции, 10/3
V2/v1 = T/10
2,5
2
1,5
1
0,5
0
0
10
20
30
40
50
60
70
Т, оС
80
Написать вывод о
характере
зависимости
скорости реакции
от температуры
6.
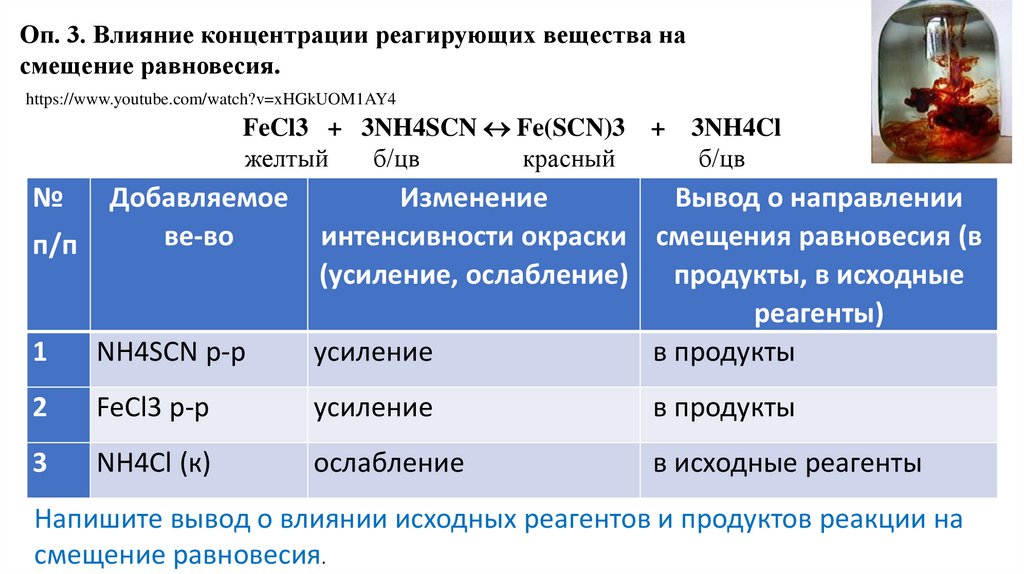
Оп. 3. Влияние концентрации реагирующих вещества насмещение равновесия.
https://www.youtube.com/watch?v=xHGkUOM1AY4
FeCl3 + 3NH4SCN Fe(SCN)3
желтый
б/цв
красный
№
3NH4Cl
б/цв
1
NH4SCN р-р
Изменение
Вывод о направлении
интенсивности окраски смещения равновесия (в
(усиление, ослабление)
продукты, в исходные
реагенты)
усиление
в продукты
2
FeCl3 р-р
усиление
в продукты
3
NH4Cl (к)
ослабление
в исходные реагенты
п/п
Добавляемое
ве-во
+
Напишите вывод о влиянии исходных реагентов и продуктов реакции на
смещение равновесия.



 Физика
Физика Химия
Химия








