Похожие презентации:
Тема 1.4 «Закономерности химических процессов». Основы химической термодинамики и биоэнергетики
1.
Тема 1.4 «Закономерностихимических процессов»
1.4.1. Основы химической
термодинамики и биоэнергетики
2.
Термодина́мика (греч. θέρμη — «тепло», δύναμις — «сила»)Химическая термодинамика - это раздел
термодинамики, изучающий взаимные превращения
различных форм энергии при протекании химических
процессов.
Цель изучения химической термодинамики - ответить на два
вопроса:
1. Возможен или нет между веществами химический
процесс?
2. Какова величина теплового эффекта данной химической
реакции?
3.
Основные понятия термодинамикиТермодинамическая
система
(тдс)
–
это
совокупность
материальных
объектов
(тел,
образованных
различными
веществами),
отделенных поверхностью раздела от окружающей
среды.
Окружающая среда – остальная часть пространства
со всем, что в ней находиться.
Фаза – часть системы, которая обладает
определенным составом и свойствами, и отделенная
от других ее частей поверхностью раздела.
4.
Системы бывают:• открытые - могут
обмениваться и энергией,
и веществом.
• закрытые - могут
обмениваться только
энергией.
• изолированные - не
обмениваются с
окружающей средой ни
веществом, ни энергией.
• гомогенные
все
компоненты находятся в
одной фазе, поверхность
раздела
между
ними
отсутствует.
• гетерогенные – система
состоит из нескольких
фаз, есть поверхность
раздела, которая видна
невооруженным глазом.
5.
Определите тип тдс6.
Состояние системы – это совокупность всехфизических и химических свойств системы.
Это состояние описывают с помощью параметров и функций
состояния.
параметры: давление (p), температура (t), объём(v),
концентрация(c) – характеристики системы, которые можно
измерить. (Изотермические процессы: T = const Изобарные процессы: P = const
Изохорные процессы: V = const)
функции (внутренняя энергия (U), энтальпия (H), энтропия
(S), изобарно-изотермический потенциал (G) характеристики системы , которые зависят от параметров
т.е., например U =f(t,p,v,c)).
(Функции состояния – это потенциалы, т.е. не Н, а ∆Н = Н2 – Н1)
7.
Внутренняя энергия (U) – это энергия, которой обладает телов состоянии равновесия, т.е. скрытая в веществах и
освобождающаяся при химических или физических
процессах, она складывается из энергии теплового движения
частиц, всех видов внутримолекулярной и внутриатомной
энергии.
Теплота (Q) – это энергия, передаваемая за счет хаотического
столкновения молекул о границу раздела системы и
окружающей среды.
Работа (A ) – энергия, передаваемая от одной системы к
другой за счет перемещения вещества или тела под
действием различных сил (например, гравитационных).
8.
0-й закон (нулевое началотермодинамики) Равновесие
Для каждой изолированной термодинамической системы
существует состояние термодинамического равновесия,
которого она с течением времени самопроизвольно
достигает.
Состояние равновесия (тд рс)– это состояние в котором в
течении неограниченного времени не изменяются параметры
и функции системы, т.е. в системе не происходят никакие
изменения. Если в системе происходят какие то изменения
(процессы), то мерой этих изменений будет изменение
параметров и функций состояния этой системы.
9.
Термодинамическое равновесие (тдс) динамическое, т.е.в системе продолжают протекать процессы, но в
противоположном направлении и скорости этих процессов
равны.
Термодинамически обратимым называется процесс, который
при определенных условиях можно реализовать в прямом и
обратном направлении, при этом никаких изменений в
окружающей среде остается.
Необратимыми называют процессы, при которых в системе или
окружающей среде возникают какие-то неисчезающие
изменения.
Все реально протекающие самопроизвольные процессы –
необратимы. В том числе и в живых организмах. Обратимый
процесс – абстракция, идеал. Он может протекать только в
изолированной системе.
10.
1-й закон (первое начало термодинамики)Закон сохранения энергии
• Теплота, поглощенная системой или выделенная ею,
расходуется на изменение внутренней энергии системы и
совершение работы.
В общем виде впервые сформулирован Ломоносовым (1744).
Подтвержден работами Гесса (1836), Джоуля (1840),
Гельмгольца (1847).
ΔQ =ΔU + PΔV
Работа может быть механической (например, работа
расширения), а может быть полезной работой по совершению
химической реакции.
11.
Совокупность внутренней энергиитела и энергии его взаимодействия с
окружающей средой объединяется
понятием «энтальпия». (Н)
Это функция, которая характеризует энергетическое состояние системы.
Изменение энтальпии равно изменению внутренней энергии ТДС и
совершению работы расширения ∆Н = ΔU + Р∙∆V
При постоянном объеме ∆Н0 = ΔU = - ΔQ
Т.е. Тепловой эффект реакции равен изменению энтальпии, но с
противоположным знаком. В термохимии положительной считают
теплоту, отдаваемую системой, а отрицательной — теплоту, получаемую
системой. Если в системе уменьшается внутренняя энергия, значит, она
выделилась в виде тепла или работы. Если система получила
дополнительную энергию в виде тепла или над системой совершена работа
– значит, внутренняя энергия системы стала больше.
12.
Термохимические уравнения- указывается агрегатное состояние веществ (г, ж, т);
- указывается знак и значение теплового эффекта
- возможны дробные коэффициенты.
• 2Н2 (г) + О2 (г) = 2Н2О (г) + 483,68 кДж
или
2Н2 (г) + О2 (г) = 2Н2О (г) ∆Н = -483,68 кДж
2Н2 (г) + О2 (г) = 2Н2О (ж) ∆Н = - 571,60 кДж
• CaCO3 (тв)= CaO(тв)+ CO2 (г) - 178 кДж
или
CaCO3 (тв)= CaO(тв)+ CO2 (г) ΔН= + 178 кДж
Если реакция протекает с выделением энергии то реакцию
называют экзотермической.
Если реакция протекает с поглощением энергии, то ее
называют эндотермической.
13.
Закон Лавуазье – Лапласа – еще однаформулировка закона сохранения энергии
Если при образовании какого-либо соединения
выделяется (или поглощается) некоторое количество
теплоты, то при разложении этого соединения в тех же
условиях такое же количество теплоты поглощается (или
выделяется).
2Н2 (г) + О2 (г) = 2Н2О (г) + 483,68 кДж
2Н2О (г) = 2Н2 (г) + О2 (г) - 483,68 кДж
Иначе говоря, если прямая реакция – экзотермическая, то
обратная будет эндотермическая и тепловые эффекты
реакций равны по величине и противоположны по знаку.
14.
Энтальпия образования вещества(теплота образования) ∆Н0
2Н2 (г) + О2 (г) = 2Н2О (г) + 483,68 кДж
Н2 (г) + 0,5О2 (г) = Н2О (г) + 241,84 кДж
Н2(г) + 0,5О2(г)= Н2О (г) ∆Н0 = - 241,84 кДж/моль
Количество теплоты, выделяющейся (или поглощающейся)
при образовании одного моля соединения из простых
веществ, называется теплотой образования.
Это справочная величина, ее определяют при т.н. стандартных условиях.
- Давление 1,013∙105 Па (1 атм)
- Температура 298 К (25 С)
- Концентрация 1 моль/л
Энтальпию образования простых веществ считают равной
нулю.
15.
Теплота сгорания вещества«Теплота сгорания», это количество теплоты, выделяющейся
при окислении одного моля какого-то соединения.
Например: 2С2Н2(г) + 5О2(г) = 2Н2О(г) + 4СО2(г) + 2600 кДж/моль
или С2Н2(г) + 2,5О2(г) = Н2О(г) + 2СО2(г) ; ∆Н = -1300 кДж/моль
1300 кДж/моль– это теплота сгорания ацетилена, справочная
величина.
По термохимическим уравнениям можно выполнять расчеты
как по обычным уравнениям.
16.
Расчеты по термохимическим уравнениямКакой объем углекислого газа выделится в реакции
разложения известняка, если на реакцию затратили 1780 кДж
тепла?
CaCO3 (тв)= CaO(тв)+ CO2 (г) - 178 кДж
17.
Закон Германа Гесса(1841) – еще однаформулировка закона сохранения энергии
Тепловой эффект (энтальпия) процесса зависит только от
начального и конечного состояния и не зависит от пути
перехода его из одного состояния в другое
18.
Следствием из этого закона является возможностьрасчета теплового эффекта реакции. Математически это
можно записать так:
ΔНхимической реакции= Σν∙ΔНпродуктов реакции - Σν∙ΔНисходных веществ
Т.е. Изменение энтальпии в химической реакции (а
значит и тепловой эффект реакции!) равен разности сумм
энтальпий образования продуктов реакции и исходных
веществ с учетом их стехиометрических коэффициентов.
Практически важным выводом из закона Гесса и закона Лавуазье – Лапласа
является возможность вычислять тепловые эффекты в тех случаях, когда их
нельзя измерить. Такой способ называется непрямой калориметрией.
Положительный тепловой эффект реакции говорит о том, что образуются
вещества с более прочными связями, чем в исходных веществах и это обычно
энергетически выгодно системе.
19.
Расчеты по уравнению ГессаОпределить тепловой эффект реакции взаимодействия
метана с кислородом.
1) Записать уравнение реакции
2) Выписать из таблицы значение теплоты образования
каждого вещества, участвующего в реакции. Помните,
что для простых веществ теплота образования равна
«0».
3) Записать уравнение Гесса и подставить в него
выписанные значения с учетом коэффициентов в
уравнении
4) Рассчитать изменение энтальпии в химической реакции
и ответить на вопрос задачи.
20.
Измерение теплового эффекта химическойреакции
Калориметрическое
определение ведется так,
чтобы энергия химической
реакции выделялась в виде
теплоты или могла быть
учтена в виде работы
расширения газа.
Такой способ называют
прямой калориметрией, а
прибор калориметром.
21.
Всем живыморганизмам для роста
и функционирования
нужна энергия.
Организм человека не продуцирует новую энергию.
Все работы в организме совершаются за счет энергии
выделяющейся при окислении питательных веществ.
Основная часть этой энергии задерживается в организме в
виде химической энергии, а не выделяется в виде теплоты.
22.
Применение калориметрии вмедицине
- Сравнение
энергетики здоровых и больных клеток
позволяет изучать различные патологические явления,
разрабатывать диагностику и методы лечения некоторых
заболеваний, например, ожирения.
- На
основании данных о калорийности продуктов
составляются нормы потребностей в пищевых веществах
для разных групп населения, с учетом возраста, пола,
характера труда, заболевания, климата и т.д.
23.
2-й закон (второе начало) термодинамики.Закон возрастания энтропия (S).
Второе начало термодинамики (закон возрастания энтропии) позволяет
определить термодинамически возможные процессы, установить
направление протекания самопроизвольных процессов, а также
сформулировать критерии равновесия в термодинамических системах.
Встречающиеся в литературе различные формулировки второго начала
термодинамики являются частными следствиями закона возрастания
энтропии.
Потребовались усилия не одного, а многих национальных гениев, для
того чтобы приоткрыть завесу над сокровенной тайной природы, которую
мы называем сейчас вторым началом термодинамики.
24.
2 закон термодинамики. Закон увеличения энтропии.1824 г Сади Карно в своей работе посвященной
тепловым двигателям сформулировал выводы, которые
легли потом в основу второго закона термодинамики.
«Если между телами нет разности температур, то
теплообмен не происходит»
1848 г Уильям Томсон (барон Кельвин) предложил
«абсолютную температурную шкалу» и сформулировал
второй закон термодинамики следующим образом:
«Невозможен процесс, единственным результатом
которого является получение системой теплоты от
одного источника и выполнение ею эквивалентного
количества работы»… Иначе говоря нельзя сделать
«вечный двигатель»…
25.
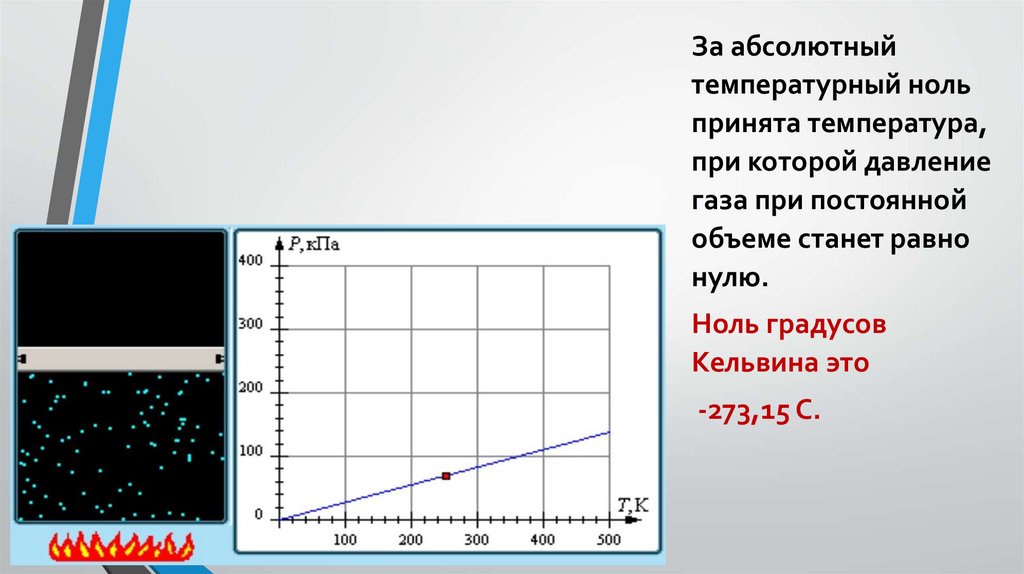
За абсолютныйтемпературный ноль
принята температура,
при которой давление
газа при постоянной
объеме станет равно
нулю.
Ноль градусов
Кельвина это
-273,15 С.
26.
• 1865 г Рудольф Клаузиус «Если два тела имеют разнуютемпературу, то процесс теплопередачи от более
нагретого тела к более холодному становится
необратимым» т.е. опять «нельзя сделать вечный
двигатель». Клаузиус дал понятие энтропии как
«отношения теплового эффекта к абсолютной
температуре».
• Под энтропией он понимал «изменения в системе» - не
очень внятная формулировка для непосвященных…
«В изолированных системах самопроизвольно
протекают процессы идущие с увеличением энтропии»
ΔS > 0
27.
1877 Людвиг Больцман показал связь между энтропиейи вероятностью микросостояний физической системы.
Закон возрастания энтропии у получил у Больцмана
простую статистическую интерпретацию:
Система стремится к наиболее вероятному состоянию;
самопроизвольно протекают только те процессы, в
которых система из менее вероятного состояния
переходит в более вероятное.
Предложенная Больцманом интерпретация энтропии как
меры упорядоченности/неупорядоченности на атомномолекулярном уровне позволила обнаружить ряд важных
закономерностей, которые становятся очевидными, если
заменить термин «энтропия» словом
«неупорядоченность».
28.
1876 г Джозайя Уиллард Гиббс сформулировалзакон, согласно которому «любой самопроизвольно
протекающий процесс идет в том направлении, которое
сопровождается уменьшением в системе свободной энергии»
Свободная энергия или Энергия Гиббса или изобарноизотермический потенциал (G) – это та часть всей энергии
системы, которую можно использовать для совершения
максимальной работы. Ее изменение в реакции определяется
разностью сумм энергий Гиббса конечных продуктов реакции и
исходных веществ:
• ΔG= Gкон – Gисх
При постоянных температуре и давлении изменение энергии
Гиббса связано с энтальпией и энтропией следующим
выражением:
• ΔG = ΔH– TΔS
29.
Итак, в химических процессах одновременно изменяются энергетический запассистемы (энтальпийный фактор) и степень ее беспорядка (энтропийный фактор, не
совершающая работу энергия). Анализ уравнения Гиббса позволяет установить, какой
из факторов, составляющих энергию Гиббса, ответственен за направление протекания
химической реакции, энтальпийный (ΔH) или энтропийный (ΔS ċ T).
Если ΔH < 0 и ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре.
Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и
уменьшением энтропии невозможна ни при каких условиях.
В остальных случаях (ΔH < 0, ΔS < 0 и ΔH > 0, ΔS > 0) знак ΔG зависит от
соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением
изобарного потенциала; при комнатной температуре, когда значение T невелико,
значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому
большинство реакций, протекающих при комнатной температуре, экзотермичны.
Чем выше температура, тем больше TΔS, и даже эндотермические реакции
становятся осуществляемыми.
30.
Чаще всего для определениявозможности самопроизвольного процесса в тдс
пользуются изменением изобарно-изотермического
потенциала, т.н. свободной энергии Гиббса (ΔG).
если ΔG =0 , система находиться в равновесии, G имеет
минимальное значение для данной системы при данных
условиях
если ΔG >0 , самопроизвольные процессы невозможны,
они могут протекать только под действием окружающей
среды
если ΔG <0, процесс может протекать самопроизвольно,
при этом энергия системы должна уменьшаться
31.
Определение возможностисамопроизвольного процесса
Определите, возможен ли самопроизвольный процесс по
уравнению Al2O3 + H2 → H2O + Al
1) Составьте уравнение реакции (поставьте коэффициенты)
2) Выпишите из термодинамических таблиц значение ΔG
для каждого вещества, участвующего в реакции.
(Помните, что для простых веществ ΔG = 0)
3) Запишите уравнение Гесса и подставьте значения ΔG, с
учетом коэффициентов в уравнении реакции
4) Рассчитать изменение энтальпии в химической
реакции и ответить на вопрос задачи.
32.
Третий закон термодинамики.Абсолютный порядок.
1906 г Вальтер Герман Нернст опубликовал свою формулировку
третьего закона термодинамики, которую называют теоремой
Нернста. Он утверждал, что энтропия химически однородного
тела при температуре, равной абсолютному нулю, также
равна нулю.
Т.е., при Т = 0 S0 системы также равна нулю.
1911 г Макс Планк дал своё определение третьего закона
термодинамики: «При стремлении температуры к
абсолютному нулю энтропия всех тел также стремится к
нулю»
Энтропия кристаллического вещества при
абсолютном нуле равна нулю.
Чтобы охладить термодинамическую систему до абсолютного нуля,
нужно отводить теплоту и уменьшать температуру системы. Теплота
отводится в результате изотермического процесса, а температура
уменьшается адиабатически. Следовательно, эти процессы нужно
чередовать. Но если отводится теплота, то изменяется энтропия.
Согласно теореме Нернста, изменения энтропии при Т → 0 не
происходит.
33.
Домашнее задание• Прочитать 1.4.1.. Выписать и выучить основные понятия
термодинамики.
• Выполнить упр. №2, 3, 4, 5,6.
































 Химия
Химия








