Похожие презентации:
Свойства кислот, оснований и солей как электролитов
1.
II четвертьЗанятие № 1
9 класс
Практическая работа № 2
Решение экспериментальных задач
по теме «Свойства кислот,
оснований и солей как
электролитов»
2.
Давайте, вспомним!!!Признаки химической реакции!
3.
Признаки химических реакций.1. Выделение газа.
2. Образование воды.
3. Выпадение осадка.
4. Изменение цвета раствора.
5. Растворение осадка.
4.
5.
Цель: изучить свойства кислот, оснований и солейкак электролитов.
Оборудование: пробирки, штатив.
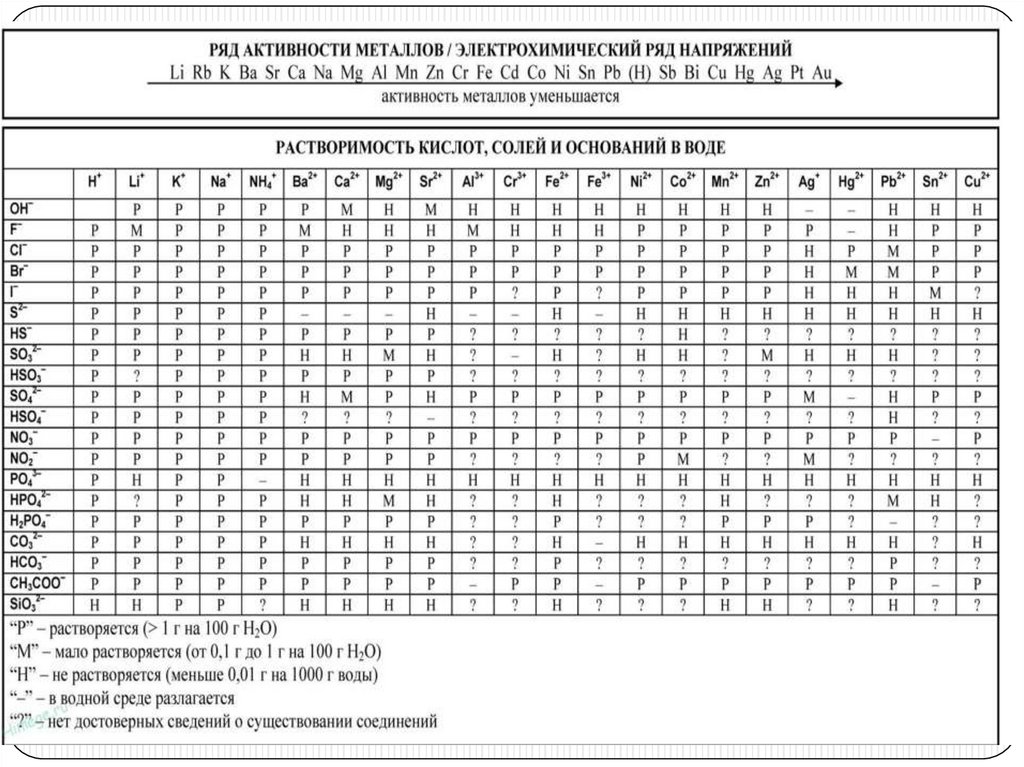
Реактивы: разбавленная H2SO4, HCl, стружки Mg,
кусочек Zn, MgCl2, NaOH, Na2CO3, Zn(NO3)2,
K3PO4, KNO3, Na2S, K2CO3, ZnCl2, HNO3, Na2SO3,
CuSO4,FeCl3, CaCl2, AgNO3.
6.
Ход работыЗадание 1.
Вариант 1. Взаимодействие разбавленной
серной кислоты и цинка.
H2SO4 + Zn = ZnSO4 + H2
2H+ + SO42- + Zn = Zn2+ + SO42- + H2
2H+ + Zn = Zn2+ + H2
Наблюдаем выделение бесцветного газа - H2
7.
Задание 1.Вариант 2. Взаимодействие соляной кислоты и
магния.
(выполняем самостоятельно!)
8.
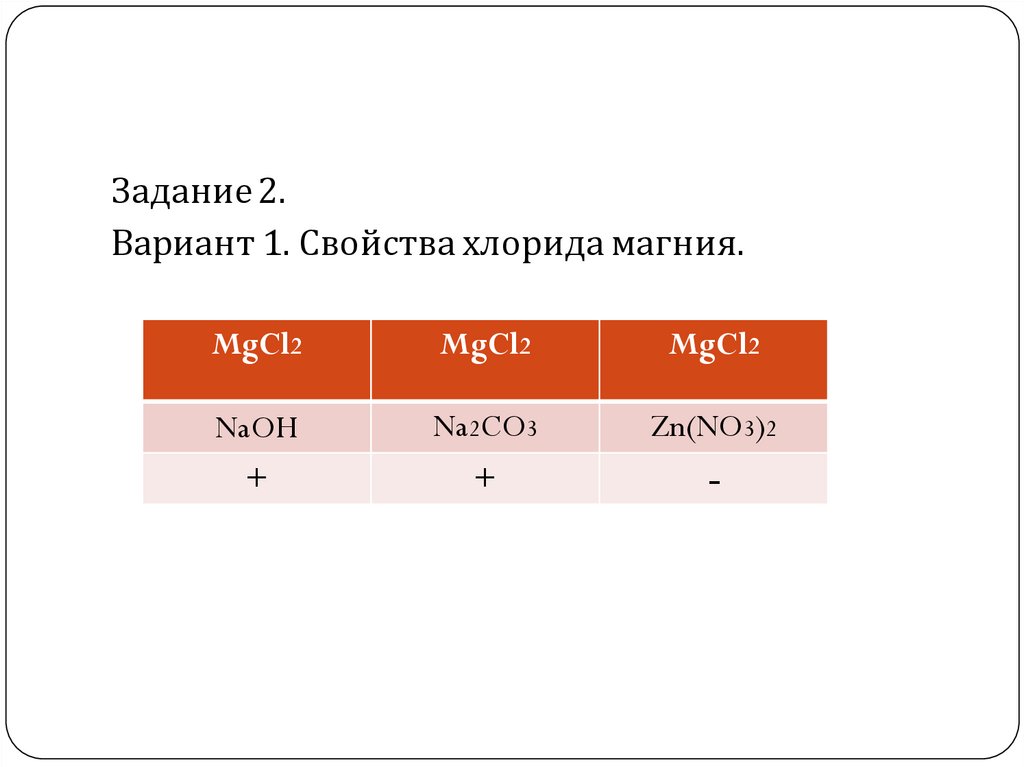
Задание 2.Вариант 1. Свойства хлорида магния.
MgCl2
MgCl2
MgCl2
NaOH
+
Na2CO3
Zn(NO3)2
+
-
9.
MgCl2 + 2NaOH = Mg (OH)2 + 2NaClMg2+ + 2Cl- + 2Na+ +2OH- = Mg (OH)2 +2Na+ + 2Cl Mg2+ + 2OH- = Mg (OH)2
Наблюдаем выпадение осадка белого цвета!
10.
MgCl2 + Na2CO3 = Mg CO3 + 2NaClMg2+ + 2Cl- + 2Na+ +CO2- = Mg CO3 +2Na+ + 2Cl Mg2+ + CO2- = Mg CO3
Наблюдаем выпадение осадка белого цвета!
11.
MgCl2 + Zn(NO3)2 =реакция не идет, потому что нет признака
реакции!!!
12.
Задание 2.Вариант 2. Свойства хлорида магния.
(выполняем самостоятельно!)
13.
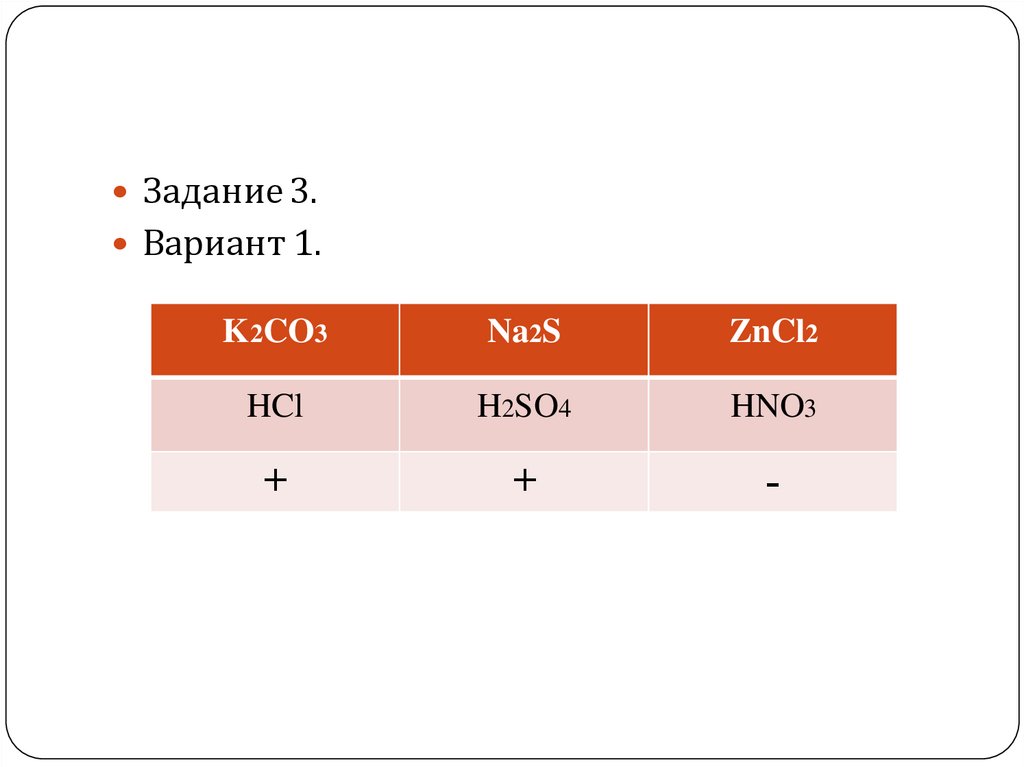
Задание 3.Вариант 1.
K 2CO3
Na2S
ZnCl2
HCl
H2SO4
HNO3
+
+
-
14.
K2CO3 + 2HCl = 2KCl + H2O + CO22K+ + CO32-+2H++2Cl- = 2K+ + 2Cl- + H2O + CO2
CO32-+2H+ = H2O + CO2
Наблюдаем выделение бесцветного газа, без
запаха!!!
15.
Na2S + H2SO4 = H2S + Na2SO42Na+ + S2- + 2H+ + SO42- = H2S + 2Na+ + SO42 S2- + 2H+ = H2S
Наблюдаем выделение газа с неприятным
запахом тухлых яиц!
16.
ZnCl2 +HNO3 =Реакция не протекает!!!
17.
Задание 3.Вариант 2.
(выполняем самостоятельно!)
18.
Задание 5.Вариант 1.
a) получение гидроксида железа (III)
FeCl3 + 3NaOH = Fe (OH)3 + 3NaCl
Fe 3+ + 3Cl- + 3Na+ + 3OH- = Fe (OH)3 + 3Na+ + 3ClFe 3+ + 3OH- = Fe (OH)3
Наблюдаем выпадение осадка бурого цвета!!!
19.
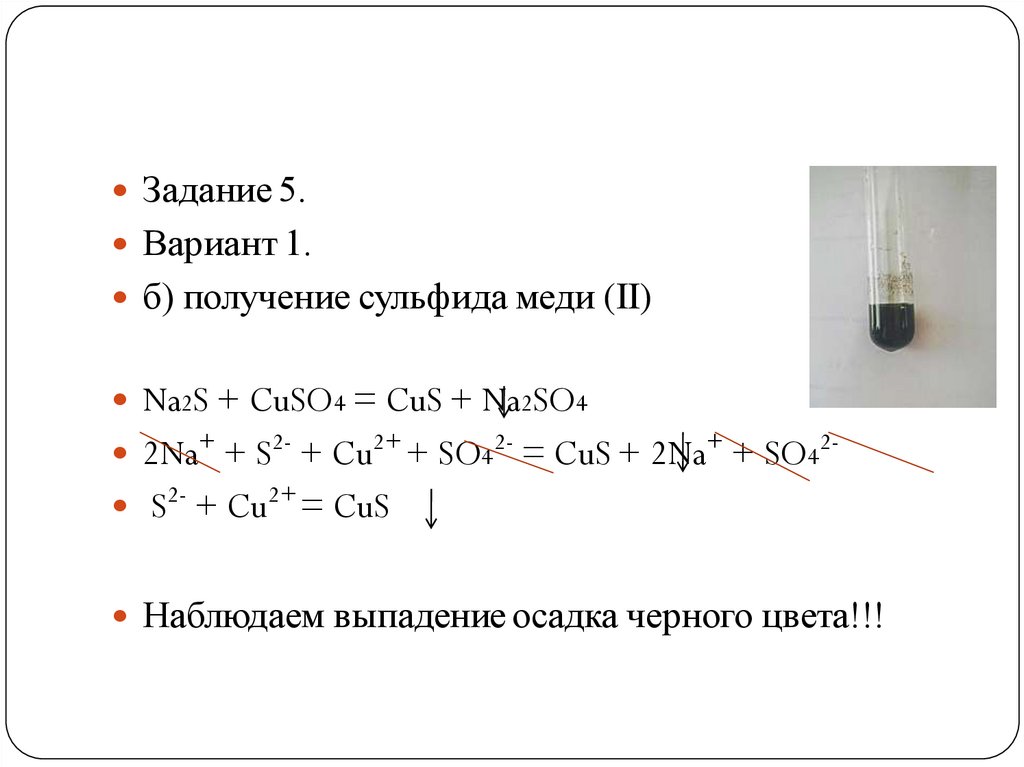
Задание 5.Вариант 1.
б) получение сульфида меди (II)
Na2S + CuSO4 = CuS + Na2SO4
2Na+ + S2- + Cu2+ + SO42- = CuS + 2Na+ + SO42 S2- + Cu2+ = CuS
Наблюдаем выпадение осадка черного цвета!!!
20.
Задание 5.Вариант 2.
(выполняем самостоятельно!)
21.
Формулируем вывод!!!Вывод: при выполнении практической работы
изучил (изучила) свойства кислот, оснований и
солеей как электролитов.

















 Химия
Химия








