Похожие презентации:
Реплікація, транскрипція для РНК-вмісних вірусів та вірусів з амбісенсовим геномом
1. Реплікація/транскрипція дл РНК-вмісних вірусів та вірусів з амбісенсовим геномом
2. Родини длРНК вірусів
Reoviridae – велика родина, мають 10-12сегменів, інфікує хребетних, безхребетних,
рослини і гриби
Partitiviridae – 2 або 3 сегменти, генетично
прості віруси, інфікує рослини і гриби
Chrysoviridae – 4 сегменти, інфікує гриби
Totiviridae – 1 або 2 сегменти, інфікує гриби і
нижчих евкаріот
Cystoviridae – 3 сегменти, віріони з
суперкапсидом, інфікують бактерії
Birnaviridae – 2 або 3 сгменти, інфікують
хребетних, безхребетних.
3.
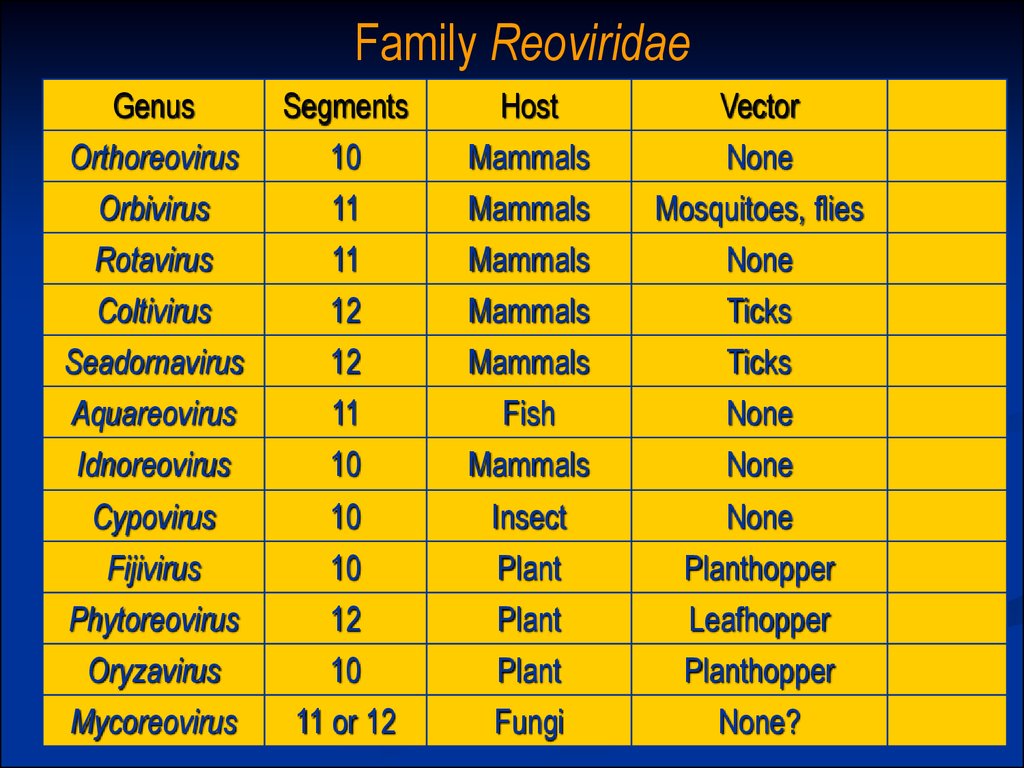
Family ReoviridaeGenus
Orthoreovirus
Orbivirus
Segments
10
11
Host
Mammals
Mammals
Vector
None
Mosquitoes, flies
Rotavirus
Coltivirus
Seadornavirus
11
12
12
Mammals
Mammals
Mammals
None
Ticks
Ticks
Aquareovirus
Idnoreovirus
11
10
Fish
Mammals
None
None
Cypovirus
Fijivirus
10
10
Insect
Plant
None
Planthopper
Phytoreovirus
Oryzavirus
Mycoreovirus
12
10
11 or 12
Plant
Plant
Fungi
Leafhopper
Planthopper
None?
4. Геном Reovirus
10-12 сегментів dsRNAПакується 1 копія в віріон
Загальний розмір геному 22-28 kb (0.8-4.5 kb
кожен сегмент)
Транскрипти представляють повнорозмірну
геномну mRNAs
Більшість геномів моноцистронні, тільки в
деяких вірусів геноми бі – або трицистронні
Сегменти геномів можуть реасорувати між
подібними штамами і видами вірусу
Мають короткі 5’ та 3’ кінцеві некодуючі
регіони
5. Консервативні кінцеві послідовності сегментів геномів роду Оrbivirus (+ ланцюг)
BTV5EHDV
AHSV
GIV(BRDV)
PALV(CHUV)
5-GUUAAA............................ACUUAC-3
5 -GUUAAA..........................A/GCUUAC-3
5 -UUA/UAA/U.....................ACA/UUAC-3
5 -GUAAAA........................AA/GGAUAC-3
5 -GUA/UAAA.......................A/GCUUAC-3
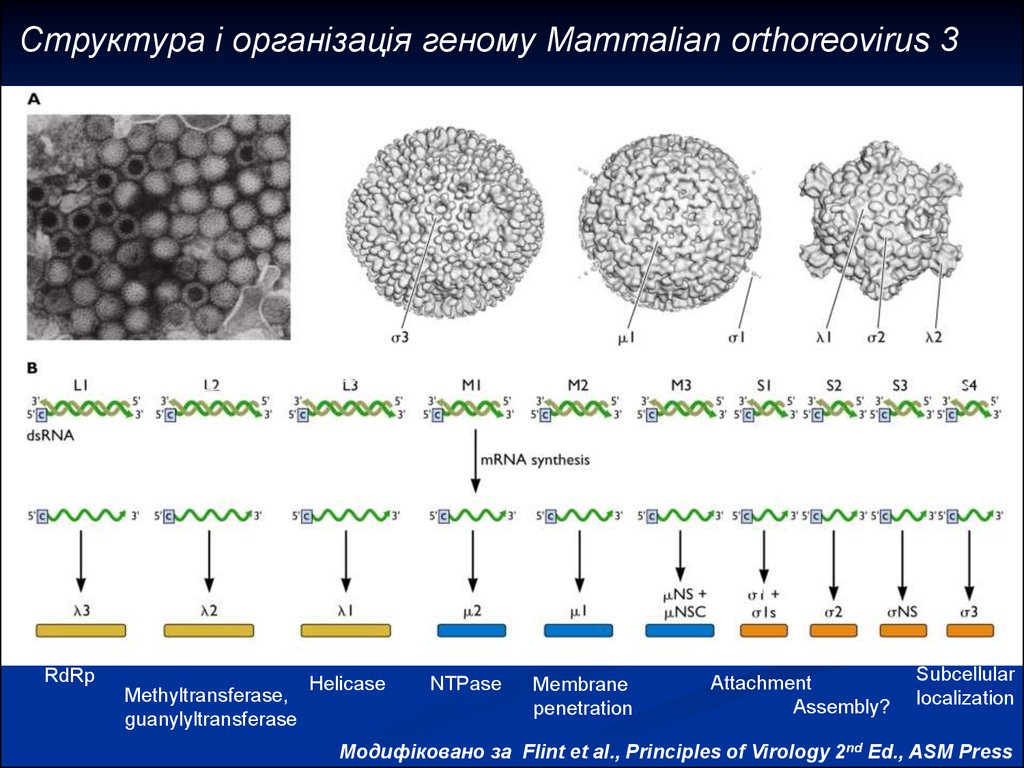
6.
Структура і організація геному Mammalian orthoreovirus 3Electron micrograph
Infectious subviral
particle (ISVP)
Virion
Core
One copy of each
dsRNA per particle
Core
Core
turret
Core
RdRp
Methyltransferase,
guanylyltransferase
Core
Helicase
NTPase
Outer
capsid
Nonstruct.
Membrane
penetration
Outer
capsid
Core Non- Outer
struct. capsid
Attachment
Assembly?
Subcellular
localization
Модифіковано за Flint et al., Principles of Virology 2nd Ed., ASM Press
7.
Structural and nonstructural proteinsencoded by Mammalian reovirus 1
8.
dsRNA 1dsRNA 2
dsRNA 3
dsRNA 4
dsRNA 5
dsRNA 6
dsRNA 7
dsRNA 8
dsRNA 9
dsRNA 10
Reoviruses містять
тільки по одному
сегменту кожного з
10-12 сегментів
dsRNA, які
визначають повний
вірусний геном,
енкапсидований в
єдиній складній
вірусній частці, що
складається з 6-8
протеїнів
Модифіковано за Alan Cann by BIH
9.
mRNAs, ймовірно,переписуються в
комплексах
транскрипції в
кожному з 12
незалежних
фрагментів
двадцятигранника
Модифіковано за Alan Cann by BIH
10.
Кепування таметилювання mRNAs
при транскрипції
відбувається в корі
реовірусної часточки
Модифіковано за Alan Cann by BIH
11. Транскрипція/Реплікація:
RNA транскрибується консервативно:Використовується тільки (-)смисловий ланцюг;
В результаті синтезується (+)смислова mRNAs,
Кепувапння відбувається в корі;
mRNAs не поліаденілюється;
5 ферментних активностей задіяно (присутньо) в
реовірусних частках для реалізації процесу
не обов'язково це окремі пептиди
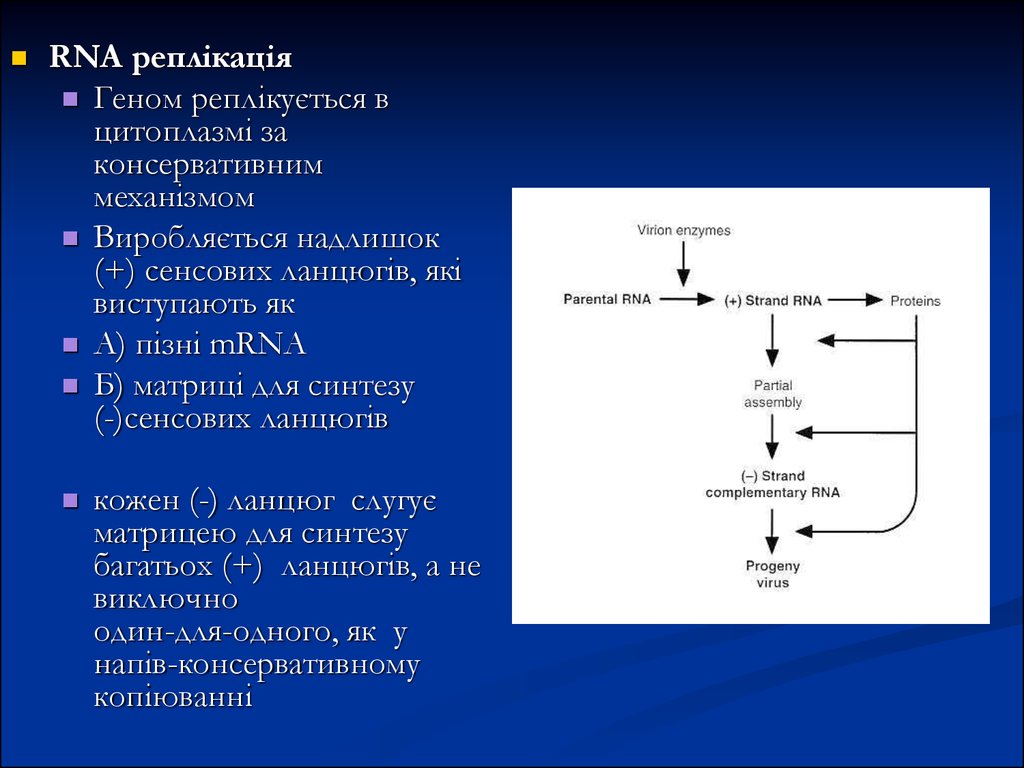
12.
RNA реплікаціяГеном реплікується в
цитоплазмі за
консервативним
механізмом
Виробляється надлишок
(+) сенсових ланцюгів, які
виступають як
А) пізні mRNA
Б) матриці для синтезу
(-)сенсових ланцюгів
кожен (-) ланцюг слугує
матрицею для синтезу
багатьох (+) ланцюгів, а не
виключно
один-для-одного, як у
напів-консервативному
копіюванні
13. Reovirus: dsRNA Virus Strategy
Протеоліз під час входу через лізосоми активізує синтез RNAСубвірусні часточки в цитоплазмамі є
місцями синтезу мRNA
RdRP: присутня в віріоні
мРНК витісняється в цитоплазму через
канали в вершинах вісі симетрії 5 порядку
Трансляція мРНК в цитоплазмі
Упаковка в нових субвірусних
частках: +РНК - матриці для синтезу
нових dsRNAs
‘core’
14. Totiviridae віруси - “killer” фунгі
Members of the family TotiviridaeНе викликає інфекції в заражених клітинах
Може включати 1 (non-killer) або 2 (killer) сегменти
dsRNA, в різних віріонах
Сегмент 1 (L або сегмент L-A) містить інформацію,
потрібну для копіювання і упаковки; може лише
копіюватися.
Сегмент 2 (М., М.1, М.2, т.п.), при умові присутності
містить ген для yeast-specific токсину і ген імунності
до цього токсину; потребує сегменту 1 для
копіювання і упаковки
15.
TotiviridaeFigure 2 Genome organization of Saccharomyces cerevisiae virus L-A (ScV-L-A). The virionassociated RNA polymerase catalyzes in vitro end-to-end transcription of dsRNA by a conservative
mechanism to produce mRNA for capsid proteins. In the case of ScV-L-A, all of the positive strand
transcripts are extruded from the particles. The positive strand of satellite RNA M1, or deletion
mutants of L-A or M1, on the other hand, often remain within the particle where they are replicated
to give two or more dsRNA molecules per particle (headful replication). The positive ssRNA of ScVL-A is the species encapsidated to form progeny virus particles. The encapsidation signal on ScV-LA or M1 positive sense ssRNA is a 24 b stem-loop sequence located 400 nts from the 3 -end in
each case. The Gag protein must be acetylated (by the cellular Mak3p) for assembly and
packaging to proceed. These particles have a replicase activity that synthesizes the negative strand
on the positive strand template to produce dsRNA, thus completing the replication cycle.
Replication requires an internal site overlapping with the packaging signal, and a specific 3 -end
sequence and secondary/tertiary structure. Virions accumulate in the cytoplasm.
16. Рослинні Reoviruses
Три головних роди відрізняються 5’ і 3’ кінцевими ділянкамии і в кодованих протеїнах.
Мають 10 або 12 dsRNAs.
Індукують пухлини, що
з'являються як
анормальний розвиток
флоеми
Передаються цикадами
Віруси розмножуються в
вектроах
Fiji Disease Virus Tumor
Філогенетичне дерево PhytoReovirus
17.
Ambisense genomes18. Організація геному ВПЗТ
19.
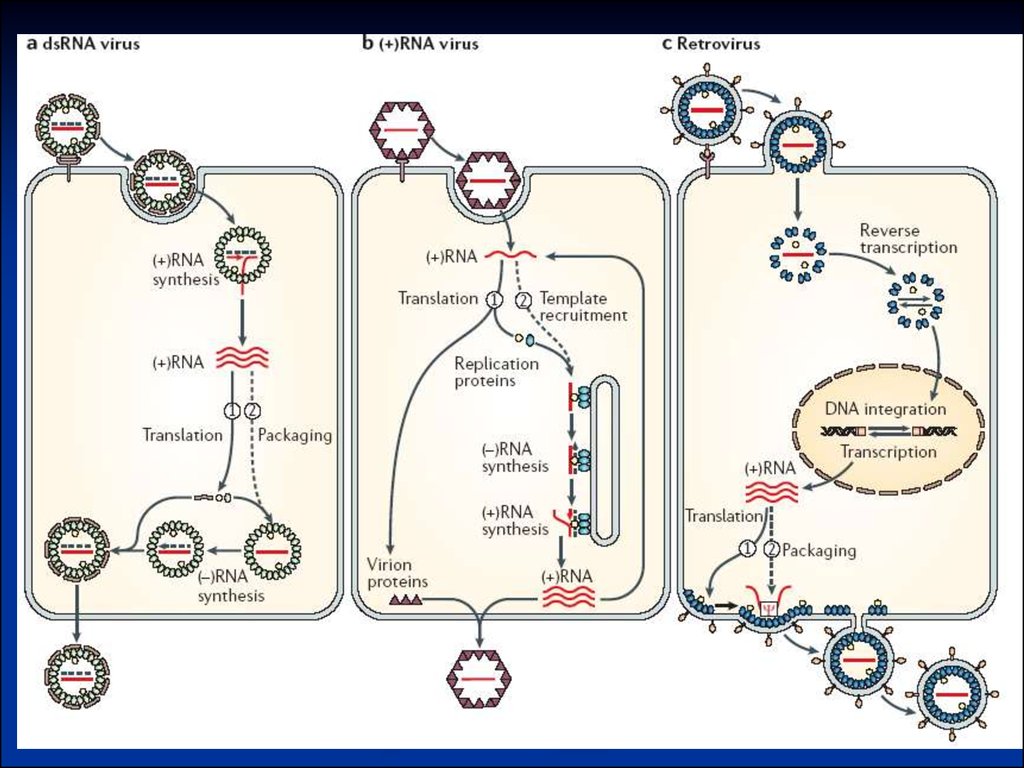
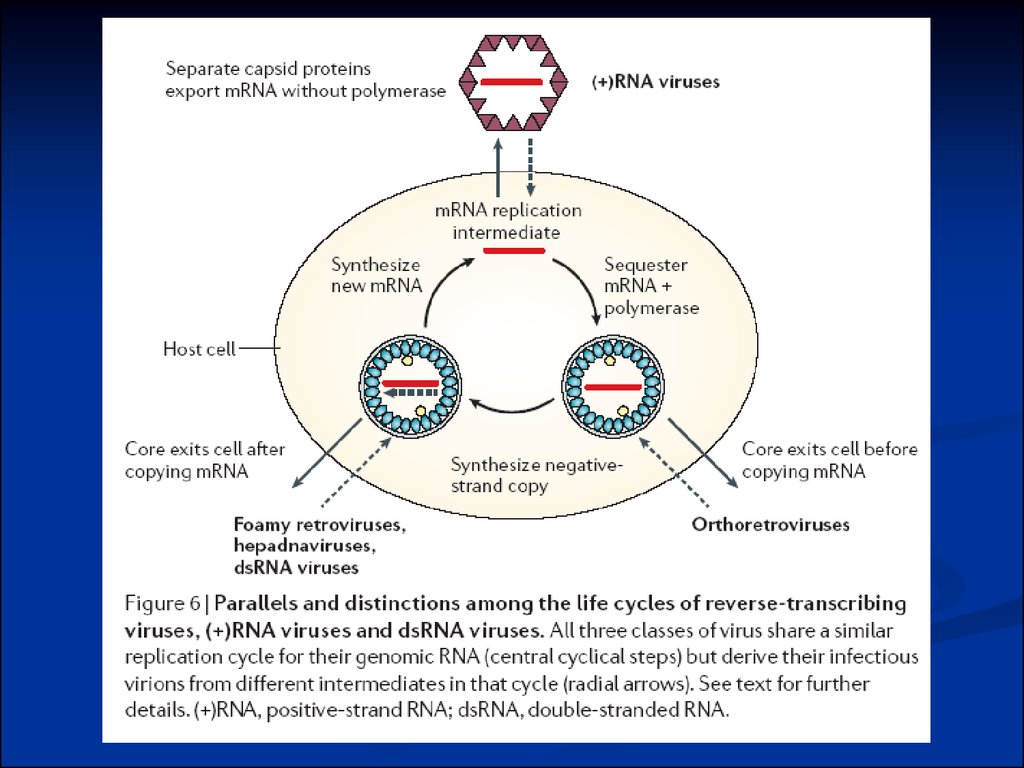
20. Подібності реплікативного процесу у (+) РНК вірусів, длРНК вірусів і зворотньо-транскрибуючих вірусів
21. 7 класів вірусів за стратегією реплікації геному та енкапсидації
22.
23. Фундаментальні зв'язки між класами
Виявлено паралелі у процесі реплікації геному між:1) (+) РНК вірусів,
2) длРНК вірусів,
3) зворотньо-транскрибуючих вірусів
Внутрішньоклітинні РНК-реплікуючі комплекси
деяких (+) РНК вірусів подібні до таких у длРНК і зворотньотранскрибуючих вірусів.
24. Паралелі між (+) РНК вірусами і ретровірусами: роль тРНК-послідовностей в ініціації синтезу (-) ланцюга
Ініціаціязворотньої
транскрипці
ї
Клітинна т-РНК
ковалентно
праймує синтез
(-) кДНК
Ініціація
реплікації
РНК
Вірусний тРНК-подібний
елемент слугує сайтом
розпізнавання і зразком для
синтезу (-) РНК de novo, без
праймеру
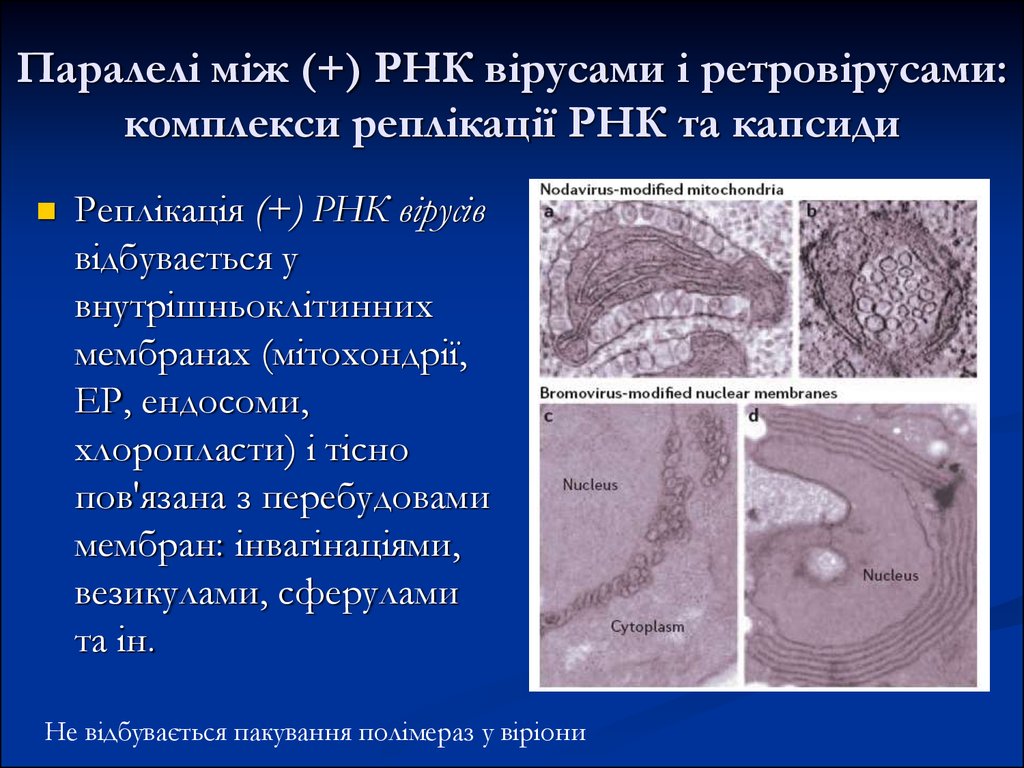
25. Паралелі між (+) РНК вірусами і ретровірусами: комплекси реплікації РНК та капсиди
Реплікація (+) РНК вірусіввідбувається у
внутрішньоклітинних
мембранах (мітохондрії,
ЕР, ендосоми,
хлоропласти) і тісно
пов'язана з перебудовами
мембран: інвагінаціями,
везикулами, сферулами
та ін.
Не відбувається пакування полімераз у віріони
26. Паралелі між (+) РНК вірусами і ретровірусами: формування сферул та капсидів
(brome mosaicvirus)
RE = RNA1,2,3
1а – мультифункціональний протеїн:
1) за відсутності інших вірусних факторів
розташовується на мембрані ЕР, індукує
інвагінацію, рекрутує 2а pol до мембран ЕР,
2) індукує перехід геномних РНК у новий
мембраноасоційований, стійкий до нуклеаз стан.
27. Регуляція Pol у ретровірусів та (+) РНК вірусів
Трансляційний зсув рамки зчитування аботрансляційна ‘readthrough’ подія
Gag/Gag-Pol = 20
Зменшення
співвідношення інгібує
збірку віріону
ретровіруса, його вихід
Як з протеїнами Gag і Pol, збільшена експресія злитих протеїнів, що містять
полімеразу, інгібує реплікацію тобамовірусів та альфавірусів
28. Паралелі між длРНК вірусами і (+) РНК вірусами: фактори реплікації
29. Паралелі між (+) РНК вірусами і длРНК вірусами:
30.
31. НЕКАНОНІЧНІ ВІРУСИ
32. Сателіти
Геном приблизно 500-2000 нуклеотидів з одноланцюговоїРНК
Геном сателіту не схожий за своїми нуклеотидними
послідовностями з вірусом-помічником
Реплікація сателіту інтерферує з реплікацією вірусапомічника (не як у дефектних вірусів)
Сателіти реплікуються в цитоплазмі клітини з
використанням РЗРП
Приклади сателітів:
Barley yellow dwarf virus satellite RNA: Helper - Luteovirus
Tobacco ringspot virus satellite RNA: Helper - Nepovirus
Subterranean clover mottle virus satellite RNA: Helper Sobemovirus
33. Вірус гепатиту дельта (HDV)
Вірус гепатиту дельта – унікальна молекула РНК,, яка схожана віроїд, однак кодує власний білок ( дельа- антиген) і
схожа за трансмісією на сателіт
Вірус гепатиту дельта викликає хворобу у людей
Вірус гепатиту дельта використовує вірус гепатиту В як
помічник .
Інфекційна часточка (віріон) вірусу гепатиту дельта
складається з структурного білку вірусу гепатиту В і
геномної РНК вірусу гепатиту дельта, яка за структурою і
конфігурацієюсхожа з віроїдами
34. Геном вірусу гепатиту дельта (HDV)
Віроїдоподібнийрегіон
Білок-кодуючий регіон (δ - антиген)
35. Віріони HBV та HDV
36. Віроїди
37. Віроїди
• Дуже малі, ковалентно замкнені, кільцеві РНКмолекули, здатні до автономної реплікації (не
потребують віруса-хелпера) та ідукувати
захворювання
• Розмір геному 246-399 нуклеотидів
• Не кодують жодного білка
• Використовують полімеразу хазяїна для
реплікації
• Зараження найчастіше через механічне
пошкодження та через насіння
• Відомо більше 40 видів віроїдів з багатьма
варіантами
• Патогени рослин
38. Відкриття
Перший виявлений віроїдPotato spindle tuber viroid
(PSTVd)
1967 Dr. Ted Diener
39. Potato spindle tuber viroid (PSTVd)
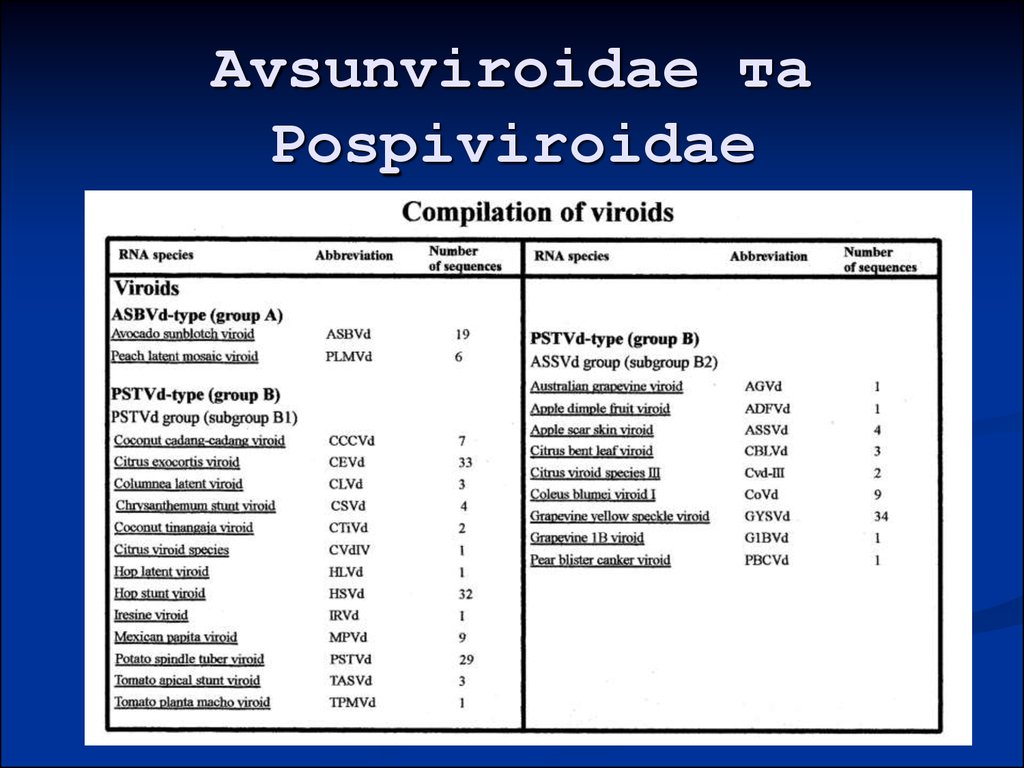
40. Avsunviroidae та Pospiviroidae
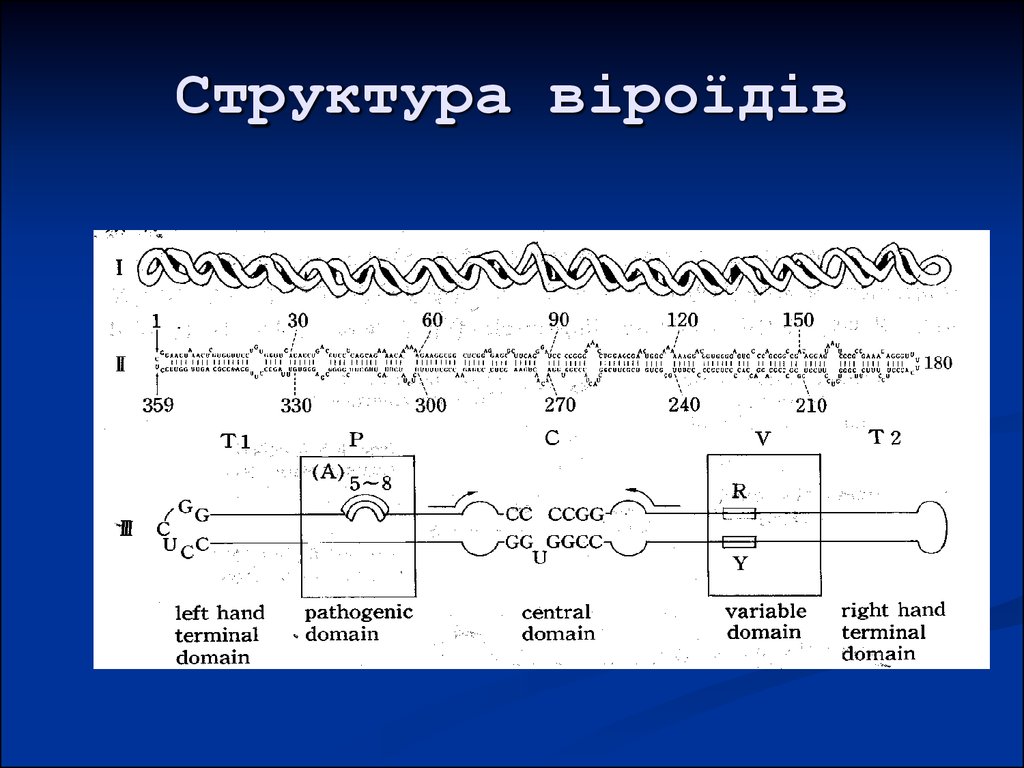
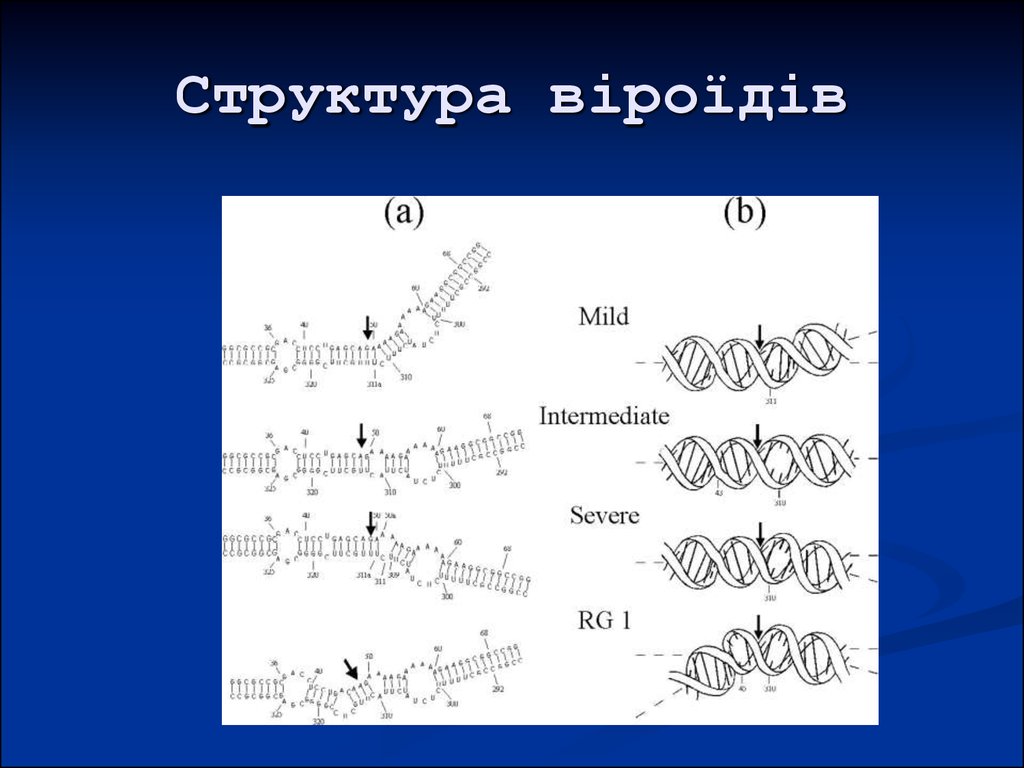
41. Структура віроїдів
42. Структура віроїдів
43. Реплікація віроїда
В ядрі (PSTVd) або хлоропласті (ASBVd)В хлоропласті розрізання рибозимопосередковане, у
ядрі - ферментом хазяїна
ДНК-залежна-РНК-полімераза хазяїна працює на + та –
послідовностях РНК
Ribozyme-mediated
RZ
RZ
RZ
Cleavage by host-factor
RZ
HF
HF
44. Локалізація
+ланцюг віроїдів локалізуєтьсяі в ядерці, і в нуклеоплазмі
-ланцюг – тільки у нуклеоплазмі
45. Переміщення віроїда
для проникненняв крізь ядерну
пору зв’язується
з білком VirP1
Через
плазмодесми
Через флоему
46. Основні питання
Які молекулярні сигнали примушуютьРНК-полімеразу хазяїна сприймати віроїд
як матрицю для побудови
комплементарного ланцюга?
Що є причиною виникнення хвороби за
відсутності віроїд-специфічних білків?
Чим визначається коло господарів і чи
обмежується воно рослинами?
47. Організація геному
5 доменів: термінальні петлі Tr і Тl, патогенності (Р),центральний з консервативною ділянкою (С),
варіабельний (V).
Інші структурно-функціональні ділянки: повтори, що
беруть участь в утворенні шпильок I-III, GC-boxes (
РНК-полімераза), RY-boxes ( VirP1), TCR, УФчутлива петля Е
48. Реплікація віроїду
реплікація за механізмом кільця, що котитьсясайт ініціації – U359 або C1 у Тl, GC-boxes
49.
-РНК локалізуються у нуклеоплазмі, де,очевидно, відбувається транскрипція, у той
час як +РНК розподілені між
нуклеоплазмою та ядерцем.
Реплікація PTSVd супроводжується появою
siRNA (21-24 н), які переважно є дериватами
+РНК, майже не представляють ділянок Рдомену. Інтерференція РНК має незначний
вплив на реплікацію та накопичення
віроїдів у протопласті.
50. Транспорт в інфікованих рослинах
відсутність movement-протеїнівмутації у правому Т-домені перешкоджають
нормальному міжклітинному транспорту
мутації у петлі Е блокують рух з флоеми до
несудинних тканин
4 послідовності у P і 1 послідовність у V-домені
визначають транспорт з обкладки судинних пучків
до мезофілу
за транспорт у ядро відповідають послідовності
верхнього ланцюга ССR (дослідження конструкції
PVX-GFP (green fluorescent protein) з вставленою в
інтрон PSTVd cDNA )
51. Взаємодія з компонентами клітини хазяїна
щонайменше 3 детермінанти патогенезу удоменах Т, Р і V
петля Е: окрема патогенна детермінанта у
позиції 257, сайт зв’язування для RIPs
(ribosome-inactivating-proteins)
вплив вторинної/третинної структури
52. Взаємодія з компонентами клітини хазяїна
інтерференція РНК господаря (суперечливірезультати досліджень)
взаємодія з протеїнами:
- неспецифічна (лектин РР2 при транспорті у
флоемі);
- специфічна (Dicer-опосередковане рощеплення
PSTVd).
Зв’язуюча ділянка описана лише для VirP1.
стимуляція протеїнкіназної активності












































 Биология
Биология








