Похожие презентации:
Гибридизация атома углерода
1. Гибридизация
Гибридизация
2. Формы электронных облаков: а – s-электроны; б – р-электроны; в – d-электроны
3. Графическая электронная формула внешнего энергетического уровня атома углерода
• Электронная формула атома углерода:+6С
2
1s
……
2
2s
2
2p .
4.
5. Графическая электронная формула внешнего энергетического уровня атома углерода в возбужденном состоянии
Графическая электронная формулавнешнего энергетического уровня
атома углерода в возбужденном
состоянии
• Атом углерода переходит в возбужденное
состояние: С* 1s2 2s1
2p12p12p1
……
6.
• Гибридизация атомных орбиталей –изменение формы и энергии орбиталей атома
при образовании ковалентной связи для
достижения более эффективного перекрывания
орбиталей.
Понятие гибридизации является
теоретическим и было введено ученым
Лайнусом Полингом в 20-е годы XX века.
7. Форма гибридной орбитали за счет комбинации s- и p-атомных орбиталей
Форма гибридной орбитали за счеткомбинации s- и p-атомных орбиталей
• гибридная орбиталь больше вытянута по одну сторону
ядра, чем по другую
• увеличивается её перекрывание с электронными
облаками взаимодействующего атома
• образуется более прочная химическая связь
• выделяется дополнительная энергия, которая
компенсирует затраты энергии на гибридизацию.
8.
• Число гибридных орбиталей равно числу атомныхорбиталей.
• Гибридные орбитали одинаковы по форме электронного
облака и по энергии
• Взаимодействие между гибридными орбиталями должно
быть минимальным,
т. е. как можно дальше друг от друга
9.
• 1 s-электрон и 3 p-электрона атомауглерода образуют четыре одинаковых
гибридных орбитали.
Этот тип гибридизации называется sp3гибридизацией.
10. Образование sp3-гибридных орбиталей
• sp3-Гибридизация – гибридизация, вкоторой участвуют атомные орбитали
одного s- и трех p-электронов (рис. 1).
11.
• Четыре sp3-гибридные орбиталисимметрично ориентированны в
пространстве под углом 109°28'
12. Тетраэдрическая пространственная конфигурация молекулы
• центральный атом образован sp3гибридными орбиталями• пространственная конфигурация– тетраэдр
13. Модель молекулы метана (CH4)
• углерода подвергается sp3-гибридизации.14.
• Однако не всегда пространственнаяконфигурация молекулы соответствует
тетраэдру, это зависит от числа атомов в
молекуле.
ион NH4+ и молекула NH3
7N
1s22s22p3
Валентность атома азота – III
Пять электронов внешнего уровня занимают четыре
орбитали - тип гибридизации – sp3
15.
ион NH4+Н
в ионе NH4+ все вершины тетраэдра заняты
атомами водорода, так что этот ион имеет
тетраэдрическую конфигурацию с атомом
азота в центре тетраэдра
Только три орбитали принимают участие в
образовании химической связи
Тетраэдр без одной вершины
превращается в пирамиду
16. Mолекула NH3 тригональная пирамида с атомом азота в ее вершине и атомами водорода в вершинах основания
• При образовании молекулы аммиака атомыводорода занимают только три вершины
тетраэдра, а к четвертой вершине направлено
электронное облако неподеленной электронной
пары атома азота.
угол связи искажается до 107°30′
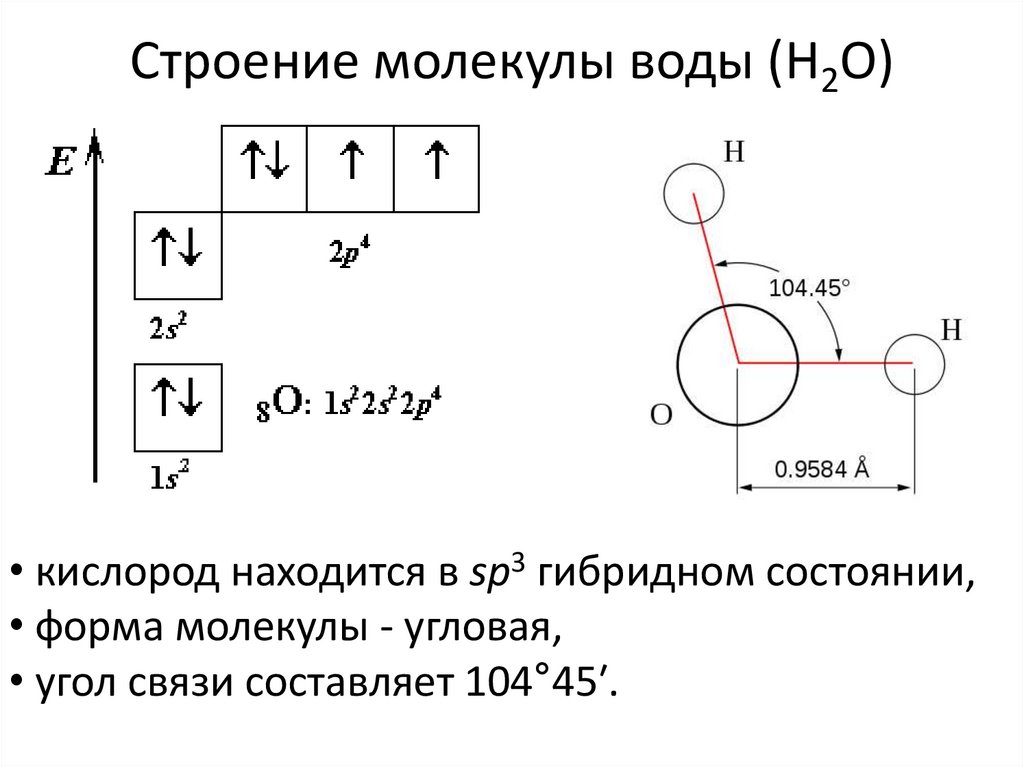
17. Строение молекулы воды (H2O)
• кислород находится в sp3 гибридном состоянии,• форма молекулы - угловая,
• угол связи составляет 104°45′.
18. Примеры соединений, для которых характерна sp3-гибридизация:
• H2O, NH3, POCl3, SO2F2, SOBr2, NH4+, H3O+.• предельные углеводороды (алканы,
циклоалканы) и др. органические
соединения: CH4, C5H12, C6H14, C8H18 и др.
19. sp2-Гибридизация
• sp2-Гибридизация – гибридизация, вкоторой участвуют атомные орбитали
одного s- и двух p-электронов
20.
• образуются три гибридные sp2 орбитали,расположенные в одной плоскости под
углом 120° друг к другу
21. Пространственная конфигурация молекулы
• центральный атом включает в себя sp2гибридные орбитали22. Модель молекулы BCl3
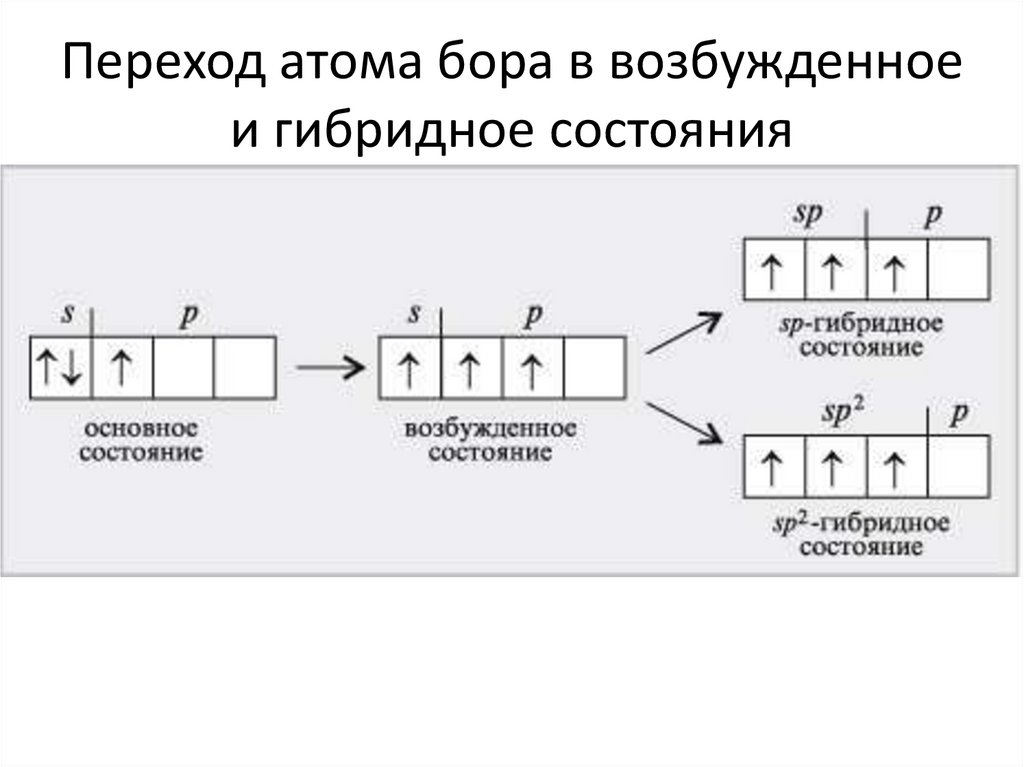
5B1s22s22p1
23.
• Атомы углерода, находящиеся во второмвалентном состоянии (sp2-гибридизация)
связаны друг с другом двойными
химическими связями. При sp2гибридизации атом углерода образует три
σ-связи и одну π-связь с соседними
атомами углерода
24. σ- и π-перекрывание орбиталей между атомами с sp2-гибридными орбиталями
25. Примеры соединений, в которых наблюдается sp2-гибридизация:
• SO3, BCl3, BF3, AlCl3, CO32-, NO3-.• все этиленовые углеводороды (алкены)
(общая формула CnH2n), карбоновые
кислоты и ароматические углеводороды
(аренов) и др. органические соединения:
C2H4 (этилен), C4H8, C6H12, C6H6 (бензол),
C8H10, C9H12, CH3COOH, C6H5OH (фенол),
СH2O (формальдегид), C5H9NO4
(глутаминовая кислота) и др.
26. Образование sp-гибридных орбиталей
• sp-Гибридизация - это гибридизация, вкоторой участвуют атомные орбитали
одного s- и одного p-электронов
27. Модель атома с sp-гибридными орбиталями
• образуются 2 гибридные орбитали, которыеориентируются друг к другу под углом 180°
28. Пространственная конфигурация молекулы, центральный атом которой включает sp-гибридные орбитали
29. Переход атома берилия в возбужденное и гибридное состояния
4Be1s22s2
30. Линейная форма молекулы BeH2
• атом бериллия образован гибридными spорбиталями31. Примеры химических соединений, для которых характерна sp-гибридизация:
• BeCl2, BeH2, CO, CO2, HCN• во всех ацетиленовых углеводородах
(алкинах): C2H2 (ацетилен), C4H6, C6H10 и т. д.
(общая формула алкинов CnH2n-2) и др.
органических соединениях.
32.
• В алкинах sp-гибридизации подвергаютсяатомы углерода, соединяющиеся между
собой тройными связями. При этом
гибридные орбитали атомов углерода
образуют две σ-связи с соседними
атомами, а негибридные орбитали атомов
углерода образуют две π-связи.
гибридные орбитали
негибридные орбитали
33. σ- и π-перекрывание орбиталей между атомами с sp-гибридными орбиталями
34. Возможные формы гибридной орбитали за счет комбинации s-, p-,и d-атомных орбиталей
Возможные формы гибриднойорбитали за счет комбинации
s-, p-,и d-атомных орбиталей
Форма этой орбитали зависит от магнитного квантового числа,
характеризующего орбиталь.
35. Расположение гибридных орбиталей в атоме
sp-гибридизация - электронные облака ориентируются в
противоположных направлениях
• sр2-гибридизация — в направлениях, лежащих в одной
плоскости и составляющих друг с другом углы в 120° (т. е. в
направлениях к вершинам правильного треугольника),
• зр3-гибридизация — к вершинам тетраэдра (угол между этими
направлениями составляет 109°28')
• sp3d2 — гибридизация — к вершинам октаэдра (т. е. по
взаимно перпендикулярным направлениям).
36. Тетрагональная пространственная конфигурация молекулы, центральный атом которой включает sp2d-гибридные орбитали
[PdCl4]2-, [Pt(NH3)4]2+, [NiII(CN)4]2-• sp2d-Гибридизация – тип гибридизации, в
которой участвуют атомные орбитали
одного s-, двух p- и одного d-электронов.
37. sp3d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и одного d-электронов.
тригональнобипирамидальнаяPF5, PCl5, SbCl5, [Fe0(CO)5]0
пирамидальная форму
Sb(C6HC5)5
38. sp3d2-Гибридизация - тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и двух d-электронов
ОктаэдрическаяТригонально-призматическая
SF6, PF6-, SiF62-
39. sp3d3-Гибридизация - тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и трех d-электронов.
Пентагонально-бипирамидальнаяпространственная конфигурация
молекулы XeF6, IF7, ZrF73-, UF73-
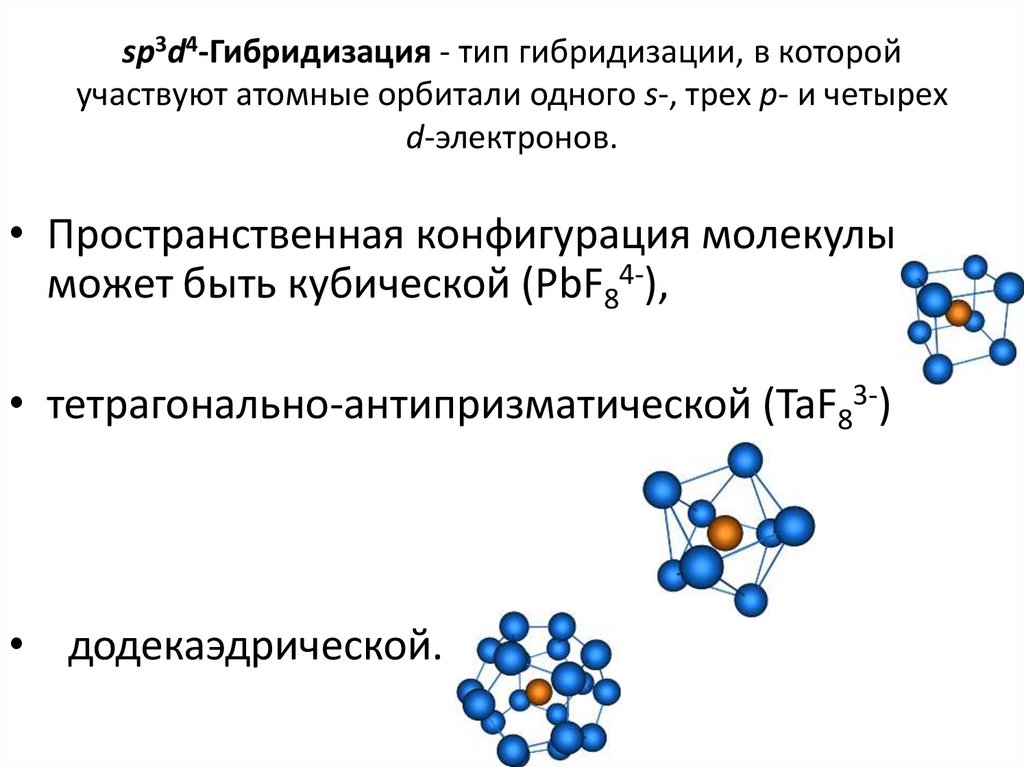
40. sp3d4-Гибридизация - тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и четырех d-электронов.
• Пространственная конфигурация молекулыможет быть кубической (PbF84-),
• тетрагонально-антипризматической (TaF83-)
• додекаэдрической.
41.
42.
3Li 4Be2
2
5B
2
6C
2
2
7N
2
2
8O
2
2
9F
2
2
10Ne
2
2 2
1s 1s 2s 1s 2s 1s 2s 1s 2s 1s 2s 1s 2s 1s 2s
2s1 2
2p1
2p2
2p3
2p4
2p5
2p6
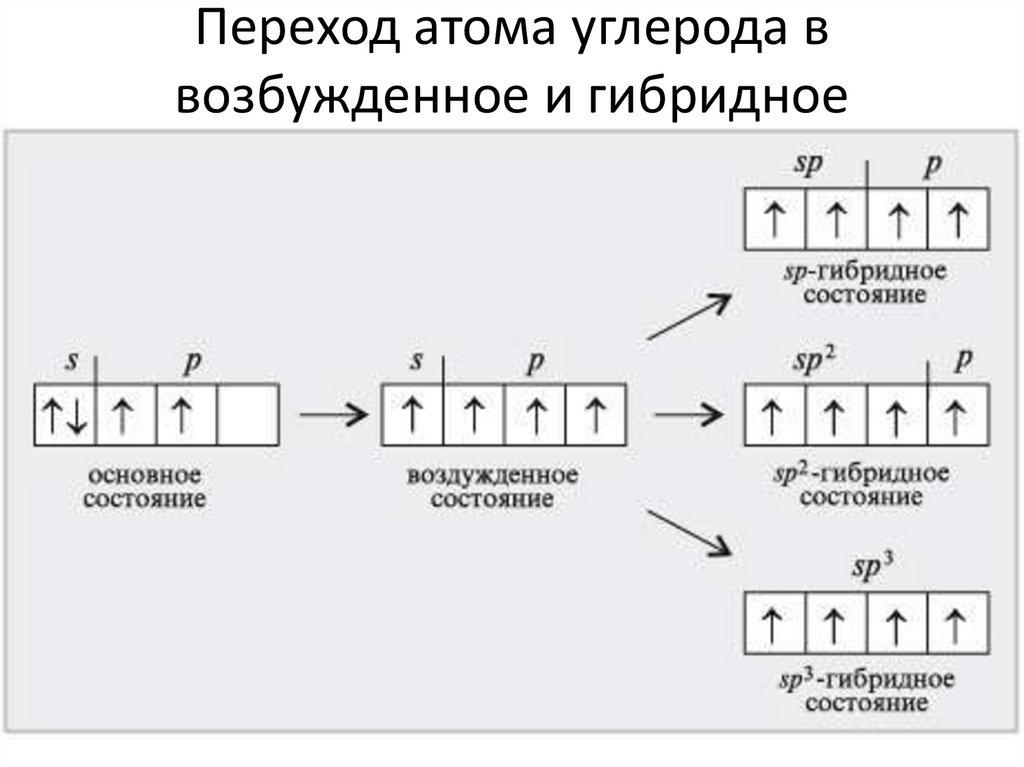
43. Переход атома углерода в возбужденное и гибридное состояния
Переход атома углерода ввозбужденное и гибридное
состояния








































 Химия
Химия








